Method Article
Количественный анализ Synaptic пополнение бассейна пузырьков в культуре нейронов мозжечка гранул использованием FM Красители
В этой статье
Резюме
Жить флуоресценции метод визуализации количественного пополнения и мобилизации конкретных синаптических везикул (SV) бассейны в центральных нервных окончаний описано. Два раунда С. В. переработки контролируются в той же нервных окончаний обеспечения внутреннего контроля.
Аннотация
After neurotransmitter release in central nerve terminals, SVs are rapidly retrieved by endocytosis. Retrieved SVs are then refilled with neurotransmitter and rejoin the recycling pool, defined as SVs that are available for exocytosis1,2. The recycling pool can generally be subdivided into two distinct pools - the readily releasable pool (RRP) and the reserve pool (RP). As their names imply, the RRP consists of SVs that are immediately available for fusion while RP SVs are released only during intense stimulation1,2. It is important to have a reliable assay that reports the differential replenishment of these SV pools in order to understand 1) how SVs traffic after different modes of endocytosis (such as clathrin-dependent endocytosis and activity-dependent bulk endocytosis) and 2) the mechanisms controlling the mobilisation of both the RRP and RP in response to different stimuli.
FM dyes are routinely employed to quantitatively report SV turnover in central nerve terminals3-8. They have a hydrophobic hydrocarbon tail that allows reversible partitioning in the lipid bilayer, and a hydrophilic head group that blocks passage across membranes. The dyes have little fluorescence in aqueous solution, but their quantum yield increases dramatically when partitioned in membrane9. Thus FM dyes are ideal fluorescent probes for tracking actively recycling SVs. The standard protocol for use of FM dye is as follows. First they are applied to neurons and are taken up during endocytosis (Figure 1). After non-internalised dye is washed away from the plasma membrane, recycled SVs redistribute within the recycling pool. These SVs are then depleted using unloading stimuli (Figure 1). Since FM dye labelling of SVs is quantal10, the resulting fluorescence drop is proportional to the amount of vesicles released. Thus, the recycling and fusion of SVs generated from the previous round of endocytosis can be reliably quantified.
Here, we present a protocol that has been modified to obtain two additional elements of information. Firstly, sequential unloading stimuli are used to differentially unload the RRP and the RP, to allow quantification of the replenishment of specific SV pools. Secondly, each nerve terminal undergoes the protocol twice. Thus, the response of the same nerve terminal at S1 can be compared against the presence of a test substance at phase S2 (Figure 2), providing an internal control. This is important, since the extent of SV recycling across different nerve terminals is highly variable11.
Any adherent primary neuronal cultures may be used for this protocol, however the plating density, solutions and stimulation conditions are optimised for cerebellar granule neurons (CGNs)12,13.
протокол
1. Мозжечка Подготовка Нейрон гранул
- Автоклав около 100 диаметром 25 мм покровные (табл. 1).
- Место покровные в 50 мл стерильной пробирку, содержащую стерильный поли-D-лизина раствор (табл. 2). Место на вращающейся платформе в течение 2 ч, чтобы покрыть покровные.
- Сухие покровные покрытием на стерильной салфеткой в ламинарном боксе (табл. 1).
- Место в стерильные покровные 6-луночных планшетах и тепло в CO 2 инкубаторе (табл. 1). Покровные стекла могут храниться в течение 1 месяца при температуре 4 ° С до использования.
- Эвтаназии на 7 дней старые Sprague Dawley крысят в соответствии с местными этическими принципами Комитета. Мы эвтаназии щенков использованием шейки дислокации.
- Рассеките мозжечка и поместить его в стерильную чашку Петри, содержащую фосфатный буферный раствор соли (раствор Б, таблица 3).
- Повторите шаги 1,5 и 1,6 для 4-6 крысят.
- Cerebella затем помещают на стерильную стадию тканей McIlwain Чоpper (табл. 1). Ткань рубится в 375 мкм, интервалы перед поворотом этапе на 90 ° и повторяя процесс.
- Нарезанного cerebella передаются в раствор трипсина (решение Т, Таблица 4), которые ранее были нагревают до 37 ° C.
- Инкубируйте cerebella при температуре 37 ° С в течение 20 мин при легком помешивании примерно каждые 5 мин.
- Во время триптического пищеварения, пламя польский три стерильные пипетки стеклянные (табл. 1) с помощью пламени Бунзена. Использование пламени для создания тонких ствола, средний диаметр и широким отверстием в устье из пипетки.
- После 20 мин инкубации в растворе Т, добавить 20 мл трипсин / ингибитор ДНКазы решение (решение W, таблица 5), чтобы мозжечка подвески и гранул клеток в 1000 г в течение 1 мин в настольной центрифуге (табл. 1).
- Декантируйте супернатант и ресуспендируют осадок клеток в 1,5 мл концентрированного трипсин / ингибитор ДНКазы (раствор C, таблица 6), используя широкие отверстия пипетки.
- Растирают клетки, используя первый широкий пипетки отверстия, то средний диаметр цилиндра и, наконец, малого диаметра, пока клеточная суспензия однородна. Это ключевой шаг, подвески должна быть однородной на данном этапе.
- Слой клеточной суспензии на вершине 10 мл предварительно нагретого (37 ° С), бычий сывороточный альбумин дополнен Earles сбалансированное решение солей (табл. 7) в 15 мл стерильной трубки.
- Центрифуга подвески в течение 5 мин при 1500 г и ресуспендируют осадок клеток в 2 мл предварительно нагретого (37 ° С) питательной среды (табл. 8).
- Оценка числа клеток использованием гемоцитометра (табл. 1) и разбавленных клеточной суспензии до конечной плотностью 3,3 • 10 6 клеток на мл.
- Клетки высевают путем добавления 75 мкл суспензии клеток в центре поли-D-лизина покрытием покровные (конечная плотность 2,5 х 10 5).
- Культуры чашки, содержащие покровные помещаются в CO 2 инкубаторе в течение 60 минут, чтобы позволить клеткамДере.
- Добавить 1,5 мл культуральной среды в каждую лунку, стараясь не беспокоить покрытием клеток и возвращение культуры пластины CO 2 инкубатора.
- На следующий день заменить культуральной среде со свежей питательной среды дополнены митотических ингибиторов цитозинарабинозид (табл. 8). Арестами пролиферация глиальных клеток в культуре.
2. Экспериментальная установка
- Основные экспериментальные установки должны состоять из следующих (см. таблицы 1 и 9 для конкретного оборудования и программного обеспечения):
- Перевернутый эпи-флуоресцентного микроскопа
- Охлаждением ПЗС-камеры
- Флуоресцентные источника света (монохроматор или фильтр колесо)
- Гравитация аппарата перфузии
- Изображения камеры с параллельными электродами платины
- Электростимуляторы
- Компьютер
- Программное обеспечение Image Acquisition
- Эксперименты должны быть выполнены в темноте или под красными дирижер светitions с минимальным флуоресцентного освещения образца, чтобы избежать FM красителя отбеливания.
- Эксперименты проводились при комнатной температуре. Если физиологической температуре не требуется, с регулируемой температурой перфузии система может быть использована.
3. Подготовка образцов
- Культуры должны быть использованы через 8-12 дней в лабораторных условиях.
- Передача одного покровное к физиологическим раствором (табл. 10) в течение 10 мин при комнатной температуре, чтобы стабилизация в новой среде.
- Удалить покровное, сухой его нижней и окрестностях прилагается клеток с небольшой кусочек бумажной салфеткой или фильтровальной бумагой.
- Использование силиконовой смазки (табл. 2), клей покровное к нижней стороне камеры изображений. Клетки должны быть между двух параллельных проводов. Достаточное силиконовой смазкой должна быть использована для уплотнения полностью камере, но без какого-либо жира ввода центре ванной камеру.
- Аккуратно заполните ванну камера с ~ 260 мкл саРешение линии, а затем заполнить входной трубки этим же раствором.
- Клей чистой покровное силиконовой смазкой для верхней части камеры, чтобы запечатать его. Входные и выходные трубы могут быть использованы для удаления пузырьков воздуха в ловушке камеры. Важно, что электрическая цепь не прерывается пузырьками воздуха.
- Зафиксируйте изображения камеры из нержавеющей стали платформой и проверить на наличие утечек, осторожно перфузии физиологического раствора через входную трубу.
- Горы собраны камеры на сцене инвертированного микроскопа, и подключить камеру к системе перфузии тяжести, предварительно загрунтовать входе с физиологическим раствором.
- Прикрепить соединительных проводов камеры к электрической стимулятора.
- Добавить каплю иммерсионного масла, чтобы цели, если нефть объектива. Сосредоточьтесь на клетки в середине камеры использованием яркого освещения поля.
4. S1 фазы
- Заливать нейронов с 1,5 млФ. М. красителя (табл. 2) разводят в физиологическом растворе.
- Стимулировать нейроны вызывают поглощение красителя по приложенному стимулятора.
- После стимуляции нейронов заливать свежей солевой раствор в течение 2 мин, чтобы смыть избыток FM красителем (расход 7 мл / мин). Глиальные загрязнения в системе культуры CGN составляет менее 5% 14, поэтому этот период времени достаточно, чтобы удалить краситель .
- Оставьте нейронов, чтобы отдохнуть в течение 8 мин.
- В течение этого интервала, найдите аксонального сетей, в которых отдельные FM красителя клеммами нерва видны использованием флуоресцеина длин волн (возбуждение, 480 нм, эмиссия,> 550 нм). Избегайте мест с группами клеток. Держите освещения до минимума на этот шаг, так как интенсивное возбуждение может привести к красителя фототоксичности. Очевидные признаки этого в настоящее blebbing аксонов и отсутствие красителя разгрузки (из-за фиксации красителя).
- Re фокусировки изображения непосредственно до получения изображения с небольшой дрейф, возможно, произошли в течение периода отдыха.
- Начните покадровой получения изображений со скоростью 1 кадр каждые 4 сек
- После приобретения 5 - 10 изображений базовой линии, вызывает экзоцитоз РРП, поставляя 30 Гц стимуляции в течение 2 с (60 потенциалы действия) 8 Приступить к стимуляции вручную сразу же после захвата кадров..
- После приобретения еще 10 изображений, вызывают С. В. экзоцитоз RP с помощью трех стимуляции 40 Гц в течение 10 с (400 потенциалов действия), каждый 30 секунд друг от друга 8.
- Приобретать еще 5 - 10 изображений, а затем приобретение паузу изображение.
5. Восстановление фазы (см. рис 2)
- Разрешить нейронов для восстановления в течение не менее 20 мин.
- По желанию - Если влияние препарата на эндоцитоз для которого требуется проверить, заливать нейронов с наркотиками решение в течение этого периода (рис. 2, б) 3,8.
6. S2 фазы
- Повторите S1 протокол фазы (раздел 4) для контрольного эксперимента с использованием того же поля зрения, какв S1.
- По желанию - Если влияние препарата на эндоцитоз для которого требуется проверить, заливать нейронов с наркотиками решение дополнить FM красителя (рис. 2, б) 3,8.
- По желанию - Либо, если препарат влияние на экзоцитоза представляют интерес, заливать нейронов с наркотиками решение как до, так и во время ОРП и РП разгрузки раздражителей (рис. 2в) 3.
7. Анализ данных
- Используйте ImageJ и Microsoft Excel или подобное программное обеспечение для анализа данных.
- Для анализа последовательности изображений в формат стека не требуется. Некоторые изображения программное обеспечение может экспортировать последовательности, как одиночных изображений. Если это так, конвертировать изображения в стек с помощью ImageJ встроенной функцией Image> Стеки> изображений в стеке.
- Отрегулируйте яркость и контрастность стек максимального динамического диапазона. Image> Adjust> Brightness / Contrast (рис. 3а).
- Если значительное горизонтального дрейфа произошло во время тОн эксперимента, запустить StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) и TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) плагинов на ImageJ для выравнивания изображения стека (рис. 3б) .
- Время выполнения серии анализатор плагин ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (рис. 3в).
- Определить регионы интерес (трансформирования) по меньшей мере, 90 нервных окончаний. Они должны быть идентичными (круговой трансформирования с 1,5 мкм в диаметре) Это полезно для переключения между изображениями до и после разгрузки красителя выявить активных нервных окончаний (или предварительной стимуляции изображение может быть вычтен из пост-стимуляции изображения). Идеальной ROI размер тот, который немного больше, чем типичный терминал нерва (рис. 3в).
- Получить общего числа / интегрированные интенсивности флуоресценции каждого ROI над Тимомэлектронной и экспорта в Microsoft Excel (рис. 3 и 4, а).
- Нормализовать ROI следы к тому же произвольное значение, совместив следы в плоскости Y-ось для первой выгрузки стимулом в обеих S1 и S2 фаз (рис. 4, б-в). Это необходимо для контроля за небольшие вариации в интенсивности фона флуоресценции.
- Измерить абсолютное снижение флуоресценции вызванные каждой разгрузки стимулом в произвольной флуоресценции агрегатов для S1 и S2 следующим образом (рис. 4, г):
- RRP = Изменение флуоресценции (ΔF) вызваны 30 Гц 2 с
- РП = Сумма ΔF вызваны 3 х 40 Гц 10 с
- Всего бассейн переработки = РРП + RP
- Для каждого соответствующего параметра в 7,9, вычислить среднее значение над всеми нервными окончаниями в одном эксперименте.
- Для статистического анализа, средние значения, полученные из нескольких независимых экспериментов могут быть усреднены. Число покровные, а не количество нервных терминалов должны использоваться в качестве STATISTICAЛ. Н.
8. Представитель Результаты:
Контрольный эксперимент, где КСГН прошли два раунда идентичные шаги погрузки и разгрузки представлена на рисунке 5. Когда начинается серия экспериментов, важно, чтобы контрольный эксперимент, такие как это выполняется каждый день, чтобы подтвердить, что S1 и S2 сопоставимы до различных экспериментальных условиях в течение S2.
В этом примере, КСГН были загружены с 10 мкМ FM1-43 использованием 80 Гц 10 с стимуляции (рис. 5а). На рисунке 5б показывает FM1-43-загружалась нервных окончаний представлены флуоресцентные puncta. Трансформирования были определены более 90 нервных окончаний, как показано на рисунке 5c. Тот же набор трансформирования был использован как для S1 и S2. Во время обеих разгружает, РРП была впервые выгружены с 30 Гц (2 с) стимулирование последующей RP разгрузки с 3 последовательных 40 Гц (10 с) раздражителей (рис. 5а). Флуоресценции падения во время каждого раздражителя можно ясно наблюдать и количественно (рис. 5, г-е). Когда рассмотрели, флуоресценции капель соответствующие оправы, RP и общий бассейн переработки были сопоставимы в обеих S1 и S2. Кроме того, 20% переработанного спутников проживал в РРП в то время как 80% проживали в РП и в S1 и S2.

Рисунок 1 Принципиальная схема типичной FM эксперимента. А) С. В. эндоцитоза срабатывает при наличии FM-красителя (представлены зеленым цветом). Красителя занимают инвагинирующий мембрана (один КА или оптовых эндосомы). Б) не внутренним красителя на мембране плазмы смыты перфузии. C) По заявлению разгрузки стимула, обозначенные спутников, которые становятся доступными для выпуска сливаются с плазматической мембраны в результате чего потери флуоресценции. D) изменение флуоресценции (ΔF), которая пропорциональна количеству выпускаемых меченых спутников может быть определена количественно.
_upload/3143/3143fig2.jpg "/>
Рисунок 2 Схемы возможных экспериментальных протоколов. А) Блок-схема контроля эксперимент, в котором клетки подвергаются два раунда FM красителя погрузки и разгрузки (S1 и S2). Клетки могут быть загружены с помощью ряда различных раздражителей. Разгрузка шаги идентичны тем, что RRP выгружается с 30 Гц в течение 2 с последующей RP выгрузить с использованием 3 раза 40 Гц в течение 10 с РРП и резервный пул разгрузки стимулы были разделены на 40 секунд, все другие раздражители на 30 сек. Клетки остаются восстановить в течение 20 минут между S1 и S2. Технологические схемы возможных модификаций для проверки эффекта какого-либо вещества по обе B) эндоцитоза или С) экзоцитоза также показаны. Корреспондент допинг-контроль может быть перфузии в камеру в течение указанного периода.
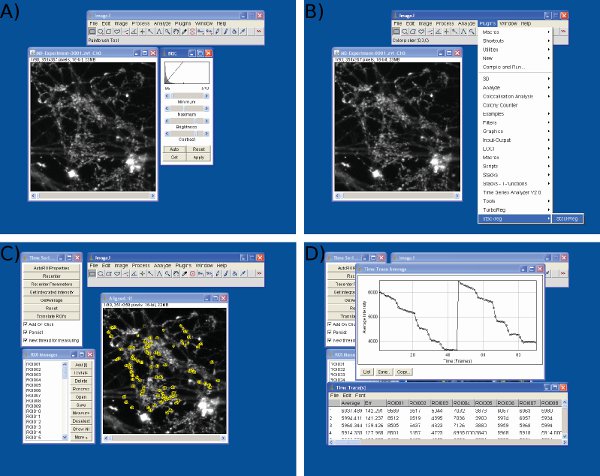
Рисунок 3 Скриншоты из анализа данных в изображение J. Скриншоты приведеныза) настройка яркости и контраста, В) цикловой синхронизации, С) трансформирования выбор и D) значения интенсивности экстракции с использованием изображения J.
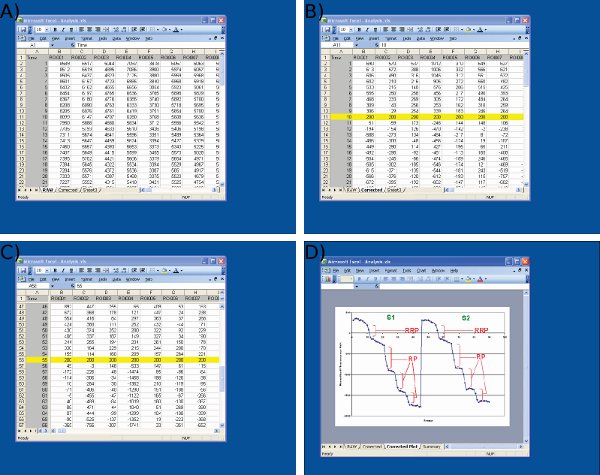
Рисунок 4 Скриншоты из анализа данных в Microsoft Excel. Скриншоты приведены для) импорт исходных данных из изображений J (1-й столбец = номер кадра, остальные столбцы = данные от отдельных нервных окончаний) Б) корректировка S1 значений исходных данных (кадр 10) для произвольного значения (200) в начале первого стимула, С) корректировка S2 значения базовой в кадре 55 использованием идентичных протокола к S1, и D) измерение флуоресценции капель использованием Microsoft Excel. Обратите внимание, что усредненный след показано на D используется для определения момента времени до и после каждой капли. Размер капель флуоресценции для каждого ROI должны быть определены из значений таблицы показано на C.
Рисунок 5. Представитель контрольного эксперимента. А) Блок-схема контроля эксперимент, в котором КСГН были загружены 10 мкм FM1-43 с использованием 80 Гц (10 с) стимуляции. S1 и S2 фаз одинаковы. РРП и резервный пул разгрузки стимулы были разделены на 40 секунд, все другие раздражители на 30 сек. Б) изображение, показывающее нервных окончаний загружены FM1-43. С) и то же изображение, как показывает B 90 пронумерованных трансформирования, отобранных для анализа. D) Изображения области изображен красный прямоугольник в B в выбранных точках времени. Базальные = до раздражения, 30 Гц = 30 Гц после 2 сек стимуляция, 40 Гц = 1,2,3 после каждой стимуляции 40 Гц 10 с. Эти изображения представлены в псевдо-для иллюстрации изменений флуоресценции (спектр бар отображается в правой). Е) Среднее ± SEM следа получены от 90 нервных окончаний изображен в С. Индивидуальные стимулы представлены турники. Шкала баров = 10 мкм.
Обсуждение
FM красители широко используются для исследования функции нервов терминала во многих нейронов препаратов. Они были использованы главным образом для контроля степени либо эндоцитоза С. В., С. В. оборота или кинетики экзоцитоза 6. Описанные протокол расширяет эти исследования для изучения дифференциальных разгрузке конкретных С. В. бассейнов. Это дает дополнительную информацию о пополнении С. В. бассейнов, а также их степень мобилизации.
FM-красители могут быть использованы для обозначения нескольких раундов С. В. переработки в пределах одного нервных окончаний. Мы использовали это свойство и предназначен протоколы, в которых С. В. оборот каждого терминала можно контролировать два раза в том же нервных окончаний. Это обеспечивает точный внутренний контроль, который необходим из-за неоднородного характера утилизации SV параллельно нервных окончаний 11. Через использование S1 фазы внутреннего контроля, заправки РРП, РП и общегоС. В. бассейн в наличии препараты могут быть надежно и напрямую сравнивать.
В дополнение к предоставлению информации абсолютный размер утилизации, РРП и RP бассейны в различных условиях стимуляции, этот протокол также может предоставить данные в следующих - 1) Разделение спутников между РРП и РП в зависимости от переработки бассейн S1 и S2, 2) относительный размер S2 бассейнов (RRP и RP) в зависимости от общего числа S1 бассейн утилизации и 3) относительный размер какой-либо определенной С. В. бассейн в S2 в зависимости от одного пула в S1. Данный протокол не будет предоставлять информацию о разгрузке кинетики однако, так как время сбора данных слишком медленная (для кинетических измерений приобретения раз должно быть как можно быстрее и разгрузки автоматически синхронизированы с захвата изображения).
Наш 30 Гц 2 с стимулами вызывает идентичные степени RRP разгрузки гипертонической сахарозы 8. Поскольку размер оправыопределяется гипертонической сахарозы разгрузки 15, мы можем констатировать, что этот протокол выгружает все RRP спутников, в согласии с исследованиями в нейронах гиппокампа 16. Резервного пула почти полностью истощены три поезда из 400 стимулов (40 Гц 10 с каждого), так как это стимуляция выгружает одинаковое количество красителя парадигмы (2 стимулы с 50 мМ KCl), которые истощают 95% всех красителей меченных спутников 8,17. Точная количественная оценка размера и РРП и резервный пул также зависит от получения информации в линейный динамический диапазон ПЗС-камерой.
Это простой протокол также может быть изменена в дальнейшем. Сила загрузки стимулы также могут быть разнообразны, чтобы определить, каким образом активность нейронов и различные режимы эндоцитоза влияют С. В. бассейн пополнения. Кроме того, более двух циклов погрузки и разгрузки могут быть выполнены, если потребуется. Этот протокол также может быть использован в клетках, трансфицированных либо гиперэкспрессия илиshRNA векторов. Из-за низкой эффективности трансфекции первичных нейронов культур, выраженная белки должны быть помечены флуоресцентным белкам. Важно, чтобы эти флуоресцентные метки не мешали FM сигнала красителя (использование голубого или красного белков, например). В этом случае, нервные окончания от трансфицированных и не трансфекции клеток в одном поле зрения, можно также сопоставить в качестве дополнительного контроля 8. В таких экспериментах сравнение степени загрузки между S1 и S2 нагрузки не имеет большого значения, так как возмущения присутствует как во время нагрузок. Разбиение красителя между бассейнами С. В. все еще может быть визуализированы Однако 8.
Генетические журналистам называется pHluorins также может быть использован для контроля С. В. экзоцитоз и эндоцитоз в первичных нейронов культуры. Эти зонды использование рН-чувствительных зеленого флуоресцентного белка рН среды просвета области С. В. меченых белков, таких как VAMP, synaptophysin и VGLUT1 18 . При использовании в сочетании с ингибиторами везикулярного АТФазы, pHluorins могут сообщать как на кинетику и степень мобилизации С. В. бассейн 19. FM-чернила на основе красителя Описанный здесь подход имеет некоторые преимущества по сравнению с техникой pHluorin, во-первых, FM красителей предоставить информацию о которых С. В. эндоцитоза режиме пополняется РРП и резервные бассейны 8. Во-вторых конкретные С. В. бассейны могут быть помечены FM красителей, которые имеют различные спектральные свойства 20 и, наконец, не существует никаких требований для трансфекции. FM красители не могут предоставить информацию о С. В. трафика между отдыха и переработки С. В. бассейны однако (в отличие от pHluorins 19), так как по определению спутников должны быть загружены с красителем во время эндоцитоза, чтобы быть видимыми. Таким образом, оба FM красителей и pHluorins имеют сильные и слабые стороны и наиболее эффективны, когда используются в независимых экспериментах на адрес тот же вопрос.
Изображения высокого качества имеют важное значение для анализа и действительным reproducibле результаты. Хотя горизонтального дрейфа может быть легко исправлена, экспериментов, где есть дрейф в Z-оси, не могут быть восстановлены. По этой причине важно, чтобы переориентировать изображений до начала S1 и S2 разгружается. В случаях, когда значительная флуоресцентные распад произошел, распад поправки могут быть применены (как правило, путем вычитания ранее записанный след от FM-загруженных клеток в отсутствие стимуляции). Тем не менее, предполагается, что распад коррекция выполняется только для графического представления и не должны использоваться для любого количественного анализа.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом Wellcome Trust (Ref: 084277).
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Каталог нет. | |
|---|---|---|---|
| AxioCam MRM Откр. 3 Цифровая камера | Carl Zeiss | 4265099901000 | |
| Axio Observer.A1 микроскоп | Carl Zeiss | 4310040000000 | |
| Клеточные культуры пластины (6 скважин) | Greiner Bio-One | 657160 | |
| Центрифуга (Universal 32R) | Hettich Zentrifugen | 1610 | |
| CO 2 инкубатор | Heraeus инструменты | 51014042 | |
| Сокол труб (15/50 мл) | Greiner Bio-One | 188271/210261 | |
| Fluar 20х / 0,75 ∞ / 0,17 Цель | Carl Zeiss | 4401459901000 | |
| Стекла покровные (Ø25mm) | VWR международное | 631-1584 | |
| Стекло пастер пипетки (230 нм) | Greiner Bio-One | 612-1799 | |
| Гемоцитометра | VWR | 15170-170 | |
| Изображения камеры | Сигнализатор | RC-21 BRFS | |
| Ламинарном потоке | Biohit | ОНЧ BHS 1200 | |
| McIlwain тканей Chopper | Михайличенко инженерной лаборатории ООО | MTC / 2 | |
| Ртутные лампы | Carl Zeiss | HBO 103 | |
| MultiStim системы Электростимуляторы (100 мВ, 1 мс pluse ширина) | Digitimer ООО | D330 | |
| Перфузии насоса | Watson-Marlow | 313S | |
| Серологические пипетки (5/10/25 мл) | Greiner Bio-One | 606180/607180/760180 | |
| Затвор контроллер | Carl Zeiss | MAC5000 | |
| Шприц (20 мл) | BD Plastipak | ST01-B002 | |
| Шприц Фильтры (Minisart - 0,20 мкм) | Сарториус Stedim | 16532 | |
| ЭП-6 шестиканальный контроллер клапана | Сигнализатор | 64-0135 | |
| YFP FilteГ Set (46) | Carl Zeiss | 1196-681 |
Таблица 1. Специальное оборудование и аппаратуры, используемой
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| FM1-43 | Кембридж BioScience | BT70021 | 10 мкМ |
| FM2-10 | Кембридж BioScience | BT70044 | 100 мкМ |
| Поли-D-лизина | Сигма | P7886 | 15 мкг / мл |
| Силиконовая смазка | Сигма | 85403 | - |
Таблица 2. Конкретные реагенты, используемые
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| Бычьего сывороточного альбумина (БСА) | Сигма | A4503 | 0,3% |
| D-глюкозы | Сигма | G5767 | 0,25% |
| MgSO 4 · 7H 2 O | Сигма | M2773 | 1,5 мМ |
| D-PBS | Гибко | 21300 | 960 мг/100 мл |
-Сделать 100 мл свежего для каждого препарата
-Стерильный фильтр перед использованием
Таблица 3. Раствор В для подготовки CGN
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| Раствор В | - | - | 19 мл |
| Трипсина (5 мг / мл акции, -20 ° С) | Сигма | T9201 | 1 мл |
Таблица 4. Решение T для подготовки CGN
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| Решение C | - | - | 3,2 мл |
| Раствор В | - | 16,8 мл |
Таблица 5. Решение Вт для подготовки CGN
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| Дезоксирибонуклеазы (ДНКазы, 500 U за 0,5 фондовом мл, -20 ° C) | Сигма | D5025 | 0,5 мл |
| MgSO 4 · 7H 2 O | Сигма | M2773 | 1,5 мМ |
| Раствор В | - | - | 10 мл |
| Соевый ингибитор трипсина (SBTI, 0,5 мг в 0,5 мл акции, -20 ° С) | Сигма | T9003 | 0,5 мл |
Таблица 6. Решение С для подготовки CGN
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| Бычьего сывороточного альбумина (БСА) | Сигма | A4503 | 4% |
| Сбалансированный солевой раствор Эрла (EBSS) | Гибко | 24010 | 10 мл |
| MgSO 4 · 7H 2 O | Сигма | M2773 | 3 мМ |
Таблица 7. EBSS Решение для подготовки CGN
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| Цитозин β-D-арабинофуранозида (Ara-C) * | Сигма | C1768 | 10 мкМ |
| Плода бычьего сывороточного | Гибко | 10106 | 10% |
| D-глюкозы | Сигма | G5767 | 30 мМ |
| L-глютамин | Сигма | G3126 | 2 мМ |
| KCl | Сигма | P5405 | 25 мМ |
| Минимально необходимой среде (MEM) | Гибко | 21090 | 500 мл |
| Пенициллин (P) / стрептомицин (S) | Гибко | 15140 | 100 ЕД / мл (Р), 100 мкг / мл (S) |
* Ara-C должны быть добавлены к среде от 1 года DIV
Таблица 8. Питательных сред для подготовки CGN
| Имя | Версия | Компания |
|---|---|---|
| AxioVision Отн. | 4,8 | Carl Zeiss |
| ImageJ | 1.42q | Национальные институты здоровья |
| Microsoft Excel | 2003 | Microsoft |
Таблица 9. Специальное программное обеспечение компьютера, используемого
| Имя | Компания | Каталог нет. | Концентрация |
|---|---|---|---|
| CaCl 2 · 2H 2 O | Сигма | C7902 | 1,3 мм |
| Глюкоза | Сигма | G5767 | 5 мМ |
| KCl | Сигма | P5405 | 3,5 мм |
| KH 2 PO 4 | Сигма | P9791 | 0,4 мМ |
| MgCl 2 · 6H 2 O | Сигма | M0250 | 1,2 мм |
| NaCl | Fluka | 71378 | 170 мм |
| NaHCO 3 | Fluka | 71627 | 5 мМ |
| Na 2 SO 4 | BDH лабораторные материалы | 10264 | 1,2 мм |
| TES | Сигма | T1375 | 20 мМ |
Таблица 10. Физиологического раствора (рН 7,4)
Ссылки
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены