Method Article
Analyse quantitative des vésicules reconstitution Piscine synaptique dans des cultures de neurones granulaires du cervelet utilisant des colorants FM
Dans cet article
Résumé
Une technique d'imagerie de fluorescence en direct à quantifier la reconstitution et la mobilisation des vésicules synaptiques spécifiques (SV) piscines dans les terminaisons nerveuses centrales est décrite. Deux séries de SV de recyclage sont suivis dans les terminaisons nerveuses offrant un contrôle interne.
Résumé
Après la libération de neurotransmetteurs dans les terminaisons nerveuses centrales, SV sont rapidement récupérées par endocytose. Récupérée SV sont ensuite rechargées avec des neurotransmetteurs et de rejoindre la piscine de recyclage, défini comme les SV qui sont disponibles pour 1,2 exocytose. La piscine de recyclage peuvent être généralement divisées en deux poules distinctes - la piscine facilement libérable (PRR) et le pool de réserve (RP). Comme leur nom l'indique, le RRP se compose de SV qui sont immédiatement disponibles pour la fusion tandis RP SV sont libérés seulement pendant 1,2 stimulation intense. Il est important d'avoir un dosage fiable que les rapports différentiels de la reconstitution de ces piscines SV afin de comprendre 1) comment le trafic de SV après avoir différents modes d'endocytose (comme dépendante de la clathrine endocytose et l'activité endocytose dépendante de vrac) et 2) les mécanismes contrôle de la mobilisation à la fois du PRR et RP en réponse à différents stimuli.
Colorants FM sont systématiquement emploiented pour quantitativement le rapport chiffre d'affaires SV dans les terminaisons nerveuses centrales 3-8. Ils ont une queue hydrophobe qui permet d'hydrocarbures partitionnement réversible dans la bicouche lipidique, et un groupe de tête hydrophile qui bloque le passage à travers les membranes. Les colorants ont peu de fluorescence en solution aqueuse, mais leur rendement quantique augmente considérablement lorsque partitionné en membrane 9. Ainsi colorants FM sont idéales pour le suivi des sondes fluorescentes activement le recyclage SV. Le protocole standard pour l'utilisation de la FM colorant est comme suit. D'abord, ils sont appliqués aux neurones et sont repris au cours d'endocytose (figure 1). Après non internalisés colorant est lavé de la membrane plasmique, recyclés redistribuer SV au sein du pool de recyclage. Ces SV sont ensuite épuisés en utilisant des stimuli déchargement (figure 1). Depuis FM étiquetage des colorants SVS est quantiques 10, la chute de la fluorescence obtenue est proportionnelle à la quantité de vésicules libéré. Ainsi, le recyclage et la fusion de SV générés par le prrondes evious d'endocytose peuvent être quantifiés de manière fiable.
Ici, nous présentons un protocole qui a été modifié afin d'obtenir deux éléments d'information supplémentaires. Premièrement, le déchargement des stimuli séquentiels sont utilisés pour le déchargement de façon différentielle le RRP et le RP, afin de permettre la quantification de la reconstitution de certaines piscines SV. Deuxièmement, chaque terminaison nerveuse subit le protocole à deux reprises. Ainsi, la réponse du terminal même nerf au S1 peut être comparée à la présence d'une substance d'essai à la phase S2 (figure 2), fournissant un contrôle interne. Ceci est important, puisque l'étendue du recyclage SV travers les terminaisons nerveuses différentes est très variable 11.
Tout adhérent cultures neuronales primaires peuvent être utilisés pour ce protocole, mais la densité de placage, des solutions et des conditions de stimulation sont optimisés pour les neurones granulaires du cervelet (CGN) 12,13.
Protocole
1. Préparation du cervelet Neuron granules
- Autoclave à environ 100 mm de diamètre 25 lamelles (tableau 1).
- Lamelles Placer dans un tube de 50 ml stérile contenant stérile poly-D-lysine solution (tableau 2). Placer sur une plateforme rotative pendant 2 h pour bien enrober les lamelles.
- Dry lamelles couché sur le papier tissu stérile sous une hotte à flux laminaire (tableau 1).
- Placer dans des lamelles stériles plaques 6 puits et les lamelles au chaud dans un incubateur à CO 2 (Tableau 1). Peuvent être stockés pendant 1 mois à 4 ° C pour les avant utilisation.
- Euthanasier un 7 jours anciens Sprague-Dawley rats nouveau-nés selon les règles locales d'comité d'éthique. Nous euthanasiés chiots par dislocation cervicale.
- Disséquer le cervelet et le placer dans une boîte de Pétri stérile contenant une solution de sels de tampon phosphate (solution B, tableau 3).
- Répétez les étapes 1,5 et 1,6 pour 4-6 ratons.
- Cervelets sont ensuite placés sur la scène stérile d'un tissu McIlwain ChoPPER (tableau 1). Le tissu est coupé à 375 um intervalles avant de tourner la scène de 90 ° et répéter le processus.
- Les cervelets hachés sont transférés dans une solution de trypsine (solution T, tableau 4), qui avait déjà été chauffée à 37 ° C.
- Incuber cervelets à 37 ° C pendant 20 min avec agitation douce environ toutes les 5 min.
- Pendant la digestion tryptique, la flamme polonaise trois pipettes en verre stérile (tableau 1) en utilisant un bec Bunsen. Utiliser la flamme de créer un alésage fin, un alésage moyen et un alésage de large à l'embouchure de la pipette.
- Après une incubation de 20 min dans la solution T, ajouter 20 ml d'une solution d'inhibiteur de trypsine / DNase (solution W, tableau 5) à la suspension du cervelet et les cellules de bouletage à 1000 g pendant 1 min dans une centrifugeuse de paillasse (tableau 1).
- Décanter le surnageant et remettre le culot cellulaire dans 1,5 ml d'une concentration de trypsine / inhibiteur de la DNase (solution C, tableau 6) en utilisant le plus large pipette alésage.
- Triturer les cellules en utilisant d'abord la pipette grand diamètre, puis le milieu alésage et enfin l'alésage étroite jusqu'à la suspension cellulaire est homogène. Ceci est une étape clé, la suspension doit être homogène à ce stade.
- Couche la suspension cellulaire sur le dessus de 10 ml d'une préchauffé (37 ° C) de sérum albumine bovine complétée Earles Solution équilibrée Sels (tableau 7) dans un tube de 15 ml stérile.
- Centrifuger la suspension pendant 5 min à 1500 g et remettre en suspension les cellules dans 2 ml de préchauffée à granulés (37 ° C) milieu de culture (tableau 8).
- Estimer le nombre de cellules en utilisant un hémocytomètre (tableau 1) et diluer la suspension de cellules à une densité finale de 3,3 x 10 6 cellules par ml.
- Les cellules sont étalées en ajoutant 75 pl de la suspension cellulaire au centre de la poly-D-lysine lamelles (densité finale de 2,5 x 10 5).
- Les plaques de culture contenant les lamelles sont placées dans l'incubateur à CO 2 pendant 60 minutes pour permettre aux cellules d'unDhere.
- Ajouter 1,5 ml de milieu de culture dans chaque puits en prenant soin de ne pas déranger les cellules étalées et retourner les plaques de culture à l'étuve à CO 2.
- Le jour suivant, remplacer le milieu de culture avec un milieu de culture frais complété avec les inhibiteurs de la cytosine arabinoside mitotique (tableau 8). Cette prolifération des arrestations de cellules gliales en culture.
2. Installation expérimentale
- Dispositif expérimental de base devrait comprendre les éléments suivants (voir les tableaux 1 et 9 pour les équipements spécifiques et des logiciels utilisés):
- Inversé épifluorescence microscope
- Refroidi caméra CCD
- Source de lumière fluorescente (monochromateur ou roue à filtres)
- Appareil de perfusion par gravité
- Chambre de l'imagerie avec des électrodes de platine parallèles
- Stimulateur électrique
- Ordinateur
- Logiciel d'acquisition d'images
- Les expériences doivent être réalisées dans l'obscurité ou sous lumière rouge conditions avec éclairage fluorescent minimale de l'échantillon afin d'éviter de teinture FM blanchiment.
- Les expériences sont réalisées à température ambiante. Si la température physiologique est nécessaire, un système de perfusion à température contrôlée peut être utilisé.
3. Préparation des échantillons
- Les cultures devraient être utilisées après 8-12 jours in vitro.
- Transfert d'une lamelle unique pour une solution saline (tableau 10) pendant 10 min à température ambiante pour permettre la stabilisation de ce nouveau média.
- Retirer la lamelle, à sec sa face inférieure et la zone entourant les cellules attachées avec un petit morceau de serviette en papier ou du papier absorbant.
- En utilisant de la graisse silicone (tableau 2), de la colle sur la lamelle à la partie inférieure de la chambre de l'imagerie. Les cellules doivent être entre les deux fils parallèles. Graisse silicone suffisantes devraient être utilisés pour sceller complètement la chambre, mais sans aucune graisse entrant dans le centre de la chambre de bain.
- Doucement remplir la chambre de bain avec ~ 260 ul SAsolution de ligne, puis remplir le tube d'entrée avec la même solution.
- Collez une lamelle propre avec de la graisse silicone sur le haut de la chambre pour le sceller. Le tube d'entrée et de sortie peuvent être utilisés pour éliminer les bulles d'air piégées dans la chambre. Il est important que le circuit électrique n'est pas interrompue par des bulles d'air.
- Immobiliser la chambre de l'imagerie dans une plate-forme en acier inoxydable et vérifier les fuites par la douceur de perfusion de solution saline à travers la tubulure d'entrée.
- Mont de la chambre monté sur la scène d'un microscope inversé, et relier la chambre à un système de perfusion par gravité, après avoir amorcé l'entrée avec une solution saline.
- Fixer des fils de liaison de la chambre au stimulateur électrique.
- Ajouter une goutte d'huile d'immersion à l'objectif, si une lentille de l'huile est utilisée. Focus sur les cellules dans le milieu de la chambre en utilisant l'éclairage en champ clair.
4. Phase S1
- Neurones perfuser avec 1,5 mlde la FM colorant (tableau 2) dilué dans une solution saline.
- Stimuler les neurones pour évoquer l'absorption de colorants en utilisant le stimulateur ci-joint.
- Après stimulation, les neurones perfuser avec une solution saline fraîche pendant 2 min pour laver l'excès de teinture FM (débit de 7 ml / min). Contamination gliales dans le système de culture CGN est inférieure à 5% 14, donc ce délai est suffisant pour éliminer le colorant .
- Laisser reposer les neurones pendant 8 min.
- Pendant cet intervalle, de localiser les réseaux où les axones individuels FM terminaisons nerveuses chargées de teinture sont visibles à l'aide des longueurs d'onde de fluorescéine (excitation, 480 nm; émission> 550 nm). Évitez les zones avec des amas de cellules. Gardez l'éclairage au minimum à cette étape, puisque d'excitation intense peut entraîner phototoxicité colorant. Des signes évidents de cette situation sont blebbing des axones et un manque de colorant déchargement (en raison de colorant de fixation).
- Réorienter l'image immédiatement avant l'acquisition d'images depuis une légère dérive a pu se produire pendant la période de repos.
- Commencez d'acquisition d'image time-lapse au taux de 1 image toutes les 4 s.
- Après l'acquisition de 5 à 10 images de référence, évoquent l'exocytose des RRP en délivrant une stimulation à 30 Hz pendant 2 s (60 potentiels d'action) 8 Commencer une stimulation manuelle immédiatement après la capture de trame..
- Après l'acquisition de 10 autres images évoquent l'exocytose SV de la RP en utilisant trois stimulations de 40 Hz pendant 10 s (400 potentiels d'action), chaque 30 s sauf 8.
- Acquérir un autre 5 - 10 images et d'acquisition d'image de pause.
5. Phase de récupération (voir Figure 2)
- Permettent aux neurones de récupérer au moins 20 min.
- Optionnel - Si l'effet d'un médicament sur l'endocytose est d'être testés, les neurones perfuser avec une solution de drogue au cours de cette période (figure 2b) 3,8.
6. Phase S2
- Répétez le protocole de phase S1 (section 4) pour une expérience de contrôle utilisant le même champ de vision queen S1.
- Optionnel - Si l'effet d'un médicament sur l'endocytose est d'être testé, perfuser neurones avec la solution médicamenteuse complétée par FM colorant (Figure 2b) 3,8.
- En option - Alternativement, si effets des médicaments sur l'exocytose sont d'intérêt, les neurones perfuser avec la solution médicamenteuse à la fois avant et pendant le RRP et RP stimuli déchargement (figure 2c) 3.
7. Analyse des données
- Utilisez ImageJ et Microsoft Excel ou un logiciel similaire pour l'analyse des données.
- Pour l'analyse, une séquence d'images au format pile est nécessaire. Certains logiciels d'imagerie peuvent exporter des séquences sous forme d'images unique. Si c'est le cas, de convertir des images d'une pile en utilisant une ImageJ intégré la fonction d'image> Piles> Images de la pile.
- Réglez la luminosité et le contraste de la pile afin de maximiser la plage dynamique. Image> Réglages> Luminosité / Contraste (figure 3a).
- Si importante dérive horizontale s'est produite pendant tIl expérimentation, exécutez StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) et TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) plugins sur ImageJ pour aligner la pile d'images (figure 3B) .
- Run Time Series Analyseur de plugin ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (figure 3C).
- Définir des régions d'intérêt (ROI) sur au moins 90 terminaisons nerveuses. Ceux-ci devraient être identiques (ROIs circulaire avec un diamètre de 1,5 um) Il est utile de basculer entre les images avant et après le déchargement de teinture pour révéler les terminaisons nerveuses actives (alternativement une stimulation pré-image peut être soustraite de l'image post-stimulation). Un idéal Taille ROI est une qui est légèrement plus grand qu'un terminaison nerveuse typique (figure 3C).
- Obtenir l'intensité totale / intégrée de fluorescence de chaque ROI plus time et l'exportation vers Microsoft Excel (figure 3d et 4a).
- Normaliser les traces ROI à la même valeur arbitraire en alignant des traces dans le plan de l'axe Y pour le premier stimulus de déchargement dans les phases à la fois S1 et S2 (figure 4b-c). C'est à contrôler pour de petites variations d'intensité de fluorescence de fond.
- Mesurer la baisse absolue de la fluorescence provoquée par chaque stimulation du déchargement en unités arbitraires de fluorescence pour S1 et S2 comme suit (figure 4D):
- RRP = changement de fluorescence (AF) déclenchée par 30 Hz 2 s
- RP = Somme des AF déclenchée par 3 x 40 Hz 10 s
- Piscine de recyclage total = RRP + RP
- Pour chaque paramètre pertinent dans 7,9, calculer la valeur moyenne sur toutes les terminaisons nerveuses d'une expérience unique.
- Pour l'analyse statistique, les valeurs moyennes obtenues à partir de plusieurs expériences indépendantes peuvent être calculées. Le nombre de lamelles plutôt que le nombre de terminaisons nerveuses doivent être utilisées comme STATISTICAL n.
8. Les résultats représentatifs:
Une expérience de contrôle, où CGN subi deux séries d'étapes de chargement et déchargement identiques est représenté dans la figure 5. Au moment de commencer une série d'expériences, il est essentiel que le contrôle d'une expérience comme celle-ci est effectuée chaque jour afin de confirmer que S1 et S2 sont comparables avant différentes conditions expérimentales durant S2.
Dans cet exemple, du SCT ont été chargés avec 10 uM FM1-43 en utilisant une stimulation de 80 Hz 10 s (figure 5a). La figure 5b montre les terminaisons nerveuses FM1-43-chargés représenté par fluorescence lacrymaux. ROIs ont été définis plus de 90 terminaisons nerveuses comme le montre la figure 5c. Le même ensemble de ROIs a été utilisé à la fois pour S1 et S2. Pendant deux décharge, le RRP a été déchargé avec un 30 Hz (2 s) de stimulation suivis de RP déchargement avec 3 40Hz séquentielle (10 s) des stimuli (figure 5a). La chute de fluorescence lors de chaque stimulus peut être clairement observé et quantifié (figure 5d-e). À l'examen, la fluorescence gouttes correspondant à la PRR, RP et la piscine de recyclage total étaient comparables dans les deux S1 et S2. En outre, 20% de matériaux recyclés SV résidé dans le RRP, alors que 80% résidaient dans les RP à la fois dans S1 et S2.

Diagramme schématique figure 1 d'une expérience typique FM. A) l'endocytose SV est déclenchée dans la présence de colorants FM (représenté en vert). Le colorant est absorbé par la membrane invagination (seule ou en vrac endosomes SV). B) non internalisés colorant sur la membrane plasmique est emporté par perfusion. C) Sur demande d'un stimulus de déchargement, étiquetés SV qui sont devenus disponibles pour le fusible communiqué avec la membrane plasmique qui entraîne une perte de fluorescence. D) Le changement de fluorescence (AF) qui est proportionnelle à la quantité d'libérés étiquetés SVS peut alors être quantifiée.
_upload/3143/3143fig2.jpg "/>
Figure 2 Schémas des éventuels protocoles expérimentaux. Ordinogramme A) d'une expérience de contrôle où les cellules subissent deux tours de FM colorant de chargement et de déchargement (S1 et S2). Les cellules peuvent être chargées en utilisant une gamme de différents stimuli. Étapes de déchargement sont identiques dans le RRP est déchargée à 30 Hz pendant 2 s suivis de RP déchargement utilisant 3 fois 40 Hz pendant 10 s. RRP et réserver la piscine stimuli déchargement étaient séparés par 40 secondes, tous les autres stimuli de 30 sec. Les cellules sont laissées à récupérer pendant 20 minutes entre S1 et S2. Les diagrammes de modifications possibles pour tester l'effet d'une substance soit sur B) endocytose ou C) exocytose sont également représentées. Médicament d'essai correspondantes peuvent être perfusés dans la chambre pendant les périodes indiquées.
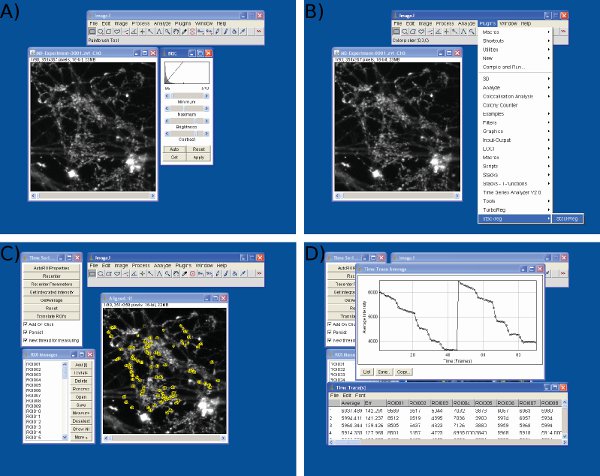
Figure 3 Screenshots de l'analyse des données dans Image J. Screenshots sont montréspour une luminosité) et de réglage du contraste, B) de verrouillage de trame, c) la sélection ROIs, et D) valeurs d'intensité d'extraction en utilisant l'image J.
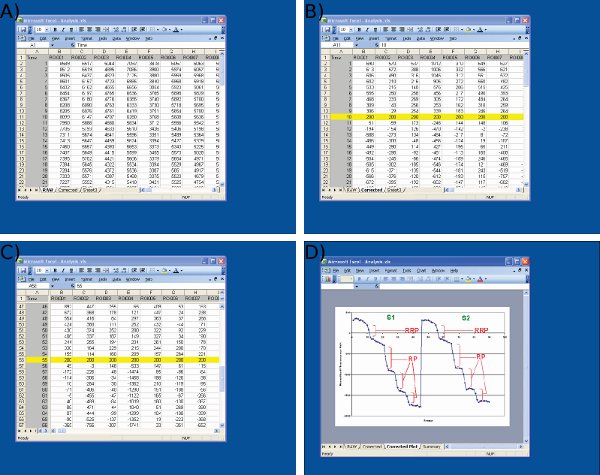
Figure 4 Screenshots de l'analyse des données dans Microsoft Excel. Captures d'écran sont indiqués pour un) d'importer des données brutes provenant Image J (1 ère colonne = numéro de châssis, les colonnes restantes = données à partir des terminaisons nerveuses individuelles) b) Ajustement des valeurs de référence S1 (image 10) pour une valeur arbitraire (200) au début du premier stimulus, C) l'ajustement des valeurs de référence S2 à l'image 55 en utilisant un protocole identique à S1 et D) de mesure de gouttes de fluorescence à l'aide de Microsoft Excel. Notez que la trace moyenne montré dans D est utilisé pour définir des points de temps avant et après chaque chute. La taille des gouttes de fluorescence pour chaque ROI doit être déterminée à partir de valeurs sur la feuille de calcul indiqué dans C.

Figure 5. Expérience de contrôle représentant. Ordinogramme A) d'une expérience de contrôle où CGN ont été chargés avec 10 uM FM1-43 à l'aide de 80 Hz (10 s) de stimulation. Les phases S1 et S2 sont identiques. RRP et réserver la piscine stimuli déchargement étaient séparés par 40 secondes, tous les autres stimuli de 30 sec. B) Une image montrant les terminaisons nerveuses chargées par FM1-43. C) La même image que B montrant 90 ROIs numérotées sélectionnés pour analyse. D) Les images d'une région représentée par un rectangle rouge en B à des moments choisis. = Basal avant la stimulation; 30 Hz = 30 Hz après stimulation 2 s, 40 Hz = 1,2,3 après chaque stimulation 40 Hz 10 s. Ces images sont présentées dans le pseudo d'illustrer les changements de fluorescence (barre de spectre affiché sur la droite). E) Moyenne ± SEM traces obtenues à partir de 90 terminaisons nerveuses représenté dans les stimuli C. individuels sont représentés par des barres horizontales. Barres d'échelle = 10 um.
Discussion
Colorants FM sont largement utilisées pour étudier la fonction terminaisons nerveuses dans de nombreuses préparations neuronales. Ils ont été principalement employés pour surveiller l'étendue de la SV soit endocytose, le chiffre d'affaires SV ou la cinétique d'exocytose 6. Le protocole décrit étend ces études afin d'examiner le différentiel de déchargement des piscines SV spécifiques. Cela fournit des informations supplémentaires concernant la reconstitution des piscines SV et aussi leur degré de mobilisation.
Colorants FM peut être utilisé pour l'étiquette de multiples séries de recyclage de SV au sein des terminaux même nerf. Nous avons exploité cette propriété et conçu des protocoles dans lesquels le chiffre d'affaires SV dans chaque terminal peut être contrôlé à deux reprises dans les bornes même nerf. Ceci fournit un contrôle précis interne, ce qui est essentiel en raison de la nature hétérogène du recyclage SV dans les terminaisons nerveuses parallèles 11. Via l'utilisation de la phase S1 comme un contrôle interne, le remplissage du PRR, RP et le totalPiscine SV dans la présence de drogues peut être fiable et directement comparés.
En plus de fournir des informations sur la taille absolue du recyclage, des piscines RRP et RP, dans des conditions de stimulation différents, ce protocole peut également fournir des données pour les suivants - 1) Le cloisonnement des SV entre le RRP et RP en fonction de la piscine de recyclage pour S1 et S2, 2) la taille relative des piscines S2 (RRP et RP) en fonction de la piscine de recyclage total S1 et 3) la taille relative de n'importe quelle piscine SV définie dans S2 en fonction de la piscine même en S1. Ce protocole particulier ne sera pas de fournir des informations sur la cinétique de déchargement cependant, puisque le temps d'acquisition est trop lent (pour les mesures cinétiques temps d'acquisition doit être aussi rapide que possible et au déchargement automatiquement synchronisées dans la capture d'image).
Nos 30 Hz 2 stimuli s évoque une mesure identique de RRP déchargement au saccharose hypertonique 8. Comme la taille du RRPest définie par le saccharose hypertonique de déchargement 15, nous pouvons affirmer que ce protocole décharge tous les VS RRP, en accord avec les études dans les neurones hippocampiques 16. Le pool de réserve est presque complètement épuisée par trois trains de 400 stimuli (40 Hz 10 s chacun) puisque cette stimulation décharge une quantité identique de teinture à un paradigme (2 stimuli avec 50 mM de KCl) qui épuise 95% de tous les colorants SV-étiquetés 8,17. La quantification précise de la taille à la fois du PRR et de la Réserve piscine est également dépendante de l'acquisition de l'information au sein de la gamme dynamique linéaire de la caméra CCD.
Ce protocole simple peut également être modifiée davantage. La force de stimuli de chargement peut également être modifiée afin de déterminer comment l'activité neuronale et des modes d'endocytose différentes affectent réapprovisionnement piscine SV. Par ailleurs, plus de deux cycles de chargement et le déchargement peut également être effectuée si nécessaire. Ce protocole peut aussi être utilisé dans les cellules transfectées avec surexpression ouvecteurs shRNA. En raison de la faible efficacité de transfection de cultures primaires de neurones, protéines exprimées doivent être étiquetés avec des protéines fluorescentes. Il est essentiel que ces balises fluorescentes ne pas interférer avec le signal FM colorant (ou protéines utilisent cyan rouge, par exemple). Dans ce cas, les terminaisons nerveuses des cellules transfectées et non transfectées dans le même champ de vision peuvent aussi être comparés en tant que contrôle supplémentaire 8. Dans les expériences d'une telle comparaison de l'étendue de chargement entre les charges S1 et S2 est de peu de valeur, puisque la perturbation est présente pendant les deux charges. Le partitionnement d'un colorant entre les pools de SV peut encore être visualisés Mais 8.
Journalistes génétique appelée pHluorins peut également être employé pour surveiller l'exocytose et l'endocytose SV dans la culture neuronale primaire. Ces sondes utilisent un pH-sensibles protéine fluorescente verte à l'environnement pH de domaines luminale des protéines étiquetées comme les SV VAMP, synaptophysine et VGLUT1 18 . Lorsqu'il est utilisé conjointement avec des inhibiteurs de l'ATPase vésiculaire, pHluorins peut signaler la fois la cinétique et l'ampleur de la mobilisation piscine SV 19. L'approche à base de colorants FM-décrite ici a quelques avantages sur la technique pHluorin, d'abord, les colorants FM fournir des informations sur le mode d'endocytose SV réapprovisionne le RRP et les piscines réserve 8. Deuxièmement spécifiques piscines SV peuvent être étiquetés avec des colorants FM qui ont différentes propriétés spectrales 20 et enfin il n'est pas nécessaire pour la transfection. Colorants FM ne peut pas fournir des informations sur le trafic entre la SV de repos et de recyclage des piscines SV cependant (contrairement à pHluorins 19), puisque par définition SV doivent être chargées avec un colorant lors de l'endocytose pour être visibles. Ainsi, les deux colorants FM et pHluorins ont des forces et faiblesses et sont plus puissants lorsqu'ils sont utilisés dans des expériences indépendantes pour traiter la même question.
Des images de haute qualité sont essentielles à l'analyse valides et reproducibLe résultat. Alors que la dérive horizontale peuvent être facilement corrigées, des expériences où il ya une dérive dans l'axe Z ne peuvent pas être récupérés. Pour cette raison, il est important de recentrer les images avant de commencer le déchargement S1 et S2. Dans les cas où une dégradation significative fluorescente a eu lieu, des corrections carie peut être appliquée (généralement en soustrayant une trace précédemment enregistré de FM-chargé cellules en l'absence de stimulation). Cependant, il est suggéré que la correction n'est effectuée que la carie de la représentation graphique et de ne pas être utilisé pour une analyse quantitative.
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Ce travail a été soutenu par une subvention du Wellcome Trust (Ref: 084277).
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Société | Catalogue no. | |
|---|---|---|---|
| AxioCam MRM Rev 3 Appareil photo numérique | Carl Zeiss | 4265099901000 | |
| Axio Observer.A1 Microscope | Carl Zeiss | 4310040000000 | |
| Des plaques de culture cellulaire (6 puits) | Greiner Bio-One | 657160 | |
| Centrifugeuse (Universal 32R) | Hettich Zentrifugen | 1610 | |
| Incubateur à CO 2 | Heraeus Instruments | 51014042 | |
| Tubes Falcon (15/50 ml) | Greiner Bio-One | 188271/210261 | |
| Fluar 20X / 0,75 / ∞ 0,17 Objectif | Carl Zeiss | 4401459901000 | |
| Verre lamelles (Ø25mm) | VWR International | 631-1584 | |
| Pipettes Pasteur en verre (230 nm) | Greiner Bio-One | 612-1799 | |
| Hémocytomètre | VWR | 15170-170 | |
| Imagerie de chambre | Warner | RC-21 BRFS | |
| Hotte à flux laminaire | BIOHIT | VLF BHS 1200 | |
| Chopper tissu McIlwain | Mickle Laboratory Engineering Co. Ltd | MTC / 2 | |
| Lampe à mercure | Carl Zeiss | HBO 103 | |
| MultiStim système électrique Stimulateur (100mV, 1ms Largeur Pluse) | Digitimer Ltd | D330 | |
| Pompe à perfusion | Watson-Marlow | 313S | |
| Pipettes sérologiques (10/05/25 ml) | Greiner Bio-One | 606180/607180/760180 | |
| Shutter contrôleur | Carl Zeiss | MAC5000 | |
| Seringue (20 ml) | BD Plastipak | ST01-B002 | |
| Filtres pour seringues (Minisart - 0,20 um) | Sartorius Stedim | 16532 | |
| VC-6 Six contrôleur de vanne Manche | Warner | 64-0135 | |
| YFP Filter ensemble (Set 46) | Carl Zeiss | 1196-681 |
Tableau 1. Equipements spécifiques et appareils utilisés
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| FM1-43 | BioScience Cambridge | BT70021 | 10 pM |
| FM2-10 | BioScience Cambridge | BT70044 | 100 pM |
| Poly-D-lysine | Sigma | P7886 | 15 pg / ml |
| De la graisse silicone | Sigma | 85403 | - |
Tableau 2. Des réactifs spécifiques utilisés
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| Albumine sérique bovine (BSA) | Sigma | A4503 | 0,3% |
| D-glucose | Sigma | G5767 | 0,25% |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| D-PBS | Gibco | 21300 | 960 mg/100 ml |
-Faire des frais 100ml pour chaque préparation
-Filtre stérile avant utilisation
Tableau 3. Solution B pour la préparation de la CGN
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| Solution B | - | - | 19 ml |
| La trypsine (5 mg / ml stock, -20 ° C) | Sigma | T9201 | 1 ml |
Tableau 4. Solution T pour la préparation de la CGN
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| Solution C | - | - | 3,2 ml |
| Solution B | - | - | 16,8 ml |
Tableau 5. Solution W pour la préparation CGN
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| Désoxyribonucléase (DNase, 500 U par 0,5 ml de bouillon, de -20 ° C) | Sigma | D5025 | 0,5 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| Solution B | - | - | 10 ml |
| Inhibiteur de trypsine de soja (SBTI, 0,5 mg par 0,5 ml de bouillon, de -20 ° C) | Sigma | T9003 | 0,5 ml |
Tableau 6. Solution C pour la préparation CGN
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| Albumine sérique bovine (BSA) | Sigma | A4503 | 4% |
| Earle solution saline équilibrée (EBSS) | Gibco | 24010 | 10 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 3 mM |
Tableau 7. Solution pour la préparation de la CGN EBSS
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| Cytosine β-D-arabinofuranoside (Ara-C) * | Sigma | C1768 | 10 pM |
| Fœtale sérum bovin | Gibco | 10106 | 10% |
| D-glucose | Sigma | G5767 | 30 mM |
| L-glutamine | Sigma | G3126 | 2 mM |
| KCl | Sigma | P5405 | 25 mM |
| Milieu essentiel minimal (MEM) | Gibco | 21090 | 500 ml |
| La pénicilline (P) / streptomycine (S) | Gibco | 15140 | 100 U / ml (p), 100 pg / ml (S) |
* Ara-C doit être ajouté au milieu d'une DIV partir
Tableau 8. Milieux de culture pour la préparation CGN
| Nom | Version | Société |
|---|---|---|
| AxioVision Rel. | 4.8 | Carl Zeiss |
| ImageJ | 1.42q | National Institutes of Health |
| Microsoft Excel | 2003 | Microsoft |
Tableau 9. Logiciels informatiques spécifiques utilisés
| Nom | Société | Catalogue no. | Concentration |
|---|---|---|---|
| CaCl 2 · 2H 2 O | Sigma | C7902 | 1,3 mM |
| Le glucose | Sigma | G5767 | 5 mM |
| KCl | Sigma | P5405 | 3,5 mM |
| KH 2 PO 4 | Sigma | P9791 | 0,4 mM |
| MgCl 2 · 6H 2 O | Sigma | M0250 | 1,2 mM |
| NaCl | Fluka | 71378 | 170 mM |
| NaHCO 3 | Fluka | 71627 | 5 mM |
| Na 2 SO 4 | Fournitures de laboratoire BDH | 10264 | 1,2 mM |
| TES | Sigma | T1375 | 20 mM |
Tableau 10. Solution saline (pH 7,4)
Références
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon