Method Article
FM染料を用いて培養小脳顆粒神経細胞のシナプス小胞プールの補充の定量分析
要約
中枢神経終末で補充し、特定のシナプス小胞の動員(SV)のプールを定量化するために、ライブ蛍光イメージング技術が記載されている。 SVリサイクルの2つのラウンドは、内部統制を提供する同じ神経終末に監視されます。
要約
中枢神経終末における神経伝達物質の放出の後、SVSは迅速にエンドサイトーシスによって取得されます。 SVSは、その後、神経伝達物質を充填し、エキソサイトーシスの1,2で使用可能なSVSなど定義されているリサイクルのプールを、再度参加している取得。容易に放出できるプール(RRP)と予備プール(RP) - リサイクルプールは一般的に2つの別個のプールに分割できます。その名前が示すように、RRPはRP SVSを強烈な刺激の1,2の間にのみリリースされている間の融合のために即座に使用できるようSVSの構成されています。 1)を理解するためにこれらのSVのプールの差動補充を報告する信頼性の高いアッセイを持つことが重要ですどのようにSVSのエンドサイトーシスの異なるモード後のトラフィック(たとえば、クラスリン依存性エンドサイトーシスおよび活動依存バルクエンドサイトーシスなど)と2)のメカニズム別の刺激に応答してRRPとRPの両方の動員を制御する。
FM色素は、日常的に採用されていますedは定量的に中枢神経端末3-8のSV売上高を報告する。彼らは、膜を横切って脂質二重層で可逆パーティショニングを可能にする疎水性の炭化水素の尾部、および親水性のヘッドグループをブロックの通路を持っている。色素は水溶液中ではほとんど蛍光持っているが、膜9でパーティション化されたときに、その量子収率が飛躍的に増加する。したがって、FM色素は積極的にSVSをリサイクル追跡するための理想的な蛍光プローブである。 FM染料の使用のための標準プロトコルは、次のとおりです。まず、彼らは、神経細胞に適用され、エンドサイトーシス(図1)中に取り上げられている。非内部化染料の後、原形質膜、リサイクルのプール内でリサイクルされたSVSの再配布から洗い流される。これらのSVSはその後、アンロードの刺激(図1)を使用して消耗している。のSV FM色素のラベリングは、量子10であるので、結果として得られる蛍光の低下が放出小胞の量に比例します。このように、SVSのリサイクルと融合はPRから生成エンドサイトーシスのeviousラウンドは確実に定量することができる。
ここで、我々は、情報の2つの追加要素を取得するために変更されているプロトコルを示す。まず、シーケンシャルアンロードの刺激は、特定のSVのプールの補充の定量化を可能にするために、差RRPとRPをアンロードするために使用されます。第二に、それぞれの神経終末は二回プロトコルを受ける。従って、S1の同じ神経終末の応答は、内部統制を提供し、S2の位相(図2)における被験物質の存在と比較することができます。異なる神経端子間SVリサイクルの程度は11非常に可変であるため、これは重要です。
どんな接着初代神経培養はこのプロトコルのために使用されるかもしれない、しかし播種密度、ソリューションと刺激条件は、小脳顆粒ニューロン(CGNS)12,13用に最適化されています。
プロトコル
1。小脳顆粒ニューロンの準備
- 約100直径25mmのカバースリップ(表1)オートクレーブ。
- 滅菌ポリ- D -リジン溶液(表2)を含む50 mlの滅菌チューブに場所のカバースリップ。コートカバースリップを2時間回転台の上に置きます。
- 層流フードで滅菌ティッシュペーパーでドライコーティングカバーガラス(表1)。
- 無菌6ウェルプレートおよびCO 2インキュベーター(表1)で暖かい。 カバーグラスに入れますカバースリップは使用前に4℃で1ヶ月間保存できます 。
- 地元の倫理委員会のガイドラインに従って子犬7日間の古いのSprague Dawleyラットを安楽死させる。我々は、頸椎脱臼を使用して子犬を安楽死。
- 小脳を摘出し、リン酸塩溶液(溶液B、表3)バッファを含む滅菌ペトリ皿に入れてください。
- 4月6日仔ラットのためのステップ1.5および1.6を繰り返します。
- 小脳は、マッキルウェーン組織チョの無菌ステージ上に配置されていますPPER(表1)。組織は、90度のステージを回転させ、プロセスを繰り返す前に、375μmの間隔で切り刻まれている。
- みじん切り小脳は、以前は次の37暖めていたトリプシン溶液(溶液T、表4)℃に転送されます。
- 37インキュベート小脳℃で穏やかに攪拌しながら約5分毎と20分。
- 中のトリプシン消化、火炎研磨ブンゼン火炎を使用して、3つの滅菌ガラスピペット(表1)。ピペットのそれぞれの口で細かいボア、ミディアムボアと広いボアを作成するには、炎を使用しています。
- ソリューションのTで20分間インキュベートした後、ベンチトップ遠心機(表1)で1分間1,000 gで小脳サスペンションと細胞をペレット化するためにトリプシン/ DNaseを阻害剤溶液(溶液W、表5)20 mlを加える。
- 上清をデカントし、広いボアピペットを用いて濃縮されたトリプシン/ DNaseを阻害剤(溶液C、表6)1.5 mlに細胞ペレットを再懸濁します。 最初のワイドボアピペットを用いて細胞をひいて粉にする、そしてミディアムボアと最終的にナローボア。 これは重要なステップであり、懸濁液は、この段階で均質にする必要があります 。
- 10mlの上の層の細胞懸濁液温めておいた(37℃)滅菌15 mlのチューブにウシ血清アルブミンを補充Earlesバランス塩溶液(表7)。
- 1500 グラムで5分間懸濁液を遠心し2で(37℃)温めておいたのMLS培地(表8)を細胞ペレットを再懸濁します。
- haemocytometerを用いて細胞数(表1)を推定し、mlあたり3.3 × 10 6細胞の最終的な密度に細胞懸濁液を希釈する。
- 細胞をポリ- D -リジンでコーティングされたカバースリップ(最終密度2.5 × 10 5)の中心に細胞懸濁液の75μlを添加してメッキが施されています。
- カバースリップを含む培養プレートに細胞を可能にするために60分間CO 2インキュベーター内に配置されていますdhere。
- 各ウェル播種した細胞を邪魔し、CO 2インキュベーターに培養プレートを返すように注意しながら中に培養液の1.5ミリリットルを追加。
- 翌日は、有糸分裂阻害剤シトシンアラビノシド(表8)を添加した新鮮培地で培養液を交換してください。 培養中のグリア細胞のこの逮捕の増殖 。
2。実験的なセットアップ
- 基本的な実験は、(使用される特定の機器およびソフトウェアのための表1と表9を参照)、以下で構成する必要があります。
- 反転落射蛍光顕微鏡
- 冷却CCDカメラ
- 蛍光光源(単色光分光器またはフィルタホイール)
- 重力の灌流装置
- パラレル白金電極とイメージング室
- 電気刺激装置
- コンピュータ
- 画像取得ソフトウェア
- 実験は、暗所でまたは赤色光のcondの下で実行する必要があります漂白FM色素を避けるために、サンプルの最小蛍光照明付きitions。
- 実験は室温で実施されています。生理的な温度が必要な場合は、温度制御灌流システムを使用することができます。
3。サンプル準備
- 培養物は、in vitroで 8〜12日後に使用する必要があります。
- 新しい培地で安定化を可能にするために室温で10分間、生理食塩水(表10)に、単一のカバースリップを転送する。
- 、カバーを取り外し、その下側およびペーパータオルまたは吸収紙の小片と接着細胞の周囲を乾燥させる。
- 接着剤イメージングチャンバーの下側にカバーガラス、シリコーングリース(表2)を使用する。細胞は二つの平行線の間でなければなりません。十分なシリコーングリースは、入浴室の中央に入るあらゆるグリースなしで完全にチャンバーを密閉するために使用されるべきですが。
- そっと〜260μlのSAでお風呂室を埋めるラインのソリューションと、同じソリューションで入力チューブを埋める。
- それを密閉するチャンバの上部に接着剤シリコーングリースを持つクリーンなカバーを。入力と出力管をチャンバー内に閉じ込められた気泡を除去するために使用することができます。 これは、電気回路が気泡によって中断されないことが重要です 。
- ステンレス製のプラットフォームでのイメージング室をImmobiliseゆっくりと入力チューブを通して生理食塩水を灌流することで漏れをチェックします。
- 倒立顕微鏡のステージ上に組み立て室をマウントして、重力の灌流システムにチャンバーを接続するには、まず生理食塩水で口をプライミングした。
- 電気刺激装置にチャンバーのワイヤを接続して取り付けます。
- オイルのレンズが使用されている場合は客観的にイマージョンオイルの滴を追加します。明視野照明を用いてチャンバーの中央にある細胞に焦点を当てる。
4。 S1フェーズ
- 1.5mlでニューロンを灌流生理食塩水で希釈したFM色素(表2)の。
- 付属の刺激を用いた色素の取り込みを喚起するニューロンを刺激する。
- 刺激の後、2分間新鮮な生理食塩水で浸み込ませる神経細胞が離れて過剰FM色素(流量率7 ml /分)を洗浄する。CGN培養系におけるグリア汚染が5%未満14です、したがって、この時間枠は、色素を除去するのに十分です。 。
- 8分間休息するニューロンを残す。
- このインターバルの間に、個々のFM色素負荷の神経終末が見える使用してフルオレセインの波長(;放射、> 550nmの励起、480nm以下)である軸索のネットワークを探します。細胞のクラスターを持つ領域を避けてください。 強い励起は色素光毒性をもたらすことができますので、この段階で最小限に照明をキープ。このモードでの明らかな兆候は、軸索と染料アンロード(固定を染色するため)の不足のブレブ形成されています 。
- 再フォーカスの画像はすぐに画像取得の前にわずかなドリフトので、残りの期間中に発生した可能性があります。
- 1フレームの速度は4秒でタイムラプス画像取得を開始
- 5取得した後- 10ベースラインの画像を、2秒(60活動電位)8 30 Hzの刺激を提供することで、RRPのエキソサイトーシスを呼び起こすフレームのキャプチャ後に手動ですぐに刺激を開始する 。。
- 別の10枚の画像を取得した後、離れて10秒(400活動電位)を40 Hzの三刺激を使用してRP、各30秒8のSVエキソサイトーシスを呼び起こす。
- 別の5を獲得 - 10個のイメージして、一時停止の画像取得を。
5。回復フェーズ(図2を参照)
- ニューロンは少なくとも20分以上回復することができます。
- オプション -エンドサイトーシスに対する薬剤の効果がテストされる場合、3,8(図2b)この期間中に薬液とニューロンを灌流。
6。 S2フェーズ
- とビューの同じフィールドを使用して対照実験のためにS1フェーズプロトコル(セクション4)を繰り返します。S1インチ
- オプション -エンドサイトーシスに対する薬剤の効果がテストされる場合、FM色素(図2b)3,8を添加した薬液とニューロンを灌流。
- オプション -エキソサイトーシスに対する薬剤の効果に関心がある代わりに場合、前とRRPとRP除荷の刺激(図2c)3時の両方の薬液で浸み込ませるニューロン。
7。データ解析
- ImageJとMicrosoft Excelやデータ解析のための同様のソフトウェアを使用してください。
- 分析のために、スタック形式のイメージシーケンスが必要です。いくつかのイメージングソフトウェアは、単一のイメージとしてのシーケンスをエクスポートできます。このような場合は、内蔵機能のイメージ>スタック>画像がスタックに ImageJを使用してスタックに画像を変換します。
- ダイナミックレンジを最大化するためにスタックの明るさとコントラストを調整します。 イメージ>調整>明るさ/コントラスト (図3a)。
- 重要な水平方向のドリフトは、tの間に発生した場合彼は実験、実行StackReg( http://bigwww.epfl.ch/thevenaz/stackreg/ )とTurboReg( http://bigwww.epfl.ch/thevenaz/turboreg/ ImageJの上に)プラグイン画像のスタック(図3b)を整列させる。
- 時系列解析のプラグイン(実行http://rsbweb.nih.gov/ij/plugins/time-series.html )(図3c)を。
- 少なくとも90神経終末上の関心の領域(ROI)を定義します。これらは、それがアクティブな神経終末を(代わりに、事前刺激のイメージは後の刺激の画像から減算することができます)明らかにするためにアンロード染料の前と後の画像を切り替えるために有用である(1.5μmの直径を持つ円形のROI)と同一である必要があります。 理想的には、 ROIのサイズは典型的な神経終末 (図3c) よりわずかに大きいものです 。
- ティム上の各ROIの合計/統合された蛍光強度を取得するMicrosoft Excelへの電子と輸出(図3D及び4A)。
- S1とS2の両方のフェーズの最初の荷刺激(図4b - c)のY -軸の平面でのトレースを調整することで、任意の同じ値にROIのトレースを正規化する。 これは、バックグラウンドの蛍光強度の小さな変動を制御することです 。
- 次のように、S1とS2の任意の蛍光単位(図4d)に各荷刺激により誘発される蛍光の絶対的減少を測定する。
- 蛍光のRRP =変化(ΔF)は、30Hzの2秒でトリガ
- RP = 3 × 40 Hzの10秒でトリガさΔFの合計
- 総合リサイクルプール= RRP + RP
- 7.9に関連する各パラメータに対して、単一の実験のすべての神経の端末上の平均値を計算する。
- 統計分析のために、複数の独立した実験から得られた平均値を平均化することができます。カバースリップの数ではなく、神経終末の数は、STATISTICAとして使用する必要がありますリットルをn
8。代表的な結果:
CGNSが同一のロードおよびアンロードの手順を2回施行した対照実験は、図5に表されます。一連の実験を開始するとき、それはこのような対照実験は、S1とS2はS2の間に実験条件を変える前に同等であることを確認するために、毎日実行されることが不可欠です。
この例では、CGNS、80 Hzの10秒の刺激(図5a)を使用して、10μMFM1 - 43を充填した。図5bは蛍光涙点で表されるFM1 - 43 -ロードされた神経末端を示しています。図5cに示すように、ROIは90神経末端を介して定義されていました。 ROIの同じセットはS1とS2の両方に使用されました。両方のアンロード時には、RRPは、最初の3シーケンシャル40Hzの(10秒)刺激(図5a)とアンロードRPで30 Hzの(2秒)刺激でアンロードされました。各刺激時の蛍光低下が明らかに(5D - E図)を観察し、定量することができる。調べたときに、RRP、RPと合計リサイクルのプールに対応する蛍光低下はS1とS2の両方で同等であった。 80%はS1とS2の両方のRPに居住しながら加えて、リサイクルのSV 20%がRRPに住んだ。

典型的なFM実験の模式図を示します 。 A)SVのエンドサイトーシスは、FM色素(緑色で表される)の存在下でトリガされます。染料はinvaginating膜(単SVはまたはバルクはエンドソーム)に取り込まれている。 B)原形質膜上の非内部化色素は灌流によって洗い流される。 C)蛍光が失われるおそれが原形質膜とリリースのヒューズのために利用可能となっているSVはラベルの付いたアン刺激、の申請により行う。 D)放出というラベルのSV量に比例する蛍光(ΔF)の変更は、定量することができる。
_upload/3143/3143fig2.jpg"/>
可能な実験プロトコルの2の回路図を図 。 A)細胞がFM色素の二回は、(S1とS2)のロードおよびアンロード受ける対照実験のフローチャートは。細胞は様々な刺激の範囲を使用してロードすることができます。 RRPは2秒間の30Hzでアンロードされるという点でアンロードする手順は同じですRPが続く10秒間に3回、40 Hzのを使用してアンロードRRPと予備のプールアンの刺激は30秒で40秒、他のすべての刺激により分離した。細胞は、S1とS2の間に20分間の回復に委ねられている。 B)エンドサイトーシスまたはC上の物質の影響をテストするために実行可能な変更のフローチャート)エキソサイトーシスも表示されます。対応するテストの薬は指示された期間中のチャンバー内に灌流することができます。
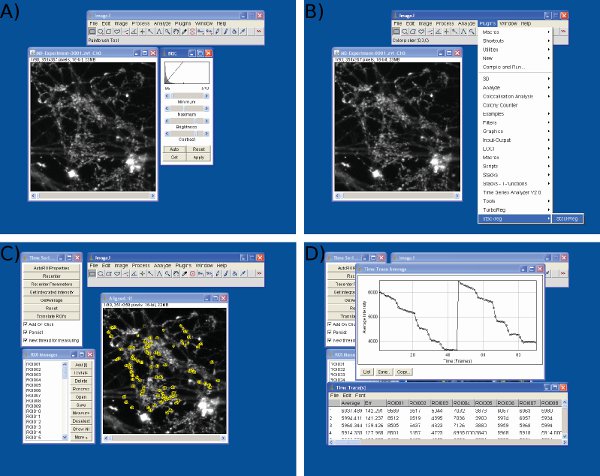
画像Jにおけるデータ分析の図3スクリーンショット 。スクリーンショットが表示されますイメージJ.を使用)明るさとコントラストの調整、B)フレームアライメント、C)のROIの選択、およびD)輝度値を抽出するための
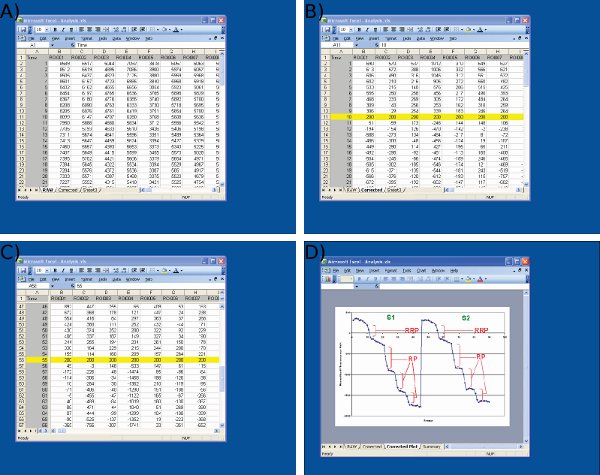
Microsoft Excelでデータ分析の4スクリーンショットを示します 。スクリーンショットは)イメージJ(第1列から生データをインポートするために示されている=フレーム番号、個々の神経終末からの残りの列は=データ)B)開始時に任意の値(200)S1から基準値(フレーム10)の調整S1に同じプロトコルを使用して、フレーム55でS2ベースライン値の最初の刺激の、C)の調整、およびMicrosoft Excelを使用して蛍光滴のD)を測定。 Dに示すように平均化されたトレースはそれぞれのドロップの前と後の時点を定義するために使用されていることに注意してください。各ROIのための蛍光滴のサイズは、Cに示すように、スプレッドシート上の値から決定されるべきである

図5。代表的な制御実験。 CGNSが80 Hzの(10秒)刺激を用いて10μMFM1 - 43を使ってロードした対照実験のA)フローチャート。 S1とS2の位相は同じです。 RRPと予備のプールアンの刺激は30秒で40秒、他のすべての刺激により分離した。 B)神経終末を示す画像は、FM1 - 43を搭載。 C)90番号のROIを示すBと同じ画像が分析のために選択。 D)選択した時点でBの赤いボックスで示されている領域の画像。刺激前の基礎=; 30 Hzの= 30Hzの2秒刺激後、40 Hzの1,2,3 =各40 Hzの10秒間刺激後。これらの画像は、蛍光の変化(右上に表示されるスペクトラムのバー)を説明するために擬似カラーで表示されます。 E)平均± C.個々の刺激に示すように90神経末端から得られたSEMトレースは水平方向の棒で表されます。スケールバーは=10μmである。
ディスカッション
FM染料は広範囲に多くの神経細胞調製物中の神経ターミナルの機能を調査するために使用されます。これらはどちらSVのエンドサイトーシス、SV売上高またはエキソサイトーシス6の動力学の程度を監視するために主に用いられてきた。記述されたプロトコルは、特定のSVのプールのアンロードの差を調べるためにこれらの研究を拡張しています。これは、SVのプールの補充とも動員の彼らの程度に関する追加情報を提供します。
FM染料は同じ神経終末内でSVリサイクルの複数のラウンドにラベルを付けるために使用することができます。我々は、このプロパティを利用し、各端末におけるSV売上高が同じ神経末端に二回監視することができるプロトコルを設計した。これが原因で、並列神経の端子11にSVリサイクルの均質性に不可欠である正確な内部統制を、提供します。内部統制としてS1相の使用を介して、RRP、RPと合計の補充薬剤の存在下でSVのプールは確実にし、直接比較することができます。
リサイクルの絶対的な大きさの情報を提供するだけでなく、RRPとRPプールが異なる刺激条件下では、このプロトコルはまた、以下のデータを提供することができます - 1)リサイクルのプールの関数としてRRPとRP間のSVパーティショニングS1とS2、2用)の合計S1リサイクルのプールとS1の同じプールの関数としてS2内の任意の定義されているSVのプールの3)相対的な大きさの関数としてS2プールの相対的な大きさ(RRPおよびRP)。収集時間が遅すぎるので、この特定のプロトコルは、(速度測定のために収集時間が可能と画像の取り込みに同期を自動的にアンロードと同じくらい急速なはず)、しかし動態をアンロードに関する情報を提供することはありません。
私たちの30 Hzの2秒の刺激は、高張ショ糖8にアンロードRRPの同一の範囲を呼び起こす。 RRPのサイズ導入15アンロード高張ショ糖によって定義され、我々は、海馬ニューロン16の研究と一致し、このプロトコルは、すべてのRRP SVSをアンロードすることを明記することができます。この刺激は、すべての色素標識のSV 95%を枯渇させるパラダイム(50mMのKClを2刺激)に染料の同一量をアンロードするので、予備のプールはほぼ完全に400の刺激(40 Hzの10秒ごと)の三列車が消耗している8,17。 RRPと予備プールの両方のサイズの正確な定量化はまた、CCDカメラのダイナミックレンジ内での情報の取得に依存しています。
この単純なプロトコルは、さらに変更することができます。ローディング刺激の強さはまた別のエンドサイトーシスのモードがSVプールの補充をどのように影響するかを神経活動と決定するために変えることができます。必要に応じてさらに、ロードおよびアンロードの3つ以上のサイクルをも行うことができます。このプロトコルは、過剰発現またはどちらかをトランスフェクションした細胞でも使用できます。shRNAベクター。プライマリーニューロン培養の低いトランスフェクション効率のために、発現されたタンパク質は蛍光タンパク質でタグ付けする必要があります。それは、これらの蛍光タグは、FM色素の信号(例えば、シアンまたは赤色のタンパク質を使用)に干渉しないことが不可欠です。このインスタンスでは、ビューの同じフィールドにトランスフェクトおよび非トランスフェクト細胞からの神経終末はまた付加的な制御8として比較することができます。摂動は、両方の負荷の間に存在しているので、そのような実験ではS1とS2の負荷との間でのロードの程度の比較は、ほとんど価値がありません。 SVプールの間に染料のパーティショニングはまだしかし、8視覚化することができます。
遺伝記者はpHluorinsも初代神経培養におけるSVエキソサイトーシスとエンドサイトーシスを監視するために用いることができると呼ばれる。このようなプローブは、VAMP、シナプトフィジンとVGLUT1 18などのタグ付きSV蛋白質の内腔ドメインのpH環境にpH感受性緑色蛍光タンパク質を使用してください。水疱性ATPアーゼ阻害剤と組み合わせて使用すると、pHluorinsはSVプール動員19の速度と程度の両方を報告することができます。ここで説明するFM -染料ベースのアプローチがpHluorinの技法に比べていくつかの利点を持って、まず、FM色素は、SVのエンドサイトーシスのモードは、RRPと予備プール8を補充する情報を提供しています。第二に、特定のSVのプールは、20種類のスペクトル特性を持ち、最終的にトランスフェクションの要件がないFM色素で標識することができます。定義SVはで表示されるようにエンドサイトーシス中に色素をロードしなければならないので、FM色素は、(pHluorins 19〜対照的に)しかし、休んでとリサイクルSVプールの間にSVトラフィックに関する情報を提供することはできません。したがって、FM色素とpHluorins両方の長所と短所を持っていると同じ問題に対処するための独立した実験で利用されるときに最も強力です。
高品質の画像は、有効な分析とreproducibのために不可欠です。ルの結果。水平方向のドリフトが簡単に補正することができる一方で、Z軸のドリフトがある実験を回復することはできません。このような理由で、S1とS2のアンロードを開始する前に画像を再集中することが重要です。かなりの蛍光減衰が発生した場合には、減衰補正が(通常は刺激の非存在下でFM -ロードされた細胞から、以前に記録されたトレースを減算すること)が適用されることがあります。しかし、減衰補正のみグラフィカルな表現のために実行され、任意の定量分析に使用されないことが示唆された。
開示事項
我々は、開示することは何もない。
謝辞
この作品は、ウェルカムトラスト(:084277参考)からの助成金によって支えられて。
資料
| Name | Company | Catalog Number | Comments |
| の名前 | 会社 | ないカタログはありません。 | |
|---|---|---|---|
| AxioCam MRM牧師3デジタルカメラ | カールツァイス | 4265099901000 | |
| アクシオObserver.A1顕微鏡 | カールツァイス | 4310040000000 | |
| 細胞培養プレート(6ウェル) | グライナーバイオワン | 657160 | |
| 遠心機(ユニバーサル32R) | Hettich Zentrifugen | 1610 | |
| CO 2インキュベーター | ヘレウスインスツルメンツ | 51014042 | |
| ファルコンチューブ(50分の15 ml)を | グライナーバイオワン | 188271/210261 | |
| Fluar 20X / 0.75∞/ 0.17目的 | カールツァイス | 4401459901000 | |
| ガラスカバースリップ(Ø25mm) | VWRインターナショナル | 631-1584 | |
| ガラスパスツールピペット(230 nm)の | グライナーバイオワン | 612-1799 | |
| Haemocytometer | VWR | 15170-170 | |
| イメージング室 | ワーナー | RC - 21 BRFS | |
| 層流フード | BIOHIT | VLF BHS 1200 | |
| マッキルウェーンのティッシュチョッパー | ミクルラボラトリーエンジニアリング株式会社 | MTC / 2 | |
| 水銀ランプ | カールツァイス | HBO 103 | |
| MultiStimシステム電気刺激装置(100mVを、1msの単相の幅) | Digitimer株式会社 | D330 | |
| 注入ポンプ | ワトソン - マーロウ | 313S | |
| 血清学的ピペット(5/10/25 ml)を | グライナーバイオワン | 606180/607180/760180 | |
| シャッターコントローラ | カールツァイス | MAC5000 | |
| 注射器(20ml)に | BD Plastipak | ST01 - B002 | |
| シリンジフィルター(Minisart - 0.20ミクロン) | ザルトリウスStedim | 16532 | |
| VC - 6 6チャンネルのバルブコントローラ | ワーナー | 64から0135 | |
| YFP FilteRセット(46セット) | カールツァイス | 1196-681 |
表1。使用される特定の機器および装置
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| FM1 - 43 | バイオサイエンスケンブリッジ | BT70021 | 10μM |
| FM2 - 10 | バイオサイエンスケンブリッジ | BT70044 | 100μM |
| ポリ- D -リジン | シグマ | P7886 | 15μg/ mlの |
| シリコーングリース | シグマ | 85403 | - |
表2。使用される特定の試薬
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| ウシ血清アルブミン(BSA) | シグマ | A4503 | 0.3パーセント |
| D -グルコース | シグマ | G5767 | 0.25パーセント |
| ミリグラムSO 4 · 7H 2 O | シグマ | M2773 | 1.5mMの |
| D - PBS | GIBCO | 21300 | 960 mg/100ミリリットル |
それぞれの準備のための新鮮な100ミリリットルを行う
使用前に、滅菌フィルタ
表3。 CGNの準備のためのソリューションB
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| ソリューションB | - | - | 19ミリリットル |
| トリプシン(5 mg / mlストック、-20 ° C) | シグマ | T9201 | 1ミリリットル |
表4。 CGNの準備のためのソリューションT
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| ソリューションC | - | - | 3.2ミリリットル |
| ソリューションB | - | - | 16.8ミリリットル |
表5。 CGN準備のためのソリューションW
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| デオキシリボヌクレアーゼ(DNase処理、0.5mlの株式500 U、-20 ° C) | シグマ | D5025 | 0.5ミリリットル |
| し、MgSO 4 · 7H 2 O | シグマ | M2773 | 1.5mMの |
| ソリューションB | - | - | 10ミリリットル |
| 大豆トリプシンインヒビター(SBTI、0.5mlの株式、-20℃あたり0.5ミリグラム) | シグマ | T9003 | 0.5ミリリットル |
表6。 CGN準備のためのソリューションC
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| ウシ血清アルブミン(BSA) | シグマ | A4503 | 4パーセント |
| アールの平衡塩類溶液(EBSS) | GIBCO | 24010 | 10ミリリットル |
| し、MgSO 4 · 7H 2 O | シグマ | M2773 | 3mMの |
表7。 CGNの準備のためのEBSSソリューション
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| シトシンβ- D -アラビノフラノシド(ARA - C)* | シグマ | C1768 | 10μM |
| 胎児ウシ血清 | GIBCO | 10106 | 10パーセント |
| D -グルコース | シグマ | G5767 | 30mMの |
| L -グルタミン | シグマ | G3126 | 2mMの |
| 塩化カリウム | シグマ | P5405 | 25 mMの |
| 最小必須培地(MEM) | GIBCO | 21090 | 500ミリリットル |
| ペニシリン(P)/ストレプトマイシン(S) | GIBCO | 15140 | 100 U / mlの(P)、100μg/ mlの(S) |
*のAra - Cは、1 DIV以降から培地に添加する必要がある
表8。 CGNの準備のための文化メディア
| の名前 | バージョン | 会社 |
|---|---|---|
| AxioVisionのDDBJリリース。 | 4.8 | カールツァイス |
| ImageJの | 1.42q | 国立衛生研究所(NIH) |
| Microsoft Excelの | 2003 | マイクロソフト |
表9。使用される特定のコンピュータソフトウェア
| の名前 | 会社 | ないカタログはありません。 | 濃度 |
|---|---|---|---|
| のCaCl 2 · 2H 2 O | シグマ | C7902 | 1.3mmの |
| グルコース | シグマ | G5767 | 5mMの |
| 塩化カリウム | シグマ | P5405 | 3.5 mmの |
| KH 2 PO 4 | シグマ | P9791 | 0.4mMの |
| のMgCl 2 · 6H 2 O | シグマ | M0250 | 1.2 mmの |
| NaClを | フルカ | 71378 | 170 mMの |
| 飽和NaHCO 3 | フルカ | 71627 | 5mMの |
| Na 2 SO 4で | BDH研究室用品 | 10264 | 1.2 mmの |
| TES | シグマ | T1375 | 20 mMの |
表10。生理食塩水液(pH7.4)
参考文献
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved