Method Article
FM 염료를 사용하여 양식 소뇌 과립 뉴런에서 시냅틱 소포 풀 보충의 정량 분석
요약
중앙 신경 터미널에있는 보충 및 특정 시냅스 소포의 동원 (SV) 풀을 수치 라이브 형광 이미징 기술이 설명되어 있습니다. SV 재활용의 두 발만 내부 통제를 제공하는 동일한 신경 터미널에서 모니터링하고 있습니다.
초록
중앙 신경 터미널에서 신경 전달 물질 릴리스 후, SVS는 신속하게 endocytosis에 의해 검색됩니다. 주소 SVS는 다음 신경 전달 물질과 리필 및 exocytosis 1,2 사용할 수 있습니다 SVS로 정의된 재활용 수영장, 다시 가입하고 있습니다. 쉽게 releasable 수영장 (RRP)와 예약 수영장 (RP) - 재활용 수영장은 일반적으로 별개의 두 수영장으로 세분화 될 수 있습니다. 그들의 이름이 암시로 RRP는 RP SVS는 강렬한 자극 1,2 동안에만 출시하는 동안 즉시 융합에 대해 사용할 수 있습니다 SVS로 구성되어 있습니다. 1) 이해하기 위해 이러한 SV 수영장의 차등 보충보고 신뢰성있는 분석을하는 것이 중요합니다 어떻게 SVS의 endocytosis의 다른 모드 이후 트래픽 (예 : clathrin 종속 endocytosis 및 활동에 의존 대량 endocytosis) 및 2) 메커니즘 다른 자극에 대한 응답으로 RRP와 RP 모두 동원을 조절.
FM의 염료는 정기적으로 채용 아르에드는 양적 중앙 신경 터미널에서 3-8 SV 매출액을보고합니다. 그들은 세포막에 걸쳐 지질 이중층에 가역 파티션을 허용 소수성 탄화 수소 꼬리와 친수성 머리 그룹 차단 통로 있습니다. 염료는 수용액에서 약간의 형광지만, 막 9 분할 때 자신의 양자 수율이 크게 증가합니다. 따라서 FM 염료 적극적으로 SVS를 재활용 추적에 이상적 형광 프로브입니다. 다음과 같은 FM 염료의 사용을위한 표준 프로토콜입니다. 먼저 그들은 뉴런에 적용되며 (그림 1) endocytosis 동안 촬영하고 있습니다. 비 내면 염료는 재활용 수영장 내에 플라즈마 막, 재활용 SVS의 재배 포할에서 씻겨 후. 이러한 SVS는 다음 하역 자극 (그림 1)를 사용 고갈됩니다. SVS의 FM 염료 라벨이 quantal 10 때문에, 결과 형광 드롭 출시 vesicles의 금액에 비례합니다. 따라서 SVS의 재활용과 융합은 PR에서 생성된endocytosis의 evious 라운드가 안정적으로 계량하실 수 있습니다.
여기, 우리는 정보의 두 개의 추가 요소를 얻기 위해 수정되었습니다 프로토콜을 제시한다. 첫째, 순차 하역 자극이 differentially 특정 SV 수영장의 보충의 부량 수 있도록, RRP와 RP를 언로 드하는 데 사용됩니다. 둘째, 각 신경 터미널 두 번 프로토콜을 겪습. 따라서, S1에서 동일한 신경 터미널의 반응은 내부 통제를 제공하고, S2 단계 (그림 2)에서 시험 물질의 존재에 대해 비교할 수 있습니다. 다른 신경 터미널 건너편 SV 재활용의 범위 11 높은 변수이기 때문에 이것은 중요합니다.
모든 자기편 기본의 연결을 문화가이 프로토콜을 사용할 수 있습니다 그러나 도금 밀도, 솔루션 및 자극 조건 소뇌 과립 뉴런 (CGNs) 12,13에 최적화되어 있습니다.
프로토콜
1. 소뇌 과립 신경 세포의 준비
- 약 100 25mm 직경의 coverslips (표 1) 압력솥.
- 멸균 폴리 - D - 라이신 용액 (표 2)를 포함하는 50 ML 멸균 튜브에 장소 coverslips. 코트 coverslips를 2 H의 회전 플랫폼에 넣습니다.
- 층류 흐름 후드의 살균 티슈에 드라이 코팅 coverslips (표 1).
- 무균 6 잘 접시와 CO 2 배양기 (표 1) 따뜻한. Coverslips로 장소 coverslips은 사용하기 전에 4 ° C에서 1 달 동안 저장할 수 있습니다.
- 지역 윤리위원회 지침에 따라 강아지 칠일 오래된 스프 Dawley 쥐를 안락사. 우리는 자궁 경부 전위를 사용하여 새끼를 euthanized.
- 소뇌를 해부하다하고 인산염 소금 솔루션 (솔루션 B, 표 3) 버퍼를 포함하는 무균 배양 접시에 넣습니다.
- 4-6 쥐 새끼에 대한 단계 1.5 1.6 반복합니다.
- Cerebella은 다음 McIlwain 조직 조의 멸균 무대에 표시됩니다pper (표 1). 조직은 90 °를 통해 무대를 회전하고 과정을 반복하기 전에 375 μm의 간격으로 잘게 수 있습니다.
- 썬 cerebella는 이전에 다음 ID로 37 기까지했다 트립신 용액 (솔루션 T, 표 4) ° C.로 전송됩니다
- 37 품어 cerebella ° C 부드러운 교반 약 5 분마다 20 분.
- tryptic 소화하는 동안, 불꽃 폴란드어 세 멸균 유리 pipettes (표 1) 분젠 불꽃을 사용합니다. pipettes의 각 입을시 벌금 보어, 중간 구멍 및 넓은 구멍을 만들 불꽃을 사용합니다.
- 솔루션 T 20 분 부화 후 benchtop의 원심 분리기에서 1 분 (표 1) 1,000그램에서 소뇌 정지 및 펠렛 세포에 트립신 / DNase 억제제 솔루션 20 ML (솔루션 W, 표 5)을 추가합니다.
- 뜨는을 가만히 따르다하고 넓은 구멍 피펫을 사용하여 농축 트립신 / DNase 억제제 (솔루션 C, 표 6) 1.5 ML에있는 세포 펠렛을 resuspend.
- 먼저 넓은 구멍의 피펫을 사용하여 세포를 씹다 다음 매체는 구멍 마지막으로 세포 현탁액까지 좁은 구멍이 동질적인 것입니다. 이것은 중요한 단계, 정지이 단계에서 동질해야합니다.
- 10 ML 위에 레이어 세포 현탁액 prewarmed (37 ° C) 살균 15 ML 튜브에 소 혈청 알부민 보충 Earles 균형 소금 솔루션 (표 7).
- 1천5백그램에서 5 분 정지를 원심과 prewarmed 2 MLS에있는 세포 펠렛 (37 ° C) 배지 (표 8).을 resuspend
- 혈구계를 사용하여 셀 번호 (표 1)을 추정하고 ML 당 3.3 X 10 6 세포의 최종 밀도에 세포 현탁액을 희석.
- 전지는 폴리 - D - 라이신 코팅 coverslips (최종 농도 2.5 × 10 5)의 중심에 세포 현탁액의 75 μl를 추가하여 도금입니다.
- coverslips를 포함하는 문화 플레이트로 세포 수 있도록 60 분에 대한 CO 2 배양기에 배치됩니다dhere.
- 각각 잘 도금 세포를 방해하고 CO 2 배양기로 배양 접시를 반환하지 않도록 돌봐으로 문화 매체의 1.5ml을 추가합니다.
- 그 다음날은 mitotic 억제제 사이 토신의 arabinoside (표 8)과 보충 신선한 문화 매체와 문화 매체를 교체합니다. 문화에 glial 세포의이 체포 확산.
2. 실험 설정
- 기본 실험 설치 (표 1 및 사용되는 특정 장비 및 소프트웨어에 대한 9 참조)은 다음으로 구성한다 :
- 거꾸로 에피 형광 현미경
- 냉각 CCD 카메라
- 형광등 광원 (단색 또는 필터 휠)
- 중력 재관류 장치
- 병렬 백금 전극과 영상 챔버
- 전기 자극기
- 컴퓨터
- 이미지 수집 소프트웨어
- 실험 빨간불이 cond에서 어두운이나 수행되어야샘플 최소 형광등 조명과 itions은 표백 FM 염료를 피할 수 있습니다.
- 실험은 상온에서 수행하고 있습니다. 생리적 온도가 필요한 경우, 온도 제어 재관류 시스템을 사용할 수 있습니다.
3. 샘플 준비
- 문화는 체외에서 8-12일 후 사용해야합니다.
- 새로운 매체 안정화를 허용하도록 실온에서 10 분에 대한 생리 식염수 (표 10)에 하나의 coverslip을 전송합니다.
- , coverslip을 제거 아래쪽 및 종이 타월이나 흡수성 종이의 작은 조각으로 연결된 세포 주변 지역을 건조.
- 접착제는 영상 챔버의 아래쪽에, 실리콘 그리스 (표 2) coverslip 사용합니다. 세포는 두 평행 전선 사이 여야합니다. 충분한 실리콘 그리스는 목욕 챔버의 중앙을 입력하는 기름없이 완전히 챔버 밀봉하는 데 사용되지만해야합니다.
- 부드럽게 ~ 260 μl SA와 함께 목욕 챔버를 채울라인 솔루션과 다음 같은 솔루션을 입력 튜빙을 작성하십시오.
- 접착제 챔버의 상단에 실리콘 그리스와 깨끗한 coverslip 그것을 날인합니다. 입력 및 출력 튜브는 챔버에 갇혀있는 공기 방울을 제거하는 데 사용할 수 있습니다. 그것은 전기 회로가 공기 방울에 의해 중단되지 것이 중요합니다.
- 스테인레스 스틸 플랫폼 이미징 챔버를 Immobilise 부드럽게 입력 튜브를 통해 생리 식염수를 perfusing하여 누출이 있는지 확인합니다.
- 거꾸로 현미경의 무대에 조립 챔버를 탑재하고, 중력 재관류 시스템에 챔버를 연결, 먼저 생리 식염수로 입구를 준비하는 데.
- 전기 자극기로 챔버의 와이어를 연결하는 연결합니다.
- 석유 렌즈를 사용하면 목표에 침지 기름 한 방울을 추가합니다. 명시야 조명을 사용하여 챔버의 중앙에있는 세포에 초점.
4. S1 단계
- 1.5 ML과 Perfuse 뉴런생리 식염수에 희석 FM 염색 (표 2).
- 첨부된 자극기를 사용하여 염료 이해를 연상하는 뉴런을 자극.
- 자극 후, 2 분 신선한 생리 식염수로 perfuse 뉴런 멀리 초과 FM 염료 (유량 7 ML / 분)을 씻어 있습니다. CGN 문화 시스템에 Glial 오염이 5 % 미만 14, 따라서이 시간 프레임은 염료를 제거하는 충분하다 .
- 8 분을 위해 나머지 뉴런 둡니다.
- 이 간격 동안, 개별 FM 염료 로드된 신경 단말이 표시를 사용하여 플루오레신 파장 (; 방출> 550 nm의 여기, 480 NM)입니다 axonal 네트워크를 찾습니다. 세포 클러스터와 지역을 피하십시오.이 단계에서 최소로 조명을 계속 강한 여진이 염료 phototoxicity이 발생할 수 있기 때문입니다. 이 명백한 증거는 axons과 염료 하역 부족 (해결을 염료에 의한)의 blebbing 수 있습니다.
- 다시 초점 이미지는 즉시 이미지 수집하기 전에 약간의 드리프트 때문에 나머지 기간 동안 발생했을 수 있습니다.
- 한 프레임의 속도 매 4 S.에서 촬영된 이미지 수집을 시작합니다
- 5 인수 후 - 10 기준 이미지를, 2의 (60 행동 잠재력) 8 30 Hz에서 자극을 제공하여 RRP의 exocytosis를 연상 프레임 캡처 후 수동으로 즉시 자극 하십시요..
- 또 다른 10 이미지를 인수 후, 각 30의 간격이 8, 10의 (400 액션 잠재력) 40 Hz에서 세 stimulations를 사용하여 RP의 SV exocytosis를 보여주고 있습니다.
- 또 5 습득 - 10 이미지와 다음 일시 정지 이미지 수집합니다.
5. 복구 단계 (그림 2 참조)
- 뉴런은 적어도 20 분 이상 복구할 수 있습니다.
- 옵션 - endocytosis에 약물의 영향이 시험하는 경우,이 기간 (그림 2B) 3,8 중 약물 솔루션 perfuse 뉴런.
6. S2 단계
- 로보기 같은 필드를 사용하여 제어 실험 S1 위상 프로토콜 (섹션 4) 반복S1 인치
- 옵션 - endocytosis에 약물의 효과가 검증이있다면, FM 염료 (그림 2B) 3,8와 보충 마약 솔루션 뉴런을 perfuse.
- 옵션 - exocytosis에 약물 효과가 관심있는 또는 경우 이전과 RRP와 RP 하역의 자극 (그림 2C) 3시 두 약물 솔루션 perfuse 뉴런.
7. 데이터 분석
- ImageJ 및 Microsoft Excel 또는 데이터 분석을위한 유사한 소프트웨어를 사용합니다.
- 분석을 위해, 스택 형식의 이미지 시퀀스가 필요합니다. 일부 이미징 소프트웨어는 단일 이미지로 시퀀스를 내보낼 수 있습니다. 이 경우 스택에 ImageJ 내장 함수 이미지> 스택> 이미지를 사용하여 스택으로 이미지를 변환합니다.
- 동적 범위를 극대화하기 위해 스택의 밝기와 대비를 조정합니다. 이미지> 조정> 밝기 / 명암 (그림 3A).
- 중요한 수평 드리프트는 t 동안 발생한 경우그는 실험을 실행 StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ )와 TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ImageJ에서) 플러그인 이미지 스택 (그림 3B)를 정렬하기 .
- 시간 시리즈 분석기 플러그인 (실행 http://rsbweb.nih.gov/ij/plugins/time-series.html ) (그림 3C)를.
- 최소 90 신경 터미널을 통해 관심을 (ROIs)의 영역을 정의합니다. 이들은 동일해야합니다 (1.5 μm의 직경과 원형 ROIs) 그것은 전에 이미지 사이의 전환에 도움이되고 염료가 활성 신경 터미널 (또는 사전에 자극 이미지가 포스트 자극 이미지에서 빼서 수) 공개에 하역 후. 이상적 투자 수익 (ROI) 크기는 전형적인 신경 터미널 (그림 3C)보다 약간 더 큰 하나입니다.
- 팀이 지남에 따라 각 투자 수익 (ROI)의 통합 / 총 형광 강도를 구합니다Microsoft Excel에서 (그림 3D 및 4A) 전자 및 수출.
- S1과 S2 두 단계의 첫 번째 하역 자극 (그림 4B - C)에 대한 Y - 축 비행기의 흔적을 정렬하여 동일한 임의의 값으로 투자 수익 (ROI) 추적을 Normalise.이 배경 형광 강도의 작은 변화를위한 제어하는 것입니다.
- S1과 (그림 4D) 다음과 S2에 대한 임의의 형광 유닛의 각 하역 자극에 의해 evoked 형광의 절대 감소를 측정 :
- 형광의 RRP = 변경 (ΔF은) 30 Hz에서 두의에 의해 발생
- ΔF의 RP = SUM은 3 X 40 Hz에서 10의에 의해 발생
- 총 재활용 수영장 = RRP + RP
- 7.9의 각 관련 매개 변수에 대해, 하나의 실험의 모든 신경 터미널을 통해 의미 가치를 계산합니다.
- 통계 분석을 위해, 여러 독립적인 실험에서 얻은 값을 평균 수 있습니다 의미합니다. 오히려 신경 단말기의 수보다 coverslips의 숫자는 statistica로 사용해야리터 N.
8. 대표 결과 :
CGNs가 동일 로딩 및 언로 드 단계의 두 라운드를 받았습니다 제어 실험은 그림 5에서 표시됩니다. 일련의 실험을 시작하면, 그것은 이와 같은 제어 실험 S1과 S2는 S2 중에 실험 조건을 변화하기 전에 비교할 수 있는지 확인하기 위해 매일 수행되는 것이 중요합니다.
이 예제에서는 CGNs는 80 Hz에서 10 님의 자극 (그림 5A)를 사용하여 10 μm의 FM1 - 43 탑재했다. 그림 5B는 형광 puncta로 표현 FM1 - 43 - 로드된 신경 터미널을 보여줍니다. 그림 5c 같이 ROIs 90 신경 터미널을 통해 정의되었다. ROIs의 동일한 집합 S1과 S2 모두 사용되었다. 모두 언로 드하는 동안, RRP 먼저 RP 3 연속 40Hz (10의) 자극 (그림 5A)와 하역 다음 30 Hz에서 (2들) 자극과 언로 드되었습니다. 각 자극하는 동안 형광 드롭은 명확하게 (5D - E 그림) 관찰 및 계량하실 수 있습니다. 조사하면 형광이 RRP에 해당하는 방울, RP 및 총 재활용 수영장 S1과 S2 모두 비교했다. 80 %가 S1과 S2에서도 RP에 살고있는 동안뿐만 아니라, 재활용 SVS의 20 %는 RRP에 살고.

전형적인 FM 실험의 그림 1 도식 다이어그램. A) SV의 endocytosis는 FM 색소 (녹색으로 표시)의 면전에서 실행됩니다. 염료 invaginating 멤브레인 (단일 SVS 또는 일괄 endosomes)에 의해 이루어집니다. 플라즈마 막에 B)이 아닌 내면 염료는 재관류에 의해 씻겨이다. C) 형광의 손실 발생하는 플라즈마 막과 함께 릴리스 퓨즈에 대해 사용할 수 있습니다 SVS 표시 하역 자극의 신청시. D) 출시 라벨 SVS의 금액에 비례 형광 (ΔF)의 변화는 다음 계량하실 수 있습니다.
_upload/3143/3143fig2.jpg "/>
가능한 실험 프로토콜 2 도식 다이어그램을 그림. 세포가 로딩과 (S1과 S2) 하역 FM 염료의 두 라운드를 받아야 제어 실험) 플로우 차트. 세포는 여러 자극의 범위를 사용하여 로드할 수 있습니다. 하역 단계는 10 s의 3 번 40 Hz에서 언로 드를 사용하여 RP 다음 RRP는 2의 30 Hz에서와 언로 드한다는 점에서 동일합니다 RRP 및 예약 수영장 내리기의 자극은 30 초 40 초, 다른 모든 자극으로 구분되었다. 전지는 S1과 S2 사이에 20 분에 대한 복구 남아 있습니다. B 중 하나에있는 물질의 효과를 테스트하기 위해 가능한 변경의 흐름 차트) endocytosis 또는 C) exocytosis도 표시됩니다. 대응 시험 약물이 표시된 기간 동안 의회에 perfused 수 있습니다.
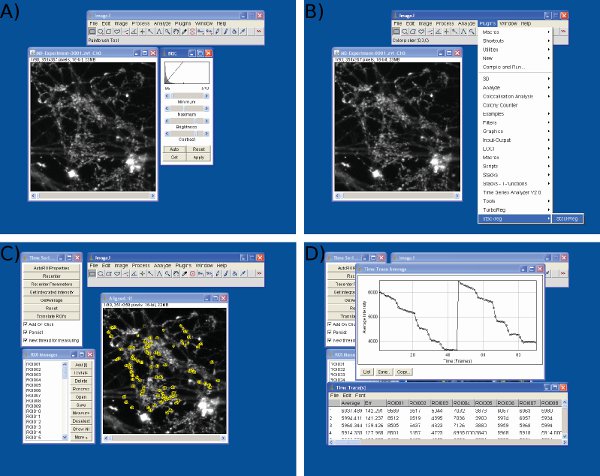
이미지 J의 데이터 분석 화면 캡처 그림 3. 스크린샷이 표시됩니다이미지 J.를 사용) 밝기 및 대비 조정, B) 프레임 정렬, C) ROIs 선택, 그리고 D) 강도 값을 추출을위한
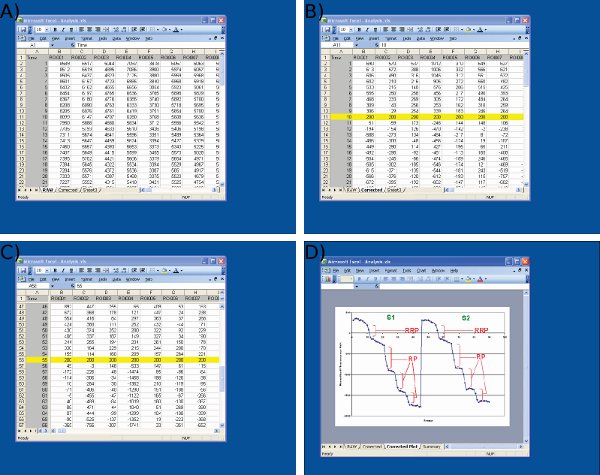
그림 Microsoft Excel에서 데이터 분석 4 스크린샷. 스크린샷은)는 이미지 J (1 일 칼럼에서 원시 데이터를 가져오기위한 표시됩니다 = 프레임 번호, 개별 신경 터미널에서 나머지 항목은 = 데이터) B) 시작시 임의의 값 (200)에 S1 기준 값 (프레임 10)의 조정 S1에 동일한 프로토콜을 사용하여 프레임 55에서 S2 기준 값의 첫 번째 자극의 C) 조정 및 Microsoft Excel을 사용하여 형광 안약 D) 측정. D에 표시된 평균 추적는 각 드롭 전후의 시간 지점을 정의하는 데 사용됩니다. 각각의 투자 수익 (ROI)에 대한 형광 방울의 크기는 C로 표시된 스프레드 시트에서 값에서 결정되어야

그림 5. 대표 제어 실험. CGNs가 80 Hz에서 (10의) 자극을 사용하여 10μM FM1 - 43 탑재했다 제어 실험) 플로우 차트. S1과 S2 단계는 동일합니다. RRP 및 예약 수영장 내리기의 자극은 30 초 40 초, 다른 모든 자극으로 구분되었다. B) 신경 터미널을 보여주는 이미지는 FM1 - 43 탑재. C) 90 번호를 ROIs을 보여주는 B로 동일한 이미지 분석을 위해 선택했습니다. D) 선택한 시간 지점에서 B에 빨간색 상자가 그려져 지역의 이미지. 자극을하기 전에 기초 =; 30 Hz에서 = 30 Hz에서 2의 자극 후, 40 Hz에서 1,2,3 = 각 40 Hz에서 10의 자극 후. 이러한 이미지는 형광의 변화 (오른쪽에 표시되는 스펙트럼 바) 설명하기 pseudocolor로 표시됩니다. E) C. 개인 자극에 묘사된 90 신경 터미널에서 얻은 ± SEM 추적이 가로 막대로 표시됩니다 의미합니다. 스케일 바 = 10 μm의.
토론
FM 염료가 광범위하게 많은의 연결 준비에 신경 터미널 기능을 조사하는 데 사용됩니다. 그들은 어느 SV의 endocytosis, SV 매출액 또는 exocytosis 6 반응 속도론의 범위를 모니터링하기 위해 주로 고용되어있다. 설명 프로토콜은 특정 SV 수영장의 하역 차등을 검토하는 연구를 확장합니다. 이것은 SV 수영장의 보충 또한 동원 자신의 범위에 관한 추가 정보를 제공합니다.
FM의 염료는 동일한 신경 터미널 내에 SV 재활용의 여러 라운드 레이블을 사용할 수 있습니다. 우리는 각 터미널에서 SV 회전율이 동일한 신경 터미널에 두번 모니터링할 수있는 프로토콜을이 속성을 이용하여 설계했습니다. 이것은 병렬로 인해 신경 터미널 11 SV 재활용의 이기종 자연 필수적이다 정확한 내부 통제를 제공합니다. 내부 통제로 S1 단계의 사용을 통해 RRP, RP 및 전체의 충진약물의 존재 SV 수영장은 안정과 직접적으로 비교할 수 있습니다.
재활용의 절대 크기의 정보를 제공하는 이외에, RRP와 RP 수영장 다른 자극 조건 하에서,이 프로토콜은 다음을위한 데이터를 제공할 수 - 1) 재활용 수영장의 함수로 RRP와 RP 사이 SVS의 파티션 S1과 S2, 2) 총 S1 재활용 수영장과 S1에서 같은 수영장의 함수로 S2에 정의된 SV 수영장 3) 상대적인 크기의 함수로 S2 수영장의 상대적 크기 (RRP와 RP). 인수 시간 (운동 측정을위한 수집 시간이 가능하고 이미지 캡처 동기화 자동으로 언로 드처럼 신속한한다) 너무 느린이기 때문에 이것은 특정 프로토콜 그러나 하역 속도론에 대한 정보를 제공하지 않습니다.
우리의 30 Hz에서 2 님의 자극은 hypertonic 자당 8 하역 RRP의 동일한 범위를 끝. RRP의 크기 때문에15 하역 hypertonic 자당에 의해 정의되고, 우리는 hippocampal 뉴런 16 연구와 계약에,이 프로토콜은 모든 RRP SVS를 언로 드되는 상태 수 있습니다. 예약 수영장은 거의 400 자극이 자극 때문에 (40 Hz에서 10의 각) 모든 염료로 분류 SVS의 95 %를 depletes 패러다임 (50 MM KCl 2 자극)에 염료의 동일한 금액을 언로 드 세 기차로 소진 8,17. RRP 및 보유 수영장 모두의 크기의 정확한 양을 정함 또한 CCD 카메라의 선형 동적 범위 내에서 정보를 취득에 따라 달라집니다.
이 간단한 프로토콜은 또한 더 이상 수정할 수 있습니다. 로딩 자극의 강도는 방법의 연결 활동 및 다른 endocytosis 모드는 SV 풀 보급에 영향을 결정하기 위해 다양한 수 있습니다. 필요한 경우 또한,로드 및 언로드보다보다 두 사이클도 수행할 수 있습니다. 이 프로토콜은 overexpression 또는 중과 transfected 세포에도 사용할 수 있습니다shRNA 벡터. 기본의 연결을 문화의 낮은 transfection 효율로 인해, 표현 단백질은 형광 단백질 태그가 있어야합니다. 그것은이 형광 태그 (예를 들어, 시안이나 붉은 단백질을 사용) FM 염료 신호를 방해하지 않는 것이 중요합니다. 이 경우에는 볼 같은 분야에서 transfected 및 비 - transfected 세포에서 신경 터미널도 추가 제어 8로 비교할 수 있습니다. 섭동가 모두로드하는 동안 존재이기 때문에 이러한 실험에서 S1과 S2 사이의 하중 부하의 범위의 비교, 작은 가치입니다. SV 풀 사이에 염료 파티션 수는 있지만, 8 시각하실 수 있습니다.
유전자 기자 pHluorins도 기본의 연결을 문화 SV exocytosis와 endocytosis을 모니터 고용 수 있습니다했다. 이 프로브는 뱀파이어, synaptophysin 및 VGLUT1 18과 같은 태그 SV 단백질의 luminal 도메인의 산도 환경 산도에 민감한 녹색 형광 단백질을 사용하여 . 기공을 갖는 ATPase 억제제와 함께 사용하면, pHluorins는 SV 풀 동원 19 반응 속도론과 범위를 모두 보고할 수 있습니다. FM - 염료 기반의 접근 방식은 여기에서 설명한 것은 pHluorin 기술을 통해 몇 가지 이점을 가지고, 첫째, FM 염료는 SV의 endocytosis 모드 RRP 및 예약 풀 8 모아있는 정보를 제공합니다. 둘째 특정 SV 풀은 20 개의 다른 스펙트럼 특성을 가지고 있으며 마지막 transfection에 대한 요구가 없습니다 FM 염료로 분류하실 수 있습니다. 볼 수 있도록 endocytosis 동안 염료로로드해야 정의 SVS로부터 FM 염료는 휴식과 (pHluorins 19 대조적으로) 그러나 SV 풀을 재활용 사이의 SV 트래픽에 대한 정보를 제공할 수 없습니다. 따라서 FM 염료와 pHluorins 모두 강점과 약점을 가지고 있으며 같은 질문을 해결하기 위해 독립적인 실험에 이용했을 때 가장 강력한 있습니다.
고품질의 이미지는 유효한 분석과 reproducib에 필수적인르 결과입니다. 수평 드리프트가 쉽게 해결할 수 있지만, Z - 축에 표류이 실험은 복구할 수 없습니다. 이러한 이유로, S1과 S2 언로 드를 시작하기 전에 이미지를 다시 집중하는 것이 중요합니다. 중요한 형광 부패가 발생하는 경우에, 붕괴의 수정은 (일반적으로 자극의 부재에서 FM -로드 세포에서 이전에 기록된 추적을 빼서으로) 적용할 수 있습니다. 그러나, 그것은 감쇠 보정만이 어떠한 정량 분석을 위해 사용되는 그래픽 표현 및 없습니다 수행할 것을 권장합니다.
공개
우리는 공개 아무것도 없어.
감사의 말
이 작품은 Wellcome 트러스트 (084277 참조)에서 부여에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 이름 | 회사 | 아무 카탈로그 없습니다. | |
|---|---|---|---|
| AxioCam MRM 목사 3 디지털 카메라 | 칼 자이스 혈구 | 4265099901000 | |
| Axio Observer.A1 현미경 | 칼 자이스 혈구 | 4310040000000 | |
| 세포 배양 접시 (6 웰스) | Greiner 바이오 - 원 | 657,160 | |
| 원심 분리기 (유니버설 32R) | Hettich Zentrifugen | 1610 | |
| CO 2 인큐베이터 | Heraeus 인 스트 루먼트 | 51014042 | |
| 팔콘 튜브 (50분의 15 ML) | Greiner 바이오 - 원 | 210,261분의 188,271 | |
| Fluar 20X / 0.75 ∞ / 0.17 목표 | 칼 자이스 혈구 | 4401459901000 | |
| 유리 coverslips (Ø25mm) | VWR 인터내셔널 | 631-1584 | |
| 유리 파스퇴르 pipettes (230 NM) | Greiner 바이오 - 원 | 612-1799 | |
| 혈구계 | VWR | 15170-170 | |
| 이미징 챔버 | 워너 | RC - 21 BRFS | |
| 층류 후드 | BIOHIT | VLF BHS 1200 | |
| McIlwain 조직 헬리콥터 | Mickle 연구소 엔지니어링 주식 회사 | MTC / 2 | |
| 수은 램프 | 칼 자이스 혈구 | HBO 103 | |
| MultiStim 시스템 전기 자극기 (100mV, 1ms pluse 폭) | Digitimer (주) | D330 | |
| 재관류 펌프 | 왓슨 - Marlow | 313S | |
| Serological Pipettes (5/10/25 ML) | Greiner 바이오 - 원 | 606180/607180/760180 | |
| 셔터 컨트롤러 | 칼 자이스 혈구 | MAC5000 | |
| 주사기 (20 ML) | BD Plastipak | ST01 - B002 | |
| 주사기 필터 (Minisart - 0.20 μm의) | Sartorius Stedim | 16,532 | |
| VC - 6 여섯 채널 밸브 컨트롤러 | 워너 | 64-0135 | |
| YFP FilteR 세트 (46 세트) | 칼 자이스 혈구 | 1196-681 |
표 1. 사용하는 특정 장비 및 장치
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| FM1 - 43 | BioScience 캠브리지 | BT70021 | 10 μm의 |
| FM2 - 10 | BioScience 캠브리지 | BT70044 | 100 μm의 |
| 폴리 - D - 라이신 | 시그마 | P7886 | 15 μg / ML |
| 실리콘 그리스 | 시그마 | 85,403 | - |
표 2. 사용되는 특정 시약
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| 소 혈청 알부민 (BSA) | 시그마 | A4503 | 0.3 % |
| D - 포도당 | 시그마 | G5767 | 0.25 % |
| MG4 SO · 7H 2 O | 시그마 | M2773 | 1.5 MM |
| D - PBS | Gibco | 21,300 | 960 mg/100의 ML |
각 준비 신선한 100ml를 만들
사용하기 전에 - 살균 필터
표 3. CGN 준비를위한 솔루션 B
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| 솔루션 B | - | - | 19 ML |
| 트립신 (5 밀리그램 / ML 주식, -20 ° C) | 시그마 | T9201 | 한 ML |
표 4. CGN 준비를위한 솔루션 T
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| 솔루션 C | - | - | 3.2 ML |
| 솔루션 B | - | - | 16.8 ML |
표 5. CGN 준비를위한 솔루션 W
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| Deoxyribonuclease (DNase, 0.5 ML 재고 당 500 U, -20 ° C) | 시그마 | D5025 | 0.5 ML |
| MgSO 4 명이 7H 2 O | 시그마 | M2773 | 1.5 MM |
| 솔루션 B | - | - | 10 ML |
| 대두 트립신 억제제 (SBTI, 0.5 ML 재고 당 0.5 MG, -20 ° C) | 시그마 | T9003 | 0.5 ML |
표 6. CGN 준비를위한 솔루션 C
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| 소 혈청 알부민 (BSA) | 시그마 | A4503 | 4퍼센트 |
| 얼의 균형 소금 솔루션 (EBSS) | Gibco | 24,010 | 10 ML |
| MgSO 4 명이 7H 2 O | 시그마 | M2773 | 3 MM |
표 7. CGN 준비를위한 EBSS 솔루션
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| 사이 토신 β - D - arabinofuranoside (ARA - C) * | 시그마 | C1768 | 10 μm의 |
| Foetal 소 혈청 | Gibco | 10,106 | 10% |
| D - 포도당 | 시그마 | G5767 | 30 MM |
| L - 글루타민 | 시그마 | G3126 | 이 MM |
| KCl | 시그마 | P5405 | 25 MM |
| 최소한의 필수 중간 (가상) | Gibco | 21,090 | 500 ML |
| 페니실린 (P) / 스트렙토 마이신 (S) | Gibco | 15,140 | 100 U / ML (P), 100 μg / ML (S) |
* 아라 - C는 1 DIV의 이후 매체에 추가되어야합니다
표 8. CGN 준비를위한 문화 미디어
| 이름 | 버전 | 회사 |
|---|---|---|
| AxioVision 상대적. | 4.8 | 칼 자이스 혈구 |
| ImageJ | 1.42q | 건강의 국립 연구소 |
| Microsoft Excel을 | 2003 | 마이크로 소프트 |
표 9. 특정 컴퓨터 소프트웨어 사용
| 이름 | 회사 | 아무 카탈로그 없습니다. | 집중 |
|---|---|---|---|
| CaCl 2 · 2 시간 2 O | 시그마 | C7902 | 1.3 MM |
| 포도당 | 시그마 | G5767 | 5 MM |
| KCl | 시그마 | P5405 | 3.5 MM |
| KH 2 PO 4 | 시그마 | P9791 | 0.4 MM |
| MgCl 2 · 6H 2 O | 시그마 | M0250 | 1.2 MM |
| NaCl | Fluka | 71,378 | 170 MM |
| NaHCO 3 | Fluka | 71,627 | 5 MM |
| 나이 SO 4 | BDH 실험실 소모품 | 10,264 | 1.2 MM |
| TES | 시그마 | T1375 | 20 MM |
표 10. 생리 식염수 (산도 7.4)
참고문헌
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유