Method Article
Quantitative Analyse der synaptischen Vesikel Pool Replenishment in Cultured Cerebellar Nervenzellen Granulat mit FM Dyes
In diesem Artikel
Zusammenfassung
Eine Live-Fluoreszenz-Imaging-Technik, um den Nachschub und die Mobilisierung der spezifischen synaptischen Vesikel (SV)-Pools in zentralen Nervenendigungen quantifizieren beschrieben. Zwei Runden SV Recycling sind in der gleichen Nervenenden Bereitstellung eines internen Kontrollsystems überwacht.
Zusammenfassung
Nach Freisetzung von Neurotransmittern im zentralen Nerven-Terminals sind SVs schnell durch Endozytose abgerufen. Retrieved SVs werden dann mit Neurotransmitter befüllt und wieder in den Recycling-Pool, als SVs definiert, die für Exozytose 1,2 sind. Die leicht lösbare pool (RRP) und die Reserve-Pool (RP) - Die Recycling-Pool kann in der Regel in zwei verschiedene Pools aufgeteilt werden. Wie die Namen vermuten lassen, besteht die UVP des SVS, die sofort verfügbar sind für die Fusion, während RP SVs nur während intensiver Stimulation 1,2 freigesetzt werden. Es ist wichtig, einen zuverlässigen Test, dass die unterschiedliche Auffüllung dieser SV-Pools Berichte, um 1 zu verstehen) haben, wie SVs Verkehr nach verschiedenen Modi der Endozytose (wie Clathrin-abhängige Endozytose und Aktivitäts-abhängigen bulk Endozytose) und 2) die Mechanismen Steuerung der Mobilisierung sowohl der UVP und RP in Reaktion auf verschiedene Reize.
FM Farbstoffe werden routinemäßig eingesetzted quantitativ Bericht SV Umsatz in Zentral-Nerven-Terminals 3-8. Sie haben einen hydrophoben Kohlenwasserstoff-Schwanz, der reversible Partitionierung ermöglicht in der Lipid-Doppelschicht und einer hydrophilen Kopfgruppe, die Blöcke Passage durch Membranen. Die Farbstoffe haben wenig Fluoreszenz in wässriger Lösung, aber ihre Quantenausbeute steigt dramatisch, wenn in Membran 9 unterteilt. So FM Farbstoffe sind ideal fluoreszierenden Sonden für das Tracking aktiv Recycling SVs. Die Standard-Protokoll für den Einsatz von FM-Farbstoff ist wie folgt. Zuerst werden sie zu Neuronen angewendet und sind während der Endozytose aufgenommen (Abbildung 1). Nach nicht verinnerlicht Farbstoff wird von der Plasmamembran, Recycling SVs Umverteilung innerhalb der Recycling-Pool gewaschen. Diese SVs sind dann erschöpft mit Entladen Reize (Abbildung 1). Da FM Farbstoff Kennzeichnung von SVS ist quantal 10, ist die resultierende Fluoreszenz Tropfen proportional zu der Menge von Vesikeln freigesetzt. So erwirtschaftete das Recycling und die Fusion von SV aus dem previous Runde der Endozytose verlässlich quantifiziert werden.
Hier präsentieren wir ein Protokoll, das modifiziert wurde, um zwei zusätzliche Elemente von Informationen zu erhalten. Erstens sind sequentielle Entladen Reize verwendet, um differentiell Entladen der UVP und der RP, um die Quantifizierung der Auffüllung der spezifischen SV-Pools ermöglichen. Zweitens wird jede Nervenendigung das Protokoll zweimal. So kann die Reaktion der gleichen Nerv Terminal S1 gegen die Anwesenheit einer Testsubstanz in der Phase S2 (Abbildung 2) verglichen werden, die Bereitstellung eines internen Kontrollsystems. Dies ist wichtig, da das Ausmaß der SV-Recycling über verschiedene Nervenendigungen ist sehr variabel 11.
Jeder Anhänger primären neuronalen Kulturen für dieses Protokoll verwendet werden kann, jedoch die Beschichtungs-Dichte, Lösungen und Stimulation Bedingungen sind für zerebelläre Nervenzellen Granulat (CGNs) 12,13 optimiert.
Protokoll
1. Kleinhirn Granulat Neuron Vorbereitung
- Autoclave etwa 100 25 mm Durchmesser Deckgläser (Tabelle 1).
- Legen Sie Deckgläschen in einer 50 ml sterilen Röhrchen mit steriler Poly-D-Lysin-Lösung (Tabelle 2). Auf eine rotierende Plattform für 2 h zur Beschichtung der Deckgläser.
- Dry beschichtete Deckgläser auf sterile Seidenpapier in einer Sterilbank (Tabelle 1).
- Legen Sie Deckgläser in sterile 6-well Platten und warm in eine CO 2-Inkubator (Tabelle 1). Deckgläser kann für 1 Monat bei 4 ° C für Vor Gebrauch gespeichert werden.
- Euthanize einer 7 Tage alten Sprague Dawley Ratten Welpen nach den örtlichen Ethikkommission Richtlinien. Wir eingeschläfert Welpen mit Genickbruch.
- Präparieren Sie die Kleinhirn und legen Sie sie in einer sterilen Petrischale mit einem Phosphat-gepufferte Salze (Lösung B, Tabelle 3).
- Wiederholen Sie die Schritte 1,5 und 1,6 für 4-6 Rattenjungen.
- Cerebella werden dann auf dem sterilen Stadium einer McIlwain Tissue Cho platziertpper (Tabelle 1). Das Gewebe wird bei 375 um Abstand vor dem Drehen der Bühne um 90 ° und den Prozess wiederholen gehackt.
- Die gehackte cerebella werden in einer Trypsin-Lösung (Lösung T, Tabelle 4), die zuvor auf 37 war ° C erwärmt übertragen
- Inkubieren cerebella bei 37 ° C für 20 min unter leichtem Schütteln ca. alle 5 min.
- Während tryptischen Verdauung, Flamme polnisch drei sterile Glaspipetten (Tabelle 1) mit einem Bunsenbrenner. Verwenden Sie die Flamme zu einer Geldstrafe Bohrung, Medium Bohrung und eine große Bohrung an der jeweiligen Mündungen der Pipetten zu schaffen.
- Nach 20 min Inkubation in Lösung T, mit 20 ml einer Trypsin / DNase-Inhibitor-Lösung (Lösung B, Tabelle 5), die Kleinhirn-Aufhängung und Pellet-Zellen bei 1.000 g für 1 min in einer Tischzentrifuge (Tabelle 1).
- Den Überstand und Zellpellet in 1,5 ml einer konzentrierten Trypsin / DNase-Inhibitor (Lösung C, Tabelle 6) mit dem breitesten Bohrung Pipette.
- Man reibt die Zellen mit Hilfe von zunächst die weite Bohrung Pipette, dann die mittlere Bohrung und schließlich die enge Bohrung, bis die Zellsuspension homogen ist. Dies ist ein wichtiger Schritt, die Aussetzung muss in dieser Phase homogen.
- Schicht der Zellsuspension auf 10 ml einer vorgewärmten (37 ° C) Rinderserumalbumin Earles Balanced Salzlösung (Tabelle 7) in ein steriles 15 ml Tube.
- Die Suspension für 5 min bei 1.500 g und Zellpellet in 2 ml vorgewärmtem (37 ° C) Kulturmedium (Tabelle 8).
- Schätzen Sie die Anzahl der Zellen mit einer Zählkammer (Tabelle 1) und verdünnen die Zellsuspension auf eine endgültige Dichte von 3,3 x 10 6 Zellen pro ml.
- Die Zellen werden durch Zugabe von 75 ul der Zellsuspension in die Mitte des Poly-D-Lysin-beschichtete Deckgläschen (Enddichte 2,5 x 10 5) beschichtet.
- Die Kultur-Platten, die die Deckgläser sind in der CO 2-Inkubator für 60 min in der Lage, die Zellen zu einem erlaubendhere.
- Fügen Sie 1,5 ml Kulturmedium in jedes Well dabei nicht auf der plattierten Zellen stören und Rückkehr der Kultur-Platten, die CO 2-Inkubator.
- Am nächsten Tag ersetzen das Kulturmedium mit frischem Kulturmedium mit der mitotischen Inhibitor Cytosinarabinosid (Tabelle 8) ergänzt. Diese Verhaftungen Proliferation von Gliazellen in Kultur.
2. Experimenteller Aufbau
- Grundlegende Versuchsaufbau sollte wie folgt aussehen (siehe Tabellen 1 und 9 für spezielle Geräte und Software):
- Inverted Auflicht-Fluoreszenz-Mikroskop
- Gekühlte CCD-Kamera
- Fluorescent Lichtquelle (Monochromator oder Filterrad)
- Gravity Perfusionsapparatur
- Imaging Kammer mit parallel Platinelektroden
- Elektrostimulatoren
- Computer
- Bildaufnahme-Software
- Experimente sollten in der Dunkelheit oder unter Rotlicht cond durchgeführt werdenitions mit einem Minimum an fluoreszierende Beleuchtung der Probe zu vermeiden, FM Farbbleichung.
- Die Experimente werden bei Raumtemperatur durchgeführt. Wenn physiologischen Temperatur erforderlich ist, kann eine Temperatur-kontrollierte Perfusion System verwendet werden.
3. Probenvorbereitung
- Kulturen sollten nach 8-12 Tagen in vitro verwendet werden.
- Übertragen einer einzigen Deckglas zu Kochsalzlösung (Tabelle 10) für 10 min bei Raumtemperatur zu einer Stabilisierung in neuen Medium zu ermöglichen.
- Entfernen Sie das Deckglas, trockenen seiner Unterseite und die Umgebung des anhaftenden Zellen mit einem kleinen Stück Papiertuch oder saugfähigen Papier.
- Mit Silikonfett (Tabelle 2), das Deckglas Kleber an der Unterseite der Bildgebung Kammer. Die Zellen sind zwischen den beiden parallelen Drähte werden. Ausreichende Silikonfett sollten verwendet werden, um vollständig zu versiegeln der Kammer werden aber ohne Fett in die Mitte des Bades Kammer.
- Vorsichtig füllt das Bad Kammer mit ~ 260 ul saline-Lösung und füllen Sie dann die Eingabe-Schlauch mit der gleichen Lösung.
- Kleben Sie ein sauberes Deckglas mit Silikonfett an die Spitze der Kammer zu verschließen. Die Input-und Output-Schlauch kann verwendet werden, um eventuell vorhandene Luftblasen in der Kammer eingeschlossen zu entfernen. Es ist wichtig, dass die elektrische Schaltung nicht durch Luftblasen unterbrochen.
- Immobilise der Imaging-Kammer in einem Edelstahl-Plattform und auf Dichtheit prüfen, indem Sie vorsichtig Perfusion Salzlösung durch die Eingabe Schlauch.
- Bringen Sie die zusammengebauten Kammer auf der Bühne eines inversen Mikroskops, und verbinden Sie die Kammer auf einen Schwerpunkt Perfusion System, nachdem er den Einlauf mit Kochsalzlösung grundiert.
- Bringen Sie Anschlussdrähte der Kammer zu den elektrischen Stimulator.
- Fügen Sie einen Tropfen Immersionsöl auf das Ziel, wenn ein Öl-Objektiv verwendet wird. Konzentrieren Sie sich auf die Zellen in der Mitte der Kammer mit Hellfeldbeleuchtung.
4. S1 Phase
- Perfundieren Neuronen mit 1,5 mlvon FM-Farbstoff (Tabelle 2) in Kochsalzlösung verdünnt.
- Stimulieren Neuronen Farbstoffaufnahme evozieren unter Verwendung des beigefügten Stimulator.
- Nach Stimulation, perfuse Neuronen mit frischen Kochsalzlösung für 2 Minuten abwaschen, um überschüssige FM-Farbstoff (Flussrate 7 ml / min). Glial Kontamination in der CGN Kultur ist weniger als 5% 14, ist daher dieser Zeitrahmen ausreicht, um Farbe zu entfernen .
- Lassen Neuronen für 8 min ruhen.
- Während dieser Zeit finden axonalen Netzwerken, in denen einzelne FM farbstoffbeladenen Nervenendigungen sind mit Fluorescein Wellenlängen (Anregung, 480 nm; Emission,> 550 nm). Vermeiden Sie Bereiche mit Clustern von Zellen. Keep Beleuchtung auf ein Minimum zu diesem Schritt, da intensive Erregung in Farbstoff Phototoxizität führen kann. Offensichtliche Anzeichen dafür sind von Axonen und ein Mangel an Farbstoff Entladung (durch Fixierung Farbstoff) blebbing.
- Re-Fokussierung Bild unmittelbar vor der Bildaufnahme, da eine leichte Drift kann während der Ruhezeit begangen haben.
- Begin Zeitraffer-Bildaufnahme mit einer Rate von 1 Frame alle 4 s.
- Nach dem Erwerb von 5 bis 10 baseline Bilder evozieren Exozytose der UVP durch die Bereitstellung einer 30 Hz Stimulation für 2 s (60 Aktionspotentiale) 8 Commence Stimulation manuell sofort nach Frame Capture..
- Nach der Übernahme von weiteren 10 Bilder evozieren SV Exozytose der RP mit drei Stimulationen von 40 Hz für 10 s (400 Aktionspotentiale), die jeweils 30 s auseinander 8.
- Erwerben Sie ein anderes 5 bis 10 Bildern und dann Pause Bildaufnahme.
5. Recovery-Phase (siehe Abbildung 2)
- Lassen Neuronen zu erholen über mindestens 20 min.
- Optional - Wenn die Wirkung eines Medikaments auf die Endozytose zu prüfenden, perfuse Neuronen mit Drogen-Lösung während dieser Zeit (Abb. 2b) 3,8.
6. S2 Phase
- Wiederholen Sie die S1-Phase-Protokoll (Abschnitt 4) für einen Kontroll-Versuch mit dem gleichen Sichtfeld wiein S1.
- Optional - Wenn die Wirkung eines Medikaments auf die Endozytose zu prüfen ist, perfuse Neuronen mit dem Medikament Lösung mit FM-Farbstoff (Abb. 2b) 3,8 ergänzt.
- Optional - Alternativ, wenn Medikament Auswirkungen auf die Exozytose von Interesse sind, perfuse Neuronen mit dem Medikament Lösung sowohl vor als auch während der RRP und RP Entladen Reize (Abbildung 2c) 3.
7. Data Analysis
- Verwenden Sie ImageJ und Microsoft Excel oder eine vergleichbare Software für die Datenanalyse.
- Für die Analyse wird eine Bildsequenz in Stack-Format erforderlich. Einige Bildbearbeitungs-Software können Sequenzen als einzelne Bilder exportieren. Wenn dies der Fall ist, Konvertieren von Bildern in einem Stapel mit einem ImageJ eingebaute Funktion Bild> Stacks> Bilder zu stapeln.
- Stellen Sie die Helligkeit und den Kontrast des Stapels, um den Dynamikbereich zu maximieren. Das Bild> Einstellen> Helligkeit / Kontrast (Abb. 3a).
- Wenn bedeutende horizontale Drift während t aufgetretenEr Experiment laufen StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) und TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) Plugins auf ImageJ zu Bildstapel (Abbildung 3b) ausrichten .
- Run Time Series Analyzer-Plugin ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (Abbildung 3c).
- Definieren regions of interest (ROI) über mindestens 90 Nervenendigungen. Diese sollten identisch sein (circular ROIs mit 1,5 Mikrometer Durchmesser) Es ist hilfreich, um zwischen den Bildern wechseln, bevor und nachdem Farbstoff Entladen der aktiven Nervenendigungen (alternativ ein Vorstimulation Image kann von einem post-Stimulation Bild subtrahiert werden) zu offenbaren. Ein idealer ROI Größe ist einer, der etwas größer als eine typische Nervenendigung (Abbildung 3c) ist.
- Besorgen Sie sich die Beiträge / integrierte Fluoreszenzintensität der einzelnen ROI über time und Export zu Microsoft Excel (Abbildung 3d und 4a).
- Normalisieren ROI Spuren auf die gleiche beliebigen Wert ein, indem Spuren in der Ebene der Y-Achse für die ersten Entladung Stimulus sowohl in S1 und S2-Phasen (Abb. 4b-c). Dies ist für kleine Variationen im Hintergrund Fluoreszenzintensität zu kontrollieren.
- Messen Sie die absolute Abnahme der Fluoreszenz von jedem Entladen Impulse in beliebiger Fluoreszenz Einheiten für S1 und S2 wie folgt (Abb. 4d) hervorgerufen:
- UVP = Veränderung der Fluoreszenz (AF) von 30 Hz 2 s ausgelöst
- RP = Summe der AF ausgelöst durch 3 x 40 Hz 10 s
- Insgesamt Recycling-Pool = RRP + RP
- Für jeden relevanten Parameter in 7,9, berechnen Sie den Mittelwert über alle Nervenendigungen von einem einzigen Experiment.
- Für die statistische Analyse, Mittelwerte aus mehreren unabhängigen Experimenten gemittelt werden können. Die Zahl der Deckgläser anstatt die Anzahl der Nervenenden sollte als statistica verwendet werdenl n.
8. Repräsentative Ergebnisse:
Ein Kontrollversuch, wo CGNs unterzog zwei Runden identischer Be-und Entladen Schritte ist in Abbildung 5 dargestellt. Bei Beginn einer Reihe von Experimenten, ist es unerlässlich, dass eine Kontrolle Experiment wie dieses durchgeführt wird jeden Tag zu bestätigen, dass S1 und S2 vergleichbar, bevor unterschiedlichen experimentellen Bedingungen während der S2 sind.
In diesem Beispiel wurden CGNs mit 10 uM FM1-43 mit einem 80 Hz 10 s Stimulation (Abbildung 5a) geladen. Abbildung 5b zeigt FM1-43-geladen Nervenendigungen durch fluoreszierende puncta vertreten. ROIs wurden über 90 Nervenendigungen definiert, wie in Abbildung 5c dargestellt. Der gleiche Satz von ROIs wurde für beide S1 und S2 verwendet. Während der beiden entlädt, wurde die RRP zunächst mit einer 30 Hz (2 s) Stimulation durch RP Entladen mit 3 sequentiellen 40Hz (10 s) Reize (Abbildung 5a), gefolgt entladen. Die Fluoreszenz-Drop bei jedem Stimulus kann deutlich beobachtet und quantifiziert werden (Abbildung 5d-e). Bei der Untersuchung der Fluoreszenz entsprechend der UVP fällt, wurden RP-und Kreislauf-Pool vergleichbar in beiden S1 und S2. Darüber hinaus wohnten 20% aus recyceltem SVs in der UVP, während 80% in der RP in beiden S1 und S2 residierte.

Abbildung 1 Schematische Darstellung eines typischen FM Experiment. A) SV Endozytose ist in Gegenwart von FM-Farbstoff (vertreten in grün) ausgelöst. Der Farbstoff wird durch einstülpende Membran (single SVs oder Bulk-Endosomen) übernommen. B) Nicht verinnerlicht Farbstoff auf der Plasmamembran entfernt durch Perfusion gewaschen. C) Auf Antrag einer Entladung Reiz, etikettiert SVs, die verfügbar sind zur Freisetzung Sicherung mit der Plasmamembran was zu einem Verlust der Fluoreszenz. D) Die Veränderung der Fluoreszenz (AF), die proportional zur Menge des freigesetzten gekennzeichnet SVs kann dann quantifiziert werden.
_upload/3143/3143fig2.jpg "/>
Abbildung 2 Schematische Darstellung der möglichen experimentelle Protokolle. A) Flussdiagramm einer Steuerung Experiment, bei dem Zellen durchlaufen zwei Runden FM Farbstoff Be-und Entladen (S1 und S2). Die Zellen können geladen mit einer Reihe von unterschiedlichen Stimuli werden. Entladen Schritte sind identisch, dass die UVP mit 30 Hz für 2 s entladen wird, gefolgt von RP Entladen mit 3 mal 40 Hz für 10 s. RRP und Reservepool Entladen Stimuli wurden von 40 sec, alle anderen Reize von 30 sec getrennt. Die Zellen sind von links nach 20 Minuten zwischen S1 und S2 zu erholen. Flussdiagramme für mögliche Änderungen an der Wirkung einer Substanz auf beiden B-Test) Endozytose oder C) Exozytose sind ebenfalls dargestellt. Entsprechende Test Medikament kann in der Kammer während angegebenen Zeiträume perfundiert werden.
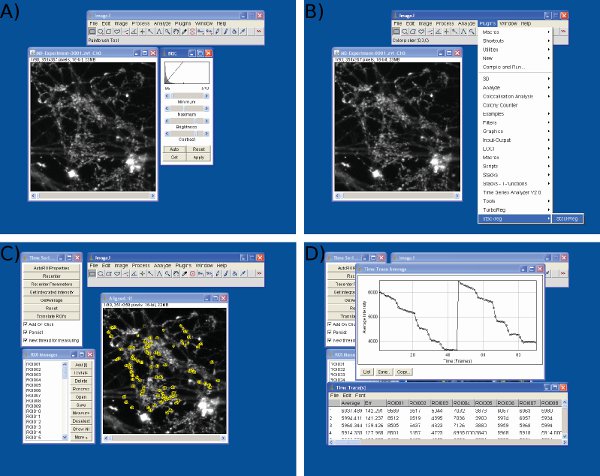
Abbildung 3 Screenshots der Datenanalyse in Image J. Screenshots werden gezeigtfür A) Helligkeits-und Kontrastwerte, B) Rahmen Ausrichtung C) ROIs Auswahl, und D) Intensitätswerte Extraktion mit Bild J.
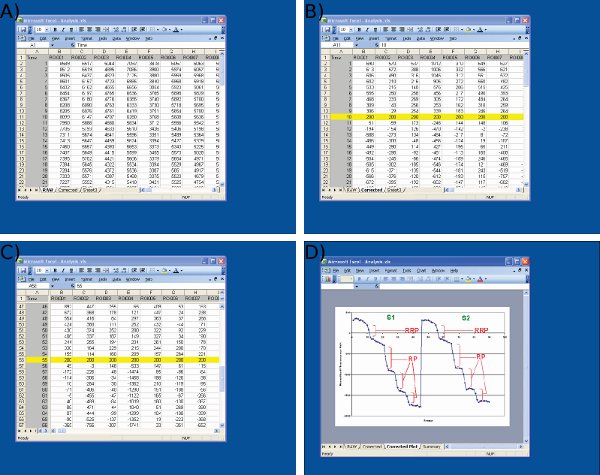
Abbildung 4 Screenshots der Datenanalyse in Microsoft Excel. Screenshots sind für A) den Import von Rohdaten von Image J (1 st Spalte = Anzahl der Frames, restlichen Spalten = Daten aus den einzelnen Nervenenden) B) Anpassung der S1 Baseline-Werten (Bild 10) auf einen beliebigen Wert (200) am Start der erste Reiz, C) Anpassung der S2 Baseline-Werte bei Bild 55 mit einem identischen Protokoll S1 und D) Messung der Fluoreszenz fällt mit Microsoft Excel. Beachten Sie, dass die gemittelten Spur in D gezeigt wird verwendet, um Zeitpunkten vor und nach jedem Tropfen zu definieren. Die Größe der Fluoreszenz-Tropfen für jede ROI sollte von Werten auf dem Arbeitsblatt in C gezeigt bestimmt werden

Abbildung 5. Vertreter Kontrolle zu experimentieren. A) Flussdiagramm einer Steuerung Experiment, bei dem CGNs mit 10 um FM1-43 geladen wurden unter Verwendung von 80 Hz (10 s) Stimulation. Die S1 und S2 Phasen identisch sind. RRP und Reservepool Entladen Stimuli wurden von 40 sec, alle anderen Reize von 30 sec getrennt. B) Ein Bild, das Nerven-Terminals mit FM1-43 geladen. C) Das gleiche Bild wie B zeigt 90 nummerierte ROIs für die Analyse ausgewählt. D) Bilder von einer Fläche mit einem roten Feld in B an ausgewählten Zeitpunkten dargestellt. Basal = vor der Stimulation, 30 Hz = 30 Hz nach 2 s Stimulation; 40 Hz 1,2,3 = nach jeder 40 Hz 10 s Stimulation. Diese Bilder werden in Falschfarben dargestellt, um Veränderungen in der Fluoreszenz (Spektrum-Bar auf der rechten Seite angezeigt) illustrieren. E) Mittelwert ± SEM Spur von 90 Nervenendigungen in C. Individuelle Reize dargestellt, erhalten durch horizontale Balken dargestellt werden. Maßstabsbalken = 10 pm.
Diskussion
FM Farbstoffe werden in großem Umfang verwendet werden, um Nervenendigung Funktion in vielen neuronalen Vorbereitungen zu untersuchen. Sie wurden vor allem auf das Ausmaß der entweder SV Endozytose, SV Umsatz oder die Kinetik der Exozytose 6 zu überwachen beschäftigt. Das beschriebene Protokoll erweitert diese Studien, um die Differenz Entladen von bestimmten SV-Pools zu untersuchen. Dies bietet zusätzliche Informationen über die Wiederauffüllung der SV-Pools und auch ihr Ausmaß der Mobilisierung.
FM-Farbstoffe können mehrere Runden SV Recycling innerhalb der gleichen Nervenenden Label sein. Wir haben diese Eigenschaft genutzt und gestaltet Protokolle, in denen SV Umsatz in jedem Terminal zweimal in den gleichen Nervenenden überwacht werden kann. Dies ermöglicht eine genaue interne Kontrolle, die wesentlich aufgrund der heterogenen Natur der SV-Recycling in parallel Nervenendigungen 11 ist. Über die Verwendung der S1-Phase als interne Kontrolle, das Nachfüllen der RRP, RP und die gesamteSV-Pool in der Gegenwart von Arzneimitteln zuverlässig und direkt verglichen werden.
Neben der Bereitstellung von Informationen über die absolute Größe des Recycling, RRP und RP-Pools unter verschiedenen Stimulation Bedingungen kann dieses Protokoll auch Daten für die folgenden - 1) Die Aufteilung der SVS zwischen dem Marktpreis und RP in Abhängigkeit von der Recycling-Pool für S1 und S2, 2) die relative Größe der S2-Pools (RRP und RP) als Funktion der gesamten S1 Recycling-Pool und 3) die relative Größe einer definierten SV Pool in S2 in Abhängigkeit von den gleichen Pool in S1. Dieses Protokoll wird insbesondere keine Informationen über Entladen Kinetik jedoch seit der Übernahme der Zeit ist zu langsam (für kinetische Messungen Messzeiten sollten so zügig wie möglich und Entladen automatisch synchronisiert image capture).
Unsere 30 Hz 2 s Stimuli evoziert ein identisches Ausmaß der RRP Entladen zu hypertonen Saccharose 8. Da die Größe des RRPvon hypertoner Saccharose Entladen 15 definiert ist, können wir feststellen, dass dieses Protokoll alle UVP SVs entlädt, im Einvernehmen mit dem Studium in Hippocampus-Neuronen 16. Die Reserve-Pool ist fast vollständig von drei Züge von 400 Stimuli (40 Hz 10 s jeweils), da diese Stimulation entlädt eine identische Menge an Farbstoff zu einem Paradigmenwechsel (2 Reize mit 50 mM KCl), dass 95% aller Farbstoff-markierten SVs erschöpft erschöpft 8,17. Genaue Quantifizierung der Größe sowohl der UVP und Reserve-Pool ist auch abhängig von den Erwerb von Informationen innerhalb des linearen dynamischen Bereich der CCD-Kamera.
Dieses einfache Protokoll kann auch weiter modifiziert werden. Die Stärke der Belastung Reize kann auch variiert werden, um festzustellen, wie neuronale Aktivität und verschiedene Endozytose Modi beeinflussen SV Pool Nachschub werden. Darüber hinaus können mehr als zwei Zyklen von Be-und Entladen auch durchgeführt werden, wenn erforderlich. Dieses Protokoll kann auch in Zellen entweder mit Überexpression oder transfiziert werdenshRNA-Vektoren. Aufgrund der geringen Transfektionseffizienz der primären neuronalen Kulturen, müssen exprimierten Proteine mit fluoreszierenden Proteinen markiert werden. Es ist wichtig, dass diese fluoreszierenden Markierungen nicht mit dem FM-Signal stören Farbstoff (Verwendung Cyan und Rot-Proteine, zum Beispiel). In diesem Fall kann Nervenendigungen von transfizierten und nicht transfizierten Zellen in der gleichen Sichtfeld auch als eine zusätzliche Steuerung 8 verglichen werden. In solchen Experimenten ein Vergleich des Ausmaßes der Belastung zwischen S1 und S2 Lasten ist von geringem Wert, da die Störung während der beiden Belastungen zu präsentieren. Partitionierung des Farbstoffs zwischen SV-Pools können noch jedoch 8 visualisiert werden.
Genetische Reporter namens pHluorins auch eingesetzt, um SV Exozytose und Endozytose in primären neuronalen Kultur zu überwachen. Diese Sonden mit einem pH-sensitive grün fluoreszierendes Protein, um den pH-Umfeld luminalen Domänen der markierten SV Proteine wie VAMP, Synaptophysin und VGLUT1 18 . In Verbindung mit vesikuläre ATPase-Inhibitoren eingesetzt wird, kann pHluorins Bericht sowohl die Kinetik und das Ausmaß der SV Pool Mobilisierung 19. Die FM-Farbstoff hier beschriebene Ansatz hat einige Vorteile gegenüber dem pHluorin Technik Erstens bieten FM Farbstoffe Informationen über die SV Endozytose-Modus füllt die RRP und Reserve-Pools 8. Zweitens spezifische SV-Pools können mit FM-Farbstoffe, die unterschiedliche spektrale Eigenschaften haben 20 und schließlich gibt es keine Anforderung für die Transfektion bezeichnet werden. FM Farbstoffe können keine Informationen über SV-Verkehr zwischen der Rast-und Recycling-SV-Pools jedoch (im Gegensatz zu pHluorins 19), da per Definition SVs mit Farbstoff während der Endozytose zu sehen sein geladen werden müssen. So auch FM Farbstoffe und pHluorins haben Stärken und Schwächen und mächtigsten, wenn in unabhängigen Experimenten verwendet, um die gleiche Frage zu stellen.
Qualitativ hochwertige Bilder sind für valide Analyse und reproducib wesentlichele Ergebnisse. Während horizontale Drift leicht korrigiert werden kann, können Experimente, in denen es einen Drift in der Z-Achse nicht wiederhergestellt werden. Aus diesem Grund ist es wichtig, wieder unscharfe Bilder vor Beginn der S1 und S2 entlädt. In Fällen, in denen eine signifikante Fluoreszenz-Zerfall stattgefunden hat, kann Zerfallskorrekturen angewendet (in der Regel durch Abzug einer zuvor aufgezeichneten Spuren von FM-beladenen Zellen in der Abwesenheit von Stimulation) werden. Allerdings wird vorgeschlagen, dass Karies Korrektur ist nur für die grafische Darstellung und nicht für jede quantitative Analyse verwendet werden durchgeführt.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch einen Zuschuss aus dem Wellcome Trust (: 084277 Ref) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name | Firma | Katalog-Nr. | |
|---|---|---|---|
| AxioCam MRm Rev. 3 Digital Camera | Carl Zeiss | 4265099901000 | |
| Axio Observer.A1 Mikroskop | Carl Zeiss | 4310040000000 | |
| Zellkulturplatten (6 Bohrlöcher) | Greiner bio-one | 657160 | |
| Zentrifuge (Universal 32R) | Hettich Zentrifugen | 1610 | |
| CO 2-Inkubator | Heraeus Instruments | 51014042 | |
| Falcon-Röhrchen (15/50 ml) | Greiner bio-one | 188271/210261 | |
| Fluar 20X / 0,75 ∞ / 0.17 Ziel | Carl Zeiss | 4401459901000 | |
| Deckgläser (Ø25mm) | VWR International | 631-1584 | |
| Glas Pasteur Pipetten (230 nm) | Greiner bio-one | 612-1799 | |
| Hämocytometer | VWR | 15170-170 | |
| Imaging Kammer | Warner | RC-21 BRFS | |
| Laminarströmungshaube | BIOHIT | VLF BHS 1200 | |
| McIlwain Tissue Chopper | Mickle Laboratory Engineering Co. Ltd | MTC / 2 | |
| Mercury Lampe | Carl Zeiss | HBO 103 | |
| MultiStim-System Elektrostimulatoren (100mV, 1ms Pluse Breite) | Digitimer Ltd | D330 | |
| Perfusionspumpe | Watson-Marlow | 313S | |
| Serologische Pipetten (5/10/25 ml) | Greiner bio-one | 606180/607180/760180 | |
| Shutter-Controller | Carl Zeiss | MAC5000 | |
| Spritze (20 ml) | BD Plastipak | ST01-B002 | |
| Spritzenvorsatzfilter (Minisart - 0,20 um) | Sartorius Stedim | 16532 | |
| VC-6 Sechs-Kanal-Ventilsteuerung | Warner | 64-0135 | |
| YFP Filter-Set (Set 46) | Carl Zeiss | 1196-681 |
Tabelle 1. Ausstattung und Geräte
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| FM1-43 | Cambridge BioScience | BT70021 | 10 uM |
| FM2-10 | Cambridge BioScience | BT70044 | 100 pM |
| Poly-D-Lysin | Sigma | P7886 | 15 ug / ml |
| Silikonfett | Sigma | 85403 | - |
Tabelle 2. Spezifische verwendeten Reagenzien
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| Bovine Serum Albumin (BSA) | Sigma | A4503 | 0,3% |
| D-Glucose | Sigma | G5767 | 0,25% |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| D-PBS | Gibco | 21300 | 960 mg/100 ml |
-Make 100ml frische für jedes Präparat
-Sterilfilter vor dem Einsatz
Tabelle 3. Lösung B für CGN Vorbereitung
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| Lösung B | - | - | 19 ml |
| Trypsin (5 mg / ml Brühe, -20 ° C) | Sigma | T9201 | 1 ml |
Tabelle 4. Lösung für T CGN Vorbereitung
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| Lösung C | - | - | 3,2 ml |
| Lösung B | - | - | 16,8 ml |
Tabelle 5. Solution W für CGN Vorbereitung
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| Deoxyribonuclease (DNase, 500 U pro 0,5 ml Brühe, -20 ° C) | Sigma | D5025 | 0,5 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| Lösung B | - | - | 10 ml |
| Sojabohnen-Trypsin-Inhibitor (SBTI, 0,5 mg pro 0,5 ml Brühe, -20 ° C) | Sigma | T9003 | 0,5 ml |
Tabelle 6. Lösung C für CGN Vorbereitung
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| Bovine Serum Albumin (BSA) | Sigma | A4503 | 4% |
| Earle Balanced Salt Solution (EBSS) | Gibco | 24010 | 10 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 3 mM |
Tabelle 7. EBSS Lösung für CGN Vorbereitung
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| Cytosin β-D-arabinofuranosid (Ara-C) * | Sigma | C1768 | 10 uM |
| Fetale Bovine Serum | Gibco | 10106 | 10% |
| D-Glucose | Sigma | G5767 | 30 mM |
| L-Glutamin | Sigma | G3126 | 2 mM |
| KCl | Sigma | P5405 | 25 mM |
| Minimal Essential Medium (MEM) | Gibco | 21090 | 500 ml |
| Penicillin (P) / Streptomycin (S) | Gibco | 15140 | 100 U / ml (P), 100 ug / ml (S) |
* Ara-C sollte mittelfristig von 1 DIV seit hinzugefügt werden
Tabelle 8. Nährmedien für CGN Vorbereitung
| Name | Version | Firma |
|---|---|---|
| AxioVision Rel.. | 4,8 | Carl Zeiss |
| ImageJ | 1.42q | National Institutes of Health |
| Microsoft Excel | 2003 | Microsoft |
Tabelle 9. Spezielle Computer-Software verwendet
| Name | Firma | Katalog-Nr. | Konzentration |
|---|---|---|---|
| CaCl 2 · 2H 2 O | Sigma | C7902 | 1,3 mM |
| Glucose | Sigma | G5767 | 5 mM |
| KCl | Sigma | P5405 | 3,5 mM |
| KH 2 PO 4 | Sigma | P9791 | 0,4 mM |
| MgCl 2 · 6 H 2 O | Sigma | M0250 | 1,2 mM |
| NaCl | Fluka | 71378 | 170 mM |
| NaHCO 3 | Fluka | 71627 | 5 mM |
| Na 2 SO 4 | BDH Laboratory Supplies | 10264 | 1,2 mM |
| TES | Sigma | T1375 | 20 mM |
Tabelle 10. Saline Solution (pH 7,4)
Referenzen
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten