Method Article
Análisis cuantitativo de Reposición Synaptic piscina vesículas en cultivos de neuronas granulares del cerebelo con tintes FM
En este artículo
Resumen
Una técnica en vivo imágenes de fluorescencia para cuantificar la reposición y la movilización de las vesículas sinápticas específicas (SV) se estanca en los terminales nerviosos centrales se describe. Dos rondas de SV de reciclaje son monitoreados en las terminales nerviosas que se proporciona un control interno.
Resumen
Después de la liberación de neurotransmisores en las terminaciones nerviosas centrales, SV son rápidamente recuperados por endocitosis. Consultado el SV se volvió a llenar con los neurotransmisores y reincorporarse a la piscina de reciclaje, definida como la SVS que están disponibles para 1,2 exocitosis. La piscina de reciclaje en general, se puede subdividir en dos grupos distintos - la piscina fácilmente liberable (PVP) y el fondo de reserva (RP). Como sus nombres lo indican, el PVP se compone de SV que están disponibles de inmediato para la fusión, mientras que RP SV sólo se liberan durante 1,2 estimulación intensa. Es importante tener un método seguro de que los informes de la reposición diferencial de estas piscinas SV a fin de comprender 1) cómo SV tráfico después de los diferentes modos de endocitosis (como clatrina dependiente de la endocitosis y la actividad dependiente de la endocitosis a granel) y 2) los mecanismos de la el control de la movilización tanto de la PRR y RP en respuesta a diferentes estímulos.
Colorantes FM se emplean habitualmenteed para informar cuantitativamente el volumen de negocios SV en los terminales nerviosos centrales 3-8. Tienen una cola de hidrocarburo hidrofóbico que permite particionar reversible en la bicapa lipídica, y un grupo de cabeza hidrofílica que bloquea el paso a través de membranas. Los colorantes tienen poca fluorescencia en solución acuosa, pero su rendimiento cuántico se incrementa dramáticamente cuando particionado en la membrana de 9. Así, colorantes FM es ideal para el seguimiento de sondas fluorescentes que se reciclan activamente SV. El protocolo estándar para el uso de tinte de FM es la siguiente. En primer lugar se aplican a las neuronas y se toman durante la endocitosis (Figura 1). Después de no internalizadas tinte se lava fuera de la membrana plasmática, reciclado redistribuir SV dentro de la piscina de reciclaje. Estos SV son consumidos con estímulos descarga (Figura 1). Desde FM tinte de etiquetado de la SVS es cuántica 10, la caída de la fluorescencia resultante es proporcional a la cantidad de vesículas liberadas. De este modo, el reciclaje y la fusión de SV generados a partir de la previous ronda de la endocitosis puede cuantificarse.
Aquí, se presenta un protocolo que ha sido modificado para obtener dos elementos adicionales de información. En primer lugar, los estímulos descarga secuencial se utilizan para descargar diferencialmente el PVP y la RP, para permitir la cuantificación de la reposición de determinados grupos de SV. En segundo lugar, cada terminación nerviosa se somete el protocolo en dos ocasiones. Por lo tanto, la respuesta de la terminal nerviosa mismo en S1 se puede comparar con la presencia de una sustancia de ensayo en fase S2 (Figura 2), proporcionando un control interno. Esto es importante, ya que el grado de reciclaje de SV a través de las terminales nerviosas distintas es muy variable 11.
Cualquier seguidor cultivos neuronales primarios pueden ser utilizados para este protocolo, sin embargo, la densidad de la galvanización, soluciones y condiciones de estimulación están optimizados para las neuronas granulares del cerebelo (CGNs) 12,13.
Protocolo
1. Granulares del cerebelo Preparación Neurona
- Autoclave de aproximadamente 100 mm de diámetro 25 cubreobjetos (Tabla 1).
- Cubreobjetos en un tubo de 50 ml estéril que contiene estéril poli-D-lisina solución (Cuadro 2). Coloque sobre una plataforma giratoria de 2 h para cubrir los cubreobjetos.
- Seco cubreobjetos recubiertos de papel de seda estéril en una campana de flujo laminar (Tabla 1).
- Cubreobjetos estériles en lugar de placas de 6 pocillos y Cubreobjetos de calor en una incubadora de CO 2 (Tabla 1). Se puede almacenar durante 1 mes a 4 ° C para antes de su uso.
- Practicar la eutanasia a 7 días de edad ratas Sprague Dawley cachorro de acuerdo a las pautas locales de comité de ética. Hemos sacrificado crías por dislocación cervical.
- Diseccionar el cerebelo y colocarlo en una placa de Petri estéril que contiene una solución de sales de tampón fosfato (solución B, Tabla 3).
- Repita los pasos 1.5 y 1.6 de 6.4 crías de rata.
- Cerebelo se colocan en la etapa estéril de un tejido McIlwain ChoPPER (Tabla 1). Tejido se corta a 375 micras intervalos antes de girar el escenario a través de 90 ° y repetir el proceso.
- El cerebelo picados se transfieren a una solución de tripsina (solución T, Tabla 4) que había sido previamente calentado a 37 ° C.
- Incubar cerebelo a 37 ° C durante 20 min con agitación suave aproximadamente cada 5 minutos.
- Durante la digestión tríptica, llama pulir tres pipetas de vidrio estériles (Tabla 1) con una llama de mechero Bunsen. Utilizar el fuego para crear un agujero bien, un agujero medio y un agujero de ancho en la desembocadura de las pipetas.
- Después de la incubación de 20 minutos en la T solución, añadir 20 ml de una solución de inhibidor de tripsina / DNasa (solución de W, tabla 5) a la suspensión del cerebelo y las células de pellets a 1.000 g durante 1 min en una centrífuga de mesa (Tabla 1).
- Se decanta el sobrenadante y resuspender el botón celular en 1,5 ml de una solución concentrada de tripsina / DNasa inhibidor (solución C, Tabla 6) con la más amplia pipeta de diámetro.
- Triturar las células utilizando primero la pipeta de ancho agujero, entonces el medio de diámetro y, finalmente, el agujero estrecho hasta que la suspensión celular homogénea. Este es un paso clave, la suspensión debe ser homogénea en esta etapa.
- La capa de células en suspensión en la parte superior de 10 ml de una precalentado (37 ° C) de albúmina sérica bovina solución de sales equilibrada complementada Earles (Tabla 7) en un tubo estéril de 15 ml.
- Centrifugar la suspensión durante 5 minutos a 1.500 gy resuspender el botón celular en 2 ml de precalentado (37 ° C) medio de cultivo (Tabla 8).
- Estimar el número de células con un hemocitómetro (Cuadro 1) y diluir la suspensión de células a una densidad final de 3,3 x 10 6 células por ml.
- Las células se colocan mediante la adición de 75 l de la suspensión de células en el centro de poli-D-lisina cubreobjetos (densidad final de 2,5 x 10 5).
- Las placas de cultivo que contiene el cubreobjetos se colocan en la incubadora de CO 2 durante 60 minutos para permitir que las células a unaDhere.
- Añadir 1,5 ml de medio de cultivo en cada pocillo con cuidado de no molestar a las células chapada y regresar las placas de cultivo a la incubadora de CO 2.
- Al día siguiente, reemplazar el medio de cultivo con medio de cultivo fresco suplementado con el inhibidor de la mitosis arabinósido de citosina (Tabla 8). Esta proliferación detenciones de células gliales en la cultura.
2. Montaje experimental
- Montaje experimental básico debe consistir en lo siguiente (ver Cuadros 1 y 9 para el equipo y el software que se utiliza):
- Invertida epi-microscopio de fluorescencia
- Cámara CCD refrigerada
- Fuente de luz fluorescente (luz monocromador o rueda de filtros)
- Gravedad aparato de perfusión
- Imágenes de cámara con electrodos de platino en paralelo
- Estimulador eléctrico
- Computadora
- Software de adquisición de la imagen
- Los experimentos deben realizarse en la oscuridad o bajo luz roja conditions con una iluminación mínima de fluorescencia de la muestra para evitar colorante FM blanqueo.
- Los experimentos se llevan a cabo a temperatura ambiente. Si la temperatura fisiológica es necesario, un sistema de perfusión con control de temperatura se pueden utilizar.
3. Preparación de la muestra
- Los cultivos deben ser utilizados después de 8-12 días in vitro.
- Transferencia de un cubre solo a una solución salina (Tabla 10) durante 10 min a temperatura ambiente para permitir la estabilización en el nuevo medio.
- Quitar los cubreobjetos, seca su parte inferior y la zona que rodea las células unido con un pequeño pedazo de papel toalla o papel absorbente.
- Con grasa de silicona (Tabla 2), pegue el cubreobjetos en la parte inferior de la cámara de imágenes. Las celdas deben estar entre los dos alambres paralelos. Grasa de silicona suficiente debe ser utilizado para sellar por completo la cámara, pero sin ningún tipo de grasa de entrar en el centro de la cámara del baño.
- Vierta la cámara de baño con ~ 260 l SAlínea de solución y luego llene el tubo de entrada con la misma solución.
- Pegue un cubreobjetos limpio con grasa de silicona en la parte superior de la cámara para sellarlo. La tubería de entrada y salida se puede utilizar para eliminar las burbujas de aire atrapado en la cámara. Es importante que el circuito eléctrico no se interrumpe por las burbujas de aire.
- Inmovilizar la cámara de imágenes en una plataforma de acero inoxidable y comprobar si hay fugas con cuidado la perfusión de solución salina a través del tubo de entrada.
- Monte la cámara montada en el escenario de un microscopio invertido, y conectar la cámara a un sistema de perfusión por gravedad, después de haber preparado la entrada con una solución salina.
- Conecte los cables de conexión de la cámara al estimulador eléctrico.
- Agregue una gota de aceite de inmersión con el objetivo, si un objetivo se utiliza el aceite. Centrarse en las células en el centro de la cámara con iluminación de campo claro.
4. S1 fase
- Neuronas perfundir con 1,5 mlFM de medio de contraste (Tabla 2) diluida en solución salina.
- Estimular las neuronas para provocar la absorción de colorante con el estimulador conectado.
- Después de la estimulación, las neuronas de perfusión con una solución salina fresca durante 2 minutos para quitar el exceso de tinte FM (velocidad de flujo de 7 ml / min). La contaminación gliales en el sistema de cultivo CGN es inferior al 5% 14, por lo tanto, este marco de tiempo es suficiente para quitar el tinte .
- Dejar las neuronas en reposo durante 8 min.
- Durante este intervalo, localizar las redes axonal en el individuo FM tinte cargado terminales nerviosas son visibles usando longitudes de onda de fluoresceína (excitación, 480 nm, emisión,> 550 nm). Evite las áreas con grupos de células. Mantenga al mínimo la iluminación en este paso, ya que la excitación intensa puede dar lugar a la fototoxicidad tinte. Signos evidentes de esto son vesiculación de los axones y la falta de tinte descarga (debido a la fijación de colorante).
- Re-enfoque de la imagen justo antes de la adquisición de imágenes desde una desviación leve puede haber ocurrido durante el período de descanso.
- Comience lapso de tiempo de adquisición de imágenes a una velocidad de 1 fotograma cada 4 s.
- Tras la adquisición de 5 a 10 imágenes de referencia, evoca la exocitosis de venta al público mediante la entrega de un estímulo de 30 Hz durante 2 s (60 potenciales de acción) 8 Comenzar la estimulación manual inmediatamente después de la captura de imágenes..
- Tras la adquisición de otras 10 imágenes, evocan exocitosis SV de la RP con tres estímulos de 40 Hz a 10 s (400 potenciales de acción), cada 30 s, aparte 8.
- Adquirir otro 5 a 10 imágenes y luego la adquisición de imágenes de pausa.
5. Fase de recuperación (ver Figura 2)
- Permiten a las neuronas para recuperar por lo menos 20 min.
- Opcional - Si el efecto de un medicamento en la endocitosis es haciéndose la prueba, las neuronas de perfusión con la solución de las drogas durante este período (Figura 2b) 3,8.
6. Fase S2
- Repita el protocolo de fase S1 (sección 4) para un experimento de control utilizando el mismo campo de visión comoen S1.
- Opcional - Si el efecto de un medicamento en la endocitosis es haciéndose la prueba, perfundir las neuronas con la solución de la droga complementa con FM tinte (Figura 2b) 3,8.
- Opcional - Por otra parte, si los efectos del fármaco sobre la exocitosis son de interés, las neuronas de perfusión con la solución de drogas, tanto antes como durante el RRP y RP estímulos descarga (figura 2c) 3.
7. Análisis de Datos
- Utilice ImageJ y Microsoft Excel u otro software similar para el análisis de datos.
- Para el análisis, una secuencia de imágenes en formato de pila es necesario. Algunos software de imágenes puede exportar secuencias de imágenes individuales. Si este es el caso, convertir las imágenes en una pila con un ImageJ incorporada en función de la imagen> Pilas> Imágenes de pila.
- Ajustar el brillo y el contraste de la pila para maximizar el rango dinámico. Imagen> Ajustes> Brillo / Contraste (Figura 3a).
- Si la deriva horizontal significativo se ha producido durante el tque experimento, ejecute StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) y TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) plugins en ImageJ para alinear la imagen de pila (Figura 3b) .
- Run Time Series Analizador de plugin ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (Figura 3c).
- Definir regiones de interés (ROI) a través de al menos 90 terminales de los nervios. Estos deben ser idénticas (ROI circular con un diámetro de 1,5 micras) Es útil para cambiar entre las imágenes antes y después del tinte descarga para revelar las terminales nerviosas activas (o bien una estimulación pre-imagen se puede restar de una imagen después de la estimulación). Un ideal tamaño de retorno de la inversión es la que es ligeramente más grande que una terminación nerviosa típica (Figura 3c).
- Obtener la intensidad de la fluorescencia total / integral de cada ROI sobre Time y la exportación a Microsoft Excel (Figura 3d y 4a).
- Normalizar las huellas retorno de la inversión al valor arbitrario misma mediante la alineación de los rastros en el plano del eje Y para el estímulo de la primera descarga en ambas fases S1 y S2 (Figura 4b-c). Esto es para controlar las variaciones en la intensidad de fluorescencia de fondo.
- Medir la disminución absoluta de la fluorescencia evocada por cada estímulo descarga en unidades arbitrarias de fluorescencia para S1 y S2 de la siguiente manera (Figura 4d):
- PVP = cambio en la fluorescencia (Df) desencadenado por 30 Hz 2 s
- RP = Suma de Df provocada por 3 x 40 Hz 10 s
- Piscina de reciclaje total = PVP + RP
- Para cada parámetro en el 7,9, calcular el valor medio de todas las terminaciones nerviosas de un solo experimento.
- Para el análisis estadístico, los valores medios obtenidos a partir de varios experimentos independientes pueden ser promediadas. El número de laminillas en vez de el número de terminaciones nerviosas se debe utilizar como el STATISTICAl n.
8. Los resultados representativos:
Un experimento de control, donde CGNs sometido a dos ruedas de idénticas medidas de carga y descarga se representa en la figura 5. Al comenzar una serie de experimentos, es esencial que un experimento de control de este tipo se lleva a cabo cada día para confirmar que S1 y S2 son comparables antes de diferentes condiciones experimentales en S2.
En este ejemplo, CGNs se cargaron con 10 M FM1-43 con un 80 Hz 10 s de estimulación (Figura 5). Figura 5b muestra FM1-43-Bornes nervio representado por fluorescentes puntos lagrimales. Rendimiento de la inversión se definieron más de 90 terminales de los nervios, como se muestra en la figura 5c. El mismo conjunto de regiones de interés se utiliza tanto para S1 y S2. Durante las dos descarga, el PVP se ha descargado primero con un 30 Hz (2 s) la estimulación seguida de RP descarga con 3 40Hz secuencial (10 s) estímulos (Figura 5). La caída de la fluorescencia en cada estímulo puede ser claramente observado y cuantificado (Figura 5d-e). Cuando se examina, la fluorescencia de gotas que corresponda a la PVP, RP y piscina reciclado total fueron comparables en ambos S1 y S2. Además, el 20% de reciclado SV residido en el PVP mientras que el 80% residía en el RP, tanto en S1 y S2.

Figura 1 Esquema de un experimento típico de FM. A) endocitosis SV se activa en presencia de FM tinte (representado en verde). El tinte es absorbido por la membrana invagina (solo SV o endosomas a granel). B) No interiorizado del colorante en la membrana plasmática es arrastrado por la perfusión. C) Tras la aplicación de un estímulo de descarga, etiquetado SV que se han hecho disponibles para fusible de liberación con la membrana plasmática que resulta en una pérdida de fluorescencia. D) El cambio en la fluorescencia (Df), que es proporcional a la cantidad de liberados etiqueta SV puede ser cuantificado.
_upload/3143/3143fig2.jpg "/>
Figura 2 Manual de usuario de los posibles protocolos experimentales. A) Diagrama de flujo de un experimento de control donde las células pasan por dos rondas de FM colorante de carga y descarga (S1 y S2). Las células se pueden cargar mediante una serie de estímulos diferentes. Pasos de descarga son idénticos en que el PVP se descarga con 30 Hz durante 2 s seguido por RP descargar usando 3 veces 40 Hz durante 10 s. PVP y los estímulos reserva piscina descarga fueron separados por 40 segundos, todos los otros estímulos por 30 segundos. Las células se dejan de recuperar durante 20 minutos entre S1 y S2. Los diagramas de flujo de posibles modificaciones para probar el efecto de una sustancia ya sea B) endocitosis o C) exocitosis también se muestran. Prueba de la droga correspondiente puede ser perfundida en la cámara durante los períodos indicados.
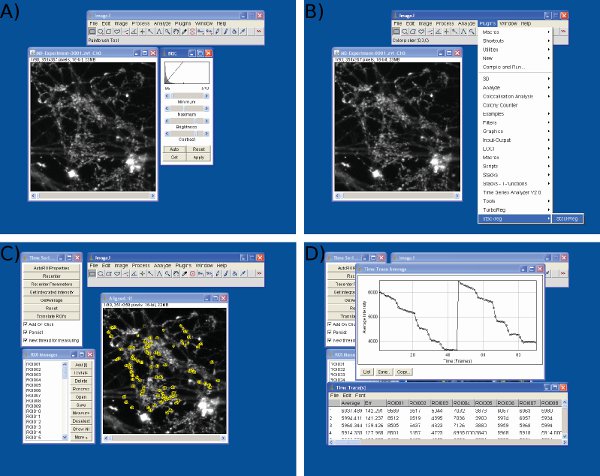
Figura 3 Imágenes de análisis de datos en J de la imagen. Imágenes se muestranUna de brillo) y ajuste de contraste, B) la alineación del marco, c) Selección ROI, y D) la extracción de los valores de intensidad de uso de la imagen J.
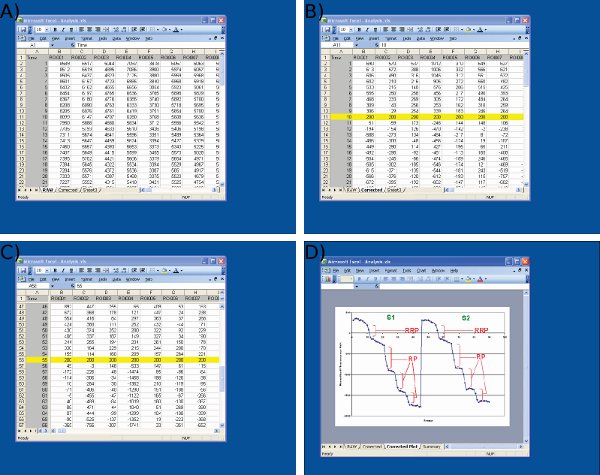
Figura 4 Imágenes de análisis de datos en Microsoft Excel. Imágenes se muestran en A) la importación de datos crudos de la imagen J (1 columna st = número del cuadro, columnas = datos de terminales nerviosas individuales) B) el ajuste de los valores de referencia S1 (cuadro 10) a un valor arbitrario (200) en el inicio del primer estímulo, C) el ajuste de los valores de referencia S2 en el fotograma 55 con un protocolo idéntico al S1, y D) la medición de las gotas de fluorescencia utilizando Microsoft Excel. Tenga en cuenta que la huella promedio se muestra en la D se utiliza para definir los puntos de tiempo antes y después de cada caída. El tamaño de las gotas de fluorescencia para cada ROI debe determinarse a partir de los valores en la hoja de cálculo se muestra en la C.

Figura 5. Representante experimento de control. A) Diagrama de flujo de un experimento de control, donde CGNs fueron cargados con 10μM FM1-43 con 80 Hz (10 s) la estimulación. Las fases de S1 y S2 son idénticos. PVP y los estímulos reserva piscina descarga fueron separados por 40 segundos, todos los otros estímulos por 30 segundos. B) Una imagen que muestra los terminales nerviosos cargados con FM1-43. C) La misma imagen que muestra B 90 ROIs contados seleccionados para el análisis. D) Las imágenes de un área representada por un recuadro rojo en la B en los puntos de tiempo seleccionado. = Antes de la estimulación basal, 30 Hz = después de la estimulación de 30 Hz 2 s, 40 Hz = 1,2,3 después de cada estimulación 40 Hz 10 s. Estas imágenes se presentan en pseudocolor para ilustrar los cambios en la fluorescencia (barra del espectro aparece a la derecha). E) Media ± SEM huella obtenida a partir de 90 terminales de los nervios se muestra en los estímulos C. individuales están representados por barras horizontales. Las barras de escala = 10 micras.
Discusión
Colorantes FM se utilizan ampliamente para investigar la función del nervio terminal en muchas preparaciones neuronales. Ellos se han empleado principalmente para controlar la extensión de cualquiera de endocitosis SV, la rotación de SV o la cinética de la exocitosis 6. El protocolo descrito extiende estos estudios para examinar la diferencia de la descarga de determinados grupos de SV. Esto proporciona información adicional con respecto a la reposición de las piscinas SV y también su grado de movilización.
Colorantes FM puede ser utilizada para etiquetar múltiples rondas de reciclaje de SV en los terminales nerviosos. Hemos explotado esta propiedad y diseñado protocolos en los que puede ser el volumen de negocios SV en cada terminal de control dos veces en los terminales nerviosos. Esto proporciona un control preciso de internos, lo cual es esencial debido a la naturaleza heterogénea de reciclaje de SV en los terminales nerviosos paralelo 11. A través de la utilización de la fase S1 como control interno, la recarga de los PVP, RP y el totalPiscina SV en la presencia de drogas puede ser confiable y comparar directamente.
Además de proporcionar información sobre el tamaño absoluto del reciclaje, piscinas y RP PVP bajo condiciones de estimulación diferentes, este protocolo también puede proporcionar datos para los siguientes - 1) La división de SV entre el PVP y RP en función de la piscina de reciclaje de S1 y S2, 2) el tamaño relativo de las piscinas S2 (RRP y RP) en función de la reserva total de reciclaje de S1 y 3) el tamaño relativo de cualquier grupo de SV se define en el S2 en función de la misma piscina en S1. Este protocolo en particular no proporcionará información sobre la cinética de descarga sin embargo, desde el tiempo de adquisición es demasiado lento (para mediciones cinéticas tiempos de adquisición deberá ser tan rápida como sea posible y descarga sincronizan automáticamente para capturar la imagen).
Nuestros 30 Hz 2 estímulos s evoca una medida idéntica de PVP descarga de sacarosa hipertónica 8. Dado que el tamaño de la venta al públicose define por la sacarosa hipertónica descarga 15, se puede afirmar que este protocolo de descarga todos los SV PVP, de acuerdo con estudios en las neuronas del hipocampo 16. La reserva está casi completamente agotados por tres trenes de 400 estímulos (40 Hz 10 s cada uno), ya que este estímulo se descarga una cantidad idéntica de medio de contraste para un nuevo paradigma (2 estímulos con KCl 50) que reduce el 95% de todos los SV marcado tinte 8,17. Cuantificación exacta de la magnitud tanto de la PRR y el fondo de reserva también depende de la adquisición de la información dentro del rango lineal dinámico de la cámara CCD.
Este protocolo simple también se puede modificar aún más. La fuerza de los estímulos de carga también se puede variar para determinar cómo la actividad neuronal y diferentes modos de endocitosis afectan reposición de SV de la piscina. Además, más de dos ciclos de carga y descarga también se puede realizar si es necesario. Este protocolo también se puede utilizar en las células transfectadas con sobreexpresión oARNhc vectores. Debido a la baja eficiencia de transfección de cultivos primarios de neuronas, proteínas que se expresan deben ser etiquetados con proteínas fluorescentes. Es esencial que estas etiquetas fluorescentes no interfieran con la señal de FM tinte (cian o utilizar proteínas de color rojo, por ejemplo). En este caso, las terminaciones nerviosas de las células transfectadas y no transfectadas, en el mismo campo de visión también puede ser comparado como un control adicional 8. En los experimentos de una comparación de la magnitud de la carga entre las cargas S1 y S2 es de poco valor, ya que la perturbación está presente durante las dos cargas. Partición de tinte entre piscinas SV todavía se pueden visualizar sin embargo 8.
Periodistas genética llamada pHluorins también se puede emplear para controlar la exocitosis y la endocitosis SV en cultivos neuronales primarios. Estas sondas utilizan un pH sensible a la proteína fluorescente verde en el medio ambiente pH luminal de los dominios de las proteínas marcadas SV como VAMP, sinaptofisina y VGLUT1 18 . Cuando se utiliza junto con inhibidores de la ATPasa vesicular, pHluorins puede reportar tanto la cinética y la magnitud de la movilización de la piscina SV 19. El enfoque basado en FM-dye descrito aquí tiene algunas ventajas sobre la técnica pHluorin, En primer lugar, colorantes FM proporcionar información sobre el modo SV endocitosis repone el RRP y las piscinas de reserva 8. Piscinas SV segundo lugar específicos pueden ser etiquetados con tintes de FM que tienen diferentes propiedades espectrales 20 y, finalmente, no hay ningún requisito para la transfección. Colorantes FM no puede proporcionar información sobre el tráfico entre el SV y el reciclaje de descanso piscinas SV sin embargo (en contraste con pHluorins 19), ya que por definición SV tiene que ser cargado con medio de contraste durante la endocitosis para ser visibles. Así, tanto los tintes FM y pHluorins tienen fortalezas y debilidades, y son más potentes cuando se utilizan en experimentos independientes para hacer frente a la misma pregunta.
Imágenes de alta calidad son esenciales para el análisis de validez y reproducibLe resultados. Mientras que la deriva horizontal puede ser fácilmente corregido, los experimentos en los que hay un desvío en el eje Z no se pueden recuperar. Por esta razón, es importante re-enfocar las imágenes antes de comenzar la descarga S1 y S2. En los casos en un deterioro significativo se ha producido fluorescentes, las correcciones de la caries se puede aplicar (por lo general, restando una huella previamente grabado de FM-cargado las células en ausencia de estimulación). Sin embargo, se sugiere que la corrección de la decadencia sólo se realiza para la representación gráfica y no a ser utilizado para cualquier análisis cuantitativo.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por una beca de la Wellcome Trust (Ref: 084277).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre | Empresa | Catálogo no. | |
|---|---|---|---|
| AxioCam MRM Rev. 3 Cámara Digital | Carl Zeiss | 4265099901000 | |
| Axio Observer.A1 Microscopio | Carl Zeiss | 4310040000000 | |
| Placas de cultivo celular (6 pozos) | Greiner Bio-One | 657160 | |
| Centrífuga (Universal 32R) | Hettich Zentrifugen | 1610 | |
| Incubadora de CO 2 | Heraeus Instrumentos | 51014042 | |
| Tubos Falcon (15/50 ml) | Greiner Bio-One | 188271/210261 | |
| Fluar 20X / 0.75 ∞ / 0.17 Objetivo | Carl Zeiss | 4401459901000 | |
| Vidrio cubreobjetos (Ø25mm) | VWR International | 631-1584 | |
| Pipetas Pasteur de vidrio (230 nm) | Greiner Bio-One | 612-1799 | |
| Hemocitómetro | VWR | 15170-170 | |
| Imágenes de la cámara | Warner | RC-21 SLRV | |
| Campana de flujo laminar | BIOHIT | VLF BHS 1200 | |
| McIlwain Chopper tejido | Mickle Laboratorio de Ingeniería Co. Ltd. | MTC / 2 | |
| Lámpara de mercurio | Carl Zeiss | HBO 103 | |
| MultiStim estimulador del sistema eléctrico (100 mV, 1 ms ancho Pluse) | Digitimer Ltd. | D330 | |
| Perfusión de la bomba | Watson-Marlow | 313S | |
| Pipetas serológicas (05/10/25 ml) | Greiner Bio-One | 606180/607180/760180 | |
| Shutter controlador | Carl Zeiss | MAC5000 | |
| Jeringa (20 ml) | BD Plastipak | ST01-B002 | |
| Filtros de jeringa (Minisart - 0,20 micras) | Sartorius Stedim | 16532 | |
| VC-6 seis canales controlador de válvula | Warner | 64-0135 | |
| YFP filtranter teléfono (46) | Carl Zeiss | 1196-681 |
Tabla 1. Equipos específicos y aparatos utilizados
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| FM1-43 | BioScience Cambridge | BT70021 | 10 M |
| FM2-10 | BioScience Cambridge | BT70044 | 100 M |
| Poli-D-lisina | Sigma | P7886 | 15 mg / ml |
| Grasa de silicona | Sigma | 85403 | - |
Tabla 2. Reactivos específicos utilizados
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| Albúmina de suero bovino (BSA) | Sigma | A4503 | 0,3% |
| D-glucosa | Sigma | G5767 | 0,25% |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| D-PBS | Gibco | 21300 | 960 mg/100 ml |
-100ml hacer de nuevo para cada preparación
-Filtro estéril antes de su uso
Tabla 3. Solución B para la preparación de CGN
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| Solución B | - | - | 19 ml |
| Tripsina (5 mg / ml, -20 ° C) | Sigma | T9201 | 1 ml |
Tabla 4. Solución de T para la preparación de CGN
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| Solución C | - | - | 3,2 ml |
| Solución B | - | - | 16,8 ml |
Tabla 5. Solución de W para la preparación de CGN
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| Desoxirribonucleasa (DNasa, 500 U por 0,5 ml de valores, -20 ° C) | Sigma | D5025 | 0,5 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| Solución B | - | - | 10 ml |
| Inhibidor de tripsina de soja (SBTI, 0,5 mg por 0.5 ml de valores, -20 ° C) | Sigma | T9003 | 0,5 ml |
Tabla 6. Solución C para la preparación de CGN
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| Albúmina de suero bovino (BSA) | Sigma | A4503 | 4% |
| Solución salina balanceada de Earle (EBSS) | Gibco | 24010 | 10 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 3 mM |
Tabla 7. EBSS solución para la preparación de CGN
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| Citosina β-D-arabinofuranoside (Ara-C) * | Sigma | C1768 | 10 M |
| Suero bovino fetal | Gibco | 10106 | 10% |
| D-glucosa | Sigma | G5767 | 30 mM |
| L-glutamina | Sigma | G3126 | 2 mM |
| KCl | Sigma | P5405 | 25 mM |
| Medio mínimo esencial (MEM) | Gibco | 21090 | 500 ml |
| Penicilina (P) / estreptomicina (S) | Gibco | 15140 | 100 U / ml (p), 100 mg / ml (S) |
* Ara-C debe ser añadido al medio a partir del 1 DIV
Tabla 8. Medios de cultivo para la preparación de CGN
| Nombre | Versión | Empresa |
|---|---|---|
| AxioVision Rel. | 4.8 | Carl Zeiss |
| ImageJ | 1.42q | Institutos Nacionales de Salud |
| Microsoft Excel | 2003 | Microsoft |
Tabla 9. Programas informáticos específicos que se utilizan
| Nombre | Empresa | Catálogo no. | Concentración |
|---|---|---|---|
| De CaCl 2 · 2H 2 O | Sigma | C7902 | 1,3 mM |
| Glucosa | Sigma | G5767 | 5 mM |
| KCl | Sigma | P5405 | 3,5 mM |
| KH 2 PO 4 | Sigma | P9791 | 0,4 mM |
| De MgCl 2 · 6H 2 O | Sigma | M0250 | 1,2 mM |
| NaCl | Fluka | 71378 | 170 mM |
| NaHCO3 | Fluka | 71627 | 5 mM |
| Na 2 SO 4 | BDH Suministros de Laboratorio | 10264 | 1,2 mM |
| TES | Sigma | T1375 | 20 mM |
Tabla 10. Solución salina (pH 7,4)
Referencias
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados