Method Article
Analisi quantitativa di Replenishment pool delle vescicole sinaptiche in colture di neuroni granuli cerebellari utilizzando coloranti FM
In questo articolo
Riepilogo
Una tecnica dal vivo imaging di fluorescenza per quantificare la ricostituzione e la mobilitazione di specifiche vescicole sinaptiche (SV) piscine in terminazioni nervose centrale è descritto. Due tornate di SV riciclaggio sono monitorati nei terminali nervosi pur prevedendo un controllo interno.
Abstract
Dopo il rilascio del neurotrasmettitore nei terminali nervosi centrali, SV sono rapidamente recuperati da endocitosi. Estratto SV sono poi riempiti con i neurotrasmettitori e raggiungere la piscina di riciclaggio, definito come SV che sono disponibili per 1,2 esocitosi. Il pool di riciclo possono essere generalmente suddivisi in due gruppi distinti - la piscina facilmente scaricabile (RRP) e il pool di riserva (RP). Come i loro nomi, il PRR è costituito da SV che sono immediatamente disponibili per la fusione, mentre RP SV vengono rilasciati solo durante 1,2 intensa stimolazione. E 'importante avere un test affidabile che riporta la ricostituzione differenziale di queste piscine SV al fine di capire 1) come il traffico SV dopo diverse modalità di endocitosi (come endocitosi clatrina-dipendenti e di attività-dipendente endocitosi bulk) e 2) i meccanismi controllare la mobilitazione sia del PRR e RP in risposta a stimoli diversi.
Coloranti FM sono sistematicamente impieganoed a segnalare quantitativamente fatturato SV nei terminali nervosi centrali 3-8. Hanno una coda idrofoba di idrocarburi che permette il partizionamento reversibile nel doppio strato lipidico, e un gruppo di testa idrofila che blocca il passaggio attraverso le membrane. I coloranti hanno poco a fluorescenza in soluzione acquosa, ma la loro resa quantica aumenta notevolmente quando partizionato in membrana 9. Così coloranti FM sono ideali sonde fluorescenti per il monitoraggio attivo riciclaggio SV. Il protocollo standard per l'utilizzo di FM tintura è il seguente. In primo luogo esse sono applicate ai neuroni e sono assorbite durante endocitosi (Figura 1). Dopo non interiorizzato colorante viene lavato via dalla membrana plasmatica, riciclati ridistribuire SV all'interno del pool di riciclaggio. Queste SV sono poi esauriti utilizzando stimoli scarico (Figura 1). Dal FM etichettatura tintura di SV è quantali 10, il calo di fluorescenza risultante è proporzionale alla quantità di vescicole rilasciato. Così, il riciclaggio e la fusione di SV generati dalla prtondo evious di endocitosi può essere attendibilmente quantificati.
Qui, presentiamo un protocollo che è stato modificato per ottenere due ulteriori elementi di informazione. In primo luogo, gli stimoli sequenziali di scarico vengono utilizzati per scaricare in modo differenziato il PRR e RP, per consentire la quantificazione del rifornimento di specifiche piscine SV. In secondo luogo, ogni terminale del nervo subisce il protocollo due volte. Quindi, la risposta del terminale stesso nervo a S1 può essere confrontata con la presenza di una sostanza in esame nella fase S2 (Figura 2), fornendo un controllo interno. Questo è importante, dal momento che l'entità del riciclaggio SV attraverso i terminali nervosi diversi è molto variabile 11.
Ogni aderente colture primarie neuronali possono essere utilizzati per questo protocollo, ma la densità di placcatura, le soluzioni e le condizioni di stimolazione sono ottimizzati per i neuroni granulari del cervelletto (CGN) 12,13.
Protocollo
1. Cerebellare granuli Preparazione Neuron
- Autoclave di circa 100 25 coprioggetto mm di diametro (Tabella 1).
- Coprioggetto posto in un tubo da 50 ml sterili contenenti sterile poli-D-lisina soluzione (Tabella 2). Posto su una piattaforma rotante per 2 ore per rivestire i coprioggetti.
- Secco coprioggetto rivestito su carta velina sterile in una cappa a flusso laminare (Tabella 1).
- Coprioggetto posto in sterili 6 pozzetti e Coprivetrini caldo in un 2 CO incubatore (Tabella 1). Può essere conservato per 1 mese a 4 ° C per prima dell'uso.
- Euthanize un 7 giorno di vita ratti Sprague Dawley cucciolo secondo le linee guida del comitato etico locale. Abbiamo cuccioli di eutanasia mediante dislocazione cervicale.
- Sezionare il cervelletto e mettetelo in una piastra di Petri sterile contenente un tampone fosfato soluzione di sali (soluzione B, tabella 3).
- Ripetere i passi 1.5 e 1.6 per 4-6 cuccioli di ratto.
- Cervelletti vengono poi immessi sul palco sterile di un tessuto McIlwain Chopper (Tabella 1). Tessuto viene tagliato a 375 micron intervalli prima di ruotare la fase di 90 ° e ripetere il processo.
- Il cervello dei pezzetti vengono trasferiti in una soluzione di tripsina (soluzione T, tabella 4) che erano stati precedentemente riscaldato a 37 ° C.
- Cervello dei incubare a 37 ° C per 20 minuti con agitazione ogni circa 5 minuti.
- Durante la digestione trittico, fiamma lucidare tre pipette di vetro sterile (Tabella 1) utilizzando una fiamma Bunsen. Utilizzare la fiamma per creare un foro fine, un foro di medie e di un foro largo alla imboccatura delle pipette.
- Dopo 20 min di incubazione a T soluzione, aggiungere 20 ml di tripsina / DNasi soluzione inibitore (soluzione W, Tabella 5) alla sospensione del cervelletto e le cellule pellet a 1.000 g per 1 minuto in una centrifuga da banco (Tabella 1).
- Decantare il surnatante e risospendere il pellet cellulare in 1,5 ml di un concentrato tripsina / DNasi inibitore (soluzione C, tabella 6) con la più ampia pipetta foro.
- Triturare le cellule utilizzando prima la pipetta ampio foro, poi il mezzo foro e, infine, il foro stretto fino a quando la sospensione cellulare è omogenea. Questo è un passo fondamentale, la sospensione deve essere omogenea in questa fase.
- Strato la sospensione cellulare in cima alla 10 ml di una preriscaldata (37 ° C), sieroalbumina bovina integrato Earles soluzione equilibrata Sali (Tabella 7) in un tubo sterile 15 ml.
- Centrifugare la sospensione per 5 min a 1.500 g e risospendere il pellet di cellule in 2 ml di preriscaldata (37 ° C), terreno di coltura (Tabella 8).
- Stimare il numero delle celle utilizzando un emocitometro (Tabella 1) e diluire la sospensione cellulare ad una densità finale di 3,3 x 10 6 cellule per ml.
- Le cellule sono placcati con l'aggiunta di 75 ml di sospensione cellulare al centro della poli-D-lisina rivestite coprioggetti (finale densità di 2,5 x 10 5).
- Le piastre di coltura contenente i coprioggetti vengono inseriti nella CO 2 incubatore per 60 minuti per consentire alle cellule ad undhere.
- Aggiungere 1,5 ml di terreno di coltura in ogni pozzetto facendo attenzione a non disturbare le cellule placcato e restituire i piatti della cultura alla CO 2 incubatore.
- Il giorno seguente sostituire il terreno di coltura con il terreno di coltura fresco integrato con il arabinoside inibitore mitotico citosina (Tabella 8). Arresti Questa proliferazione di cellule gliali in coltura.
2. Setup sperimentale
- Base sperimentale dovrebbe consistere dei seguenti elementi (vedi tabelle 1 e 9 per attrezzature specifiche e software utilizzati):
- Invertita epi-microscopio a fluorescenza
- Telecamera CCD raffreddato
- Fonte di luce fluorescente (monocromatore o ruota filtro)
- Gravity perfusione apparato
- Camera di imaging con elettrodi di platino paralleli
- Stimolatore elettrico
- Computer
- Acquisizione di immagini software
- Gli esperimenti devono essere eseguiti al buio o sotto cond luce rossaitions con un minimo di illuminazione fluorescente del campione per evitare di tingere FM sbiancamento.
- Esperimenti siano condotti a temperatura ambiente. Se la temperatura fisiologica è richiesto, a temperatura controllata sistema di perfusione possono essere utilizzati.
3. Preparazione del campione
- Culture deve essere usato dopo 8-12 giorni in vitro.
- Trasferire un coprioggetto singola soluzione salina (tabella 10) per 10 minuti a temperatura ambiente per permettere la stabilizzazione nel nuovo medium.
- Rimuovere il vetrino, asciugare la sua parte inferiore e la zona che circonda le cellule allegato con un piccolo pezzo di tovagliolo di carta o carta assorbente.
- Con grasso al silicone (Tabella 2), incollare il coprioggetto alla parte inferiore della camera di imaging. Le cellule dovrebbero essere tra i due fili paralleli. Grasso al silicone sufficiente dovrebbe essere utilizzato per sigillare completamente la stanza, ma senza alcun grasso entrare nel centro della camera da bagno.
- Delicatamente riempire la camera da bagno con ~ 260 microlitri salinea di soluzione e quindi riempire il tubo di ingresso con la stessa soluzione.
- Colla un coprioggetto pulito con grasso al silicone nella parte superiore della camera di sigillarla. Il tubo di ingresso e uscita può essere usato per rimuovere eventuali bolle d'aria intrappolate nella camera. E 'importante che il circuito elettrico non è interrotta da bolle d'aria.
- Immobilizzare la camera di imaging in una piattaforma in acciaio inox e controllare eventuali perdite con delicatezza perfusione soluzione salina attraverso il tubo di ingresso.
- Montare la camera montata sul palcoscenico di un microscopio invertito, e collegare la camera ad un sistema di perfusione gravità, dopo aver innescato l'ingresso con una soluzione salina.
- Collegare i fili di collegamento della camera allo stimolatore elettrico.
- Aggiungere una goccia di olio di immersione con l'obiettivo, se una lente olio viene utilizzato. Concentrarsi sulle cellule in mezzo la camera con illuminazione brillante campo.
4. S1 fase
- Neuroni profumato con 1,5 mldi FM colorante (Tabella 2) diluito in soluzione salina.
- Stimolare i neuroni per evocare l'assorbimento colorante utilizzando lo stimolatore allegato.
- Dopo la stimolazione, i neuroni profumato con fresco soluzione salina per 2 minuti per lavare via l'eccesso FM colorante (portata 7 ml / min). Contaminazione gliali nel sistema cultura CGN è inferiore al 5% 14, quindi questo lasso di tempo è sufficiente a rimuovere la tintura .
- Lasciare i neuroni a riposo per 8 min.
- Durante questo intervallo, individuare reti assonale in cui i singoli FM dye-caricato terminazioni nervose sono visibili usando lunghezze d'onda fluoresceina (eccitazione, 480 nm di emissione,> 550 nm). Evitare le zone con i cluster di cellule. Tenere illuminazione al minimo a questo punto, dato eccitazione intensa può causare fototossicità tintura. Segni evidenti di questo sono blebbing degli assoni e la mancanza di colorante scarico (a causa di tintura di fissaggio).
- Ri-messa a fuoco dell'immagine immediatamente prima acquisizione delle immagini in quanto una deriva leggera potrebbe essersi verificato durante il periodo di riposo.
- Iniziare time-lapse di acquisizione di immagini al ritmo di 1 fotogramma ogni 4 s.
- Dopo aver acquisito 5-10 immagini al basale, evocano esocitosi del PRR fornendo una stimolazione 30 Hz per 2 s (60 potenziali d'azione) 8 Iniziare la stimolazione manuale subito dopo la cattura del telaio..
- Dopo l'acquisizione di altre 10 immagini, evocano esocitosi SV del RP utilizzando tre stimoli di 40 Hz per 10 s (400 potenziali d'azione), a parte ogni 30 s 8.
- Acquisire un altro 5-10 immagini e poi l'acquisizione di immagini pausa.
5. Fase di recupero (vedi Figura 2)
- Permettono ai neuroni di recuperare nell'arco di almeno 20 min.
- Opzionale - Se l'effetto di un farmaco su endocitosi è da testare, i neuroni perfusione con una soluzione di farmaci in questo periodo (Figura 2b) 3,8.
6. Fase S2
- Ripetere il protocollo di fase S1 (sezione 4) per un esperimento di controllo utilizzando lo stesso campo di vistain S1.
- Opzionale - Se l'effetto di un farmaco su endocitosi è da provare, profumato neuroni con la soluzione di droga FM integrata con colorante (Figura 2b) 3,8.
- Opzionale - In alternativa, se gli effetti dei farmaci sul esocitosi sono di interesse, i neuroni profumato con la soluzione della droga sia prima che durante il PRR e RP stimoli scarico (Figura 2c) 3.
7. Analisi dei dati
- Usa ImageJ e Microsoft Excel o un software simile per l'analisi dei dati.
- Per l'analisi, una sequenza di immagini in formato pila è richiesto. Alcuni software di imaging può esportare sequenze di immagini singole. Se questo è il caso, convertire le immagini in uno stack con un ImageJ built-in funzione Immagine> Stack> Immagini di stack.
- Regolare la luminosità e il contrasto dello stack per massimizzare la gamma dinamica. Immagine> Regolazioni> Luminosità / Contrasto (Figura 3a).
- Se significativo deriva orizzontale si è verificato durante tlui esperimento, eseguire StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) e TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) plugin per ImageJ per allineare serie di immagini (Figura 3b) .
- Run Time Series Analyzer plugin ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (Figura 3c).
- Definire le aree di interesse (ROI) su almeno il 90 terminazioni nervose. Questi dovrebbero essere identici (ROI circolare con diametro di 1,5 micron) E 'utile per passare tra le immagini prima e dopo la tintura di scarico per rivelare terminazioni nervose attivo (in alternativa, un pre-stimolazione immagine può essere sottratto da un post-stimolazione immagine). Un ideale dimensioni ROI è uno che è leggermente più grande di una terminazione nervosa tipica (Figura 3c).
- Ottenere la totale / integrato intensità di fluorescenza di ogni ROI oltre time ed esportare in Microsoft Excel (Figura 3d e 4a).
- Normalise tracce ROI allo stesso valore arbitrario allineando le tracce nel piano l'asse Y per il primo stimolo scarico nelle fasi sia S1 che S2 (Figura 4b-c). Questo è il controllo per piccole variazioni di intensità di fluorescenza di fondo.
- Misurare la diminuzione assoluta della fluorescenza evocati da ogni stimolo scarico in unità arbitrarie di fluorescenza per S1 e S2 nel modo seguente (Figura 4d):
- RRP = Variazione fluorescenza (ΔF) attivate da 30 Hz 2 s
- RP = somma dei ΔF innescato da 3 x 40 Hz 10 s
- Il riciclo del pool totale = RRP + RP
- Per ogni parametro rilevante in 7,9, calcolare il valore medio su tutte le terminazioni nervose di un singolo esperimento.
- Per l'analisi statistica, i valori medi ottenuti da molteplici esperimenti indipendenti, possono essere calcolati come medie. Il numero di lamelle piuttosto che il numero di terminazioni nervose devono essere utilizzati come statistical n.
8. Rappresentante dei risultati:
Un esperimento di controllo dove CGN ha subito due turni di identiche fasi di carico e scarico è rappresentato nella Figura 5. Quando si inizia una serie di esperimenti, è essenziale che un esperimento di controllo come questo viene eseguito ogni giorno per confermare che S1 e S2 sono paragonabili prima di diverse condizioni sperimentali durante la S2.
In questo esempio, CGN sono stati caricati con 10 mM FM1-43 con un 80 10 Hz stimolazione s (figura 5a). Figura 5b mostra FM1-43-caricato terminazioni nervose fluorescenti rappresentato da puncta. ROI sono state definite oltre 90 terminali nervosi come mostrato in Figura 5c. Lo stesso insieme di ROI è stato utilizzato sia per S1 e S2. Durante entrambe le scarica, il PRR è stato scaricato con un Hz 30 (2 s) stimolazione seguita da RP scarico con 3 40Hz sequenziale (10 s) stimoli (figura 5a). La caduta di fluorescenza durante ogni stimolo può essere chiaramente osservato e quantificato (Figura 5d-e). Se esaminato, la fluorescenza gocce corrispondente al PRR, RP e il riciclo del pool totale sono stati paragonabili nei due S1 e S2. Inoltre, il 20% di riciclato SV risiedeva nel PRR mentre l'80% risiedeva nelle RP, sia S1 e S2.

Figura 1 Schema di un tipico esperimento FM. A) endocitosi SV viene attivato in presenza di FM colorante (rappresentato in verde). Il colorante è occupato da una membrana invaginating (SV singolo o alla rinfusa endosomi). B) Non interiorizzato colorante sulla membrana plasmatica viene lavato via dalla perfusione. C) Su richiesta di uno stimolo scarico, etichettati SV che si sono resi disponibili per fusibile rilascio con la membrana plasmatica con conseguente perdita di fluorescenza. D) La variazione di fluorescenza (ΔF) che è proporzionale alla quantità di rilascio etichettati SV possono essere quantificati.
_upload/3143/3143fig2.jpg "/>
Figura 2 Diagrammi di possibili protocolli sperimentali. A) Diagramma di flusso di un esperimento di controllo in cui le cellule subiscono due giri di FM tintura di carico e scarico (S1 e S2). Le celle possono essere caricati utilizzando una gamma di stimoli diversi. Fasi di scarico sono identici in quanto il PRR viene scaricato con 30 Hz per 2 s seguita da RP scarico utilizzando 3 volte 40 Hz per 10 s. RRP e prenotare piscina stimoli scarico sono separati da 40 secondi, tutti gli altri stimoli da 30 sec. Le cellule vengono lasciate a recuperare per 20 minuti tra S1 e S2. Diagrammi di flusso di eventuali modifiche di testare l'effetto di una sostanza su entrambi B) endocitosi o C) esocitosi sono mostrati. Farmaco di prova corrispondenti possono essere irrorate nella camera durante i periodi indicati.
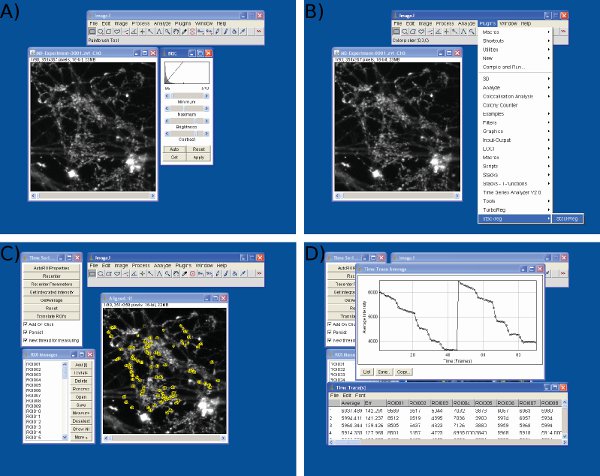
Figura 3 Screenshot di analisi dei dati in J immagini. Screenshot sono mostratiper A) regolazione di luminosità e contrasto, B) l'allineamento del telaio, C) selezione ROI e D) l'estrazione di intensità valori utilizzando immagini J.
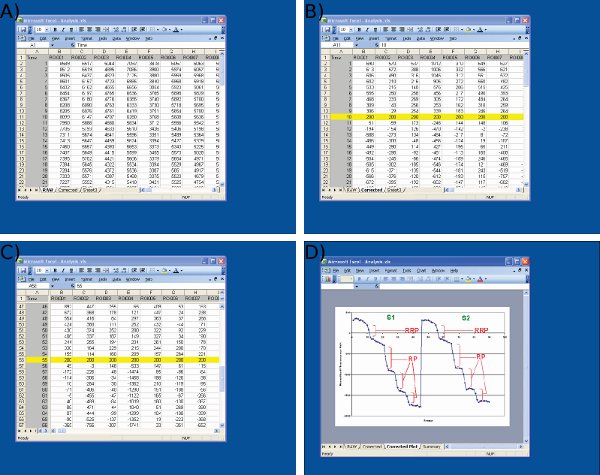
Figura 4 Screenshot di analisi dei dati in Microsoft Excel. Gli screenshot sono indicati per A) di importare i dati grezzi da immagine J (1 ° colonna = numero di frame, colonne = dati dai terminali nervosi individuali) B) adeguamento dei valori di base S1 (telaio 10) per un valore arbitrario (200) alla partenza del primo stimolo, C) adeguamento dei valori di base S2 a 55 fotogrammi utilizzando un protocollo identico a S1, e D) la misura di gocce di fluorescenza utilizzando Microsoft Excel. Si noti che la traccia media mostrato in D viene utilizzato per definire i punti prima e dopo ogni goccia. La dimensione delle gocce fluorescenza per ogni ROI deve essere determinato dai valori sul foglio mostrato in C.

Figura 5. Rappresentante di controllo esperimento. A) Diagramma di flusso di un esperimento di controllo in cui sono stati caricati CGN con 10μM FM1-43 con 80 Hz (10 s) la stimolazione. Le fasi di S1 e S2 sono identici. RRP e prenotare piscina stimoli scarico sono separati da 40 secondi, tutti gli altri stimoli da 30 sec. B) Un'immagine che mostra terminazioni nervose caricato con FM1-43. C) La stessa immagine che mostra come B 90 ROI numerati selezionati per l'analisi. D) Immagini di un territorio rappresentato da un riquadro rosso in B nei punti di tempo selezionato. = Basale, prima della stimolazione; 30 Hz = dopo stimolazione 30 Hz 2 s, 40 Hz = 1,2,3 dopo ogni stimolo 40 Hz. 10 s. Queste immagini sono presentate in pseudocolori per illustrare i cambiamenti in fluorescenza (barra dello spettro visualizzato a destra). E) Media ± SEM traccia ottenuto da 90 terminali nervosi rappresentato in C. stimoli individuali sono rappresentate da barre orizzontali. Barre di scala = 10 micron.
Discussione
Coloranti FM sono ampiamente utilizzati per studiare la funzione del nervo terminale in molte preparazioni neuronali. Sono stati impiegati principalmente per monitorare l'estensione di entrambi endocitosi SV, il fatturato SV o la cinetica di esocitosi 6. Il protocollo descritto estende questi studi per esaminare il differenziale scarico di specifiche piscine SV. Questo fornisce ulteriori informazioni riguardanti il rifornimento di piscine SV e anche il loro grado di mobilitazione.
Coloranti FM può essere utilizzato per etichettare vari cicli di riciclaggio all'interno della SV terminazioni nervose stesse. Abbiamo sfruttato questa proprietà e progettato protocolli in cui fatturato SV in ogni terminale può essere monitorato due volte nella stessa terminazioni nervose. Questo fornisce un accurato controllo interno, che è essenziale per la natura eterogenea del riciclaggio SV nei terminali nervosi paralleli 11. Attraverso l'uso della fase S1 come controllo interno, la ricarica del PRR, RP e il totalePiscina SV in presenza di farmaci può essere affidabile e confrontate direttamente.
Oltre a fornire informazioni la dimensione assoluta del riciclo, piscine RRP e RP in condizioni di stimolazione diversi, questo protocollo può anche fornire i dati per i seguenti - 1) Il partizionamento di SV tra il PRR e RP in funzione della piscina riciclaggio per S1 e S2, 2) la dimensione relativa delle piscine S2 (RRP e RP) in funzione del totale riciclo del pool di S1 e 3) la dimensione relativa di ogni piscina SV definite in S2 in funzione della piscina stessa in S1. Questo protocollo particolare, non forniscono informazioni sulla cinetica di scarico tuttavia, poiché il tempo di acquisizione è troppo lento (per misurazioni cinetiche tempi di acquisizione deve essere il più rapido possibile e scarico automaticamente sincronizzati per la cattura delle immagini).
I nostri 30 Hz 2 stimoli s evoca una misura identica di RRP scarico di saccarosio ipertonico 8. Dal momento che la dimensione del PRRè definita da saccarosio ipertonico scarico 15, possiamo affermare che questo protocollo scarica tutte SV RRP, in accordo con studi in neuroni dell'ippocampo 16. Il pool di riserva è quasi completamente esaurita da tre treni di 400 stimoli (40 Hz 10 s ciascuno) in quanto questa stimolazione scarica una quantità identica di colorante ad un paradigma (2 stimoli con mM KCl 50) che consuma il 95% di tutti i coloranti etichettati SVs 8,17. Quantificazione precisa delle dimensioni sia del PRR e prenotare piscina dipende anche dalla acquisizione di informazioni all'interno del range dinamico lineare della camera CCD.
Questo semplice protocollo può anche essere ulteriormente modificata. La forza di stimoli di carico può essere variato per determinare come l'attività neuronale e le modalità di endocitosi diverse influenzano la ricarica piscina SV. Inoltre, maggiore di due cicli di carico e scarico può anche essere eseguita, se necessario. Questo protocollo può essere utilizzata anche in cellule trasfettate sia con iperespressione oshRNA vettori. A causa della bassa efficienza di trasfezione di colture primarie di neuroni, proteine espresse devono essere contrassegnati con proteine fluorescenti. È essenziale che queste etichette fluorescenti non interferiscono con il segnale FM colorante (uso ciano o proteine rosso, per esempio). In questo caso, terminazioni nervose dalle cellule trasfettate e non transfettate nello stesso campo di vista può anche essere paragonato come un ulteriore controllo 8. In tali esperimenti un confronto tra la portata di carico tra i carichi S1 e S2 è di poco valore, dal momento che la perturbazione è presente durante entrambi i carichi. Partizionamento di colorante tra piscine SV può ancora essere visualizzati comunque 8.
Giornalisti genetica chiamata pHluorins può anche essere impiegato per monitorare SV esocitosi e endocitosi nella scuola primaria la cultura neuronale. Queste sonde utilizzano un pH-sensibile proteina fluorescente verde per l'ambiente pH luminale di domini di proteine tag SV come VAMP, sinaptofisina e VGLUT1 18 . Se utilizzato in combinazione con inibitori della vescicolare ATPasi, pHluorins possibile segnalare sia la cinetica e la portata della mobilitazione piscina SV 19. L'FM-dye approccio qui descritto ha alcuni vantaggi rispetto alla tecnica pHluorin, In primo luogo, coloranti FM fornire informazioni sulle modalità di endocitosi SV che riempie il PRR e piscine riserva 8. In secondo luogo specifico piscine SV possono essere etichettati con coloranti FM che hanno differenti proprietà spettrali 20 e infine vi è alcun obbligo per la trasfezione. Coloranti FM non può fornire informazioni sul traffico SV tra il riposo e il riciclaggio piscine SV tuttavia (a differenza di pHluorins 19), dal momento che, per definizione, SV devono essere caricati con colorante durante endocitosi per essere visibili. Così entrambi i coloranti FM e pHluorins hanno punti di forza e di debolezza e sono più potenti quando viene utilizzata in esperimenti indipendenti, per affrontare la stessa domanda.
Immagini di alta qualità sono essenziali per l'analisi valide e reproducibLe risultati. Mentre deriva orizzontale può essere facilmente corretto, esperimenti in cui vi è una deriva nella Z-asse non può essere recuperato. Per questo motivo, è importante ri-fuoco le immagini prima di iniziare la scarica S1 e S2. Nei casi in cui un decadimento significativo fluorescente si è verificato, correzioni decadimento può essere applicato (di solito sottraendo una traccia precedentemente registrato da FM-caricato le cellule in assenza di stimolazione). Tuttavia, si suggerisce che la correzione di decadimento viene eseguita solo per la rappresentazione grafica e di non essere utilizzato per qualsiasi analisi quantitativa.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da un finanziamento della Wellcome Trust (Rif.: 084277).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome | Azienda | Catalogo no. | |
|---|---|---|---|
| AxioCam MRM Rev. 3 Fotocamera Digitale | Carl Zeiss | 4265099901000 | |
| Axio Observer.A1 Microscopio | Carl Zeiss | 4310040000000 | |
| Piastre di coltura cellulare (6 pozzi) | Greiner bio-one | 657160 | |
| Centrifuga (Universal 32R) | Hettich Zentrifugen | 1610 | |
| CO 2 incubatore | Heraeus Instruments | 51014042 | |
| Provette Falcon (15/50 ml) | Greiner bio-one | 188271/210261 | |
| Fluar 20X / 0,75 ∞ / 0,17 Obiettivo | Carl Zeiss | 4401459901000 | |
| Vetro coprioggetti (Ø25mm) | VWR International | 631-1584 | |
| Pipetta Pasteur in vetro (230 nm) | Greiner bio-one | 612-1799 | |
| Emocitometro | VWR | 15170-170 | |
| Imaging Camera | Ammonitore | RC-21 BRFS | |
| Cappa a flusso laminare | Biohit | VLF BHS 1200 | |
| McIlwain Tissue Chopper | Mickle Laboratorio Engineering Co. Ltd. | MTC / 2 | |
| Lampada al mercurio | Carl Zeiss | HBO 103 | |
| MultiStim Impianto elettrico stimolatore (100 mV, 1 ms larghezza pluse) | Digitimer Ltd. | D330 | |
| Perfusione pompa | Watson-Marlow | 313S | |
| Pipette sierologiche (5/10/25 ml) | Greiner bio-one | 606180/607180/760180 | |
| Shutter Controller | Carl Zeiss | MAC5000 | |
| Siringa (20 ml) | BD Plastipak | ST01-B002 | |
| Filtri per siringa (Minisart - 0,20 micron) | Sartorius Stedim | 16532 | |
| VC-6 a sei canali per valvole | Ammonitore | 64-0135 | |
| YFP Filter set (Set 46) | Carl Zeiss | 1196-681 |
Tabella 1. Attrezzature specifiche e le apparecchiature utilizzate
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| FM1-43 | BioScience Cambridge | BT70021 | 10 micron |
| FM2-10 | BioScience Cambridge | BT70044 | 100 mM |
| Poly-D-lisina | Sigma | P7886 | 15 mcg / ml |
| Grasso al silicone | Sigma | 85403 | - |
Tabella 2. Reagenti specifici utilizzati
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| Sieroalbumina bovina (BSA) | Sigma | A4503 | 0,3% |
| D-glucosio | Sigma | G5767 | 0,25% |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| D-PBS | Gibco | 21300 | 960 mg/100 ml |
-Make 100ml fresca per ogni preparazione
-Filtro sterile prima dell'uso
Tabella 3. Soluzione B per la preparazione CGN
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| Soluzione B | - | - | 19 ml |
| Tripsina (5 mg / ml di brodo, -20 ° C) | Sigma | T9201 | 1 ml |
Tabella 4. T soluzione per la preparazione CGN
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| Soluzione C | - | - | 3,2 ml |
| Soluzione B | - | - | 16,8 ml |
Tabella 5. Soluzione W per CGN preparazione
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| Deossiribonucleasi (DNasi, 500 U per 0,5 ml di magazzino, -20 ° C) | Sigma | D5025 | 0,5 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| Soluzione B | - | - | 10 ml |
| Inibitore della tripsina di soia (SBTI, 0,5 mg per 0,5 ml di magazzino, -20 ° C) | Sigma | T9003 | 0,5 ml |
Tabella 6. Soluzione C per la preparazione CGN
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| Sieroalbumina bovina (BSA) | Sigma | A4503 | 4% |
| Salt Earle soluzione equilibrata (EBSS) | Gibco | 24010 | 10 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 3 mM |
Tabella 7. Soluzione EBSS per la preparazione CGN
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| Citosina β-D-arabinofuranoside (Ara-C) * | Sigma | C1768 | 10 micron |
| Siero fetale bovino | Gibco | 10106 | 10% |
| D-glucosio | Sigma | G5767 | 30 mM |
| L-Glutammina | Sigma | G3126 | 2 mM |
| KCl | Sigma | P5405 | 25 mM |
| Minimal Medium (MEM) | Gibco | 21090 | 500 ml |
| Penicillina (P) / Streptomicina (S) | Gibco | 15140 | 100 U / ml (P), 100 mg / ml (S) |
* Ara-C deve essere aggiunto alla media decorrere dal 1 ° DIV
Tabella 8. Terreni di coltura per la preparazione CGN
| Nome | Versione | Azienda |
|---|---|---|
| AxioVision Rel.. | 4,8 | Carl Zeiss |
| ImageJ | 1.42q | National Institutes of Health |
| Microsoft Excel | 2003 | Microsoft |
Tabella 9. Software specifici utilizzati
| Nome | Azienda | Catalogo no. | Concentrazione |
|---|---|---|---|
| CaCl 2 · 2H 2 O | Sigma | C7902 | 1,3 mm |
| Glucosio | Sigma | G5767 | 5 mM |
| KCl | Sigma | P5405 | 3,5 mm |
| KH 2 PO 4 | Sigma | P9791 | 0,4 mm |
| MgCl 2 · 6H 2 O | Sigma | M0250 | 1,2 mm |
| NaCl | Fluka | 71378 | 170 mm |
| NaHCO 3 | Fluka | 71627 | 5 mM |
| Na 2 SO 4 | BDH da Laboratorio | 10264 | 1,2 mm |
| TES | Sigma | T1375 | 20 mM |
Tabella 10. Soluzione salina (pH 7,4)
Riferimenti
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon