Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Fonte: Laboratório do Dr. Neil Branda — Universidade Simon Fraser
O desgaseamento refere-se ao processo pelo qual os gases dissolvidos são removidos de um líquido. A presença de gases dissolvidos, como oxigênio ou dióxido de carbono, pode impedir reações químicas que utilizam reagentes sensíveis, interferem com medições espectroscópicas ou podem induzir a formação indesejada de bolhas.
Uma série de técnicas diferentes estão disponíveis para desgasear líquidos; alguns deles incluem aquecimento, agitação ultrassônica, remoção química de gases, substituição por gás inerte por espumante e ciclo de degelo de bomba congelada. O ciclismo de descongelamento de bomba congelante é um método comum e eficaz para desgaseamento em pequena escala, e será demonstrado aqui com mais detalhes.
A desgassagem degelo da bomba congelante é realizada sob pressão reduzida usando um coletor duplo de gás de vácuo/inerte alto. O processo envolve inicialmente congelar o solvente usando nitrogênio líquido ou um chorume de gelo/isopropanol seco. Em seguida, é aplicado um vácuo e o espaço para a cabeça acima do solvente congelado é evacuado. O frasco é selado e, em seguida, o solvente é descongelado, permitindo a liberação de espécies gasosas dissolvidas. O processo de congelamento da bomba é normalmente repetido por pelo menos dois ciclos adicionais para diminuir a porcentagem de gases dissolvidos. 1,2
Este método aproveita a dependência de pressão da solubilidade do gás em um líquido. Em correspondência com a Lei de Henrique (Equação 1),a concentração de gás (Caq) dissolvida em um líquido é diretamente proporcional (k) à pressão parcial do gás(gásP ) na fase de vapor acima do líquido sob temperatura, volume e pressão constantes. 3
Caq =gás kP (Equação 1)
A redução da pressão do gás acima do líquido faz com que a solubilidade do gás dissolvido no líquido diminua. Portanto, para restabelecer o equilíbrio da fase líquido-gás, o gás dissolvido é liberado do líquido como uma bolha.
No procedimento a seguir, a técnica de ciclismo de congelamento-bomba-degelo será demonstrada com benzeno usando nitrogênio líquido e água morna da torneira como banhos externos de resfriamento e aquecimento, respectivamente. A configuração experimental necessária para executar esta técnica consiste em uma linha Schlenk de duplo coletor com fontes de vácuo e nitrogênio conectadas. A linha Schlenk é equipada com linhas de tubulação compatíveis com vácuo(Figura 1) para conexão com vidros apropriados, como um frasco schlenk. 1,2
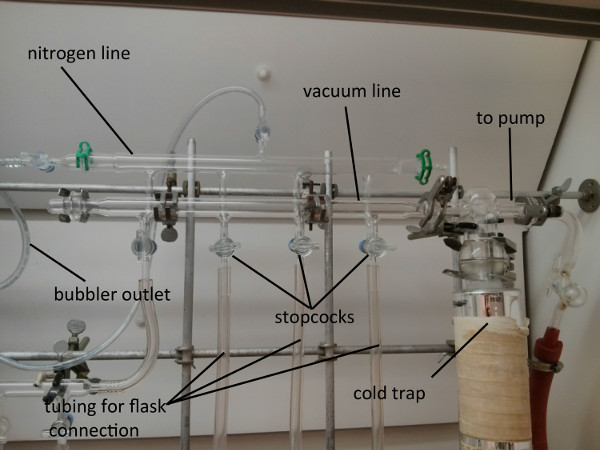
Figura 1. Foto da linha Schlenk equipada com fontes de vácuo e nitrogênio.
- Primeiro, coloque o solvente ou solução desejado em um frasco de Schlenk e feche a torneira(Figura 2a). Sele todas as outras aberturas no frasco de Schlenk. Atenção: não utilize mais de 50% do volume do frasco e inspecione o frasco para fraturas ou fraturas. Um frasco sobrecarregado ou quebrado pode quebrar durante o processo.
- Conecte o frasco a uma linha Schlenk e mantenha a válvula correspondente na linha Schlenk fechada. Congele o líquido completamente submergindo o frasco em um Dewar contendo nitrogênio líquido ou um chorume de gelo seco. (Figura 2b). Atenção: antes de congelar, lave o frasco de Schlenk com gás nitrogênio para garantir que o ambiente esteja completamente livre de oxigênio.
- Quando o solvente estiver congelado, abra a torneira do frasco de Schlenk e a válvula na linha Schlenk para aspirar(Figura 2c). Mantenha o frasco sob vácuo e dentro do banho de resfriamento por cerca de 10 minutos. Sele o frasco fechando a torneira(Figura 2d).
- Descongele o solvente até derreter usando um banho de água morna. Durante este procedimento, as bolhas de gás visivelmente evoluem do solvente (Figuras 2e, 2f). Deixe o solvente congelado descongelar lentamente e não perturbe o líquido.
- Uma vez descongelado o solvente, substitua o banho de água morna pelo banho de resfriamento e congele novamente o solvente.
- Repita os passos 3-5 até que você não veja mais a evolução do gás como a solução descongela(Figura 2g). Recomenda-se um mínimo de três ciclos para minimizar a porcentagem de gás dissolvido presente.
- Após a conclusão de três ciclos, o frasco de Schlenk deve ser selado sob nitrogênio antes do uso(Figura 2h). Abra a válvula de gás nitrogênio na linha Schlenk e abra a torneira do frasco para expor o solvente a uma atmosfera de nitrogênio. Uma vez que o frasco de Schlenk esteja cheio de nitrogênio, finalmente feche a válvula para o frasco.
- O solvente está agora desgaseado e pronto para uso.

Figura 2. Fotos detalhadas dos passos de degelo da bomba livre:(a) passo 1, coloque solvente em frasco; b Etapa 2, congelar o solvente em gelo seco (ou, alternativamente, com nitrogênio líquido); c Etapa 3, introduzir vácuo; d Passo 4, selar o frasco sob vácuo; (e), (f), passo 5, descongelar o solvente e observar a evolução das bolhas de gás; g Processo de degelo de congelamento repetido da etapa 7 (três ciclos recomendados); h Passo 8, selar o solvente sob nitrogênio.
A remoção de gases dissolvidos é importante tanto na academia quanto na indústria. Muitas vezes é necessário manter a qualidade de máquinas e instrumentos de laboratório, para proteger várias reações químicas e obter leituras precisas para cromatografia e espectrofotometria.
Reações que usam ou geram reagentes sensíveis ao ar, por exemplo, compostos organometálicos, tiols, fosfinos e aromáticos ricos em elétrons frequentemente requerem algum nível de desgaseamento para manter sua integridade durante todo o experimento. O rendimento ou mesmo o resultado de uma reação sensível ao ar pode ser alterado se as precauções apropriadas para remover gases dissolvidos não forem tomadas. O oxigênio dissolvido afeta estudos fotoquímicos saciando estados animados. Por exemplo, estados trigêmeos aromáticos podem ser saciados por pequenas quantidades de oxigênio presentes na solução, afetando a intensidade e distribuição espectral(Figura 3).
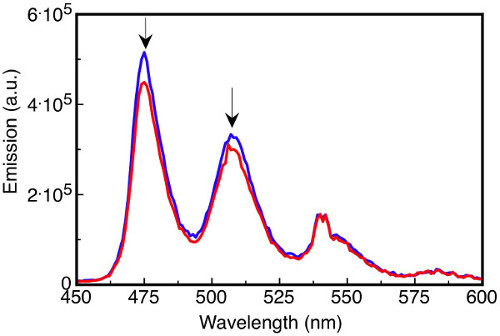
Figura 3. Espectros de emissão de fluorescência das soluções. Tetracene (16 μM) em benzeno desgaseado (linha azul) e benzeno saturado de oxigênio (linha vermelha) após excitação a 410 nm onde a intensidade de emissão em 475 nm é reduzida em 14% na solução saturada de oxigênio.
Na indústria, a água é um fluido comumente usado para troca de calor. A vida útil de tubos metálicos, sistemas de caldeiras e bombas depende da qualidade da água corrente. A água contém diferentes níveis de oxigênio e dióxido de carbono, pode causar danos a materiais metálicos. Oxigênio é um reagente oxidante, e o dióxido de carbono é corrosivo devido à sua conversão ao ácido carboxílico. A entrega de água desgaseada aos sistemas acima mencionados prolongará a vida útil dos equipamentos.
Além disso, os gases presentes nos solventes podem ter consequências negativas para instrumentos laboratoriais, como na cromatografia líquida de alto desempenho (HPLC) no que diz respeito ao desempenho e à produção. Muitos dos instrumentos possuem hélices metálicas ou bombas que distribuem solventes. Quando em contato com solvente que tem gás dissolvido, pode causar cavitação e corrosão levando a danos ou degradação de componentes metálicos. A estabilidade do detector também é influenciada pela presença de gases dissolvidos e a remoção insuficiente de oxigênio pode causar deriva na linha de base.
O ciclismo de descongelamento de bomba congelante é um método relativamente rápido e eficiente apropriado para desgaseamento de líquidos de pequena e média escala. Esse processo pode ajudar a superar algumas das questões discutidas acima associadas à presença de gases dissolvidos no solvente.
- Shriver, D. F., Drezdn, M. A. The Manipulation of Air Sensitive Compounds. 2nd ed. Wiley & Sons: New York, NY (1986).
- Girolami, G. S., Rauchfuss, T. B., Angelici, R. B. Synthesis and Technique in Inorganic Chemistry: A Laboratory Manual. 3rd ed. University Science Books: Sausalito, CA, (1999).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole: Belmont, CA. (2012).
Pular para...
Vídeos desta coleção:

Now Playing
Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Organic Chemistry
55.9K Visualizações

Introdução à Catálise
Organic Chemistry
34.1K Visualizações

Montagem de um sistema de refluxo para reações químicas aquecidas
Organic Chemistry
166.3K Visualizações

Condução de reações abaixo da temperatura ambiente
Organic Chemistry
70.3K Visualizações

Transferência de Solventes usando Linhas Schlenk
Organic Chemistry
41.5K Visualizações

Preparação de Reagentes e Equipamentos Anidros
Organic Chemistry
79.1K Visualizações

Purificação de Compostos por Recristalização
Organic Chemistry
705.3K Visualizações

Separação de Misturas por Precipitação
Organic Chemistry
157.2K Visualizações

Extração sólido-líquido
Organic Chemistry
237.1K Visualizações

Evaporação rotativa para remover solvente
Organic Chemistry
212.3K Visualizações

Destilação Fracionária
Organic Chemistry
332.8K Visualizações

Crescimento de Cristais para Análise de Difração de Raios-X
Organic Chemistry
32.3K Visualizações

Realização de Cromatografia de Camada Fina 1D
Organic Chemistry
288.4K Visualizações

Cromatografia em coluna
Organic Chemistry
358.4K Visualizações

Espectroscopia de ressonância magnética nuclear (NMR)
Organic Chemistry
246.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados