Espectroscopia de ressonância magnética nuclear (NMR)
Visão Geral
Fonte: Laboratório do Dr. Henrik Sundén – Universidade de Tecnologia Chalmers
A espectroscopia de ressonância magnética nuclear (NMR) é uma técnica de análise vital para químicos orgânicos. Com a ajuda da RMN, o trabalho no laboratório orgânico foi facilitado tremendamente. Não só pode fornecer informações sobre a estrutura de uma molécula, mas também determinar o conteúdo e a pureza de uma amostra. Em comparação com outras técnicas comumente encontradas para químicos orgânicos — como análise térmica e espectrometria de massa (MS) — a NMR é um método não destrutivo que é valioso quando a recuperação da amostra é importante.
Uma das técnicas de RMN mais utilizadas para um químico orgânico é o próton (1H) NMR. Os prótons presentes em uma molécula se comportarão de forma diferente dependendo de seu ambiente químico circundante, possibilitando elucidar sua estrutura. Além disso, é possível monitorar a conclusão de uma reação comparando os espectros de RMR do material inicial com o do produto final.
Este vídeo exemplifica como a espectroscopia de NMR pode ser usada no trabalho cotidiano de um químico orgânico. O seguinte será mostrado: i) preparação de uma amostra de RMN. ii) Utilização de 1H NMR para monitorar uma reação. iii) Identificação do produto obtido a partir de uma reação com 1H NMR. A reação que será mostrada é a síntese de um E-chalcone (3) de um aldeído (1) e uma cetona (2)(Esquema 1). 1
Esquema 1. Síntese de (2E)-3-(4-metoxifenil)-1-(4-metilfenil)-2-propen-1-one.
Princípios
Núcleos com massa ímpar ou número atômico terão uma propriedade chamada spin, possibilitando o uso de RMN para detectar elementos como hidrogênio(1H), carbono(13C) e fósforo(31P). As voltas são aleatórias e giram em direções aleatórias; no entanto, aplicando um campo magnético externo, esses núcleos se alinharão com ou contra o campo magnético aplicado. Esses dois estados têm diferentes níveis de energia: um estado de baixa energia e um estado de alta energia. Irradiação com radiação eletromagnética fará com que o estado de baixa energia vire para o estado de alta energia. Quando a radiação é cessada, os núcleos sofrerão relaxamento e uma decadência indutiva livre (FID) é obtida. O FID é Fourier transformado para dar os picos do espectro NMR. Diferentes elementos terão frequências diferentes levando a diferentes mudanças químicas(Tabela 1). O espectro NMR pode fornecer diferentes tipos de informações sobre um composto; a integral de um pico fornece o número de prótons representados por ele, a constante de acoplamento (J-acoplamento) dá a correlação dos prótons, e o padrão de divisão de um pico diz quantos outros núcleos ativos de RN estão por perto (muitas vezes chamados de "vizinhos").
Uma vez que 1H NMR mede 1H núcleos é importante usar solventes deuterados; caso contrário, o sinal de interesse será perdido no ruído do sinal de solvente.
| Tipo de próton | Shift (δ, ppm) | Tipo de carbono | Shift (δ, ppm) |
| 1° Alkyl, RCH3 | 0.8–1.2 | 1° Alkyl, RCH3 | 0–40 |
| 2° Alkyl, R2CH2R | 1.2–1.5 | 2° Alkyl, R2CH2R | 10–50 |
| 3° Alkyl, RCHR2 | 1.4–1.8 | 3° Alkyl, RCHR2 | 15–50 |
| Aliado, R2C=CRCH3 | 1.6–1.9 | Alkene, C=C | 100–170 |
| Cetona, RC(=O)CH3 | 2.1–2.6 | Aryl, C em anel aromático | 100–170 |
| Éter, ROCH2R | 3.3–3.9 | Álcool ou éter, R3COR | 50–90 |
| Álcool, HOCH2R | 3.3–4.0 | Ácido carboxílico ou éster, RC(=O)OR |
160–185 |
| Vinilic, R2C=CH2 | 4.6–5.0 | Aldeído ou cetona, RC(=O)R |
182–215 |
| Vinilic, R2C=CRH | 5.2–5.7 | ||
| Aromático, ArH | 6.0–8.5 | ||
| Aldeído RC(=O)H | 9.5–10.5 | ||
| Hidroxílado alcoólica, ROH | 0.5–6.0 | ||
| Carboxílico, RC(=O)OH | 10–13 |
Mesa 1. Mudanças químicas comuns de prótons e NMR de carbono. 2
Procedimento
1. Preparação do material de partida nmr
- Adicione ~10 mg de material inicial a um tubo NMR limpo.
- Dissolva o material de partida em solvente deuterado de ~0,7 mL (exemplo dado CDCl3). Uma altura adequada do solvente para um bom espectro é de 4,5-5 cm.
- Cape o tubo NMR cuidadosamente e escreva o nome da amostra na tampa.
- Agite a amostra suavemente para garantir que todo o material tenha dissolvido. Tome cuidado para evitar o contato entre o solvente e a tampa, o que pode levar a uma possível contaminação da amostra.
- Insira o tubo NMR cuidadosamente em um spinner. O rotador irá girar uma vez inserido no ímã para garantir que toda a amostra experimente um campo magnético homogêneo. Limpe a parte externa do tubo NMR e o rotador com tecidos de 2 propanol e laboratório, a fim de remover impressões digitais e sujeira.
- Coloque o rotador em um medidor de profundidade de amostra para garantir que a parte inferior do tubo NMR não seja inserida muito longe na sonda NMR, pois isso poderia possivelmente danificar o espectrômetro. Diferentes sondas têm diferentes profundidades de amostra e o usuário deve estar ciente do medidor de profundidade específico.
- Coloque a amostra no espectrômetro NMR. Aqui foi utilizado um espectrômetro Varian de 400 MHz, equipado com um autosampler.
- Após a conclusão da medição do NMR, processe o espectro e atribua os picos no espectro.
2. Preparação de 3 M NaOH e Chalcone Synthesis
- Adicione 60 mg NaOH a um frasco volumoso de 50 mL.
- Dissolva o NaOH adicionando água deionizada à metade do frasco. Diluir ainda mais a solução adicionando mais água até que a marca seja atingida.
- Adicione 10 mL de etanol a um frasco de fundo redondo de 50 mL equipado com uma barra de agitação magnética.
- Depois disso, adicione 680,5 mg 4-metoxibenzaldeído e 5 mL naoh solução preparada na etapa 2.1 para o mesmo frasco.
- Adicione 671 mg 4-metilacetofenona posteriormente à solução agitada e tampa o frasco e mexa à temperatura ambiente.
- Monitore o progresso da reação por 1H NMR em intervalos de 30 minutos (ver passo 3) até o consumo total de materiais iniciais.
- Adicione 5 mL de água quando a reação chegar à conclusão (~3 h). Filtre o precipitado resultante e lave-o com 20 mL 1:2 etanol/água. Deixe o ar precipitado secar.
- Calcule o rendimento do produto obtido. Prepare uma amostra de RMN de acordo com a etapa 1.2.2.7. Verifique a pureza com 1H NMR. Se não for puro, purifique o produto via recrimistificação com etanol.
- Adicione aproximadamente 3 gotas de mistura de reação a um tubo NMR usando uma pipeta Pasteur e enxágue a pipeta com solvente deuterado.
- Repetir as etapas 1.2-1.8.
3. Breve Interpretação de um Espectro NMR
- Processe o espectro com um programa adequado (exemplo dado MestReNova).
- Correlacionar os diferentes picos aos turnos da RMN na Tabela 1. As mudanças químicas dão uma dica de que tipo de ambiente os prótons existem.
- Integre os picos para dar o número de hidrogênios correspondentes a cada pico. A integração de todos os picos dá um número relativo de prótons totais.
- Avalie a divisão dos picos de prótons, que indicam o número de vizinhos.
- Meça o acoplamento J para ver como os prótons estão conectados entre si.
Resultados
Comparando-se os espectros dos materiais iniciais (Figuras 1 e 2) com o do produto final (Figura 5) pode-se observar uma clara diferença entre os espectros, indicando a formação do chalcone. O ponto final da reação pode ser determinado mediante a coleta de amostras de RMM em diferentes intervalos de tempo; por exemplo, o pico de próton de aldeído (C(=O)H) (1) pode ser visto na Figura 3, mas não na Figura 4, significando a conclusão da reação após 3h. Olhando para as integrais, padrões de divisão e acoplamentos J dos picos, é possível validar a estrutura do chalcone. As integrais dos picos (números abaixo do pico, Figura 5) mostram a quantidade relativa de hidrogênios presentes que devem se correlacionar com a quantidade de hidrogênios encontrada no produto. Além disso, o padrão de divisão dá uma indicação do número de vizinhos; por exemplo, o pico (5) e (1) — ambos singlets — não indicam vizinhos próximos com integrais de 3 correlações com o MeO e o grupo Me, respectivamente. Comparando as mudanças químicas no espectro com a Tabela 1 é possível elucidar que o grupo MeO corresponde ao singlet a 3,80 ppm e ao grupo Me a 2,45 ppm. Além disso, a formação do vínculo duplo pode ser vista como dois doublets(Figura 5),7,80 e 7,44 ppm. Olhar para o acoplamento J de 16 Hz indica a formação de um E-alkene; o Z-alkene normalmente tem um valor menor de 10-12 Hz.3 Atribuindo os picos aromáticos verifica a estrutura (Figura 5). 4
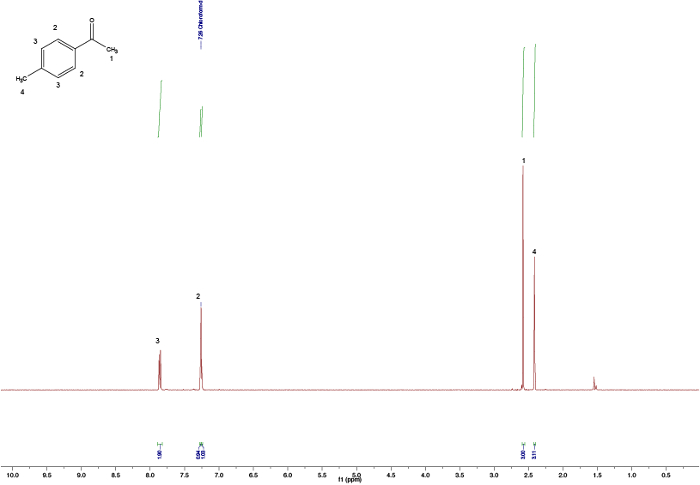
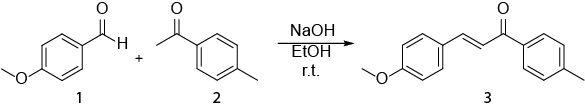
Figura 1. Especificação NMR atribuída 1H de 4-metilacetofenona Clique aqui para ver uma versão maior desta figura.
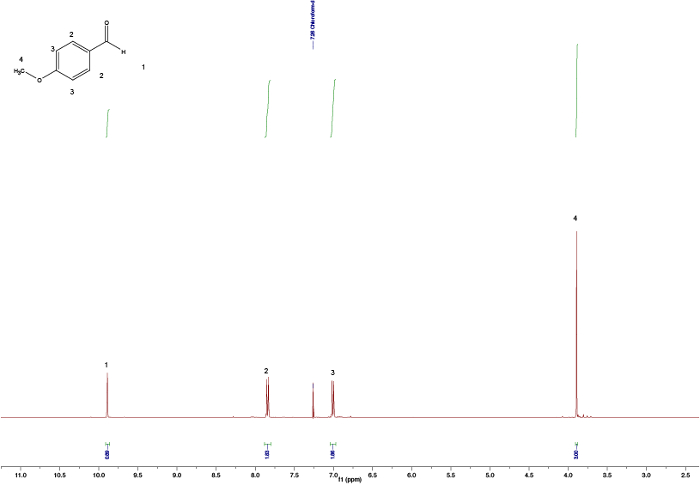
Figura 2. Especificação NMR atribuída 1H de 4-metoxibenzaldeído. Clique aqui para ver uma versão maior desta figura.
Figura 3. Espectros brutos de 1HNMR após 30 min mostrando o pico de aldeído residual. Por favor, clique aqui para ver uma versão maior desta figura.
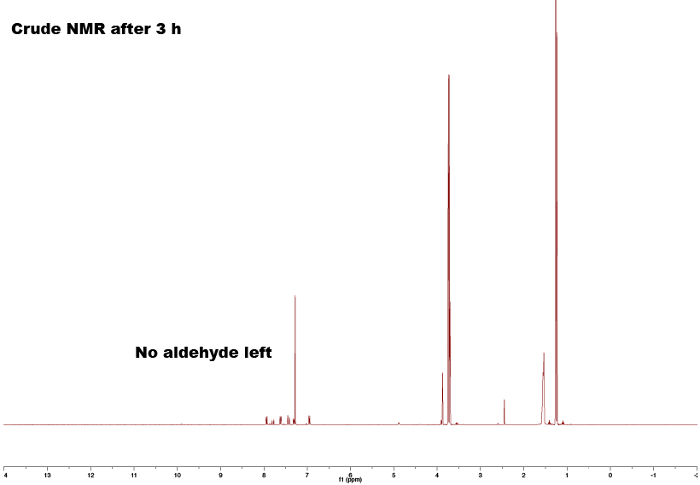
Figura 4. Espectro de NMR bruto de 1H após 3h não mostrando nenhum pico residual de aldeído. Por favor, clique aqui para ver uma versão maior desta figura.
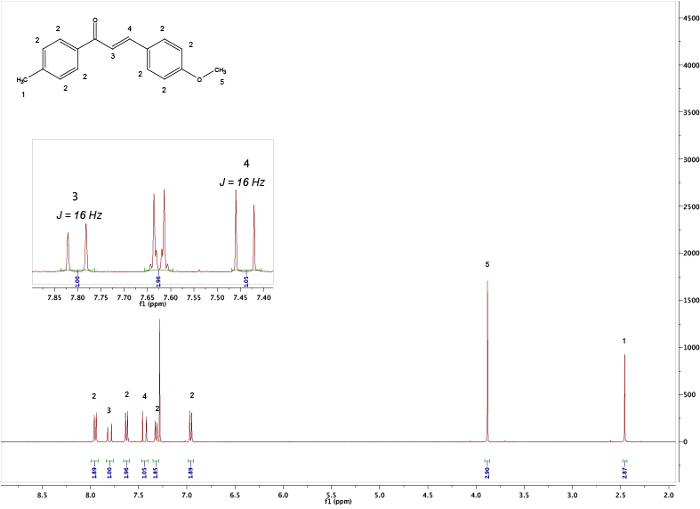
Figura 5. 1H NMR espectros do produto obtido após o trabalho. A imagem inserida mostra os acoplamentos J do alkene. Clique aqui para ver uma versão maior desta figura.
Aplicação e Resumo
A RN pode, por exemplo, ser usada para detectar intermediários de reação, facilitando o trabalho de elucidação de um mecanismo de reação. Com a ajuda da RMN também é possível observar movimentos moleculares e interações importantes para o desenvolvimento de medicamentos. Além disso, a RMN pode dar informações estruturais sobre materiais sólidos; por exemplo, para fornecer uma lógica para propriedades materiais observadas. Outras aplicações de RMN podem ser encontradas no campo da medicina, onde a ressonância magnética (RM) é frequentemente utilizada para diagnóstico médico. A RN também tem sido usada em metabolômica para detectar diferentes metabólitos excretados por um organismo, fornecendo assim uma impressão digital metabólica. Os usos de RMN são amplos; desde determinar a estrutura de uma única molécula até a imagem do cérebro humano.
Referências
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H., Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20 (43), 13889-13893 (2014).
- Table adapted from Graham Solomons, T. W. Fryhle, C. B., Organic Chemistry, 10th edition, Wiley, p. 387, 418 (2011).
- Clayden, J., Greeves, N., Warren, S., Wothers, P. Proton nuclear magnetic resonance. Organic Chemistry, Chapter 11, Oxford University Press, 269 (2001).
- Wu, X.-F., Neumann, H., Spannenberg, A., Schulz, T., Jiao, H., Beller, M.,Development of a General Palladium-Catalyzed Carbonylative Heck Reaction of Aryl Halides. J. Am. Chem. Soc. 132 (41), 14596-14602 (2010).
Tags
Pular para...
Vídeos desta coleção:

Now Playing
Espectroscopia de ressonância magnética nuclear (NMR)
Organic Chemistry
246.7K Visualizações

Introdução à Catálise
Organic Chemistry
34.1K Visualizações

Montagem de um sistema de refluxo para reações químicas aquecidas
Organic Chemistry
166.3K Visualizações

Condução de reações abaixo da temperatura ambiente
Organic Chemistry
70.3K Visualizações

Transferência de Solventes usando Linhas Schlenk
Organic Chemistry
41.5K Visualizações

Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Organic Chemistry
55.9K Visualizações

Preparação de Reagentes e Equipamentos Anidros
Organic Chemistry
79.1K Visualizações

Purificação de Compostos por Recristalização
Organic Chemistry
705.3K Visualizações

Separação de Misturas por Precipitação
Organic Chemistry
157.2K Visualizações

Extração sólido-líquido
Organic Chemistry
237.1K Visualizações

Evaporação rotativa para remover solvente
Organic Chemistry
212.3K Visualizações

Destilação Fracionária
Organic Chemistry
332.8K Visualizações

Crescimento de Cristais para Análise de Difração de Raios-X
Organic Chemistry
32.3K Visualizações

Realização de Cromatografia de Camada Fina 1D
Organic Chemistry
288.4K Visualizações

Cromatografia em coluna
Organic Chemistry
358.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados