Condução de reações abaixo da temperatura ambiente
Visão Geral
Fonte: Laboratório da Dra.
Demonstração por: Matt Smith
Quando novas ligações são formadas no curso de uma reação química, requer que as espécies envolvidas (átomos ou moléculas) se aproximem muito e colidam entre si. As colisões entre essas espécies são mais frequentes e eficazes quanto maior a velocidade com que essas moléculas estão se movendo. Uma regra de ouro amplamente utilizada, que tem suas raízes na equação de Arrhenius1,afirma que elevar a temperatura em 10 K aproximadamente dobrará a taxa de reação, e elevar a temperatura em 20 K quadruplicará a taxa:
(1) 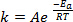
Equação (1) é frequentemente encontrada em sua forma logarítmica:
(2) 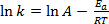
onde k é a taxa da reação química, A é o fator de frequência (relacionado à frequência de colisões moleculares), Ea é a energia de ativação necessária para a reação, R é a constante de gás ideal, e T é a temperatura em que a reação está ocorrendo.
Uma temperatura mais alta, portanto, significa que uma reação é concluída muito mais rápido. No entanto, em alguns casos é desejável realizar reações a baixas temperaturas, apesar do efeito de redução na taxa de reação. Alguns cenários a esse respeito são elaborados mais abaixo.
Quando é útil executar uma reação abaixo da temperatura ambiente, os químicos usam banhos de resfriamento para manter uma certa temperatura ou faixa de temperatura. As reações são resfriadas até a temperatura desejada, colocando o frasco de reação dentro de um banho de resfriamento apropriado. Os reagentes na reação nunca entram em contato direto com os produtos químicos no banho de resfriamento. O banho de resfriamento pode consistir em um único componente criogênico (resfriamento) (como gelo, gelo seco ou nitrogênio líquido) ou pode ser uma mistura do componente criogênico com um certo solvente e/ou um sal aditivo. O objetivo do solvente é transferir efetivamente a temperatura do agente de resfriamento para o frasco de reação, e o objetivo do aditivo é diminuir (ou deprimir) o ponto de congelamento da mistura. (Note que é possível que uma substância seja tanto um solvente quanto um aditivo.)
Princípios
Lembre-se que quando uma solução congela a uma temperatura mais baixa do que o líquido puro, isso é causado por uma propriedade colligativa conhecida como depressão de ponto de congelamento. O efeito de redução no ponto de congelamento é proporcional à quantidade de soluto (aditivo) que é adicionada a um solvente líquido. Este efeito, é descrito por equação (3):
(3) ΔDTf = Tf (solvente) − Tf (solução) = Kf × m
ΔDTf é o ponto de congelamento da depressão e é descrito pela diferença na temperatura de congelamento do solvente por si só, e a da solução com aditivo/soluto.
Kf é o ponto de congelamento constante da depressão para o sistema, e m é a molalidade da solução. Os químicos usam esse efeito a seu favor para criar uma diversidade de diferentes temperaturas com relativa facilidade e custo-benefício.
As temperaturas alcançadas pelos banhos de resfriamento podem flutuar. O banho deve ser monitorado e os ajustes feitos conforme necessário. Para obter melhores resultados, o vaso de banho em si deve ser bem isolado. Quando disponível, um frasco de Dewar deve ser usado para o banho de resfriamento. Na ausência de um frasco de Dewar, é possível configurar o banho em um vaso de vidro ou borracha, com o vaso isolado da melhor forma possível (usando, por exemplo, papel alumínio ou toalha). O vaso usado precisa ser termoestabilidade na temperatura desejada e não deve quebrar.
Existem muitas variações diferentes de banho para a realização relativamente econômica e simples de diferentes temperaturas abaixo da temperatura ambiente em um ambiente de laboratório químico.
- Para temperaturas ligeiramente abaixo de zero (mas se necessário até - 55 °C) um banho de água gelada com diferentes adição de sais servirá.
- Para temperaturas de até -78 °C, são empregados banhos de gelo seco em diferentes solventes.
- Temperaturas abaixo de -78 °C até -196 °C podem ser obtidas pelo uso de nitrogênio líquido.
A configuração desses banhos de resfriamento é relativamente simples e os procedimentos são incluídos no final deste documento.
Banhos de água gelada
Esse tipo de banho é muito fácil de configurar e disponível em todos os laboratórios de ensino de graduação. Há muita flexibilidade no tipo de recipiente de banho para usar, pois os banhos de gelo não atingem temperaturas muito baixas e não há risco de quebrar um vaso.
Embora a água gelada em si tenha uma temperatura de 0 °C, uma depressão de ponto de fusão pode ser alcançada pela adição de certos sais como NaCl, MgCl2 ou CaCl2. As temperaturas finais alcançadas variam e podem ser ajustadas pela quantidade de aditivo utilizado por 100 g de gelo. Um banho de gelo comum é aquele com NaCl como aditivo onde 33 g de NaCl são adicionados por 100 g de gelo. A temperatura final alcançada por este meio é de cerca de -20 °C. A temperatura mais fria que um banho de água gelada pode atingir é de cerca de -55 °C, que é obtida pela adição de 143 g de Hexahidrato caCl2 por 100 g de gelo.
Banhos de gelo seco
O gelo seco é dióxido de carbono sólido e sublime a uma temperatura de -78 °C. É um agente criogênico bastante barato e prontamente disponível em muitos laboratórios. Para uma transferência de calor eficiente desta temperatura para um vaso de reação, é necessário um solvente que tenha um ponto de fusão abaixo de -78 °C. Solventes com um ponto de fusão mais alto, ou mp, (melhor referido como ponto de congelamento neste caso) também podem ser usados e resultar em uma temperatura de banho mais alta.
Um solvente que é frequentemente usado em um banho de gelo seco é acetona (mp = -95 °C), que é prontamente disponível e barato. Um banho de gelo seco em acetona mantém uma temperatura de -78 °C por um período de tempo, o comprimento do qual depende do grau de isolamento. Este é o sistema mais comum de banho de gelo seco.
Para banhos de gelo secos de temperatura mais alta, são utilizados solventes com pontos de congelamento mais altos. A temperatura do banho adquirida nem sempre é igual ao ponto de congelamento do solvente. Consulte a Tabela 2 para obter temperaturas obtidas por diferentes sistemas.
Devido às baixas temperaturas alcançadas por este tipo de banho, luvas de proteção criogênica devem ser sempre usadas ao manusear gelo seco.
O recipiente de banho para um banho de gelo seco é idealmente um Dewar. Se um dewar não estiver disponível, um vaso de vidro, borracha ou aço inoxidável é usado, mas esteja ciente de que o isolamento não será muito ideal e o banho precisará ser ajustado com mais frequência.
| Temperaturas do banho de resfriamento de gelo seco | |
| Mistura | T (°C) |
| p-xileno/gelo seco | +13 |
| Ciclohexano/Gelo seco | +6 |
| Benzeno/Gelo seco | +5 |
| Etileno glicol/Gelo seco | -15 |
| Tetraclorito de carbono/Gelo seco | -23 |
| 3-Heptanona/Gelo seco | -38 |
| Acetonita/Gelo seco | -42 |
| Cylcohexanone/Gelo seco | -46 |
| Carbitol dietil/gelo seco | -52 |
| Clorofórmio/Gelo seco | -61 |
| Acetato carbitol/gelo seco | -67 |
| Etanol/Gelo seco | -72 |
| Acetona/Gelo seco | -78 |
| Isopropanol/Gelo seco | -78 |
Mesa 2. Lista de diferentes misturas de banho de gelo seco.
Banhos de nitrogênio líquido
Banhos de lama de nitrogênio líquido são usados quando temperaturas muito baixas, abaixo da de um banho de gelo seco, são desejadas. Nitrogênio líquido é um agente criogênico com um ponto de fusão de -196 °C, que é a temperatura do banho quando nenhum solvente adicional é usado. Note que, em contraste com o gelo seco, n2 é um líquido e o uso de um solvente aditivo para transferência de calor uniforme não é necessário. Se uma temperatura mais alta do que -196 °C for desejada, então uma variedade de diferentes solventes orgânicos é usada para misturas que resultarão em temperaturas diferentes, semelhante como foi o caso com banhos de gelo seco. Consulte a Tabela 3 para obter temperaturas obtidas por diferentes sistemas.
Devido às baixas temperaturas dos banhos líquidos N2, apenas um Dewar deve ser usado como recipiente de banho e sempre trabalhar com luvas ao manusear este agente criogênico.

Tabela 3. Lista de banhos de nitrogênio líquido com diferentes solventes. 2
Procedimento
Configuração do banho de resfriamento
Para uma configuração geral, prepare o banho de resfriamento de escolha conforme descrito abaixo e mergulhe o frasco de reação no banho(Figura 1). Não encha o recipiente de banho todo o caminho, mas deixe espaço suficiente para permitir a imersão do frasco de reação.
Nota: se a reação for sensível à umidade, tenha muito cuidado ao adicionar reagentes ao frasco ou a qualquer outra parte do aparelho (por exemplo, um funil caindo). Se uma abertura é gerada enquanto o vidro está imerso no banho de resfriamento, então o ar da temperatura ambiente flui rapidamente para dentro e carrega umidade dentro.
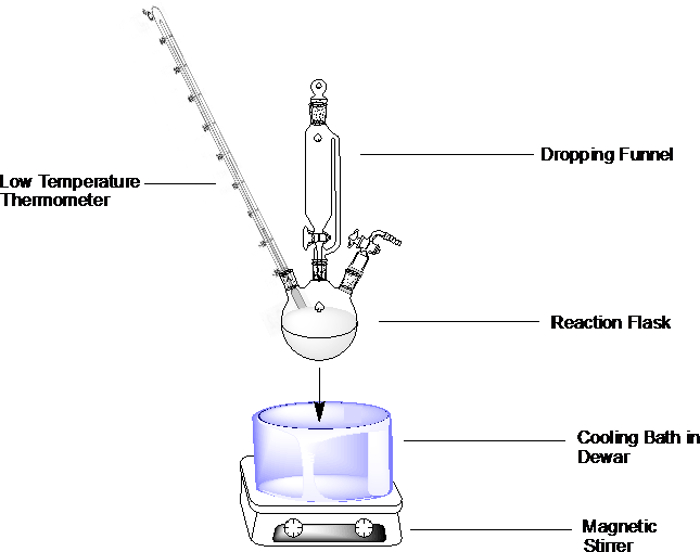
Figura 1. Exemplo para uma configuração de banho de resfriamento em um frasco de três pescoços de fundo redondo com funil caindo, termômetro sob atmosfera inerte.
1. Fazendo um banho de água gelada
- Para um banho de água gelada com um aditivo, pese e adicione a quantidade adequada de gelo ao recipiente de banho de escolha. Um Dewar é útil, mas não é necessário. O vaso pode ser plástico, borracha (por exemplo, um balde) ou vidro (por exemplo, um prato de cristalização grande). Para este experimento, adicione 500 g de gelo a uma nave 1 L.
- Pese a quantidade adequada de aditivo consultando um banho de gelo(Tabela 1),e adicione o aditivo ao gelo. Para este experimento, pese e adicione 165 g (=5x 33 g) de NaCl ao recipiente de banho.
- Adicione uma pequena quantidade de água deionizada ao recipiente de banho e mexa bem usando uma haste de mexida. Adicione água suficiente até que todo o gelo esteja coberto.
- Verifique com um termômetro para garantir que a temperatura desejada tenha sido atingida. Ajuste a quantidade de aditivo, se necessário. O banho não manterá sua temperatura por muito tempo e ajustes precisam ser feitos em intervalos frequentes de cerca de 20 a 30 minutos. Para isso pode ser necessário pipetar um pouco da água no banho e adicionar mais gelo e aditivo.
| Substância | g/100 g H2O | Temperatura final (°C) |
| Na2CO3 | 20 | -2.0 |
| NH4NO3 | 106 | -4.0 |
| NaC2H3O2 | 85 | -4.7 |
| NH4Cl | 30 | -5.1 |
| NaNO3 | 75 | -5.3 |
| Na2S2O3 ● 5H2O | 110 | -8.0 |
| CaCl2● 6H2O | 41 | -9.0 |
| Kcl | 30 | -10.9 |
| KI | 140 | -11.7 |
| NH4NO3 | 60 | -13.6 |
| NH4Cl | 25 | -15.4 |
| NH4NO3 | 45 | -16.8 |
| NH4SCN | 133 | -18.0 |
| NaCl | 33 | -21.3 |
| CaCl2 ● 6H2O | 81 | -21.5 |
| H2SO4 (66,2%) | 23 | -25 |
| NaBr | 66 | -28 |
| H2SO4 (66,2%) | 40 | -30 |
| C2H5OH (4° ) | 105 | -30 |
| MgCl2 | 85 | -34 |
| H2SO4 (66,2%) | 91 | -37 |
| CaCl2 ● 6H2O | 123 | -40.3 |
| CaCl2 ● 6H2O | 143 | -55 |
Mesa 1. Misturas de resfriamento de sal/gelo que são obtidas misturando os sais com água ou gelo nas temperaturas especificadas e nas quantidades especificadas. 1
2. Fazendo um banho de gelo seco
- Coloque luvas de proteção criogênicas e óculos de segurança. Sempre pratique isso ao manusear gelo seco e nunca tocá-lo com as mãos nuas, pois pode queimar rapidamente a pele e causar queimaduras de gelo.
- Para um recipiente de banho com um volume de cerca de 1 L, pegue cerca de 1/3 de um bloco de gelo seco (geralmente disponível em blocos de ~2 lb) e quebre-o em alguns pedaços menores.
- Adicione os pedaços de gelo seco ao recipiente de banho.
- Adicione lentamente o solvente orgânico(por exemplo, acetona) ao gelo seco enquanto mexe com uma haste de vidro. Há uma efervescência vigorosa como resultado do desenvolvimento de gás CO2.
- Continue a adicionar lentamente solvente e mexa até que um chorume homogêneo se forme e a maior parte do gelo seco se dissolva. Isto é para garantir que a transferência de calor para o frasco de reação seja o mais uniforme possível.
- Insira um termômetro de temperatura fria no banho para garantir que a temperatura desejada seja atingida.
- Verifique o banho de gelo seco em intervalos regulares e adicione mais pedaços de gelo seco quando um aumento na temperatura do banho é notado. O intervalo depende do grau de isolamento, mas geralmente fica em torno de 45 a 60 minutos.
3. Fazer um banho de nitrogênio líquido
- Coloque luvas de proteção criogênicas e óculos de segurança. Sempre pratique isso ao manusear nitrogênio líquido, pois pode queimar rapidamente tecidos da pele e fluidos oculares, causando queimaduras ou danos permanentes nos olhos.
- Para um banho sem aditivos, adicione a quantidade apropriada de N2 a um Dewar para obter uma temperatura de -196 °C. Mova-se para a etapa 3.3 se esta for a temperatura desejada.
- Para um banho com aditivos, adicione um solvente orgânico de escolha (consulte a Tabela 3 para encontrar o solvente certo para a temperatura certa) ao Dewar primeiro, depois adicione lentamente o líquido N2 ao solvente.
- Insira um termômetro de temperatura fria no banho para garantir que a temperatura desejada tenha sido atingida. Em contraste com os outros banhos, o banho líquido N2 dentro de um Dewar mantém sua temperatura por horas de cada vez.
- Verifique o banho em intervalos apropriados (algumas horas) para ver se mais N2 é necessário.
Aplicação e Resumo
Quando é útil executar uma reação a uma temperatura baixa?
Para responder a esta pergunta, vamos investigar quatro aplicações diferentes:
Aplicação 1. Às vezes, as reações são muito vigorosas e exotermicas e a mistura de reação deve ser resfriada para evitar derramamento e acúmulo de pressão devido ao desenvolvimento do gás. Uma reação altamente exotérmica também pode se tornar um risco de segurança, pois a mistura de reação pode ferver rapidamente (muitos solventes orgânicos geralmente têm pontos de ebulição baixos) e jorrando para fora. Uma aplicação muito comum para isso é o passo de saciamento ou trabalho onde uma reação inicialmente realizada sob condições anídradas é reagida com água e ácido no final, a fim de protonar o produto final e reagir a quaisquer intermediários e reagentes reativos restantes. Por exemplo, na reação de Grignard, uma reação muito comum em química orgânica, o passo de saciar no final exigirá resfriamento, mesmo que um banho de água gelada a 0 °C seja suficiente:
(4)
Aplicação 2. O resfriamento também pode ser necessário para etapas de adição no início de uma reação, quando uma reação exotérmica resultaria na ebulição do solvente orgânico. Isso é indesejável, porque as reações são melhor realizadas em solventes. Ter que adicionar mais solvente para compensar a perda de solvente não é apenas desperdício e antieconômico, mas também tedioso como solventes em muitas reações requerem um passo de secagem prévio para torná-los anidras. Além disso, é possível que certos reagentes se decomporem termicamente a temperaturas mais altas.
Para evitar essas ocorrências em uma reação exotermática, um reagente é frequentemente adicionado dropwise por seringa ou funil de gota a um frasco contendo outro reagente em solvente, enquanto mexe e esfria. Dessa forma, a adição pode ser interrompida a qualquer momento se a reação se tornar muito vigorosa. Muitas vezes, a reação deve ser resfriada bem abaixo de 0 °C e um banho de água gelada não é suficiente.
Um exemplo para uma reação onde isso é necessário é a adição da forte base n-butyllithium (n-BuLi) à diisopropilamina para formar diisopropylamida de lítio (LDA).
(5) 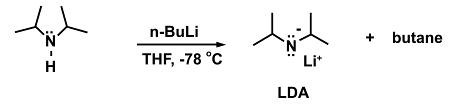
Na ausência de um banho de resfriamento, o n-BuLi pode se decompor à medida que temperaturas mais altas são atingidas:
(6) 
Aplicação 3. Em algumas reações químicas há mais de um produto possível resultante de uma via química concorrente. Um produto pode ser o resultado da via com um estado de transição mais estável, exigindo menos ativação energia (Ea1),enquanto o outro produto pode exigir mais energia de ativação (Ea2), mas é globalmente mais estável. O primeiro é chamado de produto cinético, enquanto o segundo é chamado de produto termodinâmico (TD) (ver diagrama de energia na Figura 2).
Controlando a temperatura de reação podemos controlar qual desses produtos é formado. Como o produto cinético requer menos energia de ativação é o produto que é formado a baixas temperaturas. Conduzir uma reação a baixas temperaturas muitas vezes garante a formação do produto cinético sobre o produto termodinâmico.
Um exemplo clássico no reino da química enoolada é a reação de 2-metilciclonhexanona com diferentes bases em diferentes condições de reação. O reagente é uma cetona não simétrica e, portanto, possui dois tipos diferentes de α-hidrogênios. Pequenas bases, como a NaOH, desprotodem a cetona no lado mais altamente substituído, o que resulta no enolato termodinâmico mais estável (7). Bases, que são mais estricamente exigentes, desprotodem a cetona no lado menos dificultado, resultando no enolato cinético (8). A formação do enolato cinético terá um rendimento muito maior quando a reação for realizada a -78 °C em comparação com a temperatura ambiente. As duas formas do enolate podem então ser reagidas com um eletrofildo apropriado, como o mehidiodeto, para formar os produtos α-alquilados mostrados abaixo.
(7) (8)
A base esticamente exigente usada para obter o enolato cinético é muitas vezes LDA, a preparação da qual foi mostrado anteriormente no esquema (5). É importante controlar a temperatura a -78 °C para evitar que o enolato cinético volte ao enolato termodinâmico. (Nota: não há significado para a temperatura de -78 °C além de que é facilmente obtido por um banho de gelo seco em acetona.)
Além do controle de temperatura, a ordem de adição e a forma de adição de reagentes é crucial. Para melhores resultados que favoreçam o enolato cinético, uma solução do reagente cetona é adicionada dropwise à base LDA em solvente. O solvente anidro usado para a reação com LDA é frequentemente THF. Uma reação de exemplo é mostrada no esquema (9).
(9) 
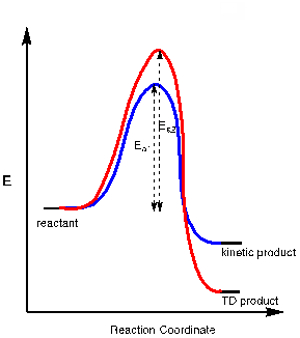
Figura 2. Diagrama de energia para uma reação que tenha um produto cinético e termodinâmico.
Aplicação 4. Em alguns casos é possível regular as reativações dos reagentes com temperatura. Considere, por exemplo, a redução de um éster. Reações com o forte hidreto de hidreto de hidreto de lítio (LAH) resultam na redução do éster até o respectivo álcool primário (10). No entanto, o uso do hidreto de hidreto volumoso do agente diisobutylaluminum hydride (DIBAL) permite a redução seletiva de um éster ao respectivo aldeído. A redução excessiva para o álcool primário pode ser evitada, desde que a temperatura de reação seja mantida abaixo de -78 °C (ainda melhor até -90 °C ) e apenas um equivalente estequiométrico de DIBAL é usado (12). Em temperaturas acima de -70 °C, o DIBAL torna-se muito reativo e reduzirá o éster ao álcool primário (11).
(10)-(12)
Referências
- Gordon, A. J., Ford, R. A. The Chemist's Companion - A Handbook of Practical Data, Techniques, and References. Chapter 11 (1973) ISBN: 978-0-471-31590-2.
- Rondeau, R. E. Slush baths. J. Chem. Eng. Data. 11, 124 (1966)
Pular para...
Vídeos desta coleção:

Now Playing
Condução de reações abaixo da temperatura ambiente
Organic Chemistry
70.3K Visualizações

Introdução à Catálise
Organic Chemistry
34.1K Visualizações

Montagem de um sistema de refluxo para reações químicas aquecidas
Organic Chemistry
166.3K Visualizações

Transferência de Solventes usando Linhas Schlenk
Organic Chemistry
41.5K Visualizações

Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Organic Chemistry
55.9K Visualizações

Preparação de Reagentes e Equipamentos Anidros
Organic Chemistry
79.1K Visualizações

Purificação de Compostos por Recristalização
Organic Chemistry
705.3K Visualizações

Separação de Misturas por Precipitação
Organic Chemistry
157.2K Visualizações

Extração sólido-líquido
Organic Chemistry
237.1K Visualizações

Evaporação rotativa para remover solvente
Organic Chemistry
212.3K Visualizações

Destilação Fracionária
Organic Chemistry
332.8K Visualizações

Crescimento de Cristais para Análise de Difração de Raios-X
Organic Chemistry
32.3K Visualizações

Realização de Cromatografia de Camada Fina 1D
Organic Chemistry
288.4K Visualizações

Cromatografia em coluna
Organic Chemistry
358.4K Visualizações

Espectroscopia de ressonância magnética nuclear (NMR)
Organic Chemistry
246.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados