Preparação de Reagentes e Equipamentos Anidros
Visão Geral
Fonte: Laboratório da Dra.
Demonstrado por: Timothy Beck e Lucas Arney
Muitas reações na química orgânica são sensíveis à umidade e devem ser realizadas sob cuidadosa exclusão da água. Nesses casos os reagentes têm alta afinidade para reagir com água da atmosfera e se deixados expostos a reação desejada não ocorrerá ou dará baixo rendimento, pois os reagentes são quimicamente alterados.
Para evitar reações indesejadas com H2O essas reações devem ser realizadas sob uma atmosfera inerte. Uma atmosfera inerte é gerada executando a reação sob gás nitrogênio, ou em casos mais sensíveis, sob um gás nobre como o argônio.
Cada componente em tal reação deve ser completamente anidro, ou livre de água. Isso inclui todos os reagentes e solventes utilizados, bem como todos os vidros e equipamentos que entrarão em contato com os reagentes. Reações extremamente sensíveis à água devem ser realizadas dentro de um porta-luvas que fornece um ambiente completamente selado para trabalhar sob através de um par de luvas que se projeta para fora para um dos lados da câmara.
Princípios
Secagem de Vidros
O glassware deve estar completamente seco ao executar reações com moléculas sensíveis à água. O vidro, que consiste em dióxido de silício (SiO2),tem traços microscópicos de água adsorvida à sua superfície, mesmo quando parece seco aos olhos. As ligações Si-O atraem água e, como resultado, um filme de moléculas de água começam a revestir a superfície do vidro e se acumulam ao longo do tempo. A fim de liberar vidros da água, ele pode ser seco durante a noite em um forno ou, alternativamente, seco diretamente antes de conduzir a reação. Evite lavar vidros no mesmo dia que executar uma reação dentro dele. Nota: para reações que não são muito sensíveis à água é possível enxaguar o vidro com acetona diretamente antes de usar. Este método de secagem é absolutamente insuficiente para reações como a reação de Grignard.
Vantagens e desvantagens dos diferentes métodos:
A secagem de vidros em um forno é demorada, mas também é muito conveniente e funciona bem para todos os tipos de vidros. O vidro de secagem de chamas é muito mais rápido, mas requer a configuração de um queimador Bunsen (que é sempre uma preocupação adicional de segurança) e pode não ser usado com frascos cônicos. Devido à espessura da base em comparação com o resto do frasco cônico, a tensão criada durante o aquecimento pode causar rachaduras no vidro. Embora a secagem de vidros com acetona seja uma correção muito rápida para reações que não são excessivamente sensíveis, deve-se sempre ter em mente o desperdício gerado de solventes e o custo e a carga ambiental associados a isso.
Secagem de Solventes
Existem muitas técnicas diferentes para a secagem de solventes com diferentes graus de eficácia. Alguns laboratórios utilizam sistemas disponíveis comercialmente para a secagem de solventes. Esses sistemas empregam os chamados trens de secagem e podem secar vários tipos diferentes de solventes simultaneamente. Este método é muito seguro e conveniente, mas bastante caro e não está disponível na maioria dos laboratórios. Valores residuais de teor de água de 1-10 ppm podem ser alcançados desta forma.
Outro método de secagem de solventes é o uso de metais altamente reativos, como o sódio nos chamados alambiques solventes. Este método apresenta várias preocupações de segurança devido ao risco de incêndios e explosões e geralmente não é realizado por estudantes em laboratórios de ensino de graduação. No entanto, é frequentemente utilizado em laboratórios de pesquisa por estudantes e profissionais mais avançados. As alambiques de solvente entregarão solventes bastante secos e devem ser empregados para a secagem extensiva de éteres (THF, diethylether, etc) ou hidrocarbonetos. Nota: este método nunca deve ser usado para a secagem de solventes clorados porque uma reação explosiva pode ocorrer. Ao secar com metal de sódio, um indicador chamado benzofenona é usado para monitorar o progresso da secagem. Na presença de água a solução será clara ou amarela, mas quando o solvente estiver seco a solução será azul ou roxo. Benzofenona é uma cetona e reage com sódio metálico (Na0) em um radical de cetil, que tem uma cor azul/roxo. Na presença de água o radical é protoado para dar um produto incolor. O teor residual de água alcançado por este método é tipicamente em torno de 10 ppm.
A água também pode ser removida de reagentes líquidos ou solventes pelo uso de dessecantes ou agentes de secagem. Estes são sólidos altamente higroscópicos, o que significa que eles absorvem e, assim, removem a água de um líquido orgânico. Nos últimos anos, um método muito eficaz foi desenvolvido usando peneiras moleculares para a secagem de vários solventes. Este método é muito mais conveniente do que o uso de alambiente metálico ativo e ignora as preocupações de segurança desse método. Peneiras moleculares são comumente usadas, e provavelmente o dessecante mais eficaz atualmente disponível. São um material micropooso feito de aluminossilicatos de sódio e cálcio. Os poros de peneiras moleculares podem variar tipicamente entre 2-5 Å (0,2-0,5 nm) e são usados para capturar ou absorver moléculas pequenas enquanto moléculas maiores não se encaixam dentro dos poros. As peneiras moleculares estão disponíveis em pó ou forma de contas e podem ser usadas para prender água (uma pequena molécula) removendo-a de outro líquido com um tamanho molecular maior. Peneiras moleculares também são componentes comuns de produtos da vida cotidiana, por exemplo, lixo de gato. Peneiras moleculares são ativadas em um forno a temperaturas acima de 300 °C a uma pressão atmosférica por um mínimo de 3h, mas melhor durante a noite. Em um forno a vácuo uma temperatura de cerca de 200 °C será suficiente. Este processo de ativação remove toda a água com a qual os poros estão saturados mesmo em uma garrafa recém-comprada e recém-aberta de peneiras moleculares. Após a ativação, as peneiras moleculares devem ser armazenadas em um forno de secagem convencional a temperaturas acima de 120 °C ou em um desiccator por várias semanas antes de exigir a reativação. Nota: se as peneiras moleculares ainda estão ativas pode ser facilmente determinada colocando uma pequena quantidade de contas em uma mão enluvada seguida por dois volumes equivalentes de água às contas. Se as peneiras ainda estiverem ativas, elas se tornarão muito quentes ao toque.
Os solventes são secos removendo as contas do forno ou do dessecador e resfriados à temperatura ambiente antes de adicioná-las a um solvente de escolha. O solvente é seco sobre as contas por pelo menos 12 h-5 dias antes que o solvente seja considerado anidro e possa ser usado em uma reação.
O tempo de armazenamento depende do solvente, assim como a quantidade de peneiras moleculares necessárias. Isso é tipicamente relatado como o carregamento % massa/volume (m/v) e descreve a quantidade de peneiras moleculares usadas por volume de solvente. Por exemplo, um 5% m/v significa que 5 g de peneiras moleculares são adicionados por 100 mL de solvente.
Para solventes comuns como diclorometano (DCM), acetonitrila ou toluene um tempo de armazenamento de 24 h sobre peneiras moleculares de 3-Å com 10% m/v é suficiente para atingir valores muito baixos de ppm para teor de água residual (0,1-0,9 ppm). O tetrahidrofurano (THF), por outro lado, deve ser seco por uma duração de 3 dias usando 20% m/v de peneiras moleculares 3-Å para atingir baixas quantidades residuais de água de cerca de 4 ppm. Álcoois de menor massa, como metanol ou etanol, devem ser armazenados cerca de 5 dias sobre peneiras moleculares de 3-Å e 20% m/v, o que produzirá teor residual de água de 8 a 10 ppm. Álcoois de maior peso molecular devem ser secos usando peneiras em pó 3-Å em vez de contas. Peneiras moleculares em pó adsorb a uma taxa muito mais rápida do que contas. Isso resulta em uma adsorção não seletiva de moléculas solventes que são pequenas o suficiente em tamanho para competir com a água para entrada no poro de peneira (por exemplo, pequenas moléculas de álcool, como o metanol). Para álcoois de peso molecular de grande porte é seguro usar a forma mais ativa em pó das peneiras porque elas são muito grandes para competir com a água para os poros. 1 Nota: os álcoois são tipicamente muito higroscópicos e quantidades de água residual muito baixas não podem ser alcançadas. A Tabela 1 resume os achados dos solventes comuns descritos acima.
Observe que as contas 4-Å ligeiramente maiores são usadas para secagem de aminas, dimetilformamida (DMF) e hexametillafosforamida (HMPA) armazenando-as sobre as contas usando 5% w/v por pelo menos 24 h. Peneiras moleculares não devem ser usadas para secar acetona, pois são básicas e induzem uma reação aldol em acetona.
Outra grande vantagem das peneiras moleculares é que elas podem ser recicladas enxaguando-as completamente com um solvente orgânico volátil, seguido de secá-las a 100 °C por algumas horas antes (ou, alternativamente, secando o ar) antes de reativá-las como de costume a temperaturas acima de 300 °C por pelo menos 3 h. Acetona pode inflamar automaticamente a altas temperaturas de > 400 °C. Portanto, deve-se ter certeza de que ele evaporou completamente antes de mover as contas para o forno de alta temperatura. Nota: nos laboratórios de graduação, os solventes às vezes são secos usando os agentes de secagem listados na Tabela 2 na seção abaixo. Este método é suficiente para reações que não são muito sensíveis à água, mas não renderão solventes suficientemente secos para executar reações sensíveis, como uma reação grignard.
| Solvente | % m/v | Tempo de armazenamento de solvente sobre 3 peneiras moleculares Å | Teor de água residual (ppm) |
| DCM | 10% | 24 h | ~0.1 |
| Acetonitrilo | 10% | 24 h | ~0,5 |
| Tolueno | 10% | 24 h | ~0,9 |
| THF | 20% | 3 dias | ~4.1 |
| Metanol | 20% | 5 dias | ~10.5 |
| Etanol | 20% | 5 dias | ~8.2 |
Tabela 1. Quantidade dessecante, tempo de secagem e teor residual de água para vários solventes secos sobre 3 peneiras moleculares Å. 2
Secagem de Reagentes
Reagentes em uma reação química podem ser sólidos ou líquidos (e em casos muito raros gases). Diferentes métodos são empregados para secar sólidos do que são usados para secar líquidos.
Os reagentes líquidos geralmente podem ser feitos anídros por métodos semelhantes aos de solventes descritos acima. Os reagentes recém-comprados são muitas vezes suficientemente anidros. Os reagentes precisam ser secos se não estiverem frescos ou se foram sintetizados como parte de uma síntese de várias etapas. Em uma síntese de várias etapas, o produto de um passo de reação é o reagente para o próximo passo. A formação de produtos de muitas reações requer uma etapa saciada, o que significa contato com uma grande quantidade de água. Posteriormente, o produto, seja sólido ou líquido, deve ser seco para garantir condições anídros para a etapa seguinte. Isso é proporcionado primeiro pela extração, um método pelo qual a fase aquosa é separada da fase orgânica, removendo assim quantidades macroscópicas de água. Após a extração, a fase orgânica, que contém o produto dissolvido em um solvente orgânico, ainda terá traços microscópicos de água presentes. Após a extração, a fase orgânica deve ser seca sobre um agente de secagem altamente higroscópico que geralmente é um sal inorgânico. Existem muitos agentes de secagem diferentes, e alguns dos mais comuns estão listados na Tabela 2.
Para fins de secagem, o agente de secagem é adicionado à fase orgânica até que o agente de secagem recém-adicionado não se aglomera mais, mas rola livremente e a solução é clara e não nublada. A fase orgânica deve ser coberta e armazenada sobre o agente de secagem por um curto período de tempo (geralmente uma hora) para garantir a secagem. Depois, o agente de secagem é filtrado e o solvente é removido sob pressão reduzida em um evaporador rotativo.
Para um produto que é um líquido, uma secagem adicional pode ser alcançada armazenando-o sobre um agente de secagem e destilando-o recentemente antes de usá-lo. Para um produto sólido, a secagem é obtida preferencialmente pelo armazenamento em um forno a vácuo a uma temperatura abaixo do seu ponto de fusão (mp). Por exemplo, se a mp do sólido estiver abaixo de 100 °C, o forno deve estar a uma temperatura em torno de 15-20 °C abaixo de sua mp. A água ainda evaporará com o tempo e o vácuo aplicado acelerará o processo. Alternativamente, o sólido pode ser seco por armazenamento dentro de um desiccador de vácuo sobre um agente de secagem apropriado (tipicamente P2O5). Isso pode ser indicado para casos em que o mp do sólido é extremamente baixo (abaixo de ~50 °C) ou quando um forno a vácuo não está disponível. Após a secagem, o reagente anidro deve ser armazenado em uma garrafa sob atmosfera inerte (N2ou Ar) e a tampa da garrafa deve ser bem selada com Parafilm. A garrafa deve ser mantida dentro de um desiccator até que o reagente seja necessário. Nota: alguns reagentes sólidos, como o metal de magnésio para uma reação grignard podem ser secos dentro do aparelho durante o processo de secagem de chamas.
Os reagentes líquidos podem ser, alternativamente, secos por peneiras moleculares, como descrito na seção anterior para solventes. Isso é indicado quando grandes quantidades de um reagente precisam ser secas. Normalmente, reagentes em sínteses de pequena escala são usados em pequenas quantidades (alguns mL ou menos). A secagem de quantidades tão pequenas com peneiras moleculares é impraticável e a secagem com os métodos acima deve ser suficiente.
| Agente de Secagem | Capacidade | Velocidade | Adequabilidade |
| Na2SO4 | alto | baixo | Geralmente útil |
| MgSO4 | alto | alto | Geralmente útil |
| CaCl2 | alto | Média | Útil para hidrocarbonetos* |
| CaSO4 | baixo | alto | Geralmente útil |
| * Líquidos orgânicos que não são hidrocarbonetos, como álcoois, aminas e diferentes compostos contendo carbonyl também são absorvidos pela CaCl2. Não pode ser usado para secar esses líquidos, mas pode ajudar a remover esses tipos de impurezas de um hidrocarboneto. | |||
Tabela 2. Os agentes de secagem mais utilizados em laboratórios orgânicos.
Procedimento
Secagem de Vidros
1. Secagem de forno
- Remova todas as peças que não são feitas de vidro, como a torneira de um funil de adição.
- Coloque todos os vidros que fazem parte do aparelho em um forno de secagem definido a cerca de 125 °C por pelo menos 24 horas antes de usar.
- Coloque luvas de proteção contra calor e remova os vidros do forno. Tenha muito cuidado ao manusear vidro quente durante a montagem do aparelho.
- Para obter melhores resultados, lave o aparelho com um gás inerte como o N 2 durante amontagem do aparelho.
2. Secagem de chamas
- Configure o aparelho completo, mas remova todos os componentes que não são feitos de vidro (como torneiras de funis ou mangas de borracha, etc.). Não conecte nenhuma tubulação ao aparelho neste momento.
- Coloque luvas de proteção contra o calor.
- Coloque um queimador Bunsen e seque cuidadosamente o aparelho. Comece por baixo e mova a chama para cima, "acompanhando" a água na saída. O vapor se desenvolverá e embaçará os vidros. Continue secando as chamas até que o embaçamento pare.
- Aguarde o aparelho esfriar para cerca de 60 °C. Isso leva alguns minutos e o vidro ainda estará quente ao toque, mas não causará queimaduras se o contato for curto.
- Adicione cuidadosamente o resto do aparelho que não é feito de vidro, como tubos e torneiras. Não remova as luvas de proteção térmica ao manusear o aparelho para evitar queimaduras.
- Depois de tudo estar devidamente montado, lave o aparelho com um gás inerte como o N2para acelerar o resfriamento do vidro a um ponto onde os reagentes podem ser adicionados.
Nota: Durante o processo de secagem de chamas nunca tenha nenhum solvente ou a barra de agitação magnética dentro do frasco, nem qualquer um dos reagentes, a menos que especificamente exigido pelo procedimento. (No entanto, ao realizar a reação grignard não há problema em deixar as aparas de magnésio no frasco durante a secagem de chamas).
3. Secagem com Acetona
- Enxágüe vidros com acetona.
- Colete as enxaguantes de acetona em um recipiente de resíduos de solvente designado.
- Lave os vidros com gás N2 ou ar comprimido seco para acelerar a secagem.
Secagem de Solventes
1. Secagem com Metal de Sódio Ativo
- Corte cuidadosamente o metal de sódio sob o éter do petróleo para minimizar o risco de ignição à medida que o metal reage com ar. A superfície metálica oxida rapidamente dando um resíduo branco. Corte o metal em fatias finas expondo o máximo de superfície metálica possível.
- Sob gás N2 adicione as aparas metálicas a um frasco de destilação contendo solvente.
- Em seguida, adicione benzofenona, um indicador que é usado para monitorar a reação. Na presença de água a solução é clara ou amarela, mas quando o solvente está seco a solução é azul ou roxo.
- Refluxo a solução usando um manto de aquecimento até que uma mudança de coloração para azul/roxo seja observada.
- Destile o solvente, colete-o em um frasco seco e use em uma reação imediatamente após o resfriamento.
Descarte de resíduos: Após o processo de secagem é importante descartar com segurança qualquer sódio restante no frasco de destilação. - Para isso, adicione cuidadosamente o etanol ao sódio até que a evolução do hidrogênio cesse.
- Mexa a solução cuidadosamente, mas bem, e certifique-se de que não restam nódulos de sódio que possam ter metal de sódio ativo preso dentro.
- Adicione cuidadosamente o metanol à mistura e deixe a mistura na parte de trás do capô por várias horas para garantir que o sódio esteja completamente consumido.
- Por fim, adicione a mistura com muito cuidado a um grande excesso de água e descarte a mistura em um recipiente de descarte de resíduos apropriado.
2. Secagem sobre peneiras moleculares
- Abra uma garrafa contendo peneiras moleculares e encha-as em um copo termoestabilidade. Seque mais do que o necessário para o experimento atual para uso futuro.
- Para ativação coloque o béquer com as contas em um forno de alta temperatura e armazene por 3-3,5 h a uma temperatura de 300-350 °C. Alternativamente, se disponível, guarde em um forno a vácuo a 200 °C pelo mesmo período de tempo.
- Usando luvas resistentes ao calor, remova o béquer com as contas e coloque-o em um forno de secagem convencional a temperaturas acima de 120 °C. Alternativamente, armazene o béquer com as contas dentro de um dessecante. As contas podem ser armazenadas por semanas antes do uso.
- Remova o béquer com as contas do forno de secagem ou do desiccador. Trabalhe rápido a partir deste ponto para minimizar o contato das contas com a água atmosférica.
- Se remover as contas de um forno, permita que elas esfriem até a temperatura ambiente. Cubra o béquer com uma toalha seca para minimizar a exposição ao ar durante este tempo de resfriamento.
- Para testar se as contas ainda estão ativas, coloque luvas descartáveis e coloque uma pequena quantidade de contas em sua mão. Adicione cerca de 2 volumes equivalentes de água. Se as contas ficarem muito quentes, significa que estão ativadas.
- Pesar a quantidade necessária de contas ativas em uma escala. Por exemplo, para obter um 10% m/v de contas em uma garrafa de solvente de 500 mL, são necessários 50 g de contas.
- Adicione as contas de temperatura ambiente a uma garrafa recém-aberta de solvente. Certifique-se de que as contas estão resfriadas, especialmente se o solvente for volátil. Nunca adicione as contas a um solvente diretamente depois de removê-las do forno.
- Para um solvente volátil, como o DCM, deixe a tampa em cima da garrafa, mas espere alguns minutos antes de aparafusar totalmente a tampa da garrafa para evitar o acúmulo de pressão.
- Sele a área ao redor da tampa, embrulhando-a com Parafilm para manter a umidade fora.
- Armazene o solvente sobre as contas pelo tempo adequado, por exemplo, 24 horas.
Secagem de Reagentes
1. Secagem da Fase Orgânica após a Extração
- Após a separação das fases em um funil separador, transfira a fase orgânica para um recipiente de vidro seco, como um frasco de béquer ou Erlenmeyer (ou um tubo de ensaio para pequenas escalas).
- Adicione um agente de secagem da Tabela 2 (geralmente NaSO4ou MgSO4) à fase orgânica usando uma espátula. Inicialmente, o agente de secagem se agrupa.
- Continue a adição até que o agente de secagem recém-adicionado não se agate e rola livremente. Além disso, a solução deve ser clara e não nebulosa.
- Se disponível, cubra o recipiente de vidro com uma rolha, caso contrário com alguma folha de alumínio.
- Deixe a solução ficar por cerca de 1h sobre o agente de secagem. Não há problema em permitir que ele fique por períodos mais longos de tempo, por exemplo, durante a noite.
- Monte um aparelho de filtragem a vácuo com funil Büchner e frasco de braço lateral.
- Adicione um papel filtro ao funil Büchner e ligue o vácuo.
- Decantar lentamente a fase orgânica para o funil Büchner. Inicialmente, tente não transferir nenhum agente de secagem ou o filtro irá entupir.
- Quando a maior parte do líquido tiver sido transferida para o funil e drenada para o frasco abaixo, adicione o restante da fase orgânica junto com o agente de secagem e deixe descansar por alguns minutos.
- Desligue o vácuo e transfira a fase orgânica em um frasco fundo redondo seco.
- Conecte o frasco de fundo redondo a um evaporador rotativo e remova todos os solventes sob pressão reduzida.
- Se o produto for um líquido, armazene-o sobre um agente de secagem e destile-o fresco antes de usá-lo.
2. Secagem de Reagentes Sólidos
- Coloque o reagente sólido dentro de um recipiente de vidro aberto e determine o peso combinado.
- Coloque o recipiente com o reagente em um forno de secagem a uma temperatura abaixo do ponto de fusão do sólido. Quando disponível, use um forno a vácuo. Use luvas de proteção térmica, se necessário.
- Deixe o reagente secar por várias horas dentro do forno.
- Retire o recipiente com o reagente do forno.
- Deixe a amostra esfriar até a temperatura ambiente, idealmente dentro de um dessecador.
- Determine o peso e certifique-se de que ele é menor do que antes de secar. Se necessário, repetir as etapas 2.2 – 2.5.
- Uma vez que o reagente é resfriado à temperatura ambiente, ele está pronto para uso.
- Se o reagente não precisar ser usado imediatamente, lave o recipiente com um gás inerte, como o N2 e sele-o firmemente com uma tampa e coloque Parafilm ao redor da tampa.
- Coloque o recipiente dentro de um desiccador e armazene-o lá até que o reagente seja necessário.
3. Secagem de Reagentes sólidos sensíveis ao calor
- Prepare um desiccator colocando um agente de secagem anidro fresco no compartimento inferior (tipicamente P2O5).
- Coloque o reagente sólido dentro de um recipiente de vidro aberto e determine seu peso.
- Coloque o recipiente com o reagente dentro de um desiccador.
- Feche a tampa do dessecador, deslizando-a horizontalmente do lado para garantir a vedação adequada.
- Aplique um vácuo ao desiccador usando a conexão stopcock.
- Depois de alguns minutos feche a torneira e desligue o vácuo.
- Deixe o reagente secar dentro do desiccator por pelo menos algumas horas.
- Abra a torneira do desiccator e deixe o ar fluir.
- Deslize cuidadosamente da tampa do dessecador horizontalmente. Não tente puxar a tampa verticalmente.
- Remova o reagente do desiccador e pese-o. Deve ter um peso menor do que antes de ser seco.
- Se necessário, a repetição das etapas 3.3 – 3.10 até que o peso permaneça estável e o reagente esteja totalmente seco.
- Se o reagente não precisar ser usado imediatamente, lave o recipiente com um gás inerte como o N2 e sele-o firmemente com uma tampa e coloque Parafilm ao redor da tampa.
- Coloque o recipiente dentro de um desiccador e armazene-o lá até que o reagente seja necessário.
Resultados
Um exemplo clássico para uma reação que deve ser feita sob condições anidras é a reação de Grignard. (Equação 1)
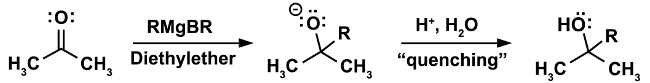
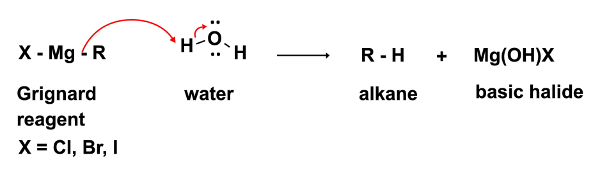
Na primeira etapa da reação, o ataque nucleofílico do reagente Grignard RMgX ocorre em um eletrofilme (neste caso uma cetona). Nesta etapa é imperativo que nem mesmo os menores vestígios de água estejam presentes. O reagente Grignard, enquanto um nucleófilo forte, é uma base ainda mais forte. Na presença de água, atuará preferencialmente como base e água desprotonada, resultando na perda do reagente grignard nucleofílico e na formação de um alkano, um subproduto indesejado. (Equação 2)
Referências
- Burfield, D. R. and Smithers, R. H. Desiccant efficiency in solvent and reagent drying. 7. Alcohols. J. Org. Chem. 48 (14), 2420-2422 (1983).
- Williams, D. B. G. and Lawton, M. Drying of Organic Solvents: Quantitative Evaluation of the Efficiency of Several Desiccants. J. Org. Chem. 75 (24), 8351-8354 (2010).
Pular para...
Vídeos desta coleção:

Now Playing
Preparação de Reagentes e Equipamentos Anidros
Organic Chemistry
79.1K Visualizações

Introdução à Catálise
Organic Chemistry
34.1K Visualizações

Montagem de um sistema de refluxo para reações químicas aquecidas
Organic Chemistry
166.3K Visualizações

Condução de reações abaixo da temperatura ambiente
Organic Chemistry
70.3K Visualizações

Transferência de Solventes usando Linhas Schlenk
Organic Chemistry
41.5K Visualizações

Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Organic Chemistry
55.9K Visualizações

Purificação de Compostos por Recristalização
Organic Chemistry
705.3K Visualizações

Separação de Misturas por Precipitação
Organic Chemistry
157.2K Visualizações

Extração sólido-líquido
Organic Chemistry
237.1K Visualizações

Evaporação rotativa para remover solvente
Organic Chemistry
212.3K Visualizações

Destilação Fracionária
Organic Chemistry
332.8K Visualizações

Crescimento de Cristais para Análise de Difração de Raios-X
Organic Chemistry
32.3K Visualizações

Realização de Cromatografia de Camada Fina 1D
Organic Chemistry
288.4K Visualizações

Cromatografia em coluna
Organic Chemistry
358.4K Visualizações

Espectroscopia de ressonância magnética nuclear (NMR)
Organic Chemistry
246.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados