Separação de Misturas por Precipitação
Visão Geral
Fonte: Laboratório da Dra.
A maioria das amostras de interesse são misturas de muitos componentes diferentes. A preparação da amostra, um passo fundamental no processo analítico, remove interferências que podem afetar a análise. Como tal, desenvolver técnicas de separação é um importante esforço não só na academia, mas também na indústria.
Uma maneira de separar misturas é usar suas propriedades de solubilidade. Neste curto artigo, lidaremos com soluções aquosas. A solubilidade de um composto de juros depende (1) da força iônica da solução, (2) pH e (3) temperatura. Manipulando com esses três fatores, uma condição em que o composto é insolúvel pode ser usada para remover o composto de juros do resto da amostra. 1
Princípios
Uma série de parâmetros podem ser usados para separar uma amostra de interesse das impurezas, reduzindo sua solubilidade, e removendo-a de uma solução como sólida, como mostrado na Figura 1. Primeiro, mudar a força iônica da solução pode mudar uma solubilidade de substâncias. Isso muitas vezes envolve a adição de sal extra (também chamado de salga), ou a adição de um contra-íon, que forma uma espécie menos solúvel com o composto de juros. 2

Figura 1. O equilíbrio da solubilidade é afetado pela força iônica, pH e temperatura. Um composto de juros (amarelo) é separado das impurezas (vermelho) alterando sua solubilidade em um determinado solvente.
Alterar o pH de uma solução pode alterar a carga líquida do composto. Em um certo pH, a carga líquida torna-se zero (também chamado de ponto isoelétrico) e o composto torna-se menos solúvel em água, eventualmente formando um sólido. A temperatura também afeta a solubilidade, pois a temperatura mais alta aumenta a solubilidade dos sólidos.
A taxa de formação sólida determina a pureza relativa(Figura 2). Em geral, o termo precipitação refere-se à formação de um sólido em um ritmo rápido, produzindo assim uma amostra amorfa com algumas impurezas presas dentro. Isso é comum em salgar e processos induzidos por mudanças de pH. Quando este processo é desacelerado, as impurezas não ficam presas dentro do composto e um sólido relativamente puro é produzido. Esta técnica é empregada na recristalização. Neste processo, um composto é dissolvido em solvente suficiente para estar apenas no ponto de saturação a uma temperatura elevada. Esta solução saturada é então permitida a esfriar lentamente. À medida que a solução esfria, a solubilidade do componente diminui, e o composto em excesso da solubilidade forma um sólido bem ordenado (também conhecido como cristais) em vez de um sólido amorfo. As impurezas na solução não ficam presas, pois o processo lento permite a remoção dessas impurezas na superfície do sólido antes de ficarem presas. 1

Figura 2. Diferença entre precipitação e recriminarização.
Uma vez que o sólido tenha se formado (seja como um cristal ou como um precipitado), ele deve ser separado do resto da mistura. Filtração é uma maneira de separá-los. Isso emprega um material poroso que inibe seletivamente a passagem do material sólido, mas não a solução.
Centrifugação é outra maneira de separar o precipitado do resto da mistura. A centrifugação usa aceleração centrípeta para separar misturas baseadas em suas densidades. Uma vez que o sólido é mais denso do que a solução aquosa, os sedimentos sólidos no fundo do recipiente. O sólido também é chamado de pelota e a solução aquosa, o supernante. O supernatante pode então ser decantado ou extraído usando uma tubulação ou seringa. Os cristais são frágeis e muitas vezes a centrifugação não é empregada para separá-los da solução.
Este vídeo cobrirá diferentes métodos de separação de compostos através da formação sólida (salgando, alterações de pH e recristallização) e sua posterior remoção da solução aquosa através de filtração ou centrifugação.
Procedimento
1. Precipitação de CaCO3
- Prepare 5 mL de 1 M CaCl2.
- Prepare 5 mL 1 M Na2CO3.
- Em um pequeno tubo de centrífuga (1,5 mL), adicione 750 μL de CaCl2 e 750 μL de Na2CO3.
- Espere 2 minutos para que a reação ocorra. A solução deve ficar nublada.
- Centrifugar a mistura a 10.000 × g por 5 min.
- Decantar o supernatante.
- Adicione 1 mL de água fria à pelota.
- Resuspend a pelota misturando em um misturador de vórtice para 10 s.
- Centrifugar a mistura a 10.000 × g por 5 min.
- Decantar o supernatante.
2. Precipitação de Proteínas do Leite
- Despeje o leite em um béquer e adicione uma barra de mexida.
- Leite morno suavemente até 40 °C em um prato quente. Não aqueça acima de 40 °C.
- Prepare 15% (v/v) de ácido acético misturando 7,5 mL de ácido acético e diluindo em água suficiente para atingir 50 mL.
- Mergulhe o eletrodo de um medidor de pH no leite morno e monitore o pH.
- Adicione o ácido acético em termos de gota ao leite até que um pH de 4.6 seja atingido.
- Filtragem do Leite
- Flauta um pedaço de papel filtro e coloque-o em um funil.
- Coloque o funil em um frasco e despeje a solução de leite acidificado no funil.
- À medida que a solução é derramada, o papel filtro pode ficar entupido. Usando uma haste de agitação, agitar a solução e filtrar o papel ocasionalmente para desentupir. Se não melhorar a passagem da solução, altere o papel filtro.
- Coloque um novo papel filtro na parte superior do banco e transfira o máximo do sólido molhado para o novo papel filtro. Isso deve absorver mais água do sólido.
- Se o novo papel filtro ficar muito molhado, continue a alterá-lo até que haja uma quantidade mínima de umidade no papel do filtro. Pressione-o levemente para absorver mais água, se necessário.
- Pegue o sólido seco e suspenda em cerca de 70% de etanol. Filtre o sólido novamente seguindo as etapas 2.6.1 para 2.6.5.
- Centrifugação do Leite (como alternativa à filtragem)
- Transfira 50 mL de porções da mistura para tubos de centrífugas de 50 mL.
- Centrifugar a 4.500 × g por 10 min, depois decantar o supernante.
- Adicione 50 mL 70% de etanol à pelota.
- Usando uma haste de agitação, resuspenque a pelota no etanol.
- Centrifugar esta suspensão após a etapa 2.7.2.
- Resuspenda a pelota no buffer para análises posteriores, como SDS-PAGE, caso contrário, armazene-a a 4°C.
3. Recristalização do KCl
- Pesar 50 g de KCl em um frasco de Erlenmeyer, e adicionar 100 mL de água
- Aqueça a mistura até ferver a água. Certifique-se de que todo o pó KCL está dissolvido. Algumas impurezas podem não se dissolver na água.
- Aqueça outro frasco (vazio) Erlenmeyer junto com a mistura e mantenha-o muito quente.
- Coloque um funil com papel filtro no frasco quente e vazio.
- Despeje a solução através do papel do filtro para remover impurezas não resolvidas. O frasco receptor é mantido aquecido para garantir que não ocorram alterações de temperatura durante a filtragem, caso contrário um precipitado bruto se formará. Se isso acontecer, reeque a mistura até que todos os precipitadores se dissolvam.
- Remova o frasco com a solução do calor.
- Mantenha-o em um lugar fresco no quarto e deixe esfriar lentamente por cerca de 30 minutos, ou até que não esteja mais quente para tocar.
- Uma vez resfriado até a temperatura ambiente, coloque o frasco em um banho de gelo para baixar ainda mais a temperatura. Alternativamente, pode-se deixar o frasco dentro da geladeira ou uma sala controlada pela temperatura a 4 °C.
- Os cristais podem ser colhidos filtrando como nas etapas 3.4-3.5 (use um frasco e funil à temperatura ambiente).
Resultados
O equilíbrio da solubilidade é empregado em muitos processos de purificação. O cálcio pode ser removido da água usando carbonato de sódio. O produto solubilidade(Ksp) de CaCO3 é de 4,8 × 10-9. Misturando 1 M de CaCl2 e 1 M de Na2CO3 produzido CaCO3 precipitado. O precipitado foi separado do resto da solução usando centrifugação.
A caseína (proteína-chave no leite) tem um ponto isoelétrico no pH 4.6 e formou coalhada insolúvel neste pH. As coalhadas foram então separadas do resto da solução (também chamada de soro) usando filtração ou centrifugação(Figura 3a). A coalhada foi lavada com etanol para remover fosfolipídios e outros compostos solúveis em água que também estavam presos na coalhada. A centrifugação impediu a perda de proteínas melhor do que a filtração, pois havia algumas proteínas que grudavam no papel filtro. Os componentes separados foram analisados utilizando-se SDS-PAGE(Figura 3b),mostrando que a reação de precipitação separou a maior parte da caseína do soro. Outras proteínas do leite, como as globulinas, precipitam-se junto com a caseína. Outras etapas podem ser aplicadas para isolar a caseína do resto das proteínas.
A precipitação remove a maioria das impurezas do sólido, porém também pode prender algumas impurezas dentro da matriz. A recristalização é frequentemente empregada para purificar ainda mais um sólido(Figura 4). Neste experimento, o sólido foi misturado com um solvente no qual o sólido não era muito solúvel. A temperatura da mistura foi então elevada ao ponto de ebulição do solvente e o sólido suficiente é adicionado para saturar o solvente quente. Outras impurezas insolúveis poderiam então ser removidas através de uma etapa de filtragem. A solução quente foi então gradualmente resfriada à temperatura ambiente e resfriada ainda mais em uma geladeira/sala fria/banho de gelo. O processo lento resultou em cristais em vez de precipitados amorfos. As impurezas solúveis não foram incorporadas à rede de cristal e os cristais resultantes eram relativamente mais puros do que o precipitado bruto. Os cristais foram então colhidos usando filtragem e deixados para secar no ar (ou no vácuo).
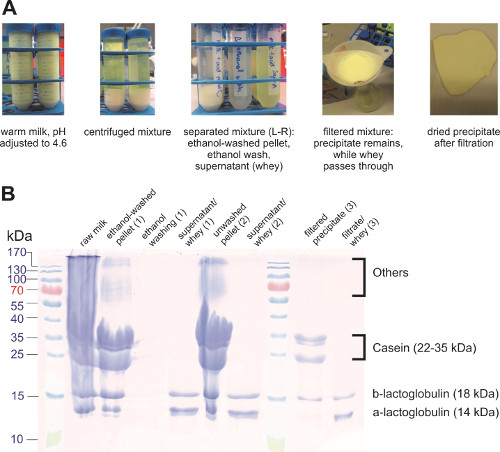
Figura 3. Precipitação de proteínas do leite. (A) Fotos de diferentes passos no isolamento da proteína do leite. (B) SDS-PAGE das diferentes amostras.

Figura 4. Recristallização de KCl.
Aplicação e Resumo
Reações de precipitação são aplicadas a muitos processos de preparação de amostras. Como mencionado anteriormente, eles podem ser usados para remover sais ou íons específicos, dependendo de seu equilíbrio de solubilidade. Eles também podem ser usados para remover proteínas e outras biomoléculas de misturas.
A recristalização é frequentemente empregada para purificar ainda mais os sólidos. Este processo remove impurezas presas dentro do sólido. Entre outros, a recristalização pode ser usada para purificar sais e moléculas orgânicas.
As técnicas de centrifugação e filtragem são aplicáveis à maioria das demandas de preparação de amostras para separar componentes insolúveis do solvente. A filtragem é frequentemente usada em química orgânica para separar compostos cristalizados puros de seu solvente. Também é usado após extrações de líquido sólido em química de produtos naturais ou química analítica. A centrifugação é frequentemente usada para separar misturas de diferentes densidades e como mostrado aqui aplicado à separação de componentes do leite e sal precipitado.
Na bioquímica, a maioria dos processos como proteína, lipídio e isolamento do DNA envolve reações de precipitação, centrifugação e métodos de filtragem para purificar amostras. E embora a maioria desses processos tenham sido totalmente padronizados em kits comerciais, ainda há muito espaço para otimização, já que diferentes moléculas biológicas requerem condições diferentes.
Referências
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Arakawa, T., Timasheff, S.N. Mechanism of Protein Salting In and Salting Out by Divalent Cation Salts: Balance between Hydration and Salt Binding. Biochemistry. 23, 5912-5923 (1984).
Declarações
Nenhum conflito de interesses declarado.
Pular para...
Vídeos desta coleção:

Now Playing
Separação de Misturas por Precipitação
Organic Chemistry
157.6K Visualizações

Introdução à Catálise
Organic Chemistry
34.4K Visualizações

Montagem de um sistema de refluxo para reações químicas aquecidas
Organic Chemistry
167.1K Visualizações

Condução de reações abaixo da temperatura ambiente
Organic Chemistry
70.4K Visualizações

Transferência de Solventes usando Linhas Schlenk
Organic Chemistry
41.6K Visualizações

Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Organic Chemistry
56.1K Visualizações

Preparação de Reagentes e Equipamentos Anidros
Organic Chemistry
79.3K Visualizações

Purificação de Compostos por Recristalização
Organic Chemistry
707.6K Visualizações

Extração sólido-líquido
Organic Chemistry
237.7K Visualizações

Evaporação rotativa para remover solvente
Organic Chemistry
212.8K Visualizações

Destilação Fracionária
Organic Chemistry
334.0K Visualizações

Crescimento de Cristais para Análise de Difração de Raios-X
Organic Chemistry
32.4K Visualizações

Realização de Cromatografia de Camada Fina 1D
Organic Chemistry
289.2K Visualizações

Cromatografia em coluna
Organic Chemistry
359.7K Visualizações

Espectroscopia de ressonância magnética nuclear (NMR)
Organic Chemistry
247.5K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados