Séparation des mélanges par précipitation
Vue d'ensemble
Source : Laboratoire de Dr. Ana J. García-Sáez — Université de Tübingen
La plupart des échantillons d’intérêt sont des mélanges de plusieurs composants différents. Préparation de l’échantillon, une étape clé dans le processus analytique, supprime les interférences susceptibles d’influer sur l’analyse. Par conséquent, développer des techniques de séparation est un effort important non seulement dans les milieux universitaires, mais aussi dans l’industrie.
Une façon de séparer les mélanges est d’utiliser leurs propriétés de solubilité. Dans ce court document, nous allons traiter des solutions aqueuses. (1) concentration ionique de la solution, le pH (2) et (3) lorsque la température dépend de la solubilité d’un composé d’intérêt. En manipulant avec ces trois facteurs, une condition dans laquelle le composé est insoluble peut servir à supprimer le composé d’intérêt du reste de l’échantillon. 1
Principles
Un certain nombre de paramètres peut servir à séparer un échantillon intéressant des impuretés en réduisant sa solubilité et désolidarisé de la solution sous forme de solide, tel qu’illustré à la Figure 1. Tout d’abord, la force ionique de la solution peut changer une solubilité de substances. Cela implique souvent l’ajout de sel supplémentaire (également appelé relargage), ou l’ajout d’une contre-ion, qui forme une espèce moins soluble avec le composé d’intérêt. 2

Figure 1. Les équilibres de solubilité sont affectés par la concentration ionique, le pH et la température. Un composé d’intérêt (jaune) est séparé des impuretés (rouges) en changeant sa solubilité dans un solvant donné.
Le pH d’une solution peut changer la charge nette du composé. À un certain pH, la charge nette devient nulle (également appelé point isoélectrique) et le composé devient moins soluble dans l’eau, finissent par former un solide. La température affecte aussi solubilité, tel qu’une température plus élevée augmente la solubilité des solides.
Le taux de formation solide détermine la pureté relative (Figure 2). En général, le terme précipitation désigne la formation d’un solide à un rythme rapide, produisant ainsi un échantillon amorphe avec certaines impuretés piégés au sein. Ceci est fréquent dans le salage et processus dues aux changements de pH. Quand ce processus est ralenti, les impuretés ne sont pas pris au piège dans l’enceinte et un solide relativement pur est produit. Cette technique est employée dans la recristallisation. Dans ce processus, un composé est dissous dans assez solvant afin d’être juste à son point de saturation à une température élevée. Cela saturé solution est ensuite laisser refroidir lentement. Lorsque la solution refroidit, diminue la solubilité du composant, et le composé excédant la solubilité forme un solide bien ordonné (autrement connu sous forme de cristaux) au lieu d’un solide amorphe. Impuretés dans la solution de ne pas obtenir coincées comme la lenteur du processus permet l’élimination de ces impuretés à la surface du solide avant qu’ils sont pris au piège. 1

La figure 2. Différence entre les précipitations et la recristallisation.
Une fois que le solide a formé (comme un cristal ou un précipité), il doit être séparé du reste du mélange. Filtration est un moyen de les séparer. Ceci emploie un matériau poreux qui inhibe sélectivement le passage de la matière solide, mais pas la solution.
Centrifugation est une autre façon de séparer le précipité du reste du mélange. Centrifugation utilise l’accélération centripète pour séparer les mélanges basés sur leur densité. Depuis le solide est plus dense que la solution aqueuse, les sédiments solides au fond du récipient. Le solide est aussi appelé le culot et la solution aqueuse, le surnageant. Le surnageant peut ensuite être décanté ou extraites à l’aide d’une pipette ou une seringue. Les cristaux sont fragiles et centrifugation n’est souvent pas employée pour les séparer de la solution.
Cette vidéo couvre différentes méthodes de séparation de composés à travers la solide formation (salage, changements de pH et recristallisation) et leur retrait subséquent de la solution aqueuse par filtration ou centrifugation.
Procédure
1. la précipitation de CaCO3
- Préparer 5 mL de 1 M CaCl2.
- Préparer 5 mL 1 M Na2CO3.
- Dans un tube à centrifuger petit (1,5 mL), ajouter 750 µL de CaCl2 et 750 µL de Na2CO3.
- Attendre 2 min pour la réaction de se produire. La solution devrait tourner nuageuse.
- Centrifuger le mélange à 10 000 × g pendant 5 min.
- Décanter le liquide surnageant.
- Ajouter 1 mL d’eau froide dans le culot.
- Resuspendre le culot en mélangeant dans un vortex pour 10 s.
- Centrifuger le mélange à 10 000 × g pendant 5 min.
- Décanter le liquide surnageant.
2. la précipitation des protéines du lait
- Versez le lait dans un bol et ajouter un.
- Lait chaud doucement jusqu'à 40 ° C dans une plaque de cuisson en remuant. Ne pas chauffer à plus de 40 ° C.
- Préparer un 15 % (v/v) d’acide acétique en mélangeant 7,5 mL d’acide acétique et diluer dans l’eau jusqu’à 50 mL.
- Plonger l’électrode d’un pH-mètre dans le lait tiède et surveiller le pH.
- Ajoutez l’acide acétique goutte-à-goutte au lait jusqu'à atteindre un pH de 4,6.
- Filtration du lait
- Flûte d’un morceau de papier filtre et le placer dans un entonnoir.
- Placez l’entonnoir dans une fiole et verser la solution de lait acidifié dans l’entonnoir.
- Que la solution est versée, le papier filtre peut s’obstruer. À l’aide d’un agitateur, agiter la solution et le papier filtre occasionnellement pour déboucher. Si elle n’améliore pas le passage de la solution, changer le filtre en papier.
- Placer un nouveau filtre en papier sur la paillasse et le transfert tout autant de l’humide solide pour le nouveau filtre en papier. Cela devrait absorber plus d’eau du solide.
- Si le nouveau filtre en papier est trop mouillé, continuer à le modifier jusqu'à ce qu’il y a peu d’humidité sur le papier filtre. Appuyez légèrement pour absorber plus d’eau si nécessaire.
- Prendre le solide séché et remettre en suspension dans environ 70 % éthanol. Filtrer le solide à la suite de mesures 2.6.1 à 2.6.5.
- Centrifugation du lait (comme alternative à la filtration)
- Transférer des portions de 50 mL du mélange de tubes à centrifuger de 50 mL.
- Centrifuger à 4 500 × g pendant 10 min, puis décanter le liquide surnageant.
- Ajouter 50 mL d’éthanol à 70 % au culot.
- À l’aide d’un agitateur, resuspendre le culot dans l’éthanol.
- Centrifuger cette suspension après étape 2.7.2.
- Resuspendre le culot dans un tampon pour approfondir l’analyse comme le SDS-PAGE, sinon conserver à 4 ° C.
3. la recristallisation de KCl
- Peser 50 g de KCl dans un erlenmeyer et ajouter 100 mL d’eau
- Faire chauffer le mélange jusqu'à ce que l’eau bout. Veillez à ce que toute la poudre KCl est dissoute. Certaines impuretés ne peuvent pas dissoudre dans l’eau.
- Faire chauffer une autre fiole d’Erlenmeyer (vide) avec le mélange et gardez-le très chaud.
- Placez un entonnoir avec filtre en papier dans le ballon chaud, vide.
- Versez la solution sur le papier filtre pour éliminer les impuretés non dissoutes. Le ballon récepteur est gardé au chaud pour vous assurer qu'aucun changement de température se produire pendant la filtration, sinon qu'un précipité brut formera. Le cas échéant, réchauffez le mélange jusqu'à ce que tous le précipité se dissout.
- Enlever le ballon avec la solution de la chaleur.
- Gardez-le dans un endroit frais dans la chambre et laissez-le refroidir lentement pendant environ 30 minutes, ou jusqu'à ce qu’il n’est donc plus chaud au toucher.
- Une fois refroidi à la température de la pièce, placer le ballon dans un bain de glace pour réduire la température. Alternativement, on peut laisser le ballon à l’intérieur du réfrigérateur ou une salle de contrôle de la température à 4 ° C.
- Cristaux peut être récoltées par filtrage tout comme aux étapes 3,4 – 3,5 (utilisez une fiole et entonnoir à température ambiante).
Résultats
Les équilibres de solubilité est employé dans de nombreux procédés de purification. Calcium peut être retiré de l’eau à l’aide de carbonate de sodium. Le produit de solubilité (Ksp) de CaCO3 est 4,8 × 10-9. Mélanger 1 CaCl2 et 1 M Na2CO3 produit CaCO3 précipité. Le précipité est séparé du reste de la solution en utilisant la centrifugation.
Caséine (une protéine clé dans le lait) a un point isoélectrique à pH 4,6 et formée insoluble caillé à ce pH. Le caillé ont ensuite été séparé du reste de la solution (également appelé lactosérum) à l’aide de filtration ou centrifugation (Figure 3 a). Le caillé a été lavé avec de l’éthanol pour éliminer des phospholipides et autres composés solubles dans l’eau qui ont été également pris au piège dans le caillé. Centrifugation a empêché la perte des protéines mieux que la filtration car il y ont quelques protéines qui collée sur le papier filtre. Les composants sont séparés ont été analysés par SDS-PAGE (Figure 3 b), montrant que la réaction de précipitation séparé la plupart de la caséine de lactosérum. Autres protéines du lait, tels que les globulines, précipitent ainsi que de la caséine. D’autres mesures peuvent être appliquées pour l’isolement des caséines du reste des protéines.
Précipitations élimine les impuretés plus de solide, mais il peut aussi intercepter certaines impuretés dans la matrice. Recristallisation est souvent employée pour purifier davantage un solide (Figure 4). Dans cette expérience, le solide a été mélangé avec un solvant dans lequel le solide n’est pas très soluble. La température du mélange puis accéda au point d’ébullition du solvant et assez solide est ajouté pour saturer le solvant à chaud. Autres impuretés insolubles pourraient alors être retirées via une étape de filtration. La solution d’eau chaude a été ensuite progressivement refroidie à température ambiante et refroidie dans un bain de chambre/glace réfrigérateur/froid. La lenteur du processus a abouti en cristaux au lieu de précipité amorphe. Les impuretés solubles ne sont pas incorporées dans le réseau cristallin et les cristaux qui en résultent sont relativement plus pur que le précipité brut. Les cristaux ont été récoltés puis à l’aide de filtration et la gauche à sécher à l’air (ou dans le vide).
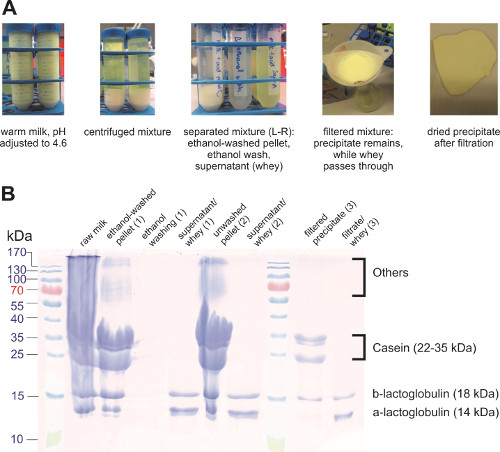
Figure 3. Précipitation des protéines du lait. (A) photos des différentes étapes dans l’isolement de protéine de lait. SDS-PAGE (B) des échantillons différents.

La figure 4. Recristallisation de KCl.
Applications et Résumé
Les réactions de précipitation sont appliquées à nombreux processus de préparation d’échantillon. Comme mentionné précédemment, ils peuvent servir à enlever les ions spécifiques selon leurs équilibres de solubilité ou sels. Ils peuvent également servir pour retirer des mélanges de protéines et autres biomolécules.
Recristallisation est souvent employée pour purifier les plus solides. Ce processus élimine les impuretés piégées dans le solide. Entre autres, la recristallisation peut être utilisée pour purifier les sels et les molécules organiques.
Les techniques de centrifugation et la filtration sont applicables à la plupart des demandes préparation d’échantillon pour séparer les composants insolubles du solvant. Filtration est souvent utilisée en chimie organique pour séparer des composés cristallisés purs de son solvant. Elle est également utilisée après extraction solide-liquide dans la chimie des produits naturels ou de la chimie analytique. Centrifugation est souvent utilisée pour séparer les mélanges de différentes densités et indiquées ici appliqué à la séparation des composants du lait et du sel précipité.
En biochimie, la plupart des processus tels que les protéines, lipides et isolement d’ADN implique des réactions de précipitation, méthodes de centrifugation et la filtration pour purifier les échantillons. Et même si la plupart de ces processus ont été entièrement normalisée dans les kits commerciaux, il n’y a encore beaucoup de place pour l’optimisation, comme des molécules biologiques différents exigent des conditions différentes.
References
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Arakawa, T., Timasheff, S.N. Mechanism of Protein Salting In and Salting Out by Divalent Cation Salts: Balance between Hydration and Salt Binding. Biochemistry. 23, 5912-5923 (1984).
Divulgations
Passer à...
Vidéos de cette collection:

Now Playing
Séparation des mélanges par précipitation
Organic Chemistry
157.3K Vues

Introduction à la catalyse
Organic Chemistry
34.1K Vues

Montage d'un chauffage à reflux
Organic Chemistry
166.7K Vues

Réaliser des réactions en dessous de la température ambiante
Organic Chemistry
70.4K Vues

Transfert de solvants via une rampe à vide (ligne Schlenk)
Organic Chemistry
41.5K Vues

Dégazage des liquides par la technique "cycle geler-pomper-dégeler"
Organic Chemistry
56.0K Vues

Préparation de réactifs anhydres et équipement
Organic Chemistry
79.1K Vues

Purification des composés par recristallisation
Organic Chemistry
706.3K Vues

Extraction solide-liquide
Organic Chemistry
237.4K Vues

Utilisation d'un évaporateur rotatif (ou Rotovap) pour éliminer un solvant
Organic Chemistry
212.6K Vues

Distillation fractionnée
Organic Chemistry
333.5K Vues

Préparation de cristaux pour analyse par diffraction des rayons X
Organic Chemistry
32.3K Vues

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.7K Vues

Chromatographie sur colonne
Organic Chemistry
359.0K Vues

Spectroscopie à résonance magnétique nucléaire (RMN)
Organic Chemistry
247.0K Vues