침전을 통한 혼합물의 분리
Overview
출처: 아나 제이 가르시아-사에즈 박사 연구소 — 튀빙겐 대학교
관심의 대부분의 샘플은 많은 다른 구성 요소의 혼합물이다. 분석 프로세스의 핵심 단계인 샘플 제제는 분석에 영향을 줄 수 있는 간섭을 제거합니다. 따라서 분리 기법을 개발하는 것은 학계뿐만 아니라 산업에서도 중요한 노력입니다.
혼합물을 분리하는 한 가지 방법은 용해도 특성을 사용하는 것입니다. 이 짧은 논문에서는 수성 솔루션을 다룰 것입니다. 관심 있는 화합물의 용해도는 용액의 (1) 이온 강도, (2) pH 및 (3) 온도에 따라 달라집니다. 이러한 세 가지 요인으로 조작함으로써 화합물이 불용성인 상태를 사용하여 나머지 시료로부터 관심 화합물을 제거할 수 있다. 1
Principles
도 1에도시된 바와 같이 여러 매개변수를 사용하여 관심 샘플을 불순물로부터 분리하여 용해도를 줄이고 고체로서 용액에서 제거할 수 있다. 첫째, 용액의 이온 강도를 변경하면 물질 용해도가 변할 수 있습니다. 이것은 종종 여분의 소금의 추가를 포함 (또한 소금 밖으로 소금이라고도 함), 또는 관심의 화합물과 덜 수용성 종을 형성하는 카운터 이온의 추가. 2

그림 1. 용해도 평형은 이온 강도, pH 및 온도에 의해 영향을 받습니다. 관심의 화합물 (노란색)은 주어진 용매에서 용해도를 변경하여 불순물 (빨간색)에서 분리됩니다.
용액의 pH를 변경하면 화합물의 순 전하가 변경될 수 있다. 특정 pH에서, 순 전하는 0 (또한 등산점이라고도 함)이되고 화합물은 물에 덜 용해되어 결국 고체를 형성합니다. 온도는 또한 고체의 용해도가 높아짐에 따라 용해도에 영향을 미칩니다.
고체 형성의 속도는 상대순도(도2)를결정한다. 일반적으로, 용어 강수량은 빠른 속도로 고체의 형성을 말하며, 이에 의해 내에 갇혀 있는 일부 불순물을 가진 무정형 샘플을 생성한다. 이것은 밖으로 염화및 pH 변경 유도 프로세스에서 일반적입니다. 이 과정이 느려지면 불순물이 화합물 내에 갇혀 있지 않으며 상대적으로 순수한 고체가 생성됩니다. 이 기술은 재결정에 사용됩니다. 이 과정에서 화합물은 높은 온도에서 채도 지점에 있을 만큼 충분한 용매에 용해된다. 이러한 포화 솔루션은 천천히 냉각할 수 있습니다. 용액이 냉각됨에 따라 성분의 용해도가 감소하고 용해도를 초과하는 화합물은 비정질 고체 대신 잘 정렬된 고체(그렇지 않으면 결정이라고도 함)를 형성합니다. 느린 과정이 갇혀되기 전에 고체 표면에서 이러한 불순물을 제거 할 수 있기 때문에 용액의 불순물이 갇히지 않습니다. 1

그림 2. 강수량과 재결정의 차이.
고체가 형성되면 (결정또는 침전으로 여부), 혼합물의 나머지 부분에서 분리되어야한다. 여과는 그들을 분리하는 한 가지 방법입니다. 이는 고체 물질의 통과를 선택적으로 억제하지만 용액은 아닌 다공성 물질을 채용한다.
원심 분리는 침전을 혼합물의 나머지 부분과 분리하는 또 다른 방법입니다. 원심 분리는 원심 가속을 사용하여 밀도에 따라 혼합물을 분리합니다. 고체는 수성 용액보다 밀도가 높기 때문에 용기 의 바닥에 있는 고체 침전물입니다. 고체는 펠릿과 수성 용액인 상수제라고도 합니다. 그런 다음 피펫 이나 주사기를 사용하여 체상제물을 탈수하거나 추출할 수 있습니다. 결정은 깨지기 쉽고 원심 분리는 종종 용액에서 분리하기 위해 사용되지 않습니다.
이 비디오는 고체 형성(소금질, pH 변경 및 재결정화)을 통해 화합물을 분리하는 다양한 방법과 여과 또는 원심분리를 통해 수성 용액에서 후속 제거를 포함합니다.
Procedure
1. CaCO3의 강수량
- 1 M CaCl2의5mL을 준비하십시오.
- 5 mL 1 M Na2CO3을준비하십시오.
- 작은 원심분리기 튜브(1.5mL)에서 Na2CO3의CaCl2 및 750 μL750 μL을 추가합니다.
- 반응이 발생할 때까지 2 분 기다립니다. 솔루션이 흐리게 됩니다.
- 혼합물을 10,000 × g에서 5분 동안 원심분리합니다.
- 상체를 장식합니다.
- 펠릿에 차가운 물 1mL를 넣습니다.
- 10s용 소용돌이 믹서에 믹싱하여 펠릿을 다시 놓습니다.
- 혼합물을 10,000 × g에서 5분 동안 원심분리합니다.
- 상체를 장식합니다.
2. 우유 단백질의 강수량
- 우유를 비커에 붓고 저어줍니다.
- 교반 핫 플레이트에 40 °C까지 부드럽게 우유를 따뜻하게. 40 °C 이상 가열하지 마십시오.
- 아세트산 7.5mL를 혼합하고 50mL에 도달하기에 충분한 물에 희석하여 아세트산의 15 %(v/v)를 준비하십시오.
- pH 미터의 전극을 따뜻한 우유에 담그고 pH를 모니터링합니다.
- 4.6의 pH에 도달 할 때까지 우유에 아세트산 드롭 와이즈를 추가합니다.
- 우유 여과
- 필터 용지 한 조각을 플루트하고 깔때기에 놓습니다.
- 깔때기를 플라스크에 넣고 산성 우유 용액을 깔때기에 붓습니다.
- 용액이 부어질 때 필터 용지가 막힐 수 있습니다. 교반 봉을 사용하여 용액을 교반하고 종이를 필터링하여 막힘 해제합니다. 용액의 통과를 개선하지 않으면 필터 용지를 변경합니다.
- 벤치 상단에 새 필터 용지를 놓고 젖은 고체를 새 필터 용지로 옮기습니다. 이것은 고체에서 더 많은 물을 흡수해야합니다.
- 새 필터 용지가 너무 젖으면 필터 용지에 습기가 최소화될 때까지 계속 변경합니다. 필요한 경우 더 많은 물을 흡수하기 위해 가볍게 누릅니다.
- 말린 고체를 가지고 약 70 % 에탄올에서 다시 중단하십시오. 2.6.1 ~ 2.6.5 단계를 따라 고체를 다시 필터링합니다.
- 우유 의 원심 분리 (여과에 대한 대안으로)
- 혼합물의 50mL 부분을 50mL 원심분리기 튜브로 옮기다.
- 원심분리기는 4,500g에서 10분 동안 ×, 그 다음에는 상수체를 추방합니다.
- 펠릿에 50mL 70% 에탄올을 넣습니다.
- 교반 봉을 사용하여 에탄올의 펠릿을 다시 놓습니다.
- 원심 분리기 이 정지 단계 다음 2.7.2.
- SDS-PAGE와 같은 추가 분석을 위해 버퍼에서 펠릿을 다시 일시 중지하고 그렇지 않으면 4 °C에 저장합니다.
3. KCl의 재결정화
- 에렌마이어 플라스크에 KCl 50g의 무게와 100mL의 물을 추가
- 물이 끓을 때까지 혼합물을 가열합니다. 모든 KCl 분말이 용해되었는지 확인합니다. 일부 불순물은 물에 녹지 않을 수 있습니다.
- 다른 (빈) 에를렌마이어 플라스크를 혼합물과 함께 가열하고 매우 따뜻하게 유지합니다.
- 따뜻하고 빈 플라스크에 필터 용지가 있는 깔때기를 놓습니다.
- 녹지 않은 불순물을 제거하기 위해 필터 용지를 통해 용액을 붓습니다. 수신 플라스크는 여과 중에 온도 변화가 발생하지 않도록 따뜻하게 유지되며, 그렇지 않으면 원유 침전물이 형성됩니다. 이 경우 모든 침전이 용해될 때까지 혼합물을 다시 가열합니다.
- 용액을 열에서 제거합니다.
- 방에 시원한 장소에 보관하고 약 30 분 동안 천천히 식히거나 더 이상 따뜻하지 않은 때까지 식힙니다.
- 실온으로 냉각되면 플라스크를 얼음 욕조에 놓아 온도를 더 낮춥니다. 또는, 하나는 4 °C에서 냉장고 또는 온도 제어 방 내부에 플라스크를 떠날 수 있습니다.
- 결정은 3.4-3.5 단계 (실온에서 플라스크와 깔때기를 사용)에서와 같이 필터링하여 수확 할 수 있습니다.
Results
용해도 평형은 많은 정화 공정에 사용됩니다. 탄산나트륨을 사용하여 물에서 칼슘을 제거할 수 있습니다. CaCO3의 용해도제품(KSp)은4.8 × 10-9입니다. 나2 CO3의 CaCl2 M 과 1 M의 혼합 1 M은 CaCO3 침전을 생산했다. 침전은 원심분리를 사용하여 용액의 나머지 부분과 분리되었다.
카제인 (우유의 핵심 단백질)은 pH 4.6에서 동전 점을 가지고 있으며이 pH에서 불용성 커드를 형성합니다. 그런 다음 커드는 여과 또는 원심분리(도3a)를사용하여 나머지 용액(유청이라고도 함)에서 분리하였다. 커드는 에탄올로 세척되어 인지질 및 커드에 갇힌 기타 수용성 화합물을 제거했습니다. 원심 분리는 필터 종이에 붙어 있는 몇몇 단백질이 있었기 때문에 여과 보다는 더 나은 단백질의 손실을 방지했습니다. 분리된 성분은 SDS-PAGE(도3b)를사용하여 분석되었으며, 강수 반응이 대부분의 카제인을 유청으로부터 분리한 것을 보여 주어. 글로불린과 같은 다른 우유 단백질은 카제인과 함께 침전시됩니다. 추가 단계는 단백질의 나머지 부분에서 카제인을 격리하기 위해 적용될 수 있습니다.
강수량은 고체에서 대부분의 불순물을 제거하지만 매트릭스 내에서 일부 불순물을 트랩 할 수도 있습니다. 재결정화는 종종 고체(도4)를더 정화하기 위해 사용된다. 이 실험에서, 고체는 고체가 용해되지 않은 용매와 혼합되었다. 혼합물의 온도는 용매의 비등점으로 상승하였고, 뜨거운 용매를 포화시키기에 충분한 고체가 첨가되었다. 그 때 여과 단계를 통해 다른 불용성 불순물을 제거할 수 있습니다. 뜨거운 용액은 점차 실온으로 냉각되고 냉장고 / 차가운 방 / 얼음 욕조에서 더 냉각되었습니다. 느린 과정은 비정질 침전물 대신 결정의 결과. 수용성 불순물이 결정 격자에 통합되지 않았고 그 결과 결정은 원유 침전물보다 상대적으로 순수하였다. 결정은 여과를 사용하여 수확하고 공기 (또는 진공)에서 건조하기 위해 떠났다.
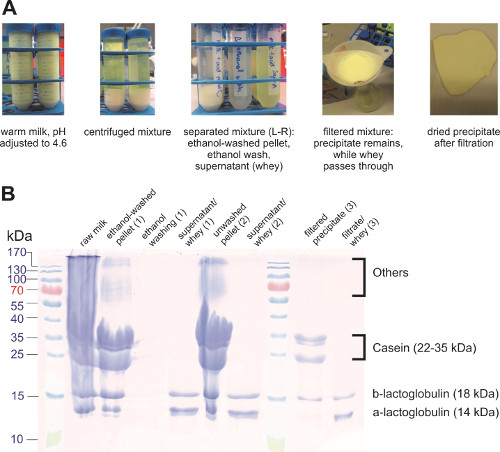
그림 3. 우유 단백질의 강수량. (A) 우유 단백질 절연에 다른 단계의 사진. (B) 상이한 샘플의 SDS-PAGE.

그림 4. KCl의 재결정화.
Application and Summary
강수 량 반응은 많은 샘플 준비 과정에 적용됩니다. 앞에서 언급했듯이 용해도 평형에 따라 염또는 특정 이온을 제거하는 데 사용할 수 있습니다. 그(것)들은 또한 혼합물에서 단백질 및 그밖 생체 분자를 제거하기 위하여 이용될 수 있습니다.
재결정화는 종종 고체를 더 정화하기 위해 사용됩니다. 이 프로세스는 고체 내의 갇힌 불순물을 제거합니다. 그 중에서도 재결정화는 소금과 유기 분자를 정화하는 데 사용될 수 있습니다.
원심분리 및 여과 기술은 용매로부터 불용성 성분을 분리하기 위해 대부분의 샘플 준비 요구에 적용됩니다. 여과는 종종 용매에서 순수한 결정화 화합물을 분리하기 위해 유기 화학에 사용됩니다. 또한 천연 제품 화학 또는 분석 화학에서 고체 액체 추출 후 사용됩니다. 원심 분리는 종종 다른 밀도의 혼합물을 분리하는 데 사용되며 여기에 표시된 바와 같이 우유 성분과 침전 된 소금의 분리에 적용됩니다.
생화학에서, 단백질, 지질 및 DNA 격리와 같은 대부분의 프로세스는 샘플을 정화하기 위하여 강수 반응, 원심분리 및 여과 방법을 관련시킵니다. 그리고 이러한 프로세스의 대부분은 완전히 상업 키트로 표준화 되었지만, 다른 생물학적 분자는 다른 조건을 필요로 하기 때문에, 최적화를 위한 여지가 아직도 많이 있습니다.
References
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Arakawa, T., Timasheff, S.N. Mechanism of Protein Salting In and Salting Out by Divalent Cation Salts: Balance between Hydration and Salt Binding. Biochemistry. 23, 5912-5923 (1984).
Disclosures
이해 상충이 선언되지 않았습니다.
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
침전을 통한 혼합물의 분리
Organic Chemistry
157.2K Views

촉매 소개
Organic Chemistry
34.1K Views

가열된 화학 반응을 위한 역류 시스템의 조립
Organic Chemistry
166.3K Views

실온 이하의 반응 수행
Organic Chemistry
70.3K Views

솔벤트의 슐렌크 라인 전송
Organic Chemistry
41.5K Views

동결 펌프 해동 사이클링으로 액체 를 탈기
Organic Chemistry
55.9K Views

무수성 시약 및 장비 준비
Organic Chemistry
79.1K Views

재결정화로 화합물 정화
Organic Chemistry
705.3K Views

고체 액체 추출
Organic Chemistry
237.1K Views

용매제거를 위한 로타리 증발
Organic Chemistry
212.3K Views

분수 증류
Organic Chemistry
332.8K Views

X선 회절 분석을 위한 커지는 결정
Organic Chemistry
32.3K Views

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.4K Views

열 크로마토그래피
Organic Chemistry
358.4K Views

핵 자기 공명 (NMR) 분광기
Organic Chemistry
246.7K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유