Voltametria Cíclica (CV)
Visão Geral
Fonte: Laboratório da Dra.
Um experimento de Voltammetry Cíclica (CV) envolve a varredura de uma série de tensões potenciais enquanto mede a corrente. No experimento cv, o potencial de um eletrodo estacionário imerso é escaneado a partir de um potencial inicial predeterminado para um valor final (chamado de potencial de comutação) e, em seguida, a varredura reversa é obtida. Isso dá uma varredura 'cíclica' de potenciais e a curva atual versus potencial derivada dos dados é chamada de ciclomograma cíclico. A primeira varredura é chamada de "varredura para a frente" e a onda de retorno é chamada de "varredura reversa". Os extremos potenciais são denominados de "janela de varredura". A magnitude das correntes de redução e oxidação e a forma dos voltammogramas são altamente dependentes da concentração de analitos, taxas de varredura e condições experimentais. Ao variar esses fatores, a voltametria cíclica pode produzir informações sobre a estabilidade do estado de oxidação metálica de transição na forma complexa, reversibilidade das reações de transferência de elétrons e informações sobre a reatividade. Este vídeo explicará a configuração básica para um experimento de voltametria cíclica, incluindo preparação de analitos e configuração da célula eletroquímica. Um simples experimento de voltammemetria cíclica será apresentado.
Princípios
Em um experimento de voltametria cíclica, o potencial aplicado entre o eletrodo de referência e o eletrodo de trabalho aumenta de forma linear com o tempo (taxa de varredura (V/s). Concomitantemente, a corrente é medida entre o eletrodo de trabalho e contador (ou auxiliar) resultando em dados que são traçados como a corrente (i) vs. potencial(E). Os eventos de redução e oxidação são observados e atribuídos nas parcelas resultantes. Eventos de redução ocorrem em tensões potenciais específicas de analitos onde a reação M+n + e- → M+n-1 (M = metal) é energeticamente favorecida (conhecida como potencial de redução) e medida pelo aumento dos valores atuais. A corrente aumentará à medida que o potencial de tensão atingir o potencial de redução do analito, mas depois cai à medida que a taxa máxima de transferência de massa foi atingida. A corrente desce apenas para alcançar o equilíbrio a algum valor constante. Reações de oxidação (M+n → M+n+1 + e- )também podem ser observadas como uma diminuição dos valores atuais em potenciais que favorecem energicamente a perda de elétrons(s).
Os voltammogramas resultantes são então analisados e são observados os dados potenciais (Ep) e atuais (Ip)para eventos de redução e oxidação em cada condição experimental de configuração. Essas informações podem ser utilizadas para avaliar a reversibilidade dos eventos de redução e oxidação acoplado. Como observado acima dos potenciais de pico (Epa e Epc) e as correntes de pico (ipc e ipa) são os parâmetros fundamentais utilizados para caracterizar um casal ou evento redox. Durante um processo reversível de redox, as formas oxidadas e reduzidas de um composto estão em equilíbrio na superfície do eletrodo. A equação de Nernst descreve a relação entre potencial e a razão de equilíbrio, ([R] / [O])x=0.
 (1)
(1)
Onde, 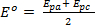 é chamado o potencial formal da reação e leva em conta os coeficientes de atividade e outros fatores experimentais.
é chamado o potencial formal da reação e leva em conta os coeficientes de atividade e outros fatores experimentais.
Especificamente, o pico de corrente de uma reação reversível é dado por:
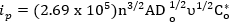 (2)
(2)
onde, ip é corrente máxima em amperes, n é o número de elétrons envolvidos, A é a área do eletrodo no cm2, Do é a constante de difusão (cm2/s), v é a taxa de varredura (V/s) e Co* é a concentração a granel (mols/cm3). A constante de difusão pode ser medida usando experimentos mais extensos detalhados em outros lugares e não são o foco deste vídeo1. No entanto, diretrizes mais básicas podem ser utilizadas para avaliar a reversibilidade de um sistema1. Critérios para um sistema totalmente reversível1:
-
 a várias taxas de varredura n = número de elétrons
a várias taxas de varredura n = número de elétrons -
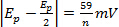 a várias taxas de varredura
a várias taxas de varredura - | ipa/ipc| = 1 a várias taxas de digitalização
- Ep é independente de vv = taxa de varredura
- em potenciais além de Ep, i-2
 t
t
Testes diagnósticos simples para definir um sistema totalmente irreversível a 25 °C são:
- Nenhum pico reverso (isso se refere à irreversibilidade química, mas não necessariamente à irreversibilidade da transferência de elétrons)
-
Epc muda
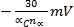 para cada década aumento em v (irreversibilidade eletroquímica)
para cada década aumento em v (irreversibilidade eletroquímica) 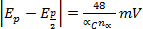
Finalmente, os testes diagnósticos para definição de um sistema quase reversível são:


- Epc muda negativamente com o aumento v
A posição dos eventos de redução e/ou oxidação pode ser usada para inferir informações sobre a natureza eletrônica dos complexos metálicos de transição e os efeitos sobre ligantes como doadores. Por exemplo, o potencial de redução fe+3/+2 de derivados ferrocenos é muito sensível ao ambiente eletrônico fornecido pelo conjunto de ligantes cyclopentadienyl (Cp). Doação de elétrons (retirada) Os substitutos cp aumentam (diminuem) a densidade eletrônica no centro de ferro e mudam o potencial redox para valores negativos (positivos) em relação ao Fc.
Neste protocolo, a ferrocena será usada como exemplo. Condições experimentais como solvente, escolha de eletrólitos e o alcance potencial estudado (janela de varredura) são em grande parte ditadas pela solubilidade de analitos e condições experimentais. Os usuários são encorajados a consultar textos relevantes como Bard e Faulkner1 para saber mais.
Procedimento
1. Preparação da Solução de Eletrólitos
- Prepare uma solução de estoque de eletrólitos (10 mL) composta de 0,1 M [Bu4N][BF4] em CH3CN.
- Coloque a solução de eletrólito no frasco eletroquímico, adicione uma pequena barra de mexida e coloque a tampa no frasco, conforme mostrado na Figura 1.
- Verifique se o chumbo nitrogênio está na solução de eletrólitos. Mexa e desgase a solução de eletrólitos com um fluxo suave de gás N2 seco (~10 min) para remover o oxigênio molecular ativo redox.
- Durante a etapa 1.3, insira cuidadosamente o eletrodo de trabalho (por exemplo, carbono vidrado), contador (Pt) e eletrodos de referência (Ag/AgNO3) na parte superior da célula Teflon. Conectar o suporte da célula leva ao eletrodo apropriado.

Figura 1. Instalação de uma célula eletroquímica.
2. Obtenção de uma varredura de antecedentes
- Defina as condições experimentais para o solvente. Para acetonitrila, a janela de varredura é tipicamente +2.000 mV – -2.000 mV.
- Execute e salve os momentos da solução eletrólito a uma série de taxas de varredura (por exemplo, 20 mV/s, 100 mV/s e/ou 300 mV/s).
- Verifique a varredura resultante para garantir que não haja impurezas na solução de eletrólitos ou oxigênio restante. Um sistema limpo não terá eventos redox. Se a configuração estiver contaminada, os eletrodos e vidros precisarão ser limpos e a solução de eletrólitos refeita utilizando componentes limpos.
3. Preparação da Solução Analyte
- Combine o analito (~2-5 mM, concentração final) de interesse com a solução de eletrólitos preparada acima.
- Verifique se o chumbo nitrogênio está na solução de eletrólitos. Mexa e desgase a solução de analito/eletrólito com um fluxo suave de gás N2 seco (~10 min) para remover o oxigênio molecular ativo redox.
4. Voltammetry Cíclica de Analyte
- Realize vários experimentos de voltammograma cíclico a taxas de varredura de 20 mV – 1.000 mV (dependendo das capacidades do suporte celular). Inicie cada varredura usando o potencial de circuito aberto calculado.
- Metodicamente varia a direção de varredura [(+ para –) e (- para +)) e a janela de varredura para isolar os eventos de interesse da redox. O voltammograma deve sempre começar a partir de corrente zero (circuito aberto). Ferroceno (Fc) sofre uma reação de oxidação ao ferrocênio (Fc+).
- Muitos grupos padronizam dados para o casal Fc/Fc+ redox. Nesta prática, ~2 mg de Fc são adicionados à solução analito e a etapa 4.2 é repetida para fins de referência. Na análise dos dados, todos os espectros são normalizados para o casal Fc/Fc+ definido para 0,00 V. Uma tabela de potenciais de redução normalizada está disponível2.
5. Limpeza de Eletrodos e células eletroquímicas
- Desessocupe cuidadosamente e remova cada eletrodo da célula eletroquímica.
- Enxágüe o eletrodo de referência com acetonitrilo e seque com um Kimwipe. Armazenar em solução de armazenamento de eletrodos de referência.
- Limpe suavemente o eletrodo de trabalho e contra-ataque de acordo com as diretrizes dos fabricantes (por exemplo, BASi: http://www.basinc.com/mans/pguide.pdf) para remover os produtos de reação redox que se acumulam durante alguns experimentos.
Resultados
Foi realizada uma varredura cv de ferrocene a 300 mV/s em acetonitrila e o voltammograma correspondente é mostrado na Figura 2.

O ΔE pode ser derivado dos dados na Figura 2 com base na diferença entre Epa e Epc.
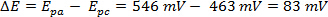
Os voltamogramas cíclicos sobrepostos na Figura 3 representam experimentos consecutivos realizados no mesmo sistema em diferentes taxas de varredura. Como observado acima, uma parcela linear de Ip vs. v1/2 (inset na Figura 3) mostra que a reação é controlada por difusão.
A posição do evento E1/2 ou redox (Epa ou Epc) pode ser usada para determinar os efeitos que o ligante tem no centro de metal ativo redox fornecendo a resposta eletroquímica. A Figura 4 mostra uma série de congêneres baseados em ferrocenos com substituições variadas no anel Cp. Como mostrado na Figura 5,o elétron que retira halide resulta no valor E1/2 deste complexo a ser deslocado para potenciais mais positivos porque a forma oxidada é desestabilizada pelo ligante de retirada de elétrons. Os grupos de metila que doam elétrons do composto C resultam no E1/2 para mudar para potenciais mais negativos à medida que a espécie oxidada é estabilizada.

Figura 2. Uma varredura cv de ferrocene a 150 mV/s em acetonitrila. Clique aqui para ver uma versão maior desta figura.

Figura 3. Um composto contendo cobalto que dá origem a um evento de redução. O inset mostra uma correlação linear entre ip e v1/2. Por favorclique aqui para ver uma versão maior desta figura.

Figura 4. Uma série de compostos à base de ferroceno. Clique aqui para ver uma versão maior desta figura.
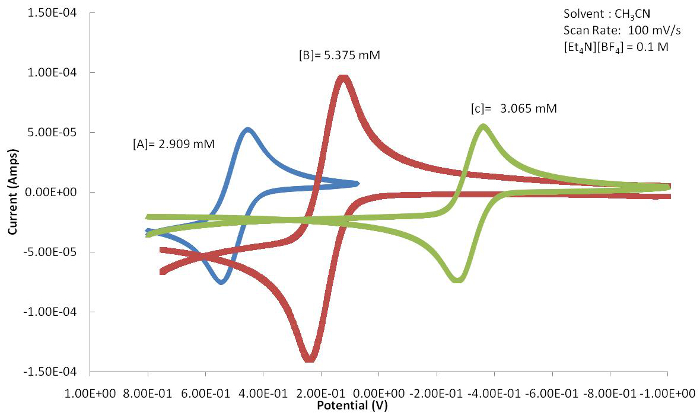
Figura 5. Os ciclogramas cíclicos resultantes de A-C (Figura 4) mostram uma mudança acentuada no E1/2 devido aos efeitos de ligantes eletrônicos ligados ao centro metálico. Por favor, clique aqui para ver uma versão maior desta figura.
Referências
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).
Tags
Pular para...
Vídeos desta coleção:

Now Playing
Voltametria Cíclica (CV)
Analytical Chemistry
124.9K Visualizações

Preparação da Amostra para Caracterização Analítica
Analytical Chemistry
84.6K Visualizações

Normas Internas
Analytical Chemistry
204.6K Visualizações

Método de adição de padrão
Analytical Chemistry
319.8K Visualizações

Curvas de calibração
Analytical Chemistry
796.0K Visualizações

Espectroscopia ultravioleta-visível (UV-Vis)
Analytical Chemistry
622.9K Visualizações

Espectroscopia raman para análise química
Analytical Chemistry
51.2K Visualizações

Fluorescência de raios X (XRF)
Analytical Chemistry
25.4K Visualizações

Cromatografia gasosa (GC) com detecção por ionização em chama
Analytical Chemistry
281.7K Visualizações

Cromatografia Líquida de Alta Eficiência (HPLC)
Analytical Chemistry
384.0K Visualizações

Cromatografia de troca iônica
Analytical Chemistry
264.3K Visualizações

Eletroforese Capilar (CE)
Analytical Chemistry
93.7K Visualizações

Introdução à Espectrometria de Massa
Analytical Chemistry
112.2K Visualizações

Microscopia Eletrônica de Varredura (MEV)
Analytical Chemistry
87.1K Visualizações

Medições eletroquímicas de catalisadores suportados usando um potenciostato/galvanostato
Analytical Chemistry
51.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados