וולטמטריה מחזורית (קורות)
Overview
מקור: המעבדה של ד"ר קיילה גרין — האוניברסיטה הנוצרית בטקסס
ניסוי וולטמטריה מחזורי (CV) כרוך בסריקה של מגוון מתחים פוטנציאליים תוך מדידת זרם. בניסוי קורות החומרים החשמלי, הפוטנציאל של אלקטרודה שקועה ונייחת נסרק מפוטנציאל התחלה קבוע מראש לערך סופי (הנקרא פוטנציאל המיתוג) ולאחר מכן מתקבלת הסריקה ההפוכה. זה נותן סריקה 'מחזורית' של פוטנציאל והעקומה הנוכחית לעומת הפוטנציאלית הנגזרת מהנתונים נקראת וולטמוגרמה מחזורית. הסריקה הראשונה נקראת 'סריקה קדימה' וגל החזרה נקרא 'סריקה הפוכה'. הקיצוניות הפוטנציאלית מכונה "חלון הסריקה". סדר הגודל של זרמי הפחתה וחמצון וצורת הווולטמוגרמות תלויים מאוד בריכוז הניתוח, שיעורי הסריקה והתנאים הניסיוניים. על ידי שינוי גורמים אלה, voltammetry מחזורי יכול להניב מידע לגבי היציבות של מצב חמצון מתכת המעבר בצורה המורכבת, הפיך של תגובות העברת אלקטרונים, ומידע לגבי תגובתיות. וידאו זה יסביר את ההתקנה הבסיסית לניסוי וולטמטריה מחזורי כולל הכנת ניתוח והקמת התא האלקטרוכימי. ניסוי וולטמטריה מחזורי פשוט יוצג.
Principles
בניסוי וולטמטריה מחזורי הפוטנציאל המיושם בין אלקטרודה הייחוס לבין אלקטרודה עובדת עולה בצורה ליניארית עם הזמן (קצב סריקה (V /s)). במקביל, הזרם נמדד בין האלקטרודה העובדת לבין המונה (או העזר) וכתוצאה מכך נתונים המותווים כזרם (i) לעומת פוטנציאל (E). אירועי הפחתה וחמצון נצפים ומוקצים בחלקות המתקבלות. אירועי הפחתה מתרחשים במתחים פוטנציאליים ספציפיים לנתח שבו התגובה M+n + e- → M+n-1 (M = מתכת) הוא מועדף אנרגטית (המכונה פוטנציאל הפחתה) ונמדד על ידי הגדלת ערכי הזרם. הזרם יגדל ככל שפוטנציאל המתח יגיע לפוטנציאל ההפחתה של הניתוח, אך לאחר מכן ייפול ככל שהקצב המרבי של העברת המסה הושג. הזרם יורד רק כדי להגיע לשיווי משקל בערך קבוע כלשהו. תגובות חמצון (M+n → M+n+1 + e-) ניתן לראות גם כירידה בערכים הנוכחיים בפוטנציאלים המעדיפים אנרגטית את אובדן האלקטרונים.
לאחר מכן מנתחים את הוולטמוגרמות המתקבלות והנתונים הפוטנציאליים (Ep) והנתונים הנוכחיים (Ip) לאירועי הפחתה וחמצון בכל תנאי ניסוי של התקנה נרשמים. מידע זה יכול להיות מנוצל כדי להעריך את הפיך של אירועי הפחתה חמצון מצמידים. כפי שצוין מעל פוטנציאל השיא (Epa ו- Epc) וזרמי השיא (ipc ו- ipa) הם הפרמטרים הבסיסיים המשמשים לאפיון זוג או אירוע redox. במהלך תהליך redox הפיך, צורות מחומצנות ומופחתות של תרכובת נמצאות בשיווי משקל על פני השטח האלקטרודה. משוואת נרנסט מתארת את הקשר בין פוטנציאל ליחס שיווי משקל, ([R] / [O])x = 0.
 (1)
(1)
איפה, 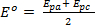 נקרא הפוטנציאל הפורמלי של התגובה ולוקח בחשבון את מקדמי הפעילות וגורמים ניסיוניים אחרים.
נקרא הפוטנציאל הפורמלי של התגובה ולוקח בחשבון את מקדמי הפעילות וגורמים ניסיוניים אחרים.
באופן ספציפי, זרם השיא של תגובה הפיכה ניתן על ידי:
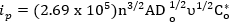 (2)
(2)
כאשר, ip הוא זרם שיא באמפרים, n הוא מספר האלקטרונים המעורבים, A הוא האזור של האלקטרודה בס"מ2, Do הוא קבוע דיפוזיה (ס"מ2/ s), v הוא קצב הסריקה (V / s) ו- Co* הוא הריכוז בתפזורת (מולים / ס"מ3). קבוע הדיפוזיה ניתן למדוד באמצעות ניסויים נרחבים יותר המפורטים במקומות אחרים ואינם המוקד של וידאו זה1. עם זאת, ניתן להשתמש בהנחיות בסיסיות יותר להערכת הפיך של מערכת1. קריטריונים למערכת הפיכה לחלוטין1:
-
 בקצבי סריקה שונים n = מספר האלקטרונים
בקצבי סריקה שונים n = מספר האלקטרונים -
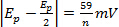 בקצבי סריקה שונים
בקצבי סריקה שונים - | ipa/ipc| = 1 בקצבי סריקה שונים
- Ep אינו תלוי v= קצב סריקה
- בפוטנציאלים מעבר ל- Ep, i-2
 t
t
בדיקות אבחון פשוטות להגדרת מערכת בלתי הפיכה לחלוטין ב 25 °C (70 °F) הן:
- אין פסגה הפוכה (הכוונה לאי-הפיכות כימית, אך לא בהכרח לבלתי הפיך להעברת אלקטרונים)
-
Epc משמרות
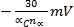 עבור כל עשור עלייה v (הפיכה אלקטרוכימית)
עבור כל עשור עלייה v (הפיכה אלקטרוכימית) 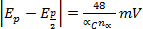
לבסוף, בדיקות אבחון להגדרת מערכת מעין הפיכה הן:


- מחשב E משתנה לרעה עם הגדלת v
ניתן להשתמש במיקום אירועי ההפחתה ו/או החמצון כדי להסיק מידע על האופי האלקטרוני של מתחמי מתכת המעבר וההשפעות על ליגנדים כתורמים. לדוגמה, פוטנציאל הפחתה Fe+3/+2 של נגזרות פרוקן רגיש מאוד לסביבה האלקטרונית המסופקת על ידי ערכת ליגנד ציקלופנטדיניל (Cp). אלקטרון תורם (משיכה) Cp מחליף להגדיל (להקטין) את צפיפות האלקטרונים במרכז הברזל ולהסיט את פוטנציאל redox לערכים שליליים (חיוביים) ביחס Fc.
בפרוטוקול זה פרוקן ישמש כדוגמה. תנאי ניסוי כגון ממס, בחירת אלקטרוליטים, ואת הטווח הפוטנציאלי נחקר (חלון סריקה) מוכתבים במידה רבה על ידי מסיסות ניתוח ותנאי ניסוי. מומלץ למשתמשים להתייעץ עם טקסטים רלוונטיים כגון בארד ופוקנר1 כדי לקבל מידע נוסף.
Procedure
1. הכנת פתרון אלקטרוליטים
- הכן פתרון מלאי אלקטרוליטים (10 מ"ל) המורכב מ- 0.1 M [Bu4N][BF4]ב- CH3CN.
- הניחו את תמיסת האלקטרולייט בוויאל האלקטרוכימי, הוסיפו מוט מוקפץ קטן והנחו את המכסה על גבי המצוין כפי שמוצג באיור 1.
- בדוק כדי לוודא כי עופרת החנקן הוא בתמיסת אלקטרוליט. מערבבים ומוציאים את תמיסת האלקטרוליט עם זרם עדין של גז N2 יבש (~10 דקות) להסרת חמצן מולקולרי פעיל של Redox.
- במהלך שלב 1.3, הכנס בזהירות את האלקטרודה העובדת (למשל פחמן מזוגג), מונה (Pt) ואלקטרודות התייחסות (Ag / AgNO3) לראש תא הטפלון. חבר את מעמד התא מוביל לאלקטרודה המתאימה.

איור 1. התקנה של תא אלקטרוכימי.
2. קבלת סריקת רקע
- הגדר את תנאי הניסוי עבור הממס. עבור acetonitrile, חלון הסריקה הוא בדרך כלל +2,000 mV – -2,000 mV.
- הפעל ולשמור וולטמוגרמות של פתרון אלקטרוליטים בטווח של קצבי סריקה (למשל 20 mV/s, 100 mV/s, ו/או 300 mV/s).
- בדוק את הסריקה המתקבלת כדי לוודא שאין זיהומים בתמיסת האלקטרולייט או בחמצן שנותר. למערכת נקייה לא יהיו אירועי redox. אם ההתקנה מזוהמת, האלקטרודות וכלי הזכוכית יצטרכו לנקות ופתרון אלקטרוליטים מחדש באמצעות רכיבים נקיים.
3. הכנת פתרון ניתוח
- שלב את הניתוח (~ 2-5 mM, ריכוז סופי) של עניין עם פתרון אלקטרוליט מוכן לעיל.
- בדוק כדי לוודא כי עופרת החנקן הוא בתמיסת אלקטרוליט. מערבבים ומערבבים את תמיסת הניתוח/אלקטרוליט עם זרם עדין של גז N2 יבש (כ-10 דקות) להסרת חמצן מולקולרי פעיל.
4. וולטמטריה מחזורית של אנליטי
- בצע מספר ניסויי וולטמוגרמה מחזורית בקצבי סריקה של 20 mV – 1,000 mV (תלוי ביכולות מעמד התא). התחל כל סריקה באמצעות פוטנציאל המעגל הפתוח המחושב.
- שנה באופן שיטתי את כיוון הסריקה [(+ ל-–) ו (– ל-+)] ואת חלון הסריקה כדי לבודד אירועי redox בעלי עניין. וולטמוגרמה צריך תמיד להתחיל מזרם אפס (מעגל פתוח). פרוקן (Fc) עובר תגובת חמצון לפרוקניום (Fc+).
- קבוצות רבות לתקנן נתונים לזוג Fc /Fc+ redox. בפרקטיקה זו, ~ 2 מ"ג של Fc מתווספים לפתרון הניתוח ושלב 4.2 חוזר על עצמו למטרות הפניה. בניתוח נתונים, כל הספקטרום מנורמל ל- Fc/Fc+ זוג המוגדר ל- 0.00 V. טבלה של פוטנציאל הפחתה מנורמל זמינה2.
5. ניקוי אלקטרודות והתא האלקטרוכימי
- בזהירות לבטל ולהסיר כל אלקטרודה מהתא האלקטרוכימי.
- לשטוף את אלקטרודה הייחוס עם acetonitrile ויבש עם Kimwipe. יש לאחסן בפתרון אחסון אלקטרודות ייחוס.
- נקה בעדינות את האלקטרודה העובדת והנגדית בהתאם להנחיות היצרנים (למשל BASi: http://www.basinc.com/mans/pguide.pdf) כדי להסיר את מוצרי התגובה האדומים המצטברים במהלך כמה ניסויים.
Results
סריקת קורות רנטגן של פרוקן במהירות של 300 mV/s באצטוניטרייל בוצעה והוולטאמוגרמה המתאימה מוצגת באיור 2.

ניתן להפיק את ה- ΔE מהנתונים באיור 2 בהתבסס על ההבדל בין Epa למחשבאלקטרוני.
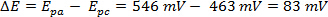
הוולטמוגרמות המחזוריות שבראשן איור 3 מייצגות ניסויים רצופים המבוצעים באותה מערכת בקצבי סריקה שונים. כפי שצוין לעיל, עלילה ליניארית של Ip לעומת v1/2 (inset באיור 3) מראה כי התגובה נשלטת דיפוזיה.
המיקום של E1/2 או redox אירוע (Epa או Epc) ניתן להשתמש כדי לקבוע את ההשפעות שיש לליגנד על מרכז המתכת הפעיל redox המספק את התגובה האלקטרוכימית. איור 4 מציג סדרה של חביבים מבוססי פרוקן עם תחליפים שונים בטבעת Cp. כפי שניתן לראות באיור 5, האליד הנסוג של האליד גורם לערך E1/2 של קומפלקס זה לעבור לפוטנציאל חיובי יותר מכיוון שהצורה החמוצה מתערערת על ידי הליבנד הנסוג של האלקטרונים. האלקטרון התורם קבוצות מתיל של תרכובת C לגרום E1/2 לעבור לפוטנציאלים שליליים יותר כמו המינים החמומצנים מיוצב.

איור 2. סריקת קורות קורות עסקים של פרוקן במהירות של 150 mV/s באצטוניטרייל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3. תרכובת המכילה קובלט שמעוררת אירוע הפחתה אחד. ה- Inset מציג מתאם ליניארי בין ip ל- v1/2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4. סדרה של תרכובות מבוססות פרוקן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
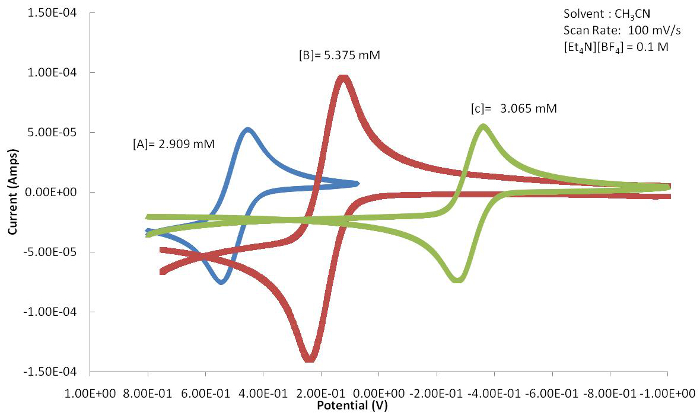
איור 5. הוולטמוגרמות המחזוריות של A-C (איור 4) מציגות שינוי ניכר ב- E1/2 בשל אפקטי הליגנד האלקטרוניים המצורפים למרכז המתכת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
References
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).
Tags
Skip to...
Videos from this collection:

Now Playing
וולטמטריה מחזורית (קורות)
Analytical Chemistry
125.0K Views

הכנה לדוגמה לאפיון אנליטי
Analytical Chemistry
84.6K Views

תקנים פנימיים
Analytical Chemistry
204.7K Views

שיטת התוספת הסטנדרטית
Analytical Chemistry
319.8K Views

עקומות כיול
Analytical Chemistry
796.2K Views

ספקטרוסקופיה אולטרה סגולה (UV-Vis)
Analytical Chemistry
623.0K Views

רמאן ספקטרוסקופיה לניתוח כימי
Analytical Chemistry
51.2K Views

פלואורסצנטיות של קרני רנטגן (XRF)
Analytical Chemistry
25.4K Views

כרומטוגרפיה של גז (GC) עם גילוי יינון להבה
Analytical Chemistry
281.8K Views

כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC)
Analytical Chemistry
384.1K Views

כרומטוגרפיה של חילופי יונג
Analytical Chemistry
264.4K Views

אלקטרופורזה נימית (CE)
Analytical Chemistry
93.7K Views

מבוא לספקטרומטריית מסה
Analytical Chemistry
112.2K Views

סריקת מיקרוסקופיית אלקטרונים (SEM)
Analytical Chemistry
87.1K Views

מדידות אלקטרוכימיות של זרזים נתמכים באמצעות פוטנציוסטט /גלוונוסטאט
Analytical Chemistry
51.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved