Voltammetria ciclica
Panoramica
Fonte: Laboratorio della dott.à 18.0. Kayla Green — Texas Christian University
Un esperimento di voltammetria ciclica (CV) prevede la scansione di una gamma di tensioni potenziali durante la misurazione della corrente. Nell'esperimento CV, il potenziale di un elettrodo stazionario immerso viene scansionato da un potenziale iniziale predeterminato a un valore finale (chiamato potenziale di commutazione) e quindi si ottiene la scansione inversa. Questo dà una scansione "ciclica" dei potenziali e la curva corrente vs potenziale derivata dai dati è chiamata voltammogramma ciclico. La prima sweep è chiamata "scansione in avanti" e l'onda di ritorno è chiamata "scansione inversa". I potenziali estremi sono definiti "finestra di scansione". L'entità delle correnti di riduzione e ossidazione e la forma dei voltammogrammi dipendono fortemente dalla concentrazione di analiti, dai tassi di scansione e dalle condizioni sperimentali. Variando questi fattori, la voltammetria ciclica può fornire informazioni sulla stabilità dello stato di ossidazione dei metalli di transizione nella forma complessata, sulla reversibilità delle reazioni di trasferimento di elettroni e sulle informazioni relative alla reattività. Questo video spiegherà la configurazione di base per un esperimento di voltammetria ciclica che include la preparazione dell'analita e la configurazione della cella elettrochimica. Verrà presentato un semplice esperimento di voltammetria ciclica.
Principi
In un esperimento di voltammetria ciclica il potenziale applicato tra l'elettrodo di riferimento e l'elettrodo di lavoro aumenta in modo lineare con il tempo (velocità di scansione (V/s)). Contemporaneamente, la corrente viene misurata tra l'elettrodo funzionante e contatore (o ausiliario) risultando in dati che vengono tracciati come corrente (i) vs potenziale (E). Gli eventi di riduzione e ossidazione sono osservati e assegnati nei grafici risultanti. Gli eventi di riduzione si verificano a tensioni potenziali specifiche dell'analita in cui la reazione M+n + e- → M+n-1 (M = metallo) è energeticamente favorita (nota come potenziale di riduzione) e misurata aumentando i valori di corrente. La corrente aumenterà man mano che il potenziale di tensione raggiungerà il potenziale di riduzione dell'analita, ma poi cadrà quando è stata raggiunta la velocità massima di trasferimento di massa. La corrente scende solo per raggiungere l'equilibrio a un certo valore costante. Le reazioni di ossidazione (M+n → M+n+1 + e-) possono anche essere osservate come una diminuzione dei valori di corrente a potenziali che favoriscono energeticamente la perdita di elettroni.
I voltammogrammi risultanti vengono quindi analizzati e vengono annotati i dati potenziali (Ep) e correnti (Ip) sia per gli eventi di riduzione che di ossidazione in ciascuna condizione sperimentale di configurazione. Queste informazioni possono essere utilizzate per valutare la reversibilità degli eventi di riduzione e ossidazione accoppiati. Come notato sopra i potenziali di picco (Epa ed Epc) e le correnti di picco (ipc e ipa) sono i parametri fondamentali utilizzati per caratterizzare una coppia o un evento redox. Durante un processo redox reversibile, le forme ossidate e ridotte di un composto sono in equilibrio sulla superficie dell'elettrodo. L'equazione di Nernst descrive la relazione tra potenziale e rapporto di equilibrio, ([R] / [O])x=0.
 (1)
(1)
Dove, 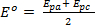 è chiamato il potenziale formale della reazione e tiene conto dei coefficienti di attività e di altri fattori sperimentali.
è chiamato il potenziale formale della reazione e tiene conto dei coefficienti di attività e di altri fattori sperimentali.
Nello specifico, la corrente di picco di una reazione reversibile è data da:
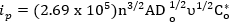 (2)
(2)
dove, ip è corrente di picco in ampere, n è il numero di elettroni coinvolti, A è l'area dell'elettrodo in cm2, Do è la costante di diffusione (cm2/s), v è la velocità di scansione (V/s) e Co* è la concentrazione di massa (moli/cm3). La costante di diffusione può essere misurata utilizzando esperimenti più estesi dettagliati altrove e non sono al centro di questo video1. Tuttavia, è possibile utilizzare linee guida più basilari per valutare la reversibilità di un sistema1. Criteri per un sistema totalmente reversibile1:
-
 a varie velocità di scansione n = numero di elettroni
a varie velocità di scansione n = numero di elettroni -
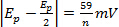 a varie velocità di scansione
a varie velocità di scansione - | ipa/ipc| = 1 a varie velocità di scansione
- Ep è indipendente da vv = velocità di scansione
- a potenziali superiori a Ep, i-2
 t
t
Semplici test diagnostici per definire un sistema totalmente irreversibile a 25 °C sono:
- Nessun picco inverso (questo si riferisce all'irreversibilità chimica, ma non necessariamente all'irreversibilità del trasferimento di elettroni)
-
Epc sposta
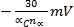 per ogni decennio l'aumento di v (irreversibilità elettrochimica)
per ogni decennio l'aumento di v (irreversibilità elettrochimica) 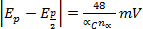
Infine, i test diagnostici per la definizione di un sistema quasi-reversibile sono:


- Epc si sposta negativamente con l'aumentare della v
La posizione degli eventi di riduzione e/o ossidazione può essere utilizzata per dedurre informazioni sulla natura elettronica dei complessi di metalli di transizione e sugli effetti sui ligandi come donatori. Ad esempio, il potenziale di riduzione Fe+3/+2 dei derivati ferrocenici è molto sensibile all'ambiente elettronico fornito dall'insieme di ligandi ciclopentadienil (Cp). I sostituenti Cp che donano (ritirano) gli elettroni aumentano (diminuiscono) la densità elettronica sul centro di ferro e spostano il potenziale redox a valori negativi (positivi) rispetto a Fc.
In questo protocollo il ferrocene sarà usato come esempio. Le condizioni sperimentali come il solvente, la scelta dell'elettrolita e l'intervallo di potenziale studiato (finestra di scansione) sono in gran parte dettate dalla solubilità dell'analita e dalle condizioni sperimentali. Gli utenti sono invitati a consultare testi pertinenti come Bard e Faulkner1 per saperne di più.
Procedura
1. Preparazione della soluzione elettrolitica
- Preparare una soluzione stock di elettrolita (10 mL) composta da 0,1 M [Bu4N][BF4] in CH3CN.
- Posizionare la soluzione elettrolitica nel flaconcino elettrochimico, aggiungere una piccola barra di agitazione e posizionare il tappo sul flaconcino come mostrato nella Figura 1.
- Verificare che il piombo di azoto sia nella soluzione elettrolitica. Mescolare e degassare la soluzione elettrolitica con un flusso delicato di gas N2 secco (~ 10 min) per rimuovere l'ossigeno molecolare attivo redox.
- Durante la fase 1.3, inserire con attenzione l'elettrodo di lavoro(ad es. carbonio vetroso), il contatore (Pt) e gli elettrodi di riferimento (Ag/AgNO3)nella parte superiore della cella in Teflon. Collegare il supporto cellulare porta all'elettrodo appropriato.

Figura 1. Configurazione di una cella elettrochimica.
2. Ottenere una scansione in background
- Definire le condizioni sperimentali per il solvente. Per l'acetonitrile, la finestra di scansione è in genere +2.000 mV – -2.000 mV.
- Eseguire e salvare voltammogrammi della soluzione elettrolitica a una gamma di velocità di scansione (ad es. 20 mV/s, 100 mV/s e/o 300 mV/s).
- Controllare la scansione risultante per assicurarsi che non vi siano impurità nella soluzione elettrolitica o ossigeno rimanente. Un sistema pulito non avrà eventi redox. Se la configurazione è contaminata, gli elettrodi e gli oggetti in vetro dovranno essere puliti e la soluzione elettrolitica rifairà utilizzando componenti puliti.
3. Preparazione della soluzione di analita
- Combinare l'analita (~2-5 mM, concentrazione finale) di interesse con la soluzione elettrolitica preparata sopra.
- Verificare che il piombo di azoto sia nella soluzione elettrolitica. Mescolare e degassare la soluzione di analita / elettrolita con un flusso delicato di gas N2 secco (~ 10 min) per rimuovere l'ossigeno molecolare attivo redox.
4. Voltammetria ciclica dell'analita
- Eseguire più esperimenti di voltammogramma ciclico a velocità di scansione da 20 mV a 1.000 mV (a seconda delle capacità del supporto cellulare). Iniziare ogni scansione utilizzando il potenziale a circuito aperto calcolato.
- Variare metodicamente la direzione di scansione [(+ a –) e (da – a +)] e la finestra di scansione per isolare gli eventi redox di interesse. Il voltammogramma dovrebbe sempre partire da corrente zero (circuito aperto). Il ferrocene (Fc) subisce una reazione di ossidazione al ferrocenio (Fc+).
- Molti gruppi standardizzano i dati alla coppia Fc/Fc+ redox. In questa pratica, ~ 2 mg di Fc vengono aggiunti alla soluzione analita e il passaggio 4.2 viene ripetuto a scopo di riferimento. Nell'analisi dei dati, tutti gli spettri sono normalizzati alla coppia Fc/Fc+ impostata su 0,00 V. Una tabella dei potenziali di riduzione normalizzati è disponibile2.
5. Pulizia degli elettrodi e della cella elettrochimica
- Rimuovere con cura e rimuovere ogni elettrodo dalla cella elettrochimica.
- Risciacquare l'elettrodo di riferimento con acetonitrile e asciugare con un Kimwipe. Conservare nella soluzione di stoccaggio dell'elettrodo di riferimento.
- Pulire delicatamente l'elettrodo funzionante e contatore secondo le linee guida dei produttori (ad esempio BASi: http://www.basinc.com/mans/pguide.pdf)per rimuovere i prodotti di reazione redox che si accumulano durante alcuni esperimenti.
Risultati
È stata effettuata una scansione CV del ferrocene a 300 mV/s in acetonitrile e il voltammogramma corrispondente è mostrato nella Figura 2.

Il ΔE può essere derivato dai dati in Figura 2 in base alla differenza tra Epa ed Epc.
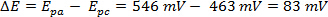
I voltammogrammi ciclici sovrapposti nella Figura 3 rappresentano esperimenti consecutivi eseguiti sullo stesso sistema a velocità di scansione diverse. Come notato sopra, un grafico lineare di Ip vs. v1/2 (inserto in Figura 3) mostra che la reazione è controllata dalla diffusione.
La posizione dell'evento E1/2 o redox (Epa o Epc) può essere utilizzata per determinare gli effetti che il ligando ha sul centro metallico attivo redox fornendo la risposta elettrochimica. La Figura 4 mostra una serie di congeneri basati sul ferrocene con sostituzioni variabili sull'anello Cp. Come mostrato nella Figura 5,l'alogenuro che preleva l'elettrone fa spostare il valore E1/2 di questo complesso a potenziali più positivi perché la forma ossidata è destabilizzata dal ligando che ritira l'elettrone. L'elettrone che dona gruppi metilici del composto C fa in modo che L'E1/2 si sposti verso potenziali più negativi man mano che la specie ossidata si stabilizza.

Figura 2. Una scansione CV del ferrocene a 150 mV/s in acetonitrile. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3. Un composto contenente cobalto che dà origine a un evento di riduzione. L'inserto mostra una correlazione lineare tra ip e v1/2. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4. Una serie di composti a base di ferrocene. Fare clic qui per visualizzare una versione più grande di questa figura.
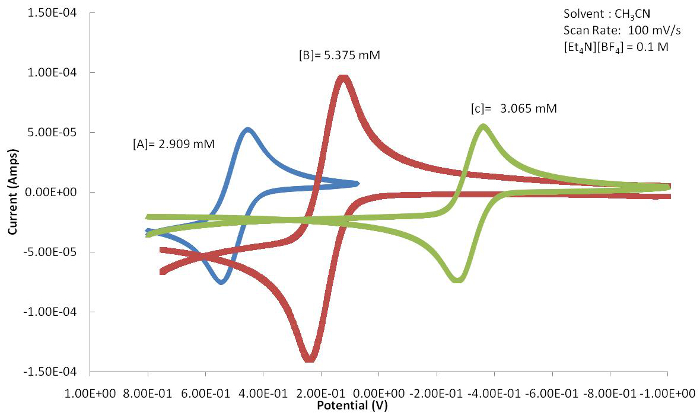
Figura 5. I voltammogrammi ciclici risultanti di A-C (Figura 4) mostrano un marcato spostamento di E1/2 a causa degli effetti del ligando elettronico attaccato al centro metallico. Fare clic qui per visualizzare una versione più grande di questa figura.
Riferimenti
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).
Tags
Vai a...
Video da questa raccolta:

Now Playing
Voltammetria ciclica
Analytical Chemistry
124.9K Visualizzazioni

Preparazione del campione per la caratterizzazione analitica
Analytical Chemistry
84.5K Visualizzazioni

Standard interni
Analytical Chemistry
204.6K Visualizzazioni

Metodo delle aggiunte standard
Analytical Chemistry
319.7K Visualizzazioni

Curve di calibrazione
Analytical Chemistry
796.0K Visualizzazioni

Spettroscopia ultravioletta/visibile (UV-VIs)
Analytical Chemistry
622.8K Visualizzazioni

Spettroscopia Raman per analisi chimiche
Analytical Chemistry
51.1K Visualizzazioni

Fluorescenza a raggi X (XRF)
Analytical Chemistry
25.4K Visualizzazioni

Gascromatografia con rivelatore a ionizzazione di fiamma
Analytical Chemistry
281.7K Visualizzazioni

Cromatografia liquida ad alta prestazione (HPLC)
Analytical Chemistry
384.0K Visualizzazioni

Cromatografia a scambio ionico
Analytical Chemistry
264.3K Visualizzazioni

Elettroforesi capillare
Analytical Chemistry
93.7K Visualizzazioni

Introduzione alla spettrometria di massa
Analytical Chemistry
112.2K Visualizzazioni

Microscopia elettronica a scansione (SEM)
Analytical Chemistry
87.1K Visualizzazioni

Misurazioni elettrochimiche di catalizzatori supportati mediante l'utilizzo di un potenziometro/galvanometro
Analytical Chemistry
51.3K Visualizzazioni