Method Article
Explorando aberrações cromossômicas X em células ovarianas usando hibridização in situ fluorescente
Neste Artigo
Resumo
Este artigo apresenta dois métodos baseados na hibridização in situ fluorescente para determinar o conteúdo cromossômico X de células ovarianas em tecido córtex ovariano não enxertado e enxertado de fêmeas com aberrações cromossômicas X.
Resumo
Milhões de pessoas em todo o mundo lidam com questões relativas à fertilidade. A redução da fertilidade, ou mesmo a infertilidade, pode ser devida a muitas causas diferentes, incluindo doenças genéticas, das quais as anormalidades cromossômicas são as mais comuns. A hibridação in situ fluorescente (FISH) é um método bem conhecido e frequentemente utilizado para detectar aberrações cromossômicas em humanos. A FISH é usada principalmente para a análise de anormalidades cromossômicas nos espermatozoides de machos com aberrações cromossômicas numéricas ou estruturais. Além disso, essa técnica também é frequentemente aplicada em mulheres para detectar aberrações cromossômicas X que sabidamente causam disgenesia ovariana. No entanto, ainda faltam informações sobre o conteúdo cromossômico X de células ovarianas de mulheres com aberrações cromossômicas X em linfócitos e/ou células bucais.
O objetivo deste estudo é avançar na pesquisa básica sobre aberrações cromossômicas X em fêmeas, apresentando dois métodos baseados em FISH para identificar o conteúdo cromossômico X de células ovarianas. Primeiro, um método é descrito para determinar o conteúdo cromossômico X de células ovarianas isoladas (ovócitos, células da granulosa e células estromais) em tecido do córtex ovariano não enxertado de mulheres com aberrações cromossômicas X. O segundo método é direcionado a avaliar o efeito das aberrações cromossômicas na foliculogênese, determinando o conteúdo cromossômico X de células ovarianas de folículos secundários e antrais recém-formados no tecido ovariano, de fêmeas com aberrações cromossômicas X após enxertia de longo prazo em camundongos imunocomprometidos. Ambos os métodos podem ser úteis em pesquisas futuras para obter informações sobre o potencial reprodutivo de fêmeas com aberrações cromossômicas X.
Introdução
A infertilidade é um problema de saúde do sistema reprodutor masculino ou feminino, afetando aproximadamente 186 milhões de indivíduos em idade reprodutiva no mundo1. Em pelo menos 35% dos casais inférteis, a infertilidade é causada por um distúrbio do sistema reprodutor feminino2. Vários são os fatores que podem causar a infertilidade feminina, como fatores genéticos, anormalidades do trato genital, disfunção endócrina, doenças inflamatórias e tratamento iatrogênico3.
Anormalidades genéticas estão presentes em aproximadamente 10% das fêmeas inférteis 4,5. De todas as anormalidades genéticas, as aberrações do cromossomo X são a causa mais comum de disgenesia ovariana2. Vários estudos relatam que aberrações cromossômicas X em mulheres com síndrome de Turner (ST) ou síndrome do triplo X estão associadas à falência ovariana prematura devido à perda acelerada de células germinativas ou oogênese prejudicada 6,7,8.
As aberrações do cromossomo X podem ser divididas em: 1) aberrações numéricas, nas quais o número de cromossomos X é diferente, mas os cromossomos X estão intactos; e 2) aberrações estruturais, nas quais o cromossomo X ganhou ou perdeu material genético 3,9. As aberrações numéricas do cromossomo X são mais comuns que as anormalidades estruturais e são frequentemente causadas por erros espontâneos durante a divisão celular 3,9. Quando este erro ocorre durante a meiose, pode levar a gametas aneuplóides e, finalmente, a descendentes com aberrações cromossômicas em todas as células. Quando defeitos cromossômicos surgem em células somáticas como resultado de erros que ocorrem durante a mitose nos estágios iniciais da ontogênese, isso pode levar ao mosaicismo. Nesses indivíduos, tanto células com conteúdo cromossômico X normal quanto células com aberrações cromossômicas X estão presentes.
Na década de 1980, uma técnica citogenética chamada hibridização in situ fluorescente (FISH) foi desenvolvida para visualizar e localizar sequências específicas de ácidos nucléicos em cromossomos metafásicos e interfásicos10,11. Essa técnica usa sondas de DNA marcadas com fluorescência para se ligar a uma sequência específica no cromossomo, que pode ser visualizada usando um microscópio de fluorescência.
Atualmente, a FISH é amplamente utilizada como ferramenta diagnóstica clínica e considerada o padrão-ouro na detecção de aberrações cromossômicas10. No campo da medicina reprodutiva, a análise de FISH em espermatozoides tem sido utilizada para obter informações sobre o conteúdo cromossômico X dos espermatozoides em machos com aberrações cromossômicas numéricas ou estruturais em células somáticas12,13,14. Esses estudos mostraram que homens com aberrações cromossômicas eram mais propensos a ter uma maior frequência de espermatozoides aneuploides presentes em seu sêmen em comparação com homens com cariótipos normais12,13,14.
Em contraste com os espermatozoides, muito pouco se sabe sobre o conteúdo cromossômico X das células ovarianas (incluindo ovócitos, células granulosas/tecais e células estromais) em indivíduos com aberração cromossômica, bem como as possíveis consequências das aneuploidias dessas células sobre seu potencial reprodutivo. Uma razão importante para a escassa informação sobre o cariótipo das células ovarianas em comparação com os espermatozoides é o fato de que as mulheres têm que se submeter a um procedimento invasivo, como uma punção do folículo ou cirurgia para obter ovócitos ou tecido do córtex ovariano. Os gametas femininos são, portanto, de difícil obtenção para fins de pesquisa.
Atualmente, um estudo observacional de intervenção está sendo realizado na Holanda para explorar a eficácia da criopreservação do tecido ovariano em mulheres jovens com ST15. Um fragmento de tecido do córtex ovariano da paciente estava disponível para identificar o conteúdo cromossômico X das células ovarianas16,17. Como parte do estudo, um novo método foi desenvolvido com base em FISH do tecido dissociado do córtex ovariano para determinar se aberrações cromossômicas estão presentes em células ovarianas em fêmeas portadoras de uma aberração cromossômica em células somáticas não ovarianas, como linfócitos ou células bucais. Além disso, o efeito das aneuploidias nas células ovarianas sobre a foliculogênese também foi determinado. Para este fim, um protocolo de FISH estabelecido foi modificado que permite a análise de cortes histológicos do tecido do córtex ovariano após foliculogênese artificialmente induzida durante xenotransplante de longo prazo em camundongos imunocomprometidos. Neste estudo, apresentamos dois métodos baseados em FISH para determinar o conteúdo cromossômico X em células ovarianas em tecido do córtex ovariano não enxertado e enxertado em mulheres com aberrações cromossômicas X, com o objetivo de aprimorar a ciência básica sobre este tema.
Protocolo
O protocolo do estudo TurnerFertility foi aprovado pelo Comitê Central de Pesquisa Envolvendo Seres Humanos (NL57738.000.16). Neste estudo, o tecido do córtex ovariano de 93 fêmeas com ST foi obtido. Os materiais que requerem precauções de segurança estão listados na Tabela 1.
Tabela 1: Precauções de segurança.
| Material | Perigo | ||
| Ácido acético | Queimaduras graves na pele e irritação do sistema respiratório | ||
| Colagenase | Irritante para os olhos, sistema respiratório e pele | ||
| DAPI | Irritante para os olhos, sistema respiratório e pele | ||
| DNase I | Irritante para os olhos, sistema respiratório e pele | ||
| Etanol | Altamente inflamável | ||
| Formaldeído | Tóxico após inalação, ingestão e contato com a pele | ||
| Formamida (em sondas de fluorescência) | Pode prejudicar o nascituro | ||
| Liberase | Irritante para os olhos, sistema respiratório e pele | ||
| Metanol | Altamente inflamável, tóxico por inalação, ingestão e contato com a pele | ||
| Nonidet P40 | Irritante para a pele ou olhos | ||
| Pepsina | Irritante para os olhos, sistema respiratório e pele | ||
| Proteinase K | Dificuldades respiratórias após inalação | ||
| Xileno | Altamente inflamável, tóxico após inalação e contato com a pele. Evite o contato com os olhos. | ||
Tabela 1: Materiais que requerem precauções de segurança.
1. FISH em células isoladas do córtex ovariano
- Dissociação do tecido do córtex ovariano para obtenção de células individuais
- Cortar o tecido do córtex ovariano criopreservado/descongelado em pequenos pedaços de aproximadamente 1 mm x 1 mm x 1 mm usando um bisturi.
- Digerir enzimaticamente os fragmentos de tecido em 4 mL de meio L15 pré-aquecido (37 °C) contendo 0,1 mg/mL de mistura de enzimas de dissociação tecidual, 10 μg/mL de DNase I e 1 mg/mL de colagenase I de C. histolyticum por um máximo de 75 min a 37 °C. Pipetar a mistura de digestão para cima e para baixo a cada 15 min.
- Interromper a digestão enzimática adicionando 4 mL de L15 frio suplementado com 10% de soro fetal bovino (SFB). Lavar o tecido dissociado uma vez com 8 mL de meio L15 frio por centrifugação a 500 x g e ressuspender em 500 μL de meio L15 sem vórtice para evitar danos às células.
- Transferir a suspensão celular contendo em grande parte células estromais individuais e pequenos folículos (ovócitos circundados por uma única camada de células da granulosa) para uma placa de Petri plástica e examinar a suspensão celular sob um estereomicroscópio (aumento de 100x).
- Pegar os pequenos folículos (<50 μm) manualmente usando uma pipeta plástica de 75 μm e transferir os folículos para uma gota de meio L15 suplementado com FBS a 10% a 4 °C para evitar a agregação dos folículos. Realizar a coleta de folículos por no máximo 30 min. Para melhorar a dispersão celular folicular antes da análise de FISH, transferir os folículos purificados para uma solução de tripsina a 0,06%, ácido etilenodiaminotetracético (EDTA) 1 mg/mL e glicose 1 mg/mL e incubar por 20 min a 37 °C.
- Obter células do estroma ovariano a partir da suspensão de células do córtex usando uma pipeta plástica de 75 μm, tomando especial cuidado para evitar a contaminação com pequenos folículos.
- Análise FISH de células ovarianas individuais
- Transferir os folículos ovarianos tratados (recomendado n = 5-20) com tripsina/EDTA/glicose ou células estromais (n > 1.000) para gotículas de 5 μL de KCl/15 μL de solução salina tamponada com fosfato (DPBS) de Dulbecco em uma lâmina e incubar por 20 min a 37 °C.
- Secar e pré-fixar as lâminas em 300 μL de KCl 0,05 mM/ácido acético 7,5%/metanol 22,5% por 2 min à temperatura ambiente (TR). Cobrir as lâminas com metanol/ácido acético (3:1) por 2 min no TR para finalizar a fixação.
- Fazer 20x citrato de sódio padrão (SSC) adicionando 876 g de cloreto de sódio e 441 g de citrato trissódico di-hidratado em 5 L de água destilada. Em seguida, adicionar 100 mL de 20x de CSC a 900 mL de água desmineralizada (demi) para obter 2x SSC. Lavar a amostra em 2x SSC a 73 °C, cobri-la com 100 μL de proteinase K a 2% e selá-la com uma lamínula. Incubar as lâminas por 10 min a 37 °C na estação de hibridização.
- Retire a lamínula e lave as lâminas por 5 min em DPBS no RT. Fixe a amostra por 5 min com formol a 1% no RT. Nesta fase, o material ainda não está totalmente preso às lâminas de vidro e, portanto, não deve ser colocado em uma plataforma de agitação.
- Lavar as lâminas por 5 min em DPBS no TR, seguido de desidratação em 70%, 80%, 90% e etanol 100% subsequentes por 2 min cada. Secar ao ar a amostra desidratada e hibridizá-la com sondas fluorescentemente marcadas.
- Selecionar uma sonda centromérica-específica para o cromossomo X e outra sonda centromérica cromossômica-específica como controle para determinar o conteúdo cromossômico X das células ovarianas. Neste caso, são usadas sondas centromémeras específicas para o cromossomo X (CEP X [DXZ1]) diretamente marcado com fluorocromo SpectrumGreen e cromossomo 18 (CEP 18 [D18Z1]) diretamente marcado com fluorocromo SpectrumOrange.
- Adicionar 1 μL de CEP X, 1 μL de CEP 18 e 18 μL do tampão de hibridização à amostra e selar com uma lamínula que é colada às lâminas para evitar a evaporação da sonda durante a hibridização. Transferir as lâminas para a estação de hibridização para desnaturação a 73 °C por 3 min, seguida de hibridização durante uma incubação noturna a 37 °C.
- Remova a lamínula e qualquer cola restante da lâmina após a hibridização. Lavar as lâminas em 0,4x SSC/0,3% Tween-20 a 72 °C por 2 min, seguido de incubação por 1 min em 2x SSC/0,1% Tween-20 em TR.
- Desidratar as lâminas por incubações subsequentes de 2 min em 70%, 80%, 90% e 100% etanol e secar ao ar no escuro. Cubra as lâminas com um meio de montagem contendo 4′,6-diamidino-2-fenilindol (DAPI). Conservar a -20 °C durante, pelo menos, 10 minutos antes da análise por microscopia de fluorescência.
- Imagiologia
- Examine o(s) sinal(s) do(s) cromossomo X(s) com um microscópio de fluorescência ligado a um software de processamento de imagens.
- Primeiro, selecione DAPI fluorocromo.
- Adquira uma imagem selecionando Nova célula > Captura de > ao vivo com ampliação de 630x. Uma nova janela com o limite será exibida. Defina a barra azul do limite como 0 para minimizar o plano de fundo e a barra vermelha como o máximo (255) para tornar os sinais mais brilhantes. Clique em Aceitar.
- Uma nova janela com aprimoramento aparecerá com uma sugestão para mais escuro/brilhante (12), raio (3) e profundidade (1). Use os valores sugeridos ou ajuste-os se não estiver satisfeito.
- Em segundo lugar, selecione fluorochrome SpectrumOrange e clique em Capture.
- Defina a barra azul do limite como 0 para minimizar o plano de fundo e a barra vermelha como o máximo (255) para tornar os sinais mais brilhantes. Clique em Aceitar.
- A janela com realce aparecerá com uma sugestão para mais escuro/brilhante (-11), raio (2,7) e profundidade (0,6). Use os valores sugeridos ou ajuste-os se não estiver satisfeito.
- Finalmente, selecione fluorochrome SpectrumGreen e clique em Capture.
- Defina a barra azul do limite como 0 para minimizar o plano de fundo e a barra vermelha como o máximo (255) para tornar os sinais mais brilhantes. Clique em Aceitar.
- A janela com realce aparecerá com uma sugestão para mais escuro/brilhante (0), raio (3) e profundidade (0). Use os valores sugeridos ou ajuste-os se não estiver satisfeito. Salve a imagem em um arquivo recém-criado.
NOTA: As células somáticas só foram avaliadas quando dois sinais do cromossomo controle 18 eram visíveis. Na maioria dos ovócitos, apenas um sinal pôde ser detectado para cada cromossomo.
- Primeiro, selecione DAPI fluorocromo.
- Conservar as lâminas no escuro a 4 °C após a análise para evitar a perda de sinais.
- Examine o(s) sinal(s) do(s) cromossomo X(s) com um microscópio de fluorescência ligado a um software de processamento de imagens.
2. FISH em cortes de parafina de tecido córtex ovariano enxertado
NOTA: Um fragmento de tecido do córtex ovariano criopreservado/descongelado de 18 fêmeas com ST foi xenoenxertado em camundongos imunodeficientes combinados graves (SCID) por 5 meses. O procedimento de xenoenxertia já foi descrito anteriormente e foi realizado na Université Catholique de Louvain (Bruxelas, Bélgica) seguindo as diretrizes locais do Committee on Animal Research em relação ao bem-estar animal (referência 2014/UCL/MD/007)18,19.
- Seleção de cortes de tecido do córtex ovariano xenoenxertado contendo folículos
- Fixar o tecido do córtex ovariano xenoenxertado em formaldeído a 4% e embutir o tecido em parafina. Aparar os blocos com bisturi para remover parafina extra e cortar o bloco de parafina para 4 μm de espessura em micrótomo de rotação.
- Selecione cada sétima seção da fita de parafina para coloração de hematoxilina e eosina (HE) para determinar quais seções contêm folículos. Colocar a secção em banho-maria a 40-45 °C e montá-la em lâminas de microscópio imunohistoquímico.
- Desparafinização e coloração HE
- Coloque as lâminas em um fogão por 10 min a 60 °C e, em seguida, mergulhe as lâminas em xileno 100% por 5 min. Não é necessário colocar as lâminas diretamente no fogão. Hidratar as seções por 15 s em etanol 100%, seguido de 2 x 15 s em etanol 96%. Enxágue as lâminas em água corrente por 2 min.
- Manchar as lâminas em hematoxilina por 10 min e, em seguida, enxaguar as lâminas brevemente em água da torneira. Imergir brevemente as lâminas em uma solução de bicarbonato (100 g de sulfato de magnésio e 10 g de bicarbonato de sódio em 5 L de água destilada). Enxágue as lâminas em água corrente por 5 min.
- Contracorar as lâminas com eosina por 4 min e desidratá-las três vezes com etanol 100%, seguido de xileno. Cobrir as colorações de HE nas lâminas e avaliar os cortes de HE em microscópio de luz para selecionar os cortes com folículos (aumento de 100x).
- Pré-tratamento e hibridização de cortes em parafina para DNA FISH
- Selecione novas seções que estejam antes ou depois da seção que continha folículos da faixa de parafina. Monte uma seção em uma lâmina de vidro. Secar as secções de parafina durante, pelo menos, 45 minutos num fogão a 56 °C. Não é necessário colocar as lâminas diretamente no fogão.
- Desparafinizar as seções em xileno por 10 min. Imergir as lâminas em etanol 99,5% e enxaguar por 5 min em água da torneira. Pré-tratar as lâminas com solução de recuperação do alvo (pH baixo) por 10 min a 96 °C. Após esfriar, enxágue as lâminas em água destilada.
- Tratar as lâminas por 5 min com ácido clorídrico 0,01 M, seguido de digestão com pepsina (200 U/mL) por 15 min a 37 °C. Enxaguar novamente as lâminas em ácido clorídrico 0,01 M e posteriormente em PBS.
- Fixar as lâminas em formol a 1%/PBS por 5 min. Enxágue as lâminas brevemente em PBS e, em seguida, novamente em água demi. Desidrate as lâminas em etanol 99,5% e deixe-as secar ao ar.
- Selecionar uma sonda centromérica-específica para o cromossomo X e outra sonda centromérica cromossômica-específica como controle para determinar o conteúdo cromossômico X das células da granulosa. Aqui, o cromossomo 18 é usado como controle.
- Aplicar 5 μL da sonda CEP 18 (D18Z1) diretamente marcada com fluorocromo SpectrumGreen e da sonda CEP X (DXZ1) diretamente marcada com fluorocromo SpectrumRed nas lâminas pré-tratadas. Aplique uma lamínula e sele a área com cola fotográfica. Colocar as lâminas num hibridizador para desnaturação a 80 °C durante 10 min e hibridização durante a noite a 37 °C.
- No dia seguinte, enxaguar as lâminas por 5 min em 2x SSC a 42 °C, seguido de 2 min e 1 min de enxágue em Nonidet P40 0,3% a 73 °C. Atualize o CSC 2x e enxágue as lâminas novamente por 5 min à temperatura ambiente. Cubra a cubeta para que as seções sejam mantidas no escuro.
- Enxágue brevemente as lâminas em água destilada. Desidrate as lâminas em etanol 99,5% e deixe-as secar ao ar novamente. Por fim, monte as lâminas com uma solução contendo DAPI e meio de montagem.
- Imagiologia
- Analise os resultados em microscópio de fluorescência com aumento de 630x. Abra o software de processamento de imagens no computador. Selecione FISH como o perfil.
- Verifique se a emissão DAPI está ajustada em 431 nm e a excitação em 359 nm, emissão vermelha Texas em 613 nm e excitação em 595 nm, e emissão FITC em 519 nm e excitação em 495 nm.
- Adquira uma imagem selecionando Live > Capture Single Image. Otimize a qualidade da imagem ajustando a exposição e o ganho movendo o Controle Deslizante de Exposição e o Controle Deslizante de Ganho no menu Imagem à esquerda (por exemplo, exposição: 212 ms e ganho: 7,9). A exposição e o ganho necessários podem variar por imagem; Observe as mudanças durante esse processo para obter uma imagem otimizada. Salve a imagem em um arquivo recém-criado.
- Conservar as lâminas no escuro a 4 °C após a análise para evitar a perda de sinais.
Resultados
FISH em células ovarianas isoladas antes da enxertia
Tecido cortical ovariano criopreservado de fêmeas com ST 45,X/46,XX (paciente A) ou 45,X/46,XX/47,XXX (paciente B) foi utilizado para ilustrar os resultados utilizando este protocolo. No paciente A, 50% dos linfócitos tinham cariótipo 45,X e 50% tinham cariótipo 46,XX. No paciente B, 38% dos linfócitos eram 45,X, 28% 46,XX e 34% 47,XXX. Sondas centrômero-específicas para o cromossomo X (verde) e o cromossomo 18 como controle (vermelho) foram usadas para determinar o conteúdo cromossômico X de células granulosas, células estromais e oócitos isolados do tecido do córtex ovariano de pacientes com ST sem xenotransplante prévio (Figura 1).
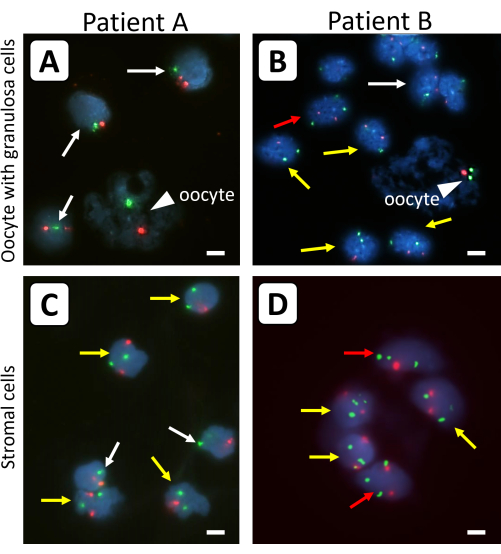
Figura 1: Análise por FISH de células ovarianas isoladas do tecido do córtex ovariano antes da enxertia. Oócitos (cabeças de setas) e células da granulosa de folículos primordiais únicos (A,B) e (C,D) das células estromais circunvizinhas foram analisados com sondas fluorescentes específicas para o cromossomo X (sinais verdes) e o cromossomo controle 18 (sinais vermelhos). As setas brancas indicam 45,X linhas celulares, as setas amarelas indicam 46,XX linhas celulares e as setas vermelhas indicam 47,XXX linhas celulares. Nem todos os sinais fluorescentes estão no mesmo plano de foco. As barras representam 10 μm. A ampliação dos sinais de FISH foi ajustada em 630x. Clique aqui para ver uma versão maior desta figura.
As diferenças entre os folículos primordiais individuais que foram tratados com e sem tripsina antes da FISH são mostradas na Figura 2. Com o uso de tripsina previamente à análise de FISH, a massa celular da granulosa e os ovócitos foram menos aglomerados, permitindo a análise do conteúdo cromossômico X de células granulosas e ovócitos individuais. O DNA dos ovócitos pode ser facilmente distinguido daquele das células da granulosa circundantes devido à forma irregular, tamanho e aparência difusa do DNA dos ovócitos. Além disso, apenas um forte sinal de FISH para cada cromossomo é observado nos ovócitos de pequenos folículos, devido à proximidade das quatro cromátides irmãs nessas células. O conteúdo cromossômico X dos ovócitos pode ser determinado usando a razão de superfície do sinal FISH do cromossomo X para o do cromossomo 18.

Figura 2: Folículos pequenos tratados com e sem tripsina previamente à FISH. (A) A digestão enzimática do tecido do córtex ovariano resultou em uma suspensão de células em grande parte dissociadas, mas deixando os folículos primordiais, consistindo de um ovócito intacto cercado por uma única camada de células granulosas (cabeças de seta no painel A). (B) Folículos pequenos foram escolhidos a dedo da suspensão celular, mas apresentaram dificuldades para interpretar sinais após FISH devido à aglomeração das células da granulosa (C). (D,E) A digestão adicional dos folículos isolados com tripsina antes da FISH resultou em células granulosas individuais a contrair-se em uma morfologia esférica na superfície dos folículos e foram mais propensas a se dissociar do folículo para se tornarem acessíveis para a análise de FISH. Os sinais FISH derivados de ovócitos são indicados por setas. As barras pretas representam 100 μm e as barras brancas representam 10 μm. A ampliação dos sinais de FISH foi ajustada em 630x. O painel D foi reproduzido com permissão de Peek et al.16. Clique aqui para ver uma versão maior desta figura.
Análise de células da granulosa por FISH em cortes em parafina de tecido córtex ovariano enxertado
Folículos secundários e antrais mostraram-se menos suscetíveis à digestão enzimática, o que torna o método descrito anteriormente de dissociação tecidual para obtenção de células ovarianas individuais inadequado para o crescimento de folículos encontrados no tecido ovariano após xenoenxertia de longa duração. Portanto, o protocolo de FISH foi otimizado usando cortes histológicos de 4 μm para determinar o conteúdo cromossômico X das células da granulosa de folículos secundários e antrais no tecido do córtex ovariano após a enxertia (Figura 3). Nesse cenário, é improvável que o sinal FISH do cromossomo X ou do cromossomo controle em ovócitos seja capturado em uma única seção de 4 μm, devido ao grande diâmetro dos ovócitos nos folículos em crescimento.
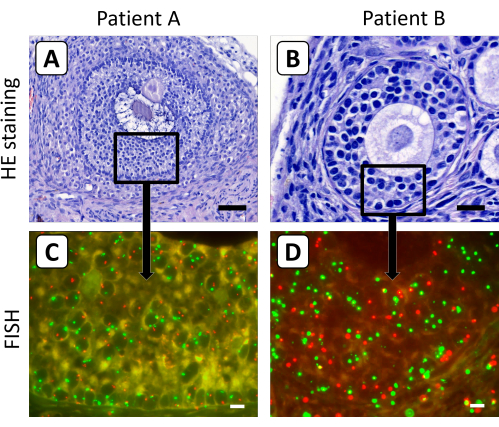
Figura 3: Coloração histológica e FISH de cortes de tecido do córtex ovariano após xenotransplante. (A,B) A coloração hematoxilina/eosina mostrou folículos secundários e antrais morfologicamente normais no tecido do córtex ovariano após 5 meses de xenoenxertia. (C,D) O conteúdo cromossômico X das células da granulosa desses folículos foi determinado pela análise de FISH. Nesta figura, o cromossomo X é mostrado em vermelho e o cromossomo 18 em verde. A barra no painel A representa 50 μm, a barra no painel B representa 20 μm e as barras nos painéis C e D representam 10 μm. A ampliação dos sinais de FISH foi ajustada em 630x. Clique aqui para ver uma versão maior desta figura.
Como primeiro passo, experimentos com diferentes técnicas de fixação dos tecidos foram realizados para determinar qual método resulta nos melhores sinais de FISH. A análise de FISH foi realizada em tecido enxertado que foi fixado em solução de Bouin e posteriormente imerso em formaldeído a 4%, e em tecido enxertado que foi fixado apenas em formaldeído a 4%. O tecido enxertado que foi fixado pela primeira vez em Bouin exibiu uma névoa verde na imagem, dificultando a contagem precisa do número de sinais de FISH (Figura 4).

Figura 4: Enxertado tecido do córtex ovariano fixado apenas em solução de Bouin e formaldeído. (A) A fixação de tecido do córtex ovariano enxertado na solução de Bouin resultou em sinais fluorescentes borrados e amplamente obscurecidos nas células foliculares devido a uma névoa verde. (B) O tecido do córtex ovariano fixado em formaldeído forneceu apenas excelentes sinais fluorescentes e de fácil interpretação. As barras representam 10 μm. A ampliação dos sinais de FISH foi ajustada em 630x. Clique aqui para ver uma versão maior desta figura.
Para determinar o conteúdo cromossômico X das células da granulosa dos folículos em cortes histológicos, não é possível simplesmente contar os sinais de FISH das células da granulosa. Parte dos cromossomos de uma célula granulosa individual pode ser perdida em um determinado corte histológico, devido à secção do tecido. Portanto, é necessário primeiro determinar a porcentagem de sinais de FISH perdidos devido à secção antes de finalmente determinar a perda de conteúdo cromossômico X da população de células da granulosa devido a aneuploidias em folículos secundários e antrais recém-formados após a enxertia do tecido.
A porcentagem de sinais de FISH perdidos devido à secção pode ser calculada determinando-se o número de sinais de FISH por célula da granulosa do cromossomo controle não-aneuploide 18. Espera-se que a mesma porcentagem do cromossomo X seja perdida devido à secção. Qualquer redução adicional no número de sinais de FISH do cromossomo X na população de células da granulosa é devida à aneuploidia. No entanto, o uso de sinais FISH de um cromossomo controle para determinar a perda cromossômica X devido a aneuploidias requer que a sensibilidade de detecção dos sinais FISH do cromossomo X e do cromossomo controle seja muito semelhante. A sensibilidade de detecção de ambas as sondas de FISH em células da granulosa de folículos em crescimento em cortes histológicos de indivíduos não-aneuplóides 46,XX foi, portanto, determinada. Quando a relação entre os sinais do cromossomo X/FISH do cromossomo controle é próxima de 1, pode-se assumir que a sensibilidade de detecção de ambas as sondas é realmente muito semelhante, e que as sondas FISH podem, portanto, ser usadas para determinar o nível de aneuploidia na população de células da granulosa de folículos em crescimento em cortes histológicos de tecido ovariano após xenotransplante.
Exemplo
Ao analisar o número de sinais do cromossomo 18 em 130 células da granulosa de um folículo de um ovário de um indivíduo 46,XX, espera-se que 260 sinais estejam presentes. No entanto, em uma seção de 4 μm dessas células, apenas 204 sinais do cromossomo 18 foram observados. Isso indica que 21,5% dos sinais são perdidos devido ao seccionamento ((260-204)/260 x 100 = 21,5%). O número de sinais do cromossomo 18 por célula da granulosa é, portanto, reduzido para 204/130 = 1,57 devido à secção.
Em seguida, analisa-se o número de cromossomos X nas células da granulosa de um folículo antral após enxertia no tecido ovariano de uma mulher com ST. No total, 191 sinais para o cromossomo X e 199 sinais para o cromossomo 18 foram contados. O número de células da granulosa pode ser determinado dividindo-se o número total de sinais para o cromossomo 18 pelo número de sinais do cromossomo 18 por célula da granulosa (199/1,57 = 127 células da granulosa). Finalmente, a porcentagem de células da granulosa 45,X pode ser determinada dividindo-se a diferença dos sinais do cromossomo 18 e do cromossomo X com o número de células da granulosa (i.e., [199-191]/127 x 100 = 6% das células da granulosa são 45,X, e 94% dessas células são 46, XX).
Vale ressaltar que, em pacientes com linhagem celular 47,XXX, só é possível determinar a porcentagem mínima de células da granulosa com cariótipo 47,XXX, uma vez que uma mistura de 45,X e 47,XXX células da granulosa apresenta o mesmo número de sinais cromossômicos X que as células da granulosa 46,XX.
Discussão
A análise de FISH é uma técnica bem conhecida para detectar aberrações cromossômicas X em linfócitos ou células bucais de homens e mulheres10. Vários estudos descreveram FISH em gametas de machos com aberrações cromossômicas X, mas informações detalhadas obtidas por FISH em células ovarianas de fêmeas com aberrações cromossômicas X ainda são escassas14. Este artigo apresenta novos métodos baseados em FISH para determinar se aneuploidias estão presentes em células ovarianas de tecido córtex ovariano não enxertado e enxertado de fêmeas com aberrações cromossômicas X.
O principal desafio do protocolo de isolamento de células ovarianas individuais em tecido córtex ovariano não enxertado está na digestão enzimática do tecido, o que requer alguma prática prévia. A fim de obter sinais precisos de FISH de células ovarianas suficientes, é importante seguir rigorosamente os passos referentes à digestão enzimática, tempos de incubação e temperaturas indicadas. O desvio do protocolo pode causar uma perda substancial de células ovarianas durante o processo, e isso deve ser evitado especialmente em pacientes que já têm uma baixa reserva ovariana. Outro passo crítico neste método é tratar os folículos primordiais purificados com tripsina para evitar que os ovócitos e a massa celular da granulosa se aglutinem, o que impede a análise de células individuais. Sem tratamento com tripsina, o número de células individuais da granulosa que podem ser analisadas de forma confiável por FISH é severamente reduzido.
A análise de FISH no tecido do córtex ovariano recuperado após enxertia de longa duração requer uma técnica diferente, pois apenas pequenos folículos foram suficientemente suscetíveis à digestão enzimática necessária para obter células ovarianas individuais. Além disso, semelhante ao autotransplante de tecido do córtex ovariano, muitos folículos se perdem após a enxertia devido à hipóxia e à falta de nutrientes antes que o enxerto seja suficientemente revascularizado pelo hospedeiro20. Espera-se, portanto, que o número de folículos após a enxertia seja consideravelmente menor do que antes da enxertia. Para esta técnica de FISH usada para cortes histológicos, é importante fixar o tecido enxertado em formaldeído a 4% apenas para obter sinais ótimos de FISH. A fixação do tecido do córtex ovariano no fixador de Bouin é rotineiramente usada em laboratório e, embora isso dê excelentes resultados quando combinado com a coloração padrão de HE, a fixação do tecido com o de Bouin antes da FISH leva a sinais fluorescentes fracos e embaçados que são difíceis de interpretar.
Embora esse protocolo tenha se mostrado bem-sucedido na determinação do conteúdo cromossômico X das células ovarianas, ele ainda apresenta algumas limitações. Uma limitação é que esses métodos só podem ser usados para analisar as células ovarianas de fêmeas com aberrações numéricas. Aberrações numéricas podem ser detectadas com o uso de sondas direcionadas a sequênciasrepetitivas21. Essas sondas hibridizam múltiplas sequências de pares de bases repetidas na região do centrômero, resultando em fortes sinais de hibridização. Em contraste, aberrações estruturais só podem ser detectadas usando sondas contra sequências únicas únicas. Essas sondas hibridizam em sequências que ocorrem apenas uma vez no genoma haploide, resultando em um sinal de FISH consideravelmente menos intenso em comparação com aberrações numéricas. Devido a esses sinais FISH relativamente fracos, é difícil determinar adequadamente o conteúdo cromossômico X das células ovarianas em fêmeas com aberrações estruturais.
Em segundo lugar, os sinais de FISH de ovócitos de pequenos folículos em tecido não enxertado são difíceis de analisar, devido à proximidade das quatro cromátides irmãs na prófase da meiose I22. Apenas um forte sinal de hibridização estará presente nos ovócitos e, portanto, não é possível simplesmente contar o número de sinais nos ovócitos para determinar o conteúdo cromossômico X. Em vez disso, a razão de superfície dos sinais do cromossomo X e 18 FISH deve ser usada para determinar o conteúdo cromossômico X nessas células. Isso só pode ser determinado de forma confiável se os sinais de FISH nos ovócitos estiverem claramente presentes.
Além disso, a FISH no tecido enxertado só pode ser usada para determinar o conteúdo cromossômico X das células da granulosa dos folículos secundários e antrais, já que pequenos folículos em cortes histológicos do tecido enxertado têm apenas algumas células da granulosa que podem ser adequadamente analisadas. Além disso, o conteúdo cromossômico X dos ovócitos não pode ser determinado com precisão usando este método devido ao grande diâmetro dos ovócitos.
Finalmente, permanece um desafio a obtenção de gametas femininos em comparação com os masculinos, pois a cirurgia invasiva é necessária para obter células ovarianas ou tecido do córtex ovariano. Portanto, esses métodos são mais prováveis de serem aplicados em um ambiente de pesquisa.
Em conclusão, a análise por FISH de células ovarianas de tecido córtex ovariano não enxertado e enxertado de fêmeas com aberrações cromossômicas X é uma técnica única e útil para obter informações sobre o conteúdo cromossômico X das células ovarianas deste grupo específico. Essas técnicas mostram que a criopreservação do tecido do córtex ovariano de fêmeas com aberrações cromossômicas X é possível, e que folículos primordiais criopreservados são capazes de crescer para folículos secundários e antrais. No entanto, deve-se ter em mente que ambos os métodos se destinam a facilitar pesquisas futuras em mulheres com aberrações cromossômicas X e não são projetados para serem usados como uma ferramenta diagnóstica para rastrear resultados reprodutivos de mulheres com aberrações cromossômicas X na prática clínica.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem a Marjo van Brakel, Dominique Smeets, Guillaume van de Zande, Patricia van Cleef e Milan Intezar por sua experiência e assistência técnica. Fontes de financiamento: Merck Serono (A16-1395), Goodlife e Ferring.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
Referências
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados