Method Article
蛍光 In situ ハイブリダイゼーションを用いた卵巣細胞のX染色体異常の探索
要約
この記事では、X染色体異常のある女性の非移植および移植卵巣皮質組織における卵巣細胞のX染色体含有量を決定するための蛍光 in situ ハイブリダイゼーションに基づく2つの方法を紹介します。
要約
世界中の何百万人もの人々が出生力に関する問題に取り組んでいます。生殖能力の低下、あるいは不妊症でさえ、染色体異常が最も一般的である遺伝性疾患を含む多くの異なる原因が原因である可能性があります。蛍光 in situ ハイブリダイゼーション(FISH)は、ヒトの染色体異常を検出するためによく知られ、頻繁に使用される方法です。FISHは主に、数値的または構造的な染色体異常を有する雄の精子の染色体異常の解析に使用されます。さらに、この技術は、卵巣発育異常を引き起こすことが知られているX染色体異常を検出するために女性にも頻繁に適用されます。しかし、リンパ球および/または頬細胞にX染色体異常を有する雌の卵巣細胞のX染色体含量に関する情報はまだ不足しています。
本研究の目的は、卵巣細胞のX染色体含量を特定するためのFISHに基づく2つの方法を提示することにより、女性のX染色体異常に関する基礎研究を進めることです。まず、X染色体異常を有する雌から移植されていない卵巣皮質組織中の単離卵巣細胞(卵母細胞、顆粒膜細胞、間質細胞)のX染色体含量を測定する方法について説明する。第2の方法は、免疫不全マウスへの長期移植後のX染色体異常を有する雌から、卵巣組織において新たに形成された二次卵胞および胞状卵胞の卵巣細胞のX染色体含有量を決定することによって、卵胞形成に対する染色体異常の影響を評価することに向けられている。どちらの方法も、X染色体異常のある女性の生殖能力についての洞察を得るための将来の研究に役立つ可能性があります。
概要
不妊症は男性または女性の生殖器系の健康問題であり、世界中で約1億8600万人の生殖年齢の個人が罹患しています1。不妊症のカップルの少なくとも35%で、不妊症は女性の生殖器系の障害によって引き起こされます2。遺伝的要因、生殖管異常、内分泌機能障害、炎症性疾患、医原性治療など、女性の不妊症を引き起こす可能性のある多くの要因があります3。
遺伝的異常は、不妊症の女性の約10%に存在します4,5。すべての遺伝的異常の中で、X染色体異常は卵巣発育不全の最も一般的な原因です2。いくつかの研究では、ターナー症候群(TS)またはトリプルX症候群の女性のX染色体異常は、生殖細胞の喪失の加速または卵形成障害による早期卵巣不全に関連していることが報告されています6,7,8。
X染色体の異常は、1)X染色体の数が異なっているがX染色体が損なわれていない数値異常に分けることができます。2)X染色体が遺伝物質を獲得または失った構造異常3,9。X染色体の数値異常は、構造異常よりも一般的であり、細胞分裂中の自発的なエラーによって引き起こされることがよくあります3,9。減数分裂中にこのようなエラーが発生すると、異数性配偶子につながり、最終的にはすべての細胞に染色体異常を伴う子孫につながる可能性があります。個体発生の初期段階の有糸分裂中に発生するエラーの結果として染色体細胞に染色体欠損が生じると、モザイク現象につながる可能性があります。これらの個体では、X染色体含有量が正常な細胞とX染色体異常を有する細胞の両方が存在する。
1980年代には、中期および間期の染色体上の特定の核酸配列を視覚化して位置を特定するために、蛍光in situハイブリダイゼーション(FISH)と呼ばれる細胞遺伝学的手法が開発されました10,11。この手法では、蛍光標識されたDNAプローブを使用して染色体内の特定の配列に結合し、蛍光顕微鏡を使用して視覚化できます。
現在、FISHは臨床診断ツールとして広く使用されており、染色体異常を検出する際のゴールドスタンダードと見なされています10。生殖医療の分野では、精子に関するFISH分析を使用して、体細胞に数値的または構造的な染色体異常がある男性の精子のX染色体含有量に関する洞察を得ています12,13,14。これらの研究は、染色体異常のある男性は、正常な核型の男性と比較して、精液中に存在する異数性精子の頻度が高い可能性が高いことを示しました12,13,14。
精子とは対照的に、染色体異常を有する個体における卵巣細胞(卵母細胞、顆粒膜/テカ細胞、および間質細胞を含む)のX染色体含有量、およびこれらの細胞の異数性が生殖能力に及ぼす可能性のある結果についてはほとんど知られていない。精子と比較して卵巣細胞の核型に関する情報が不足している重要な理由は、女性が卵母細胞または卵巣皮質組織を得るために卵胞穿刺または手術などの侵襲的処置を受けなければならないという事実である。したがって、女性の配偶子は研究目的で入手することは困難です。
現在、TS15の若い女性における卵巣組織凍結保存の有効性を調査するために、オランダで観察介入研究が行われています。患者の卵巣皮質組織の1つの断片は、卵巣細胞のX染色体含量を同定するために利用可能であった16、17。研究の一環として、解離した卵巣皮質組織のFISHに基づいて、リンパ球や頬細胞などの非卵巣体細胞に染色体異常がある女性の卵巣細胞に染色体異常が存在するかどうかを判断する新しい方法が開発されました。さらに、卵胞形成に対する卵巣細胞の異数性の影響も決定されました。この目的のために、確立されたFISHプロトコルが変更され、免疫不全マウスの長期異種移植中に人為的に誘導された卵胞形成後の卵巣皮質組織の組織学的切片の分析が可能になりました。本研究では、X染色体異常を有する雌の非移植および移植卵巣皮質組織の卵巣細胞におけるX染色体含量を決定するためのFISHに基づく2つの方法を提示し、このトピックに関する基礎科学の向上を目指します。
プロトコル
ターナー出生力研究プロトコルは、人間を対象とする研究に関する中央委員会(NL57738.000.16)によって承認されています。この研究では、TSの女性93人の卵巣皮質組織が得られた。安全上の注意が必要な材料を 表1に示します。
表1:安全上のご注意。
| 材料 | ハザード | ||
| 酢酸 | 重度の皮膚火傷と呼吸器系の刺激 | ||
| コラゲナーゼ | 目、呼吸器系および皮膚を刺激する | ||
| ダピ | 目、呼吸器系および皮膚を刺激する | ||
| ドナーゼ I | 目、呼吸器系および皮膚を刺激する | ||
| エタノール | 引火性が高い | ||
| ホルムアルデヒド | 吸入、摂取および皮膚接触後に有毒 | ||
| ホルムアミド (蛍光プローブ内) | 胎児に害を及ぼす可能性があります | ||
| リベラーゼ | 目、呼吸器系および皮膚を刺激する | ||
| メタノール | 引火性が高く、吸入、摂取、皮膚接触による毒性 | ||
| ノニデットP40 | 皮膚や目を刺激する | ||
| ペプシン | 目、呼吸器系および皮膚を刺激する | ||
| プロテイナーゼK | 吸入後の呼吸困難 | ||
| キシレン | 非常に可燃性で、吸入および皮膚接触後に有毒です。目との接触を避けてください。 | ||
表1:安全上の注意が必要な材料。
1.単離された個々の卵巣皮質細胞上のFISHは
- 個々の細胞を得るための卵巣皮質組織の解離
- 凍結保存/解凍した卵巣皮質組織をメスで約1mm x 1mm x 1mmの小片に切断します。
- 組織断片を、0.1 mg/mLの組織解離酵素ミックス、10 μg/mLのDNase I、および C.ヒストリカム 由来の1 mg/mLのコラゲナーゼIを含む4 mLの予温(37°C)L15培地で、37°Cで最大75分間酵素的に消化します。 消化ミックスを15分ごとに上下にピペットします。
- 10%ウシ胎児血清(FBS)を添加した4 mLの冷たいL15を加えて、酵素消化を停止します。解離した組織を500 x g の遠心分離により8 mLの冷たいL15培地で1回洗浄し、細胞への損傷を避けるためにボルテックスせずに500 μLのL15培地に再懸濁します。
- 主に個々の間質細胞と小さな卵胞(単層の顆粒膜細胞に囲まれた卵母細胞)を含む細胞懸濁液をプラスチック製のシャーレに移し、実体顕微鏡(倍率100倍)で細胞懸濁液を調べます。
- 75 μmのプラスチックピペットを使用して小さな卵胞(<50 μm)を手動でピックアップし、卵胞の凝集を防ぐために4°Cで10%FBSを添加したL15培地の液滴に卵胞を移します。卵胞ピックアップを最大30分間実行します。FISH分析の前に卵胞細胞の広がりを改善するには、精製した卵胞を0.06%トリプシン、1 mg/mLエチレンジアミン四酢酸(EDTA)、および1 mg/mLグルコースの溶液に移し、37°Cで20分間インキュベートします。
- 75 μmのプラスチックピペットを使用して皮質細胞懸濁液から卵巣間質細胞を取得し、小さな卵胞による汚染を避けるために特別な注意を払います。
- 個々の卵巣細胞のFISH分析
- トリプシン/EDTA/グルコースまたは間質細胞(n > 1,000)を含む処理した卵巣卵胞(推奨n = 5-20)を、0.15 mM KCl/15 μLのダルベッコリン酸緩衝生理食塩水(DPBS)の5 μLの液滴に移し、37°Cで20分間インキュベートします。
- スライドを乾燥させ、300 μLの0.05 mM KCl/7.5%酢酸/22.5%メタノール中で室温(RT)で2分間プレフィケーションします。スライドをメタノール/酢酸(3:1)でRTで2分間覆い、固定を完了します。
- 5 Lの蒸留水に876 gの塩化ナトリウムと441 gのクエン酸三ナトリウム二水和物を加えて、20倍の標準クエン酸ナトリウム(SSC)を作ります。次に、20x SSC100 mLを900 mLの脱塩(デミ)水に加えて、2x SSCを取得します。サンプルを73°Cの2x SSCで洗浄し、100 μLの2%プロテイナーゼKで覆い、カバーガラスで密封します。ハイブリダイゼーションステーションで37°Cで10分間スライドをインキュベートします。
- カバーガラスを取り外し、RTのDPBSでスライドを5分間洗浄します。 RTで1%ホルムアルデヒドでサンプルを5分間固定します。この段階では、材料はまだスライドガラスに完全に取り付けられていないため、振とうプラットフォームに置かないでください。
- スライドをRTのDPBSで5分間洗浄し、続いて70%、80%、90%、および100%エタノールでそれぞれ2分間脱水します。脱水したサンプルを風乾し、蛍光標識プローブとハイブリダイズします。
- X染色体用のセントロメア特異的プローブと別の染色体特異的セントロメアプローブをコントロールとして選択し、卵巣細胞のX染色体含量を測定します。この場合、X染色体(CEP X [DXZ1])を蛍光色素スペクトラムグリーンで直接標識したセントロメア特異的プローブと、蛍光色素スペクトラムオレンジで直接標識した18番染色体(CEP 18[D18Z1])を用いる。
- 1 μLのCEP X、1 μLのCEP 18、および18 μLのハイブリダイゼーションバッファーをサンプルに加え、ハイブリダイゼーション中のプローブの蒸発を防ぐためにスライドに接着されたカバーガラスで密封します。スライドをハイブリダイゼーションステーションに移して73°Cで3分間変性させ、続いて37°Cで一晩インキュベーションしながらハイブリダイゼーションを行った。
- ハイブリダイゼーション後にカバーガラスと残っている接着剤をスライドから取り除きます。スライドを0.4x SSC/0.3% Tween-20 72°Cで 2 分間洗浄した後、室温で 2x SSC/0.1% Tween-20 中で 1 分間インキュベートします。
- その後、70%、80%、90%、および100%エタノール中で2分間インキュベーションしてスライドを脱水し、暗所で風乾します。スライドを4′,6-ジアミジノ-2-フェニルインドール(DAPI)を含む封入剤で覆います。蛍光顕微鏡による分析の前に、少なくとも10分間-20°Cに保ってください。
- イメージング
- 画像処理ソフトウェアにリンクされた蛍光顕微鏡でX染色体のシグナルを調べます。
- まず、 蛍光色素DAPIを選択します。
- 630倍の倍率で ライブ>キャプチャ>新規セル を選択して画像を取得します。しきい値を含む新しいウィンドウが表示されます。しきい値の青いバーを0に設定するとバックグラウンドが最小になり、赤いバーが最大(255)に設定されて信号が明るくなります。[ 同意する]をクリックします。
- 拡張された新しいウィンドウが表示され、暗い/明るい(12)、半径(3)、および深さ(1)の提案が表示されます。推奨値を使用するか、満足できない場合は調整してください。
- 次に、蛍光色素スペクトラムオレンジを選択し、[キャプチャ]をクリックします。
- しきい値の青いバーを0に設定するとバックグラウンドが最小になり、赤いバーが最大(255)に設定されて信号が明るくなります。[ 同意する]をクリックします。
- 拡張されたウィンドウが表示され、暗い/明るい(-11)、半径(2.7)、および深さ(0.6)の提案が表示されます。推奨値を使用するか、満足できない場合は調整してください。
- 最後に、 蛍光色素スペクトラムグリーン を選択し、[ キャプチャ]をクリックします。
- しきい値の青いバーを0に設定するとバックグラウンドが最小になり、赤いバーが最大(255)に設定されて信号が明るくなります。[ 同意する]をクリックします。
- 強調されたウィンドウが表示され、暗い/明るい(0)、半径(3)、および深さ(0)の提案が表示されます。推奨値を使用するか、満足できない場合は調整してください。新しく作成したファイルに画像を保存します。
注:体細胞は、対照染色体18の2つのシグナルが見える場合にのみ評価されました。ほとんどの卵母細胞では、染色体ごとに1つのシグナルしか検出できませんでした。
- まず、 蛍光色素DAPIを選択します。
- 解析後は、信号の損失を防ぐために、スライドを4°Cの暗所に保管してください。
- 画像処理ソフトウェアにリンクされた蛍光顕微鏡でX染色体のシグナルを調べます。
2.移植卵巣皮質組織のパラフィン切片上のFISHは
注:TSの18人の女性の凍結保存/解凍された卵巣皮質組織の1つの断片を、重度の複合免疫不全(SCID)マウスに5か月間異種移植しました。異種移植の手順は以前に説明されており、動物福祉に関する動物研究委員会の現地ガイドライン(参考文献2014 / UCL / MD / 007)18,19に従って、ルーヴァンカトリック大学(ベルギー、ブリュッセル)で実施されました。
- 卵胞を含む異種移植卵巣皮質組織の切片の選択
- 異種移植卵巣皮質組織を4%ホルムアルデヒドで固定し、その組織をパラフィンに埋め込みます。メスでブロックをトリミングして余分なパラフィンを取り除き、回転ミクロトームでパラフィンブロックを4μmの厚さにカットします。
- ヘマトキシリンおよびエオジン(HE)染色用のパラフィンリボンの7番目のセクションごとに選択して、どのセクションに卵胞が含まれているかを判断します。切片を40〜45°Cの水浴に入れ、免疫組織化学顕微鏡スライドに取り付けます。
- 脱パラフィンとHE染色
- スライドを60°Cで10分間ストーブに置き、その後スライドを100%キシレンに5分間浸します。スライドをストーブの上に直接置く必要はありません。切片を100%エタノール中で15秒間水和させ、続いて96%エタノール中で2 x 15秒間水和させる。スライドを水道水で2分間すすぎます。
- スライドをヘマトキシリンで10分間染色し、その後水道水でスライドを短時間すすいでください。スライドを重炭酸塩溶液(5 Lの蒸留水に100 gの硫酸マグネシウムと10 gの重炭酸ナトリウム)に短時間浸します。スライドを水道水で5分間すすぎます。
- スライドをエオジンで4分間対比染色し、100%エタノール、続いてキシレンでスライドを3回脱水します。スライド上のHE染色をカバースリップし、光学顕微鏡でHE切片を評価して、卵胞のある切片を選択します(倍率100倍)。
- DNA FISHのためのパラフィン切片の前処理とハイブリダイゼーション
- パラフィンリボンから卵胞を含むセクションの前または後にある新しいセクションを選択します。スライドガラスに1つのセクションを取り付けます。パラフィン切片を56°Cのストーブで少なくとも45分間乾燥させます。 スライドをストーブの上に直接置く必要はありません。
- 切片をキシレン中で10分間脱パラフィンします。スライドを99.5%エタノールに浸し、水道水で5分間すすぎます。スライドをターゲット回収溶液(低pH)で96°Cで10分間前処理します。 冷却後、スライドを蒸留水ですすいでください。
- スライドを0.01 M塩酸で5分間処理した後、ペプシン消化(200 U/mL)を37°Cで15分間処理します。 スライドを0.01 M塩酸で再度すすぎ、続いてPBSですすいでください。
- スライドを1%ホルムアルデヒド/ PBSで5分間固定します。スライドをPBSで簡単にすすぎ、次にデミ水で再度すすぎます。スライドを99.5%エタノールで脱水し、風乾させます。
- コントロールとしてX染色体用のセントロメア特異的プローブと別の染色体特異的セントロメアプローブを選択して、顆粒膜細胞のX染色体含量を測定した。ここでは、18番染色体が対照として用いられる。
- 前処理されたスライドに、蛍光色素スペクトラムグリーンで直接標識されたプローブCEP 18(D18Z1)と蛍光色素スペクトラムレッドで直接標識されたプローブCEP X(DXZ1)を5 μL塗布します。カバーガラスを貼り、写真のりでその領域をシールします。スライドをハイブリダイザーに入れ、80°Cで10分間変性し、37°Cで一晩ハイブリダイゼーションを行います。
- 翌日、スライドを42°Cの2x SSCで5分間すすぎ、続いて73°Cの0.3%ノニデットP40で2分間と1分間すすぎます。 2x SSCを更新し、室温で5分間スライドを再度すすぎます。切片が暗所に保たれるようにキュベットを覆います。
- スライドを蒸留水で短時間すすいでください。スライドを99.5%エタノールで脱水し、再び風乾させます。最後に、DAPIと封入剤を含む溶液でスライドをマウントします。
- イメージング
- 630倍の倍率で蛍光顕微鏡で結果を分析します。パソコンで画像処理ソフトウェアを開きます。プロファイルとして FISH を選択します。
- DAPI発光が431 nm、励起が359 nm、テキサスレッド発光が613 nm、励起が595 nm、FITC発光が519 nm、励起が495 nmに設定されているかどうかを確認します。
- [ライブ] > [単一イメージをキャプチャ] を選択してイメージを取得します。左側の画像メニューの露出スライダーとゲインスライダーを動かして、露出とゲインを調整して画質を最適化します(例:露出:212ミリ秒、ゲイン:7.9)。必要な露出とゲインは画像ごとに異なる場合があります。このプロセス中の変化を観察して、最適化された画像を取得します。新しく作成したファイルに画像を保存します。
- 解析後は、信号の損失を防ぐために、スライドを4°Cの暗所に保管してください。
結果
移植前の単離卵巣細胞に対するFISH
45,X/46,XX(患者A)または45,X/46,XX/47,XXX(患者B)TSの女性からの凍結保存された卵巣皮質組織を使用して、このプロトコルを使用した結果を説明しました。患者Aでは、リンパ球の50%が45,X核型を有し、50%が46,XXを有していた。患者Bではリンパ球の38%が45,X、28%が46,XX、34%が47,XXであった。コントロールとしてX染色体(緑)と18番染色体(赤)のセントロメア特異的プローブを使用して、事前の異種移植なしでTS患者の卵巣皮質組織から分離された個々の顆粒膜細胞、間質細胞、および卵母細胞のX染色体含有量を測定しました(図1)。
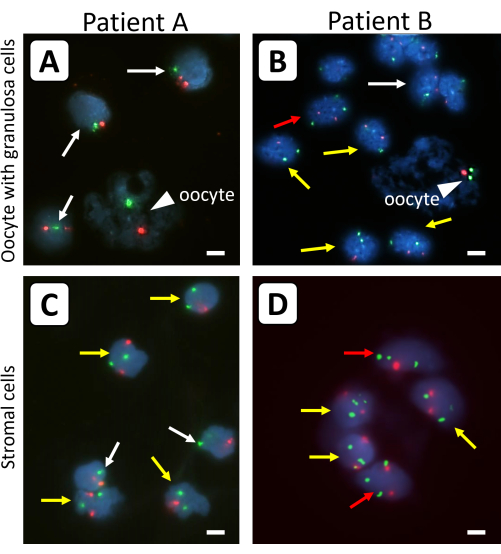
図1:移植前の卵巣皮質組織から単離された卵巣細胞のFISH分析。 単一の始原卵胞(A、B)および(C、D)から卵母細胞(矢印)および顆粒膜細胞を、X染色体(緑色のシグナル)および対照染色体18(赤色のシグナル)の蛍光特異的プローブで分析しました。白い矢印は45,X細胞株を示し、黄色の矢印は46,XX細胞株を示し、赤い矢印は47,XXX細胞株を示す。すべての蛍光シグナルが同じ焦点面にあるわけではありません。バーは10μmを表す。FISH信号の倍率は630倍に設定しました。 この図の拡大版を表示するには、ここをクリックしてください。
FISHの前にトリプシンで処理された個々の原始卵胞となしで処理された個々の原始卵胞の違いを 図2に示します。FISH分析の前にトリプシンを使用することにより、顆粒膜細胞塊および卵母細胞の凝集が少なくなり、個々の顆粒膜細胞および卵母細胞のX染色体含有量の分析が可能になりました。卵母細胞のDNAは、卵母細胞からのDNAの不規則な形状、サイズ、およびびまん性の外観により、周囲の顆粒膜細胞のDNAと容易に区別できます。さらに、これらの細胞内の4つの姉妹染色分体が近接しているため、小卵胞の卵母細胞では、各染色体に対して1つの強いFISHシグナルのみが観察されます。卵母細胞のX染色体含量は、X染色体のFISHシグナルと18番染色体のFISHシグナルの表面比を用いて決定することができる。

図2:FISHの前にトリプシンの有無にかかわらず処理された小さな卵胞。 (A)卵巣皮質組織の酵素消化は、大部分が解離した細胞の懸濁液をもたらしましたが、顆粒膜細胞の単層に囲まれた無傷の卵母細胞からなる原始卵胞を残しました(パネルAの矢印の頭)。(B)細胞懸濁液から小さな卵胞を厳選したが、顆粒膜細胞の凝集によりFISH後のシグナルの解釈が困難であった(C)。(D,E)FISHの前に単離された卵胞をトリプシンでさらに消化すると、個々の顆粒膜細胞が卵胞の表面で球形の形態に収縮し、卵胞から解離してFISH分析にアクセスできるようになる可能性が高まりました。卵母細胞由来のFISHシグナルは矢印で示されています。黒いバーは100μm、白いバーは10μmを表します。FISH信号の倍率は630倍に設定されました。パネルDは、Peekらの許可を得て複製されています。16. この図の拡大版を表示するには、ここをクリックしてください。
移植卵巣皮質組織のパラフィン切片における顆粒膜細胞のFISH解析
二次卵胞および胞状卵胞は酵素消化の影響を受けにくいことが見出されたため、個々の卵巣細胞を得るための前述の組織解離方法は、長期異種移植後に卵巣組織に見られる卵胞の成長には適していません。したがって、FISHプロトコルは、移植後の卵巣皮質組織における二次卵胞および胞状卵胞の顆粒膜細胞のX染色体含有量を決定するために、4μmの組織学的切片を使用して最適化されました(図3)。この設定では、成長する卵胞の卵母細胞の直径が大きいため、卵母細胞のX染色体または制御染色体のいずれかのFISHシグナルが単一の4μmセクションでキャプチャされる可能性は低いです。
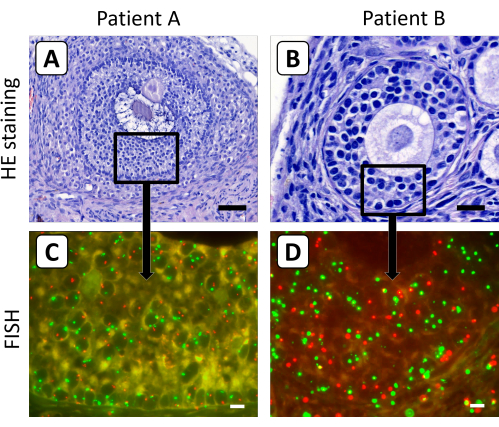
図3:異種移植後の卵巣皮質組織切片の組織学的およびFISH染色。 (A,B)ヘマトキシリン/エオジン染色では、異種移植の5か月後に卵巣皮質組織に形態学的に正常な二次卵胞と胞状卵胞が見られました。(C,D)これらの卵胞の顆粒膜細胞のX染色体含量をFISH分析により測定した。この図では、X染色体は赤色で、18番染色体は緑色で示されています。パネルAのバーは50μm、パネルBのバーは20μm、パネルCとDのバーは10μmを表します。FISH信号の倍率は630倍に設定しました。 この図の拡大版を表示するには、ここをクリックしてください。
最初のステップとして、組織のさまざまな固定技術を使用した実験を実施して、どの方法が最良のFISHシグナルをもたらすかを決定しました。FISH分析は、ブアン溶液の両方に固定され、その後4%ホルムアルデヒドに浸漬された移植組織、および4%ホルムアルデヒドのみに固定された移植組織に対して実施されました。Bouin'sに最初に固定された移植組織は、画像に緑色のもやを表示し、FISHシグナルの数を正確にカウントすることが困難になりました(図4)。

図4:ブアン溶液とホルムアルデヒドのみに固定された移植卵巣皮質組織 。 (A)移植された卵巣皮質組織をブアンの溶液に固定すると、緑色のもやのために濾胞細胞の蛍光シグナルがぼやけ、ほとんど不明瞭になりました。(B)ホルムアルデヒドで固定された卵巣皮質組織は、解釈しやすい優れた蛍光シグナルのみを提供しました。バーは10μmを表す。FISH信号の倍率は630倍に設定しました。 この図の拡大版を表示するには、ここをクリックしてください。
組織切片における卵胞の顆粒膜細胞のX染色体含量を決定するために、顆粒膜細胞のFISHシグナルを単純に計数することは不可能である。個々の顆粒膜細胞の染色体の一部は、組織の切片化のために、特定の組織学的切片で失われる可能性があります。したがって、組織の移植後に新たに形成された二次卵胞および胞状卵胞における異数性による顆粒膜細胞集団のX染色体含有量の損失を最終的に決定する前に、切片化によって失われたFISHシグナルの割合を最初に決定する必要がある。
切片化によるFISHシグナルの消失の割合は、非異数性対照染色体18の顆粒膜細胞当たりのFISHシグナル数を決定することによって算出することができる。切片化により、同じ割合のX染色体が失われると予想されます。顆粒膜細胞集団におけるX染色体FISHシグナルの数のさらなる減少は、異数性によるものである。しかしながら、対照染色体のFISHシグナルを用いて異数性によるX染色体喪失を判定するには、X染色体と対照染色体のFISHシグナルの検出感度が非常に類似していることが必要である。したがって、非異数体46,XX個体の組織学的切片における成長卵胞の顆粒膜細胞における両方のFISHプローブの検出感度が決定されました。染色体X/対照染色体FISHシグナルの比率が1に近い場合、両方のプローブの検出感度は実際に非常に類似していると想定でき、したがって、FISHプローブを使用して、異種移植後の卵巣組織の組織切片の成長卵胞の顆粒膜細胞集団の異数性のレベルを決定できます。
例
46,XX個体の卵巣由来の卵胞の130個の顆粒膜細胞における染色体18番のシグナルの数を分析すると、260個のシグナルが存在することが予想される。しかし、これらの細胞の4μm切片では、204番染色体18のシグナルしか観察されませんでした。これは、信号の21.5%がセクショニング((260-204)/260 x 100 = 21.5%)によって失われていることを示しています。したがって、顆粒膜細胞あたりの染色体18シグナルの数は、切片化により204/130 = 1.57に減少します。
次に、TSを有する雌の卵巣組織に移植した後の胞状卵胞の顆粒膜細胞中のX染色体の数を分析する。合計で、X染色体に対する191のシグナルおよび18番染色体の199のシグナルがカウントされた。顆粒膜細胞数は、18番染色体に対するシグナルの総数を18番染色体18番染色体シグナル数で除することにより決定することができる(199/1.57=127顆粒膜細胞)。最後に、45,X顆粒膜細胞の割合は、18番染色体およびX染色体シグナルの差を顆粒膜細胞の数で割ることによって決定することができる(すなわち、[199-191]/127×100=顆粒膜細胞の6%が45,Xであり、これらの細胞の94%が46、XXである)。
47,XXX細胞株を有する患者では、45,Xおよび47,XXX顆粒膜細胞の混合物が46,XX顆粒膜細胞と同じ数のX染色体シグナルを有するので、47,XXX核型を有する顆粒膜細胞の最小パーセンテージを決定することしかできないことは注目に値する。
ディスカッション
FISH分析は、男性と女性の両方のリンパ球または頬側細胞のX染色体異常を検出するためのよく知られた技術です10。いくつかの研究では、X染色体異常のある男性の配偶子に関するFISHが説明されていますが、X染色体異常のある女性の卵巣細胞に関するFISHによって得られた詳細な情報はまだ不足しています14。この記事では、X染色体異常の女性の非移植および移植卵巣皮質組織の卵巣細胞に異数性が存在するかどうかを判断するためのFISHに基づく新しい方法を紹介します。
移植されていない卵巣皮質組織における個々の卵巣細胞の単離のためのプロトコルの主な課題は、組織の酵素消化にあり、これには事前にいくつかの練習が必要です。十分な卵巣細胞の正確なFISHシグナルを得るためには、酵素消化、インキュベーション時間、および指示温度に関する手順に厳密に従うことが重要です。プロトコルから逸脱すると、プロセス中に卵巣細胞が大幅に失われる可能性があり、これはすでに卵巣予備能が低い患者では特に避けるべきです。この方法の別の重要なステップは、精製された原始卵胞をトリプシンで処理して、卵母細胞と顆粒膜細胞塊が凝集するのを防ぐことです。トリプシンで処理しないと、FISHで確実に分析できる個々の顆粒膜細胞の数が大幅に減少します。
長期移植後に回収された卵巣皮質組織のFISH分析は、個々の卵巣細胞を得るために必要な酵素消化に十分に感受性が高いのは小さな卵胞のみであることがわかったため、異なる技術が必要です。さらに、卵巣皮質組織の自家移植と同様に、移植片が宿主20によって十分に血行再建される前に、低酸素症および栄養素の不足のために移植後に多くの卵胞が失われる。したがって、接ぎ木後の卵胞の数は、接ぎ木前よりもかなり少なくなると予想されます。組織学的切片に使用されるこのFISH技術では、最適なFISHシグナルを得るためにのみ、移植組織を4%ホルムアルデヒドで固定することが重要です。ブアン固定液への卵巣皮質組織の固定は実験室で日常的に使用されており、標準的なHE染色と組み合わせると優れた結果が得られますが、FISHの前にブアンで組織を固定すると、解釈が困難な弱くてぼやけた蛍光シグナルが得られます。
このプロトコルは、卵巣細胞のX染色体含有量の決定に成功することが証明されていますが、それでもいくつかの制限があります。1つの制限は、これらの方法は、数値収差のある女性の卵巣細胞を分析するためにのみ使用できることです。数値収差は、反復配列21に向けられたプローブを用いて検出することができる。これらのプローブは、セントロメア領域において複数の繰り返し塩基対配列をハイブリダイズし、強いハイブリダイゼーションシグナルをもたらす。対照的に、構造異常は、固有の単一配列に対するプローブを使用することによってのみ検出できます。これらのプローブは、一倍体ゲノムに一度だけ発生する配列にハイブリダイズし、数値収差と比較してFISHシグナルの強度がかなり低くなります。これらの比較的弱いFISHシグナルのために、構造異常を有する女性における卵巣細胞のX染色体含有量を適切に決定することは困難である。
第二に、非移植組織における小卵胞の卵母細胞のFISHシグナルは、減数分裂の前期に4つの姉妹染色分体が近接しているため、分析が困難であるI22。卵母細胞には1つの強力なハイブリダイゼーションシグナルしか存在しないため、X染色体含有量を決定するために卵母細胞内のシグナルの数を単純に数えることはできません。代わりに、染色体Xおよび18個のFISHシグナルの表面比を使用して、これらの細胞のX染色体含有量を決定する必要があります。これは、卵母細胞内のFISHシグナルが明確に存在する場合にのみ確実に決定できます。
さらに、移植組織の組織学的切片の小さな卵胞には適切に分析できる顆粒膜細胞が数個しかないため、移植組織上のFISHは、二次卵胞および胞状卵胞からの顆粒膜細胞のX染色体含有量を決定するためにのみ使用できます。さらに、卵母細胞のX染色体含有量は、卵母細胞の直径が大きいため、この方法では正確に決定することができません。
最後に、卵巣細胞または卵巣皮質組織を得るために侵襲的手術が必要であるため、雄性配偶子と比較して雌配偶子を得ることは依然として困難である。したがって、これらの方法は研究環境に適用される可能性が最も高いです。
結論として、X染色体異常を有する女性からの非移植および移植卵巣皮質組織の卵巣細胞のFISH分析は、この特定のグループの卵巣細胞のX染色体含有量に関する洞察を得るためのユニークで有用な技術です。これらの技術は、X染色体異常を有する雌の卵巣皮質組織の凍結保存が可能であり、凍結保存された原始卵胞が二次卵胞および胞状卵胞に成長できることを示しています。ただし、どちらの方法も、X染色体異常のある女性の将来の研究を促進することを目的としており、臨床診療でX染色体異常の女性の生殖転帰をスクリーニングするための診断ツールとして使用するようには設計されていないことに注意してください。
開示事項
著者は開示するものは何もありません。
謝辞
著者らは、マルジョ・ヴァン・ブラーケル、ドミニク・スミーツ、ギヨーム・ファン・デ・ザンデ、パトリシア・ファン・クリーフ、ミラン・インテザールの専門知識と技術支援を認めています。資金源:メルクセローノ(A16-1395)、グッドライフ、フェリング。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
参考文献
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved