Method Article
Explorer les aberrations chromosomiques X dans les cellules ovariennes en utilisant l’hybridation in situ par fluorescence
Dans cet article
Résumé
Cet article présente deux méthodes basées sur l’hybridation in situ par fluorescence pour déterminer le contenu chromosomique X des cellules ovariennes dans le tissu du cortex ovarien non greffé et greffé de femelles présentant des aberrations chromosomiques X.
Résumé
Des millions de personnes dans le monde sont confrontées à des problèmes de fertilité. La baisse de la fertilité, voire l’infertilité, peut être due à de nombreuses causes différentes, y compris des troubles génétiques, dont les anomalies chromosomiques sont les plus courantes. L’hybridation in situ par fluorescence (FISH) est une méthode bien connue et fréquemment utilisée pour détecter les aberrations chromosomiques chez l’homme. FISH est principalement utilisé pour l’analyse des anomalies chromosomiques dans les spermatozoïdes des mâles présentant des aberrations chromosomiques numériques ou structurelles. En outre, cette technique est également fréquemment appliquée chez les femmes pour détecter les aberrations chromosomiques X connues pour causer la dysgénésie ovarienne. Cependant, les informations sur le contenu chromosomique X des cellules ovariennes de femelles présentant des aberrations chromosomiques X dans les lymphocytes et / ou les cellules buccales font encore défaut.
Le but de cette étude est de faire progresser la recherche fondamentale sur les aberrations chromosomiques X chez les femelles, en présentant deux méthodes basées sur FISH pour identifier le contenu chromosomique X des cellules ovariennes. Tout d’abord, une méthode est décrite pour déterminer le contenu chromosomique X de cellules ovariennes isolées (ovocytes, cellules de la granulosa et cellules stromales) dans le tissu du cortex ovarien non greffé de femelles présentant des aberrations chromosomiques X. La deuxième méthode vise à évaluer l’effet des aberrations chromosomiques sur la folliculogenèse en déterminant le contenu chromosomique X des cellules ovariennes des follicules secondaires et antraux nouvellement formés dans le tissu ovarien, à partir de femelles présentant des aberrations chromosomiques X après greffe à long terme chez des souris immunodéprimées. Les deux méthodes pourraient être utiles dans les recherches futures pour mieux comprendre le potentiel de reproduction des femelles présentant des aberrations chromosomiques X.
Introduction
L’infertilité est un problème de santé du système reproducteur masculin ou féminin, affectant environ 186 millions de personnes en âge de procréer dans le monde1. Chez au moins 35% des couples infertiles, l’infertilité est causée par un trouble du système reproducteur féminin2. De nombreux facteurs peuvent causer l’infertilité féminine, tels que des facteurs génétiques, des anomalies des voies génitales, un dysfonctionnement endocrinien, des maladies inflammatoireset un traitement iatrogène3.
Des anomalies génétiques sont présentes chez environ 10 % des femelles infertiles 4,5. De toutes les anomalies génétiques, les aberrations du chromosome X sont la cause la plus fréquente de dysgénésie ovarienne2. Plusieurs études ont rapporté que les aberrations chromosomiques X chez les femmes atteintes du syndrome de Turner (TS) ou du syndrome Triple X sont associées à une insuffisance ovarienne prématurée due à une perte accélérée de cellules germinales ou à une altération de l’oogenèse 6,7,8.
Les aberrations du chromosome X peuvent être divisées en: 1) aberrations numériques, dans lesquelles le nombre de chromosomes X est différent mais les chromosomes X sont intacts; et 2) les aberrations structurelles, dans lesquelles le chromosome X a gagné ou perdu du matériel génétique 3,9. Les aberrations numériques du chromosome X sont plus fréquentes que les anomalies structurelles et sont souvent causées par des erreurs spontanées lors de la division cellulaire 3,9. Lorsqu’une telle erreur se produit pendant la méiose, elle peut conduire à des gamètes aneuploïdes et finalement à une progéniture avec des aberrations chromosomiques dans toutes les cellules. Lorsque des défauts chromosomiques apparaissent dans les cellules somatiques à la suite d’erreurs survenant pendant la mitose dans les premiers stades de l’ontogenèse, cela peut conduire au mosaïcisme. Chez ces individus, les cellules ayant un contenu chromosomique X normal et les cellules présentant des aberrations chromosomiques X sont présentes.
Dans les années 1980, une technique cytogénétique appelée hybridation in situ par fluorescence (FISH) a été développée pour visualiser et localiser des séquences d’acides nucléiques spécifiques sur les chromosomes métaphasiques et interphasiques10,11. Cette technique utilise des sondes d’ADN marquées par fluorescence pour se lier à une séquence spécifique du chromosome, qui peut ensuite être visualisée à l’aide d’un microscope à fluorescence.
De nos jours, FISH est largement utilisé comme outil de diagnostic clinique et est considéré comme l’étalon-or dans la détection des aberrations chromosomiques10. Dans le domaine de la médecine de la reproduction, l’analyse FISH sur le sperme a été utilisée pour mieux comprendre le contenu chromosomique X des spermatozoïdes chez les mâles présentant des aberrations chromosomiques numériques ou structurelles dans les cellules somatiques12,13,14. Ces études ont montré que les hommes présentant des aberrations chromosomiques étaient plus susceptibles d’avoir une fréquence plus élevée de spermatozoïdes aneuploïdes présents dans leur sperme par rapport aux hommes ayant des caryotypesnormaux 12,13,14.
Contrairement aux spermatozoïdes, on sait très peu de choses sur le contenu chromosomique X des cellules ovariennes (y compris les ovocytes, les cellules granulosa / thèques et les cellules stromales) chez les individus présentant une aberration chromosomique, ainsi que sur les conséquences possibles de l’aneuploïdie de ces cellules sur leur potentiel de reproduction. Une raison importante pour le peu d’informations sur le caryotype des cellules ovariennes par rapport aux spermatozoïdes est le fait que les femmes doivent subir une procédure invasive telle qu’une ponction de follicule ou une intervention chirurgicale pour obtenir des ovocytes ou du tissu du cortex ovarien. Les gamètes femelles sont donc difficiles à obtenir à des fins de recherche.
Actuellement, une étude d’intervention observationnelle est en cours aux Pays-Bas pour explorer l’efficacité de la cryoconservation du tissu ovarien chez les jeunes femmes atteintes de TS15. Un fragment du tissu du cortex ovarien de la patiente était disponible pour identifier le contenu chromosomique X des cellules ovariennes16,17. Dans le cadre de l’étude, une nouvelle méthode a été développée basée sur FISH du tissu dissocié du cortex ovarien pour déterminer si des aberrations chromosomiques sont présentes dans les cellules ovariennes chez les femelles porteuses d’une aberration chromosomique dans les cellules somatiques non ovariennes, telles que les lymphocytes ou les cellules buccales. En outre, l’effet de l’aneuploïdie dans les cellules ovariennes sur la folliculogenèse a également été déterminé. À cette fin, un protocole FISH établi a été modifié qui permet l’analyse de coupes histologiques de tissu du cortex ovarien après folliculogenèse induite artificiellement pendant la xénotransplantation à long terme chez des souris immunodéprimées. Dans cette étude, nous présentons deux méthodes basées sur FISH pour déterminer le contenu chromosomique X dans les cellules ovariennes dans le tissu du cortex ovarien non greffé et greffé chez les femmes présentant des aberrations chromosomiques X, dans le but d’améliorer la science fondamentale sur ce sujet.
Protocole
Le protocole de l’étude TurnerFertility a été approuvé par le Comité central de recherche sur des sujets humains (NL57738.000.16). Dans cette étude, le tissu du cortex ovarien de 93 femmes atteintes de SGT a été obtenu. Les matériaux qui nécessitent des précautions de sécurité sont énumérés dans le tableau 1.
Tableau 1 : Précautions de sécurité.
| Matériel | Danger | ||
| Acide acétique | Brûlures graves de la peau et irritation du système respiratoire | ||
| Collagènase | Irritant pour les yeux, le système respiratoire et la peau | ||
| Le | Irritant pour les yeux, le système respiratoire et la peau | ||
| DNase I | Irritant pour les yeux, le système respiratoire et la peau | ||
| Éthanol | Facilement inflammable | ||
| Formaldéhyde | Toxique après inhalation, ingestion et contact cutané | ||
| Formamide (dans les sondes de fluorescence) | Peut nuire à l’enfant à naître | ||
| Liberase | Irritant pour les yeux, le système respiratoire et la peau | ||
| Méthanol | Facilement inflammable, toxique par inhalation, ingestion et contact cutané | ||
| Nonidet P40 | Irritant pour la peau ou les yeux | ||
| Pepsine | Irritant pour les yeux, le système respiratoire et la peau | ||
| Protéinase K | Difficultés respiratoires après inhalation | ||
| Xylène | Hautement inflammable, toxique après inhalation et contact cutané. Évitez tout contact avec les yeux. | ||
Tableau 1 : Matériaux nécessitant des mesures de sécurité.
1. FISH sur des cellules isolées du cortex ovarien
- Dissociation du tissu du cortex ovarien pour obtenir des cellules individuelles
- Couper le tissu du cortex ovarien cryoconservé/décongelé en petits morceaux d’environ 1 mm x 1 mm x 1 mm à l’aide d’un scalpel.
- Digérer par voie enzymatique les fragments de tissu dans 4 mL de milieu L15 préchauffé (37 °C) contenant 0,1 mg/mL de mélange d’enzymes de dissociation tissulaire, 10 μg/mL de DNase I et 1 mg/mL de collagénase I de C. histolyticum pendant un maximum de 75 minutes à 37 °C. Pipeter le mélange de digestion de haut en bas toutes les 15 minutes.
- Arrêtez la digestion enzymatique en ajoutant 4 mL de L15 froide additionnée de sérum fœtal bovin (FBS) à 10%. Laver le tissu dissocié une fois avec 8 mL de milieu L15 froid par centrifugation à 500 x g et remettre en suspension dans 500 μL de milieu L15 sans vortex pour éviter d’endommager les cellules.
- Transférer la suspension cellulaire contenant en grande partie des cellules stromales individuelles et de petits follicules (ovocytes entourés d’une seule couche de cellules de la granulosa) dans une boîte de Petri en plastique et examiner la suspension cellulaire au stéréomicroscope (grossissement 100x).
- Ramasser les petits follicules (<50 μm) manuellement à l’aide d’une pipette en plastique de 75 μm et transférer les follicules dans une gouttelette de milieu L15 supplémentée avec 10% FBS à 4 °C pour empêcher l’agrégation des follicules. Effectuer le ramassage des follicules pendant un maximum de 30 min. Pour améliorer la propagation des cellules folliculaires avant l’analyse FISH, transférer les follicules purifiés dans une solution de trypsine à 0,06 %, 1 mg/mL d’acide éthylènediaminetétraacétique (EDTA) et 1 mg/mL de glucose et incuber pendant 20 minutes à 37 °C.
- Obtenir des cellules stromales ovariennes à partir de la suspension de cellules du cortex à l’aide d’une pipette en plastique de 75 μm, en prenant soin d’éviter la contamination par de petits follicules.
- Analyse FISH de cellules ovariennes individuelles
- Transférer les follicules ovariens traités (n recommandé = 5-20) avec de la trypsine/EDTA/glucose ou des cellules stromales (n > 1 000) à des gouttelettes de 5 μL de 0,15 mM KCl/15 μL de solution saline tamponnée au phosphate de Dulbecco (DPBS) sur une lame et incuber pendant 20 min à 37 °C.
- Sécher et préfixer les lames dans 300 μL de 0,05 mM KCl/7,5 % d’acide acétique/22,5 % de méthanol pendant 2 min à température ambiante (RT). Couvrir les lames de méthanol/acide acétique (3:1) pendant 2 min à TA pour finaliser la fixation.
- Faire 20x le citrate de sodium standard (SSC) en ajoutant 876 g de chlorure de sodium et 441 g de citrate de tri-sodium dihydraté dans 5 L d’eau distillée. Ensuite, ajoutez 100 mL de 20x SSC à 900 mL d’eau déminéralisée (demi) pour obtenir 2x SSC. Lavez l’échantillon dans 2x SSC à 73 °C, recouvrez-le de 100 μL de protéinase K à 2 % et scellez-le avec une lamelle de couverture. Incuber les lames pendant 10 min à 37 °C dans la station d’hybridation.
- Retirer la lame-couverture et laver les lames pendant 5 min dans DPBS at RT. Fixer l’échantillon pendant 5 min avec 1% de formaldéhyde à TA. À ce stade, le matériau n’est pas encore complètement fixé aux lames de verre et ne doit donc pas être placé sur une plate-forme tremblante.
- Laver les lames pendant 5 minutes dans DPBS à TA, suivies d’une déshydratation dans 70%, 80%, 90% et 100% d’éthanol pendant 2 minutes chacune. Sécher à l’air libre l’échantillon déshydraté et l’hybrider avec des sondes marquées par fluorescence.
- Sélectionnez une sonde spécifique du centromère pour le chromosome X et une autre sonde centromérique spécifique au chromosome comme témoin pour déterminer le contenu chromosomique X des cellules ovariennes. Dans ce cas, des sondes spécifiques aux centromères pour le chromosome X (CEP X [DXZ1]) directement marquées avec du fluorochrome SpectrumGreen et le chromosome 18 (CEP 18 [D18Z1]) directement marquées avec du fluorochrome SpectrumOrange sont utilisées.
- Ajouter 1 μL de CEP X, 1 μL de CEP 18 et 18 μL du tampon d’hybridation à l’échantillon et sceller avec un couvercle collé sur les lames pour empêcher l’évaporation de la sonde pendant l’hybridation. Transférer les lames à la station d’hybridation pour une dénaturation à 73 °C pendant 3 min, suivie d’une hybridation pendant une nuit d’incubation à 37 °C.
- Retirez la lamelle de couverture et toute colle restante de la lame après hybridation. Laver les lames dans 0,4x SSC/0,3% Tween-20 à 72 °C pendant 2 min, puis les incuber pendant 1 min dans 2x SSC/0,1% Tween-20 à TA.
- Déshydrater les lames par des incubations ultérieures de 2 minutes dans 70%, 80%, 90% et 100% d’éthanol et sécher à l’air libre dans l’obscurité. Couvrir les lames avec un support de montage contenant du 4′,6-diamidino-2-phénylindole (DAPI). Conserver à -20 °C pendant au moins 10 min avant analyse par microscopie à fluorescence.
- Imagerie
- Examinez le(s) signal(s) pour le chromosome X avec un microscope à fluorescence relié à un logiciel de traitement d’image.
- Tout d’abord, sélectionnez le DAPI fluorochrome.
- Obtenez une image en sélectionnant Nouvelle cellule > Capture > Live à un grossissement de 630x. Une nouvelle fenêtre avec le seuil apparaîtra. Réglez la barre bleue du seuil sur 0 pour minimiser l’arrière-plan et la barre rouge sur maximum (255) pour rendre les signaux plus lumineux. Cliquez sur Accepter.
- Une nouvelle fenêtre avec amélioration apparaîtra avec une suggestion pour plus sombre/plus clair (12), rayon (3) et profondeur (1). Utilisez les valeurs suggérées ou ajustez-les si vous n’êtes pas satisfait.
- Deuxièmement, sélectionnez fluorochrome SpectrumOrange et cliquez sur Capturer.
- Réglez la barre bleue du seuil sur 0 pour minimiser l’arrière-plan et la barre rouge sur maximum (255) pour rendre les signaux plus lumineux. Cliquez sur Accepter.
- La fenêtre avec amélioration apparaîtra avec une suggestion pour plus sombre/plus clair (-11), rayon (2,7) et profondeur (0,6). Utilisez les valeurs suggérées ou ajustez-les si vous n’êtes pas satisfait.
- Enfin, sélectionnez fluorochrome SpectrumGreen et cliquez sur Capturer.
- Réglez la barre bleue du seuil sur 0 pour minimiser l’arrière-plan et la barre rouge sur maximum (255) pour rendre les signaux plus lumineux. Cliquez sur Accepter.
- La fenêtre avec amélioration apparaîtra avec une suggestion pour plus sombre/plus clair (0), rayon (3) et profondeur (0). Utilisez les valeurs suggérées ou ajustez-les si vous n’êtes pas satisfait. Enregistrez l’image dans un fichier nouvellement créé.
REMARQUE: Les cellules somatiques n’ont été évaluées que lorsque deux signaux du chromosome 18 de contrôle étaient visibles. Dans la plupart des ovocytes, un seul signal a pu être détecté pour chaque chromosome.
- Tout d’abord, sélectionnez le DAPI fluorochrome.
- Conservez les lames dans l’obscurité à 4 °C après analyse pour éviter la perte de signaux.
- Examinez le(s) signal(s) pour le chromosome X avec un microscope à fluorescence relié à un logiciel de traitement d’image.
2. FISH sur des sections de paraffine de tissu du cortex ovarien greffé
REMARQUE : Un fragment de tissu du cortex ovarien cryoconservé/décongelé de 18 femelles atteintes du SGT a été xénogreffé à des souris immunodéficientes combinées sévères (DICS) pendant 5 mois. La procédure de xénogreffe a été décrite précédemment et a été menée à l’Université catholique de Louvain (Bruxelles, Belgique) conformément aux directives locales du Comité de la recherche animale concernant le bien-être animal (référence 2014/UCL/MD/007)18,19.
- Sélection de sections de tissu du cortex ovarien xénogreffé contenant des follicules
- Fixez le tissu du cortex ovarien xénogreffé dans du formaldéhyde à 4% et incorporez le tissu dans de la paraffine. Coupez les blocs avec un scalpel pour éliminer la paraffine supplémentaire et coupez le bloc de paraffine à 4 μm d’épaisseur sur un microtome de rotation.
- Sélectionnez une section sur sept du ruban de paraffine pour la coloration à l’hématoxyline et à l’éosine (HE) afin de déterminer quelles sections contiennent des follicules. Placez la section dans un bain-marie à 40-45 °C et montez-les sur des lames de microscope immunohistochimique.
- Déparaffinisation et coloration HE
- Placez les lames sur un poêle pendant 10 min à 60 °C, puis immergez les lames dans 100% xylène pendant 5 min. Il n’est pas nécessaire de placer les lames directement sur le poêle. Hydrater les sections pendant 15 s dans de l’éthanol à 100 %, puis 2 x 15 s dans de l’éthanol à 96 %. Rincer les lames à l’eau du robinet pendant 2 min.
- Colorer les lames dans de l’hématoxyline pendant 10 minutes, puis rincer brièvement les lames à l’eau du robinet. Immerger brièvement les lames dans une solution de bicarbonate (100 g de sulfate de magnésium et 10 g de bicarbonate de sodium dans 5 L d’eau distillée). Rincer les lames à l’eau du robinet pendant 5 min.
- Contre-colorer les lames avec de l’éosine pendant 4 min et déshydrater les lames trois fois avec de l’éthanol à 100%, puis du xylène. Couvrir les taches HE sur les lames et évaluer les sections HE au microscope optique pour sélectionner les sections avec follicules (grossissement 100x).
- Prétraitement et hybridation de coupes de paraffine pour DNA FISH
- Sélectionnez de nouvelles sections qui se trouvent avant ou après la section contenant des follicules du ruban de paraffine. Montez une section sur une lame de verre. Sécher les sections de paraffine pendant au moins 45 min sur un poêle à 56 °C. Il n’est pas nécessaire de placer les lames directement sur le poêle.
- Déparaffiner les sections dans le xylène pendant 10 min. Plongez les lames dans de l’éthanol à 99,5% et rincez-les pendant 5 min à l’eau du robinet. Prétraiter les lames avec une solution de récupération cible (pH bas) pendant 10 min à 96 °C. Après refroidissement, rincer les lames à l’eau distillée.
- Traiter les lames pendant 5 min avec de l’acide chlorhydrique 0,01 M, puis digérer la pepsine (200 U/mL) pendant 15 min à 37 °C. Rincer à nouveau les lames dans de l’acide chlorhydrique 0,01 M, puis dans du PBS.
- Fixer les lames dans 1% de formaldéhyde/PBS pendant 5 min. Rincer brièvement les lames dans du PBS, puis à nouveau dans de l’eau demi. Déshydratez les lames dans de l’éthanol à 99,5 % et laissez-les sécher à l’air.
- Sélectionnez une sonde spécifique du centromère pour le chromosome X et une autre sonde centromérique spécifique au chromosome comme témoin pour déterminer le contenu chromosomique X des cellules de la granulosa. Ici, le chromosome 18 est utilisé comme témoin.
- Appliquer 5 μL de sonde CEP 18 (D18Z1) directement marquée avec du fluorochrome SpectrumGreen et sonde CEP X (DXZ1) directement marquée avec du fluorochrome SpectrumRed sur les lames prétraitées. Appliquez un bordereau de couverture et scellez la zone avec de la colle photo. Placer les lames dans un hybrideur pour dénaturation à 80 °C pendant 10 min et hybridation pendant une nuit à 37 °C.
- Le lendemain, rincer les lames pendant 5 min dans 2x SSC à 42 °C, suivi d’un rinçage de 2 min et d’un rinçage de 1 min dans du Nonidet P40 à 0,3 % à 73 °C. Rafraîchir le 2x SSC et rincer à nouveau les lames pendant 5 min à température ambiante. Couvrir la cuvette de manière à ce que les sections soient maintenues dans l’obscurité.
- Rincer brièvement les lames à l’eau distillée. Déshydratez les lames dans de l’éthanol à 99,5 % et laissez-les sécher à l’air libre. Enfin, montez les diapositives avec une solution contenant DAPI et support de montage.
- Imagerie
- Analysez les résultats au microscope à fluorescence à un grossissement de 630x. Ouvrez le logiciel de traitement d’image sur l’ordinateur. Sélectionnez FISH comme profil.
- Vérifiez si l’émission DAPI est réglée à 431 nm et l’excitation à 359 nm, l’émission rouge Texas à 613 nm et l’excitation à 595 nm, et l’émission FITC à 519 nm et l’excitation à 495 nm.
- Acquérir une image en sélectionnant Live > Capture Single Image. Optimisez la qualité de l’image en ajustant l’exposition et le gain en déplaçant le curseur d’exposition et le curseur de gain dans le menu Image à gauche (par exemple, exposition : 212 ms et gain : 7,9). L’exposition et le gain requis peuvent varier selon l’image; Observez les changements au cours de ce processus pour obtenir une image optimisée. Enregistrez l’image dans un fichier nouvellement créé.
- Conservez les lames dans l’obscurité à 4 °C après analyse pour éviter la perte de signaux.
Résultats
FISH sur cellules ovariennes isolées avant la greffe
Des tissus du cortex ovarien cryoconservés de femelles atteintes de 45,X/46,XX (patient A) ou 45,X/46,XX/47,XXX (patient B) TS ont été utilisés pour illustrer les résultats à l’aide de ce protocole. Chez le patient A, 50% des lymphocytes avaient un caryotype 45,X et 50% avaient 46,XX. Chez le patient B, 38% des lymphocytes étaient 45,X, 28% étaient 46,XX et 34% étaient 47,XXX. Des sondes spécifiques aux centromères pour le chromosome X (vert) et le chromosome 18 comme témoin (rouge) ont été utilisées pour déterminer le contenu chromosomique X de cellules de granulosa individuelles, de cellules stromales et d’ovocytes isolés du tissu du cortex ovarien de patientes atteintes de SGT sans xénotransplantation préalable (Figure 1).
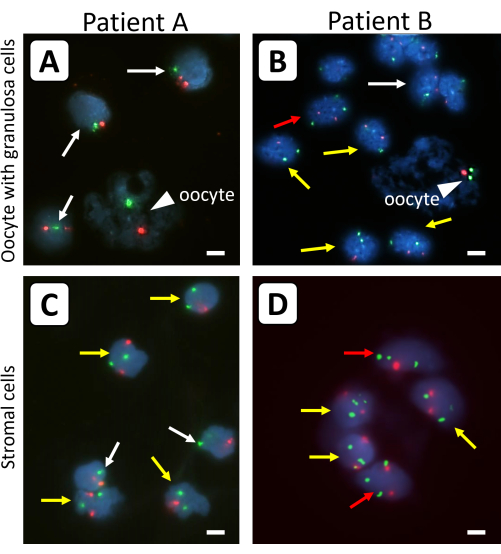
Figure 1 : Analyse FISH de cellules ovariennes isolées provenant de tissus du cortex ovarien avant la greffe. Les ovocytes (pointes de flèches) et les cellules de la granulosa provenant de follicules primordiaux simples (A, B) et (C, D) des cellules stromales environnantes ont été analysés avec des sondes spécifiques fluorescentes pour le chromosome X (signaux verts) et le chromosome 18 de contrôle (signaux rouges). Les flèches blanches indiquent 45,X lignées cellulaires, les flèches jaunes indiquent 46,XX lignées cellulaires et les flèches rouges indiquent 47,XXX lignées cellulaires. Tous les signaux fluorescents ne sont pas dans le même plan de mise au point. Les barres représentent 10 μm. Le grossissement des signaux FISH a été réglé à 630x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les différences entre les follicules primordiaux individuels qui ont été traités avec et sans trypsine avant FISH sont montrées à la figure 2. En utilisant la trypsine avant l’analyse FISH, la masse cellulaire de la granulosa et les ovocytes étaient moins agglomérés, ce qui a permis d’analyser le contenu chromosomique X des cellules et des ovocytes individuels de la granulosa. L’ADN des ovocytes peut facilement être distingué de celui des cellules de la granulosa environnantes en raison de la forme irrégulière, de la taille et de l’aspect diffus de l’ADN des ovocytes. De plus, un seul signal FISH fort pour chaque chromosome est observé dans les ovocytes des petits follicules, en raison de la proximité des quatre chromatides sœurs dans ces cellules. Le contenu chromosomique X des ovocytes peut être déterminé en utilisant le rapport de surface du signal FISH pour le chromosome X à celui du chromosome 18.

Figure 2 : Petits follicules traités avec et sans trypsine avant FISH. (A) La digestion enzymatique du tissu du cortex ovarien a entraîné une suspension de cellules largement dissociées mais laissant les follicules primordiaux, constitués d’un ovocyte intact entouré d’une seule couche de cellules de la granulosa (pointes de flèches dans le panneau A). (B) De petits follicules ont été prélevés à la main dans la suspension cellulaire, mais ont fourni des difficultés pour interpréter les signaux après FISH en raison de l’agglutination des cellules de la granulosa (C). (D, E) Une digestion supplémentaire des follicules isolés avec de la trypsine avant FISH a entraîné la contraction des cellules individuelles de la granulosa en une morphologie sphérique à la surface des follicules et étaient plus susceptibles de se dissocier du follicule pour devenir accessibles pour l’analyse FISH. Les signaux FISH dérivés des ovocytes sont indiqués par des flèches. Les barres noires représentent 100 μm et les barres blanches représentent 10 μm. Le grossissement des signaux FISH a été réglé à 630x. Le panneau D a été reproduit avec la permission de Peek et al.16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse FISH de cellules de granulosa sur des coupes de paraffine de tissu du cortex ovarien greffé
Les follicules secondaires et antraux se sont avérés moins sensibles à la digestion enzymatique, ce qui rend la méthode de dissociation tissulaire décrite précédemment pour obtenir des cellules ovariennes individuelles non adaptées à la croissance des follicules trouvés dans le tissu ovarien après une xénogrification à long terme. Par conséquent, le protocole FISH a été optimisé en utilisant des coupes histologiques de 4 μm pour déterminer le contenu chromosomique X des cellules de la granulosa des follicules secondaires et antraux dans le tissu du cortex ovarien après greffe (Figure 3). Dans ce contexte, il est peu probable que le signal FISH du chromosome X ou du chromosome témoin dans les ovocytes soit capturé dans une seule section de 4 μm, en raison du grand diamètre des ovocytes dans les follicules en croissance.
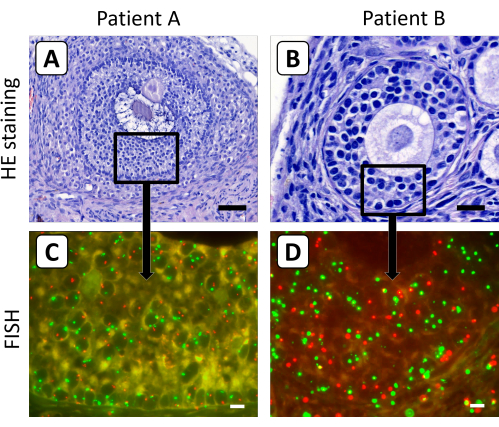
Figure 3 : Coloration histologique et FISH de coupes de tissu du cortex ovarien après xénotransplantation. (A,B) La coloration à l’hématoxyline/éosine a montré des follicules secondaires et antraux morphologiquement normaux dans le tissu du cortex ovarien après 5 mois de xénogrographie. (C, D) Le contenu chromosomique X des cellules de la granulosa de ces follicules a été déterminé par analyse FISH. Sur cette figure, le chromosome X est représenté en rouge et le chromosome 18 en vert. La barre du panneau A représente 50 μm, la barre du panneau B représente 20 μm et les barres des panneaux C et D représentent 10 μm. Le grossissement des signaux FISH a été réglé à 630x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dans un premier temps, des expériences avec différentes techniques de fixation des tissus ont été effectuées pour déterminer quelle méthode donne les meilleurs signaux FISH. L’analyse FISH a été réalisée sur du tissu greffé qui a été fixé à la fois dans la solution de Bouin et ensuite immergé dans du formaldéhyde à 4%, et sur du tissu greffé qui a été fixé dans du formaldéhyde à 4% seulement. Le tissu greffé qui a d’abord été fixé chez Bouin présentait une brume verte sur l’image, ce qui rendait difficile le comptage précis du nombre de signaux FISH (Figure 4).

Figure 4 : Tissu greffé du cortex ovarien fixé dans la solution de Bouin et formaldéhyde uniquement. (A) La fixation du tissu du cortex ovarien greffé dans la solution de Bouin a entraîné des signaux fluorescents flous et largement obscurcis dans les cellules folliculaires en raison d’une brume verte. (B) Le tissu du cortex ovarien qui était fixé dans le formaldéhyde ne fournissait que d’excellents signaux fluorescents faciles à interpréter. Les barres représentent 10 μm. Le grossissement des signaux FISH a été réglé à 630x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Afin de déterminer le contenu chromosomique X des cellules de granulosa des follicules dans les coupes histologiques, il n’est pas possible de simplement compter les signaux FISH des cellules de la granulosa. Une partie des chromosomes d’une cellule de granulosa individuelle peut être perdue dans une certaine section histologique, en raison de la section du tissu. Par conséquent, il est nécessaire de déterminer d’abord le pourcentage de signaux FISH perdus en raison de la sectionnement avant de déterminer finalement la perte de contenu chromosomique X de la population de cellules de la granulosa due à l’aneuploïdie dans les follicules secondaires et antraux nouvellement formés après greffe du tissu.
Le pourcentage de signaux FISH perdus en raison de la section peut être calculé en déterminant le nombre de signaux FISH par cellule de granulosa du chromosome témoin 18 non aneuploïde. On s’attend à ce que le même pourcentage du chromosome X soit perdu en raison de la section. Toute réduction supplémentaire du nombre de signaux FISH du chromosome X dans la population de cellules de la granulosa est due à l’aneuploïdie. Cependant, l’utilisation des signaux FISH d’un chromosome témoin pour déterminer la perte chromosomique X due à l’aneuploïdie nécessite que la sensibilité de détection des signaux FISH du chromosome X et du chromosome témoin soit très similaire. La sensibilité de détection des deux sondes FISH dans les cellules de la granulosa des follicules en croissance dans les coupes histologiques d’individus non aneuploïdes 46,XX a donc été déterminée. Lorsque le rapport chromosome X/chromosome témoin signaux FISH est proche de 1, on peut supposer que la sensibilité de détection des deux sondes est en effet très similaire, et que les sondes FISH peuvent donc être utilisées pour déterminer le niveau d’aneuploïdie dans la population de cellules de la granulosa des follicules en croissance dans les coupes histologiques du tissu ovarien après xénotransplantation.
Exemple
Lors de l’analyse du nombre de signaux du chromosome 18 dans 130 cellules de granulosa d’un follicule d’un ovaire d’un individu 46,XX, on s’attend à ce que 260 signaux soient présents. Cependant, dans une section de 4 μm de ces cellules, seulement 204 signaux du chromosome 18 ont été observés. Cela indique que 21,5 % des signaux sont perdus en raison de la section ((260-204)/260 x 100 = 21,5 %). Le nombre de signaux du chromosome 18 par cellule de la granulosa est donc réduit à 204/130 = 1,57 en raison de la section.
Ensuite, le nombre de chromosomes X dans les cellules de la granulosa d’un follicule antral après greffe dans le tissu ovarien d’une femme atteinte de SGT est analysé. Au total, 191 signaux pour le chromosome X et 199 signaux pour le chromosome 18 ont été comptés. Le nombre de cellules de la granulosa peut être déterminé en divisant le nombre total de signaux pour le chromosome 18 par le nombre de signaux du chromosome 18 par cellule de la granulosa (199/1,57 = 127 cellules de la granulosa). Enfin, le pourcentage de cellules de granulosa 45,X peut être déterminé en divisant la différence dans les signaux du chromosome 18 et du chromosome X par le nombre de cellules de la granulosa (c.-à-d. [199-191]/127 x 100 = 6% des cellules de la granulosa sont 45,X, et 94% de ces cellules sont 46, XX).
Il est à noter que, chez les patients avec une lignée cellulaire 47,XXX, il n’est possible de déterminer que le pourcentage minimum de cellules de granulosa avec un caryotype 47,XXX, car un mélange de cellules de granulosa 45,X et 47,XXX a le même nombre de signaux chromosomiques X que les cellules de granulosa 46,XX.
Discussion
L’analyse FISH est une technique bien connue pour détecter les aberrations chromosomiques X dans les lymphocytes ou les cellules buccales des mâles et des femelles10. Plusieurs études ont décrit FISH sur des gamètes de mâles présentant des aberrations chromosomiques X, mais les informations détaillées obtenues par FISH sur les cellules ovariennes de femelles présentant des aberrations chromosomiques X font encore défaut14. Cet article présente de nouvelles méthodes basées sur FISH pour déterminer si l’aneuploïdie est présente dans les cellules ovariennes du tissu du cortex ovarien non greffé et greffé de femelles présentant des aberrations chromosomiques X.
Le principal défi du protocole pour l’isolement de cellules ovariennes individuelles dans le tissu du cortex ovarien non greffé réside dans la digestion enzymatique du tissu, qui nécessite une certaine pratique au préalable. Afin d’obtenir des signaux FISH précis de cellules ovariennes suffisantes, il est important de suivre strictement les étapes concernant la digestion enzymatique, les temps d’incubation et les températures indiquées. S’écarter du protocole peut entraîner une perte substantielle de cellules ovariennes au cours du processus, ce qui doit être évité en particulier chez les patientes qui ont déjà une faible réserve ovarienne. Une autre étape critique de cette méthode consiste à traiter les follicules primordiaux purifiés avec de la trypsine pour empêcher les ovocytes et la masse cellulaire de la granulosa de s’agglutiner, ce qui empêche l’analyse des cellules individuelles. Sans traitement à la trypsine, le nombre de cellules individuelles de la granulosa pouvant être analysées de manière fiable par FISH est considérablement réduit.
L’analyse FISH sur le tissu du cortex ovarien prélevé après une greffe à long terme nécessite une technique différente, car seuls les petits follicules se sont révélés suffisamment sensibles à la digestion enzymatique nécessaire pour obtenir des cellules ovariennes individuelles. En outre, à l’instar de l’autotransplantation du tissu du cortex ovarien, de nombreux follicules se perdent après la greffe en raison de l’hypoxie et d’un manque de nutriments avant que le greffon ne soit suffisamment revascularisé par l’hôte20. Le nombre de follicules après greffe devrait donc être considérablement inférieur à celui avant greffe. Pour cette technique FISH utilisée pour les coupes histologiques, il est important de fixer le tissu greffé dans du formaldéhyde à 4% uniquement pour obtenir des signaux FISH optimaux. La fixation du tissu du cortex ovarien dans le fixateur de Bouin est couramment utilisée en laboratoire, et bien que cela donne d’excellents résultats lorsqu’il est combiné avec la coloration HE standard, la fixation du tissu avec le tissu de Bouin avant FISH conduit à des signaux fluorescents faibles et flous qui sont difficiles à interpréter.
Bien que ce protocole se soit avéré efficace pour déterminer le contenu chromosomique X des cellules ovariennes, il présente encore certaines limites. Une limite est que ces méthodes ne peuvent être utilisées que pour analyser les cellules ovariennes des femmes présentant des aberrations numériques. Les aberrations numériques peuvent être détectées à l’aide de sondes dirigées vers des séquences répétitives21. Ces sondes hybrident plusieurs séquences de paires de bases répétitives dans la région du centromère, ce qui entraîne de forts signaux d’hybridation. En revanche, les aberrations structurelles ne peuvent être détectées qu’en utilisant des sondes contre des séquences uniques uniques. Ces sondes s’hybrident en séquences qui ne se produisent qu’une seule fois dans le génome haploïde, ce qui entraîne un signal FISH considérablement moins intense que les aberrations numériques. En raison de ces signaux FISH relativement faibles, il est difficile de déterminer correctement le contenu chromosomique X des cellules ovariennes chez les femelles présentant des aberrations structurelles.
Deuxièmement, les signaux FISH des ovocytes de petits follicules dans les tissus non greffés sont difficiles à analyser, en raison de la proximité des quatre chromatides sœurs dans la prophase de la méiose I22. Un seul signal d’hybridation fort sera présent dans les ovocytes, et il n’est donc pas possible de simplement compter le nombre de signaux dans les ovocytes pour déterminer le contenu chromosomique X. Au lieu de cela, le rapport de surface du chromosome X et des 18 signaux FISH devrait être utilisé pour déterminer le contenu chromosomique X dans ces cellules. Cela ne peut être déterminé de manière fiable que si les signaux FISH dans les ovocytes sont clairement présents.
De plus, FISH sur le tissu greffé ne peut être utilisé que pour déterminer le contenu chromosomique X des cellules de la granulosa à partir de follicules secondaires et antraux, car les petits follicules dans les sections histologiques du tissu greffé n’ont que quelques cellules de la granulosa qui peuvent être correctement analysées. De plus, le contenu chromosomique X des ovocytes ne peut pas être déterminé avec précision à l’aide de cette méthode en raison du grand diamètre des ovocytes.
Enfin, il reste difficile d’obtenir des gamètes femelles par rapport aux gamètes mâles car une chirurgie invasive est nécessaire pour obtenir des cellules ovariennes ou du tissu du cortex ovarien. Par conséquent, ces méthodes sont plus susceptibles d’être appliquées dans un contexte de recherche.
En conclusion, l’analyse FISH des cellules ovariennes du tissu du cortex ovarien non greffé et greffé de femelles présentant des aberrations chromosomiques X est une technique unique et utile pour mieux comprendre le contenu chromosomique X des cellules ovariennes de ce groupe spécifique. Ces techniques montrent que la cryoconservation du tissu du cortex ovarien de femelles présentant des aberrations chromosomiques X est possible et que les follicules primordiaux cryoconservés sont capables de se développer en follicules secondaires et antraux. Cependant, il convient de garder à l’esprit que les deux méthodes sont destinées à faciliter la recherche future chez les femmes présentant des aberrations chromosomiques X et ne sont pas conçues pour être utilisées comme outil de diagnostic pour dépister les résultats reproductifs des femmes présentant des aberrations chromosomiques X dans la pratique clinique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Marjo van Brakel, Dominique Smeets, Guillaume van de Zande, Patricia van Cleef et Milan Intezar pour leur expertise et leur assistance technique. Sources de financement : Merck Serono (A16-1395), Goodlife et Ferring.
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
Références
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon