Method Article
Fluorescence In Situ Hybridization을 사용한 난소 세포의 X 염색체 이상 탐색
요약
이 기사는 X 염색체 이상이 있는 여성의 비이식 및 이식된 난소 피질 조직에서 난소 세포의 X 염색체 함량을 결정하기 위한 형광 제자리 혼성화를 기반으로 하는 두 가지 방법을 제시합니다.
초록
전 세계 수백만 명의 사람들이 다산과 관련된 문제를 다루고 있습니다. 생식력 감소 또는 불임은 염색체 이상이 가장 흔한 유전 질환을 비롯한 다양한 원인으로 인해 발생할 수 있습니다. FISH(Fluorescence in situ hybridization)는 인간의 염색체 이상을 감지하기 위해 잘 알려져 있고 자주 사용되는 방법입니다. FISH는 주로 수치적 또는 구조적 염색체 이상이 있는 남성의 정자에서 염색체 이상을 분석하는 데 사용됩니다. 또한, 이 기술은 난소 이형성을 유발하는 것으로 알려진 X 염색체 이상을 감지하기 위해 여성에게도 자주 적용됩니다. 그러나 림프구 및/또는 협측 세포에서 X 염색체 이상이 있는 여성의 난소 세포의 X 염색체 함량에 대한 정보는 여전히 부족합니다.
이 연구의 목적은 난소 세포의 X 염색체 함량을 확인하기 위해 FISH를 기반으로 한 두 가지 방법을 제시함으로써 여성의 X 염색체 이상에 관한 기초 연구를 발전시키는 것입니다. 먼저, X 염색체 이상을 갖는 여성으로부터 이식되지 않은 난소 피질 조직에서 단리된 난소 세포(난모세포, 과립구 세포 및 기질 세포)의 X 염색체 함량을 측정하는 방법이 설명된다. 두 번째 방법은 면역 저하 마우스에 장기간 이식 한 후 X 염색체 이상을 가진 여성으로부터 난소 조직에서 새로 형성된 2 차 및 전방 난포의 난소 세포의 X 염색체 함량을 결정함으로써 모낭 형성에 대한 염색체 이상의 영향을 평가하는 것입니다. 두 방법 모두 X 염색체 이상을 가진 여성의 생식 가능성에 대한 통찰력을 얻기 위한 향후 연구에 도움이 될 수 있습니다.
서문
불임은 남성 또는 여성의 생식 기관의 건강 문제로, 전 세계적으로 약 1억 8,600만 명의 가임기 개인에게 영향을 미칩니다1. 불임 부부의 35% 이상에서 불임은 여성 생식 기관의 장애로 인해 발생한다2. 여성 불임의 원인은 유전적 요인, 생식기 이상, 내분비 기능 장애, 염증성 질환, 의원성 치료 등 여러 가지가 있다3.
유전적 이상은 불임 여성의 약 10%에서 나타난다 4,5. 모든 유전적 이상 중에서 X 염색체 이상은 난소 이형성증의 가장 흔한 원인이다2. 여러 연구에서 터너 증후군(Turner syndrome, TS) 또는 트리플 X 증후군(Triple X syndrome)이 있는 여성의 X 염색체 이상은 생식 세포의 가속화된 손실 또는 난소 형성 장애로 인한 조기 난소 부전과 관련이 있다고 보고되었다 6,7,8.
X 염색체의 수차는 다음과 같이 나눌 수 있습니다 : 1) X 염색체의 수는 다르지만 X 염색체는 손상되지 않은 수치 수차; 2) X 염색체가 유전 물질을 얻거나 잃는 구조적 이상 3,9. X 염색체의 수치 이상은 구조적 이상보다 더 흔하며 종종 세포 분열 중 자발적인 오류로 인해 발생합니다 3,9. 감수 분열 중에 이러한 오류가 발생하면 이수성 배우자로 이어질 수 있으며 궁극적으로 모든 세포에서 염색체 이상이있는 자손이 될 수 있습니다. 개체 발생의 초기 단계에서 유사 분열 동안 발생하는 오류의 결과로 체세포에서 염색체 결함이 발생하면 모자이크 현상으로 이어질 수 있습니다. 이 개체들에는 정상적인 X 염색체 함량을 가진 세포와 X 염색체 이상을 가진 세포가 모두 존재합니다.
1980년대에는 중기 및 간기 염색체10,11에서 특정 핵산 서열을 시각화하고 찾기 위해 FISH(Fluorescence in situ hybridization)라는 세포유전학적 기술이 개발되었습니다. 이 기술은 형광 표지 DNA 프로브를 사용하여 염색체의 특정 서열에 결합한 다음 형광 현미경을 사용하여 시각화할 수 있습니다.
오늘날 FISH는 임상 진단 도구로 널리 사용되고 있으며 염색체 이상을 감지하는 데 있어 황금 표준으로 여겨진다10. 생식 의학 분야에서, 정자에 대한 FISH 분석은 체세포에서 수치적 또는 구조적 염색체 이상을 가진 남성의 정자의 X 염색체 함량에 대한 통찰력을 얻기 위해 사용되어 왔다12,13,14. 이 연구는 염색체 이상을 가진 남성이 정상적인 핵형을 가진 남성에 비해 정액에 존재하는 이수성 정자의 빈도가 더 높다는 것을 보여주었습니다12,13,14.
정자와는 대조적으로, 염색체 이상이 있는 개인의 난소 세포(난모세포, 과립구/테카 세포 및 기질 세포 포함)의 X 염색체 함량과 이러한 세포의 이수성이 생식 가능성에 미칠 수 있는 결과에 대해서는 알려진 바가 거의 없습니다. 정자에 비해 난소 세포의 핵형에 대한 정보가 부족한 중요한 이유는 여성이 난모세포나 난소 피질 조직을 얻기 위해 난포 천자나 수술과 같은 침습적 시술을 받아야 하기 때문입니다. 따라서 암컷 배우자는 연구 목적으로 얻기가 어렵습니다.
현재 네덜란드에서는 TS15를 가진 젊은 여성에서 난소 조직 냉동 보존의 효능을 조사하기 위해 관찰 개입 연구가 수행되고 있습니다. 환자의 난소 피질 조직의 한 단편은 난소 세포의 X 염색체 함량을 확인하기 위해 이용 가능하였다16,17. 연구의 일환으로, 해리된 난소 피질 조직의 FISH를 기반으로 한 새로운 방법이 개발되어 림프구 또는 협측 세포와 같은 비난소 체세포에서 염색체 이상을 수행하는 여성의 난소 세포에 염색체 이상이 존재하는지 확인했습니다. 또한, 난소 세포에서 이수성이 모낭 형성에 미치는 영향도 측정되었습니다. 이를 위해, 면역저하 마우스에서 장기간 이종이식 동안 인위적으로 유도된 모낭 형성 후 난소 피질 조직의 조직학적 절편을 분석할 수 있도록 확립된 FISH 프로토콜이 수정되었습니다. 이 연구에서 우리는 이 주제에 대한 기초 과학을 개선하기 위해 X 염색체 이상이 있는 여성의 비이식 및 이식된 난소 피질 조직에서 난소 세포의 X 염색체 함량을 결정하기 위해 FISH를 기반으로 하는 두 가지 방법을 제시합니다.
프로토콜
TurnerFertility 연구 프로토콜은 인간 피험자와 관련된 중앙 연구 위원회(NL57738.000.16)의 승인을 받았습니다. 이 연구에서는 TS를 가진 93명의 여성의 난소 피질 조직을 얻었습니다. 안전 예방 조치가 필요한 재료는 표 1에 나열되어 있습니다.
표 1: 안전 예방 조치.
| 재료 | 위험 | ||
| 아세트산 | 심한 피부 화상과 호흡기 자극 | ||
| 콜라게나제 | 눈, 호흡기 및 피부에 자극적입니다 | ||
| 증권 시세 표시기 | 눈, 호흡기 및 피부에 자극적입니다 | ||
| DNase I | 눈, 호흡기 및 피부에 자극적입니다 | ||
| 에탄올 | 고인화성 | ||
| 포름알데히드 | 흡입, 섭취 및 피부 접촉 후 독성 | ||
| 포름 아미드 (형광 프로브에서) | 태아에게 해를 끼칠 수 있습니다 | ||
| 리베라제 | 눈, 호흡기 및 피부에 자극적입니다 | ||
| 메탄올 | 고인화성, 흡입, 섭취 및 피부 접촉에 의한 독성 | ||
| 노니뎃 P40 | 피부나 눈에 자극적 | ||
| 펩신 | 눈, 호흡기 및 피부에 자극적입니다 | ||
| 프로테이나제 K | 흡입 후 호흡 곤란 | ||
| 크실렌 | 인화성이 높고 흡입 및 피부 접촉 후 독성이 있습니다. 눈과의 접촉을 피하십시오. | ||
표 1: 안전 예방 조치가 필요한 재료.
1. 분리된 개별 난소 피질 세포에 대한 FISH
- 개별 세포를 얻기 위한 난소 피질 조직의 해리
- 메스를 사용하여 냉동 보존/해동된 난소 피질 조직을 약 1mm x 1mm x 1mm의 작은 조각으로 자릅니다.
- 0.1mg/mL 조직 해리 효소 혼합물, 10μg/mL DNase I 및 C. histolyticomin 의 1mg/mL 콜라게나제 I을 포함하는 예열된(37°C) L15 배지 4mL에서 조직 단편을 37°C에서 최대 75분 동안 효소적으로 분해합니다. 15분마다 소화 믹스를 위아래로 피펫합니다.
- 10% 소 태아 혈청(FBS)이 보충된 차가운 L15 4mL를 추가하여 효소 소화를 중지합니다. 해리된 조직을 500 x g 에서 원심분리하여 8mL의 차가운 L15 배지로 한 번 세척하고 세포 손상을 방지하기 위해 볼텍싱 없이 500μL의 L15 배지에 재현탁합니다.
- 주로 개별적인 기질 세포와 작은 모낭(과립구 세포의 단일 층으로 둘러싸인 난모세포)을 포함하는 세포 현탁액을 플라스틱 페트리 접시에 옮기고 실체 현미경(100x 배율)으로 세포 현탁액을 검사합니다.
- 75μm 플라스틱 피펫을 사용하여 작은 모낭(<50μm)을 수동으로 채취하고, 모낭의 응집을 방지하기 위해 4°C에서 10% FBS가 보충된 L15 배지 방울로 모낭을 옮깁니다. 최대 30분 동안 모낭 픽업을 수행합니다. FISH 분석 전에 모낭 세포 확산을 개선하기 위해 정제된 모낭을 0.06% 트립신, 1mg/mL 에틸렌디아민테트라아세트산(EDTA) 및 1mg/mL 포도당 용액으로 옮기고 37°C에서 20분 동안 배양합니다.
- 75μm 플라스틱 피펫을 사용하여 피질 세포 현탁액에서 난소 기질 세포를 얻고 작은 모낭으로 인한 오염을 피하기 위해 특별한 주의를 기울입니다.
- 개별 난소 세포의 FISH 분석
- 트립신/EDTA/포도당 또는 기질 세포(n > 1,000)로 처리된 난소 난포(권장 n = 5-20)를 슬라이드에서 0.15mM KCl/15μL의 Dulbecco 인산염 완충 식염수(DPBS) 5μL 방울로 옮기고 37°C에서 20분 동안 배양합니다.
- 실온(RT)에서 2분 동안 0.05mM KCl/7.5% 아세트산/22.5% 메탄올 300μL에 슬라이드를 건조하고 사전 고정합니다. 슬라이드를 메탄올/아세트산(3:1)으로 RT에서 2분 동안 덮어 고정을 완료합니다.
- 5L의 증류수에 876g의 염화나트륨과 441g의 시트르산삼나트륨 이수화물을 첨가하여 20배 표준 구연산나트륨(SSC)을 만듭니다. 다음으로, 20x SSC 100mL를 탈염수(demi) 물 900mL에 첨가하여 2x SSC를 얻습니다. 샘플을 73°C에서 2x SSC로 세척하고 100μL의 2% 프로테이나제 K로 덮고 커버슬립으로 밀봉합니다. 하이브리드화 스테이션에서 37°C에서 10분 동안 슬라이드를 인큐베이션한다.
- 커버슬립을 제거하고 RT에서 DPBS에서 5분 동안 슬라이드를 세척합니다. RT에서 1% 포름알데히드로 샘플을 5분 동안 고정합니다. 이 단계에서 재료는 아직 유리 슬라이드에 완전히 부착되지 않았으므로 흔들리는 플랫폼에 놓아서는 안됩니다.
- 슬라이드를 RT에서 DPBS에서 5분 동안 세척한 다음, 각각 2분 동안 후속 70%, 80%, 90% 및 100% 에탄올에서 탈수시켰다. 탈수된 샘플을 자연 건조하고 형광 표지된 프로브와 혼성화합니다.
- 난소 세포의 X 염색체 함량을 결정하기 위한 대조군으로 염색체 X에 대한 중심체 특이적 프로브와 다른 염색체 특이적 중심체 프로브를 선택합니다. 이 경우, 형광색소 SpectrumGreen으로 직접 표지된 염색체 X(CEP X[DXZ1])와 형광색소 SpectrumOrange로 직접 표지된 염색체 18(CEP 18[D18Z1])에 대한 중심체 특이적 프로브가 사용됩니다.
- CEP X 1μL, CEP 18 1μL 및 하이브리드화 완충액 18μL를 샘플에 추가하고 하이브리드화 중 프로브의 증발을 방지하기 위해 슬라이드에 접착된 커버슬립으로 밀봉합니다. 슬라이드를 73°C에서 3분 동안 변성시키기 위해 하이브리드화 스테이션으로 옮기고, 37°C에서 하룻밤 동안 하이브리드화하였다.
- 하이브리드화 후 슬라이드에서 커버슬립과 남아 있는 접착제를 제거합니다. 슬라이드를 72°C에서 0.4x SSC/0.3% Tween-20에서 2분 동안 세척한 다음, RT에서 2x SSC/0.1% Tween-20에서 1분 동안 인큐베이션합니다.
- 슬라이드를 70%, 80%, 90% 및 100% 에탄올에서 2분 동안 연속적으로 배양하여 탈수시키고 암실에서 자연 건조시킨다. 4′,6-디아미디노-2-페닐인돌(DAPI)이 포함된 장착 매체로 슬라이드를 덮습니다. 형광 현미경으로 분석하기 전에 최소 10분 동안 -20°C에서 보관하십시오.
- 이미징
- 이미지 처리 소프트웨어에 연결된 형광 현미경으로 X 염색체에 대한 신호를 검사합니다.
- 먼저 형광 색소 DAPI를 선택합니다.
- New Cell(새 셀) > Live > Capture(630x 배율)를 선택하여 이미지를 획득합니다. 임계값이 있는 새 창이 나타납니다. 임계값의 파란색 막대를 0으로 설정하여 배경을 최소화하고 빨간색 막대를 최대(255)로 설정하여 신호를 더 밝게 만듭니다. 수락을 클릭합니다.
- 더 어둡게/더 밝게(12), 반경(3) 및 깊이(1)에 대한 제안과 함께 향상된 기능이 있는 새 창이 나타납니다. 제안된 값을 사용하거나 만족스럽지 않은 경우 조정합니다.
- 둘째, fluorochrome SpectrumOrange 를 선택하고 캡처를 클릭합니다.
- 임계값의 파란색 막대를 0으로 설정하여 배경을 최소화하고 빨간색 막대를 최대(255)로 설정하여 신호를 더 밝게 만듭니다. 수락을 클릭합니다.
- 향상된 기능이 있는 창은 더 어둡게/더 밝게(-11), 반경(2.7) 및 깊이(0.6)에 대한 제안과 함께 나타납니다. 제안된 값을 사용하거나 만족스럽지 않은 경우 조정합니다.
- 마지막으로 fluorochrome SpectrumGreen 을 선택하고 캡처를 클릭합니다.
- 임계값의 파란색 막대를 0으로 설정하여 배경을 최소화하고 빨간색 막대를 최대(255)로 설정하여 신호를 더 밝게 만듭니다. 수락을 클릭합니다.
- 향상된 기능이 있는 창은 더 어둡게/더 밝게(0), 반경(3) 및 깊이(0)에 대한 제안과 함께 나타납니다. 제안된 값을 사용하거나 만족스럽지 않은 경우 조정합니다. 새로 만든 파일에 이미지를 저장합니다.
참고: 체세포는 대조군 18번 염색체의 두 신호가 보일 때만 평가되었습니다. 대부분의 난모세포에서는 각 염색체에 대해 하나의 신호만 감지할 수 있습니다.
- 먼저 형광 색소 DAPI를 선택합니다.
- 신호 손실을 방지하기 위해 분석 후 슬라이드를 4°C의 어두운 곳에 보관하십시오.
- 이미지 처리 소프트웨어에 연결된 형광 현미경으로 X 염색체에 대한 신호를 검사합니다.
2. 이식된 난소 피질 조직의 파라핀 절편에 대한 FISH
참고: TS가 있는 18명의 암컷의 냉동 보존/해동된 난소 피질 조직 한 조각을 5개월 동안 중증 복합 면역결핍(SCID) 마우스에 이종이식했습니다. 이종 이식 절차는 이전에 설명되었으며 동물 복지에 관한 동물 연구 위원회의 현지 지침에 따라 Université Catholique de Louvain(벨기에 브뤼셀)에서 수행되었습니다(참조 2014/UCL/MD/007)18,19.
- 난포를 포함하는 이종이식 난소 피질 조직의 절편 선택
- 이종이식된 난소 피질 조직을 4% 포름알데히드에 고정하고 조직을 파라핀에 삽입합니다. 메스로 블록을 다듬어 여분의 파라핀을 제거하고 회전 마이크로톰에서 파라핀 블록을 4μm 두께로 자릅니다.
- 헤마톡실린 및 에오신(HE) 염색을 위한 파라핀 리본의 일곱 번째 섹션마다 선택하여 모낭이 포함된 섹션을 결정합니다. 섹션을 40-45°C의 수조에 넣고 면역조직화학 현미경 슬라이드에 장착합니다.
- 탈파라핀화 및 HE 염색
- 슬라이드를 60°C에서 10분 동안 스토브에 넣은 다음, 슬라이드를 100% 크실렌에 5분 동안 담근다. 슬라이드를 스토브에 직접 놓을 필요는 없습니다. 100 % 에탄올에서 15 초 동안 절편을 수화 한 다음 96 % 에탄올에서 2 x 15 초 동안 수화시킵니다. 슬라이드를 수돗물로 2분 동안 헹굽니다.
- 헤마톡실린에서 슬라이드를 10분 동안 얼룩지게 한 다음 슬라이드를 수돗물로 짧게 헹굽니다. 슬라이드를 중탄산염 용액 (증류수 5L에 황산 마그네슘 100g과 중탄산 나트륨 10g)에 잠깐 담그십시오. 슬라이드를 수돗물로 5분 동안 헹굽니다.
- 슬라이드를 에오신으로 4분 동안 카운터스테인으로 염색하고 100% 에탄올로 슬라이드를 3회 탈수한 다음 자일렌으로 탈수합니다. 슬라이드의 HE 염색을 커버슬립하고 광학 현미경으로 HE 섹션을 평가하여 모낭이 있는 섹션(100x 배율)을 선택합니다.
- DNA FISH에 대한 파라핀 절편의 전처리 및 혼성화
- 파라핀 리본의 모낭이 포함된 섹션 앞이나 뒤에 있는 새 섹션을 선택합니다. 유리 슬라이드에 한 섹션을 장착합니다. 파라핀 부분을 56°C의 스토브에서 최소 45분 동안 건조시킵니다. 슬라이드를 스토브에 직접 놓을 필요는 없습니다.
- 자일렌의 절편을 10분 동안 탈파라핀화합니다. 슬라이드를 99.5% 에탄올에 담그고 수돗물에 5분 동안 헹굽니다. 슬라이드를 96°C에서 10분 동안 표적 회수 용액(낮은 pH)으로 전처리합니다. 식힌 후 슬라이드를 증류수로 헹굽니다.
- 슬라이드를 0.01M 염산으로 5분 동안 처리한 후 37°C에서 15분 동안 펩신 분해(200U/mL)를 수행합니다. 슬라이드를 0.01M 염산으로 다시 헹구고 이어서 PBS에서 헹굽니다.
- 슬라이드를 1% 포름알데히드/PBS에 5분 동안 고정합니다. 슬라이드를 PBS로 간단히 헹구고 다시 데미 물로 헹굽니다. 슬라이드를 99.5% 에탄올로 탈수하고 자연 건조시킵니다.
- X 염색체에 대한 중심체 특이적 프로브와 다른 염색체 특이적 중심체 프로브를 대조군으로 선택하여 과립구 세포의 X 염색체 함량을 결정합니다. 여기서, 염색체 18은 대조군으로 사용된다.
- 전처리된 슬라이드에 형광색소 SpectrumGreen으로 직접 표지된 프로브 CEP 18(D18Z1) 5μL와 형광색소 SpectrumRed로 직접 표지된 프로브 CEP X(DXZ1)를 적용합니다. 커버슬립을 바르고 포토 접착제로 해당 부위를 밀봉합니다. 슬라이드를 80°C에서 10분 동안 변성시키고 37°C에서 하룻밤 동안 혼성화를 위해 하이브리드화에 넣는다.
- 다음날, 슬라이드를 42°C에서 2x SSC로 5분 동안 헹구고, 이어서 73°C에서 0.3% 노니데트 P40에서 2분 및 1분 동안 헹구었다. 2x SSC를 새로 고치고 실온에서 5분 동안 슬라이드를 다시 헹굽니다. 섹션이 어둠 속에 유지되도록 큐벳을 덮으십시오.
- 슬라이드를 증류수로 간단히 헹굽니다. 슬라이드를 99.5% 에탄올로 탈수하고 다시 자연 건조시킵니다. 마지막으로 DAPI와 장착 매체가 포함된 솔루션으로 슬라이드를 장착합니다.
- 이미징
- 형광 현미경으로 630x 배율로 결과를 분석합니다. 컴퓨터에서 이미지 처리 소프트웨어를 엽니다. 프로필로 FISH 를 선택합니다.
- DAPI 방출이 431nm에서 설정되고 여기가 359nm에서 여기, 텍사스 적색 방출이 613nm에서 설정되고 여기가 595nm에서 여기, FITC 방출이 519nm에서 설정되고 여기가 495nm에서 설정되었는지 확인합니다.
- [라이브] > [단일 이미지 캡처]를 선택하여 이미지를 획득합니다. 왼쪽의 이미지 메뉴에서 노출 슬라이더와 게인 슬라이더를 움직여 노출과 게인을 조정하여 이미지 품질을 최적화합니다(예: 노출: 212ms, 게인: 7.9). 필요한 노출과 게인은 이미지마다 다를 수 있습니다. 이 프로세스 중에 변경 사항을 관찰하여 최적화된 이미지를 얻습니다. 새로 만든 파일에 이미지를 저장합니다.
- 신호 손실을 방지하기 위해 분석 후 슬라이드를 4°C의 어두운 곳에 보관하십시오.
결과
이식 전 분리된 난소 세포에 대한 FISH
45,X/46,XX(환자 A) 또는 45,X/46,XX/47,XXX(환자 B) TS를 가진 여성의 냉동 보존된 난소 피질 조직을 사용하여 이 프로토콜을 사용한 결과를 설명했습니다. 환자 A에서 림프구의 50 %는 45,X 핵형을 가졌고 50 %는 46,XX를 가졌다. 환자 B에서 림프구의 38 %는 45,X, 28 %는 46,XX, 34 %는 47,XXX였다. 대조군인 X 염색체(녹색) 및 18번 염색체(빨간색)에 대한 중심체 특이적 프로브를 사용하여 이전 이종 이식 없이 TS 환자의 난소 피질 조직에서 분리된 개별 과립구 세포, 기질 세포 및 난모세포의 X 염색체 함량을 측정했습니다(그림 1).
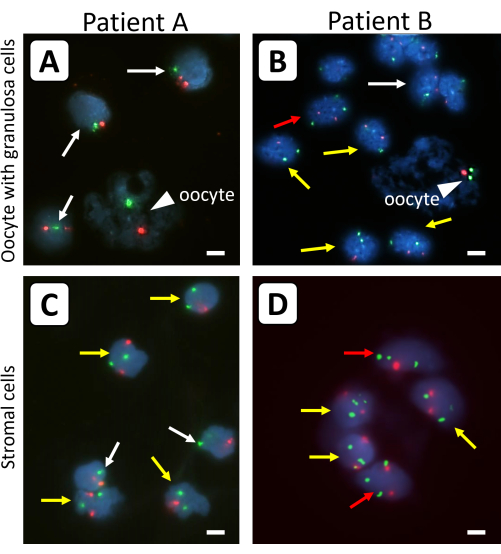
그림 1: 이식 전 난소 피질 조직에서 분리된 난소 세포의 FISH 분석. 주변 간질 세포인 단일 원시 난포(A,B) 및 (C,D)의 난모세포(화살촉) 및 과립구 세포를 염색체 X(녹색 신호) 및 대조군 염색체 18(적색 신호)에 대한 형광 특이적 프로브로 분석했습니다. 흰색 화살표는 45,X 세포주, 노란색 화살표는 46,XX 세포주, 빨간색 화살표는 47,XXX 세포주를 나타냅니다. 모든 형광 신호가 동일한 초점면에 있는 것은 아닙니다. 막대는 10μm를 나타냅니다. FISH 신호의 배율은 630x로 설정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
FISH 전에 트립신을 사용하거나 사용하지 않고 치료한 개별 원시 난포의 차이는 그림 2에 나와 있습니다. FISH 분석 전에 트립신을 사용함으로써, 과립구 세포 덩어리 및 난모세포가 덜 응집되어, 개별 과립구 세포 및 난모세포의 X 염색체 함량의 분석이 가능하였다. 난모세포의 DNA는 난모세포에서 나온 DNA의 불규칙한 모양, 크기 및 확산된 모양으로 인해 주변 과립구 세포의 DNA와 쉽게 구별할 수 있습니다. 또한, 각 염색체에 대해 단 하나의 강력한 FISH 신호만이 작은 난포의 난모세포에서 관찰되는데, 이는 이들 세포에서 4개의 자매 염색분체가 매우 근접하기 때문입니다. 난모세포의 X 염색체 함량은 18번 염색체의 표면 비율에 대한 X 염색체에 대한 FISH 신호의 표면 비율을 사용하여 결정할 수 있습니다.

그림 2: FISH 전에 트립신을 사용하거나 사용하지 않고 처리된 작은 모낭. (A) 난소 피질 조직의 효소 소화는 크게 해리된 세포의 현탁액을 초래했지만 과립구 세포의 단일 층으로 둘러싸인 온전한 난모세포로 구성된 원시 난포를 남겼습니다(패널 A의 화살촉). (B) 세포 현탁액에서 작은 모낭을 직접 채취했지만 과립구 세포의 응집으로 인해 FISH 후 신호를 해석하는 데 어려움을 겪었습니다(C). (D,E) FISH 이전에 트립신으로 분리된 모낭의 추가 소화는 개별 과립구 세포가 난포 표면의 구형 형태로 수축하고 FISH 분석을 위해 접근할 수 있도록 난포에서 분리될 가능성이 더 높았습니다. 난모세포 유래 FISH 신호는 화살표로 표시됩니다. 검은색 막대는 100μm를 나타내고 흰색 막대는 10μm를 나타냅니다. FISH 신호의 배율은 630x로 설정되었습니다. 패널 D는 Peek et al.의 허가를 받아 복제되었습니다.16. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이식된 난소 피질 조직의 파라핀 절편에 있는 과립구 세포의 FISH 분석
이차 및 전방 난포는 효소 소화에 덜 민감한 것으로 밝혀졌으며, 이는 장기간 이종 이식 후 난소 조직에서 발견되는 난포 성장에 적합하지 않은 개별 난소 세포를 얻기 위해 이전에 기술된 조직 해리 방법을 만듭니다. 따라서 FISH 프로토콜은 이식 후 난소 피질 조직에서 이차 및 전방 난포의 과립구 세포의 X 염색체 함량을 결정하기 위해 4μm 조직학적 절편을 사용하여 최적화되었습니다(그림 3). 이 설정에서는 성장하는 난포에서 난모세포의 직경이 크기 때문에 난모세포의 X 염색체 또는 제어 염색체의 FISH 신호가 단일 4μm 섹션에서 캡처될 가능성이 거의 없습니다.
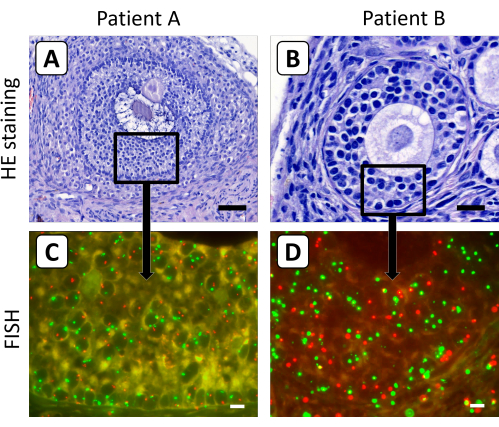
그림 3: 이종 이식 후 난소 피질 조직 절편의 조직학적 및 FISH 염색. (ᄀ,ᄂ) 헤마톡실린/에오신 염색은 이종이식 5개월 후 난소 피질 조직에서 형태학적으로 정상적인 이차 및 전방 난포를 보여주었습니다. (씨, 디) 이들 난포의 과립구 세포의 X 염색체 함량은 FISH 분석에 의해 결정되었습니다. 이 그림에서 염색체 X는 빨간색으로, 염색체 18은 녹색으로 표시됩니다. 패널 A 의 막대는 50 μm, 패널 B 의 막대는 20 μm, 패널 C 와 D 의 막대는 10 μm를 나타냅니다. FISH 신호의 배율은 630x로 설정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
첫 번째 단계로서, 어떤 방법이 최상의 FISH 신호를 초래하는지 결정하기 위해 조직의 다양한 고정 기술을 사용한 실험을 수행하였다. FISH 분석은 Bouin의 용액에 고정된 후 4% 포름알데히드에 담근 이식 조직과 4% 포름알데히드에만 고정된 이식 조직에 대해 수행되었습니다. Bouin's에 처음 고정된 이식 조직은 이미지에 녹색 연무를 나타내어 FISH 신호의 수를 정확하게 계산하기 어려웠습니다(그림 4).

그림 4: Bouin 용액과 포름알데히드에만 고정된 이식된 난소 피질 조직. (A) Bouin의 용액에 이식된 난소 피질 조직을 고정하면 녹색 연무로 인해 여포 세포에서 형광 신호가 흐려지고 크게 가려졌습니다. (B) 포름알데히드에 고정된 난소 피질 조직은 해석하기 쉬운 우수한 형광 신호만 제공했습니다. 막대는 10μm를 나타냅니다. FISH 신호의 배율은 630x로 설정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
조직 학적 절편에서 난포의 과립구 세포의 X 염색체 함량을 결정하기 위해, 과립구 세포의 FISH 신호를 단순히 계산하는 것은 불가능하다. 개별 과립구 세포의 염색체 부분은 조직의 절편으로 인해 특정 조직 학적 섹션에서 손실 될 수 있습니다. 따라서, 조직 이식 후 새로 형성된 이차 및 전방 난포에서 이수성으로 인한 과립구 세포 집단의 X 염색체 함량 손실을 궁극적으로 결정하기 전에 절편으로 인해 손실된 FISH 신호의 백분율을 먼저 결정할 필요가 있습니다.
절편으로 인한 손실된 FISH 신호의 백분율은 비이수성 대조군 염색체 18의 과립구 세포당 FISH 신호의 수를 결정함으로써 계산할 수 있습니다. 절편으로 인해 X 염색체의 동일한 비율이 손실될 것으로 예상됩니다. 과립구 세포 집단에서 X 염색체 FISH 신호의 수의 추가 감소는 이수성 때문입니다. 그러나 이수성으로 인한 X 염색체 손실을 결정하기 위해 대조 염색체의 FISH 신호를 사용하려면 X 염색체와 대조 염색체의 FISH 신호의 검출 감도가 매우 유사해야 합니다. 따라서 비이수성 46,XX 개체의 조직학적 섹션에서 성장하는 모낭의 과립구 세포에서 두 FISH 프로브의 검출 감도가 결정되었습니다. 염색체 X/대조 염색체 FISH 신호의 비율이 1에 가까울 때, 두 프로브의 검출 감도가 실제로 매우 유사하다고 가정할 수 있으며, 따라서 FISH 프로브는 이종 이식 후 난소 조직의 조직학적 절편에서 성장하는 난포의 과립구 세포 집단에서 이수성 수준을 결정하는 데 사용할 수 있습니다.
본보기
46,XX 개체의 난소에서 난포의 130 개의 과립구 세포에서 염색체 18 개의 신호 수를 분석 할 때 260 개의 신호가 존재할 것으로 예상됩니다. 그러나 이들 세포의 4μm 부분에서는 204개의 염색체 18 신호만 관찰되었습니다. 이는 단면화로 인해 신호의 21.5%가 손실됨을 나타냅니다((260-204)/260 x 100 = 21.5%). 따라서 과립구 세포당 염색체 18 신호의 수는 절편으로 인해 204/130 = 1.57로 감소합니다.
다음으로, TS를 가진 여성의 난소 조직에 이식한 후 전방 난포의 과립구 세포에서 X 염색체의 수를 분석합니다. 총 191 개의 X 염색체 신호와 199 개의 염색체 18 개 신호가 계산되었습니다. 과립구 세포의 수는 18번 염색체에 대한 총 신호 수를 과립구 세포당 18번 염색체 신호 수로 나누어 결정할 수 있습니다(199/1.57 = 127 과립구 세포). 마지막으로, 45,X 과립구 세포의 비율은 18번 염색체와 X 염색체 신호의 차이를 과립구 세포의 수로 나누어 결정할 수 있습니다(즉, [199-191]/127 x 100 = 과립구 세포의 6%는 45,X이고 이 세포의 94%는 46, XX).
47,XXX 세포주를 가진 환자에서 45,X 및 47,XXX 과립구 세포의 혼합은 46,XX 과립구 세포와 동일한 수의 X 염색체 신호를 갖기 때문에 47,XXX 핵형을 가진 과립구 세포의 최소 비율을 결정하는 것이 가능하다는 점은 주목할 만하다.
토론
FISH 분석은 남성과 여성 모두의 림프구 또는 협측 세포에서 X 염색체 이상을 검출하는 잘 알려진 기술이다10. 여러 연구에서 X 염색체 이상을 가진 남성의 배우자에 대해 FISH를 설명했지만 X 염색체 이상을 가진 여성의 난소 세포에 대해 FISH가 얻은 자세한 정보는 여전히부족합니다 14. 이 기사는 X 염색체 이상이 있는 여성의 이식되지 않은 난소 피질 조직의 난소 세포에 이수성이 존재하는지 확인하기 위해 FISH를 기반으로 하는 새로운 방법을 제시합니다.
이식되지 않은 난소 피질 조직에서 개별 난소 세포를 분리하기 위한 프로토콜의 주요 과제는 조직의 효소 소화에 있으며, 이는 사전에 약간의 연습이 필요합니다. 충분한 난소 세포의 정확한 FISH 신호를 얻기 위해서는 효소 소화, 배양 시간 및 표시된 온도에 관한 단계를 엄격하게 따르는 것이 중요합니다. 프로토콜에서 벗어나면 과정 중에 난소 세포가 상당히 손실될 수 있으며, 특히 이미 난소 예비력이 낮은 환자에서는 피해야 합니다. 이 방법의 또 다른 중요한 단계는 정제된 원시 모낭을 트립신으로 처리하여 난모세포와 과립구 세포 덩어리가 응집되는 것을 방지하여 개별 세포의 분석을 방해하는 것입니다. 트립신으로 치료하지 않으면 FISH로 안정적으로 분석할 수 있는 개별 과립구 세포의 수가 크게 감소합니다.
장기 이식 후 회수된 난소 피질 조직에 대한 FISH 분석은 개별 난소 세포를 얻는 데 필요한 효소 소화에 충분히 민감한 작은 난포만이 발견되었기 때문에 다른 기술이 필요합니다. 또한, 난소 피질 조직의 자가이식과 유사하게, 이식편이 숙주에 의해 충분히 혈관재생되기 전에 저산소증 및 영양소 부족으로 인해 이식 후 많은 모낭이 소실된다(20). 따라서 이식 후 모낭의 수는 이식 전보다 상당히 적을 것으로 예상됩니다. 조직학적 절편에 사용되는 이 FISH 기술의 경우 최적의 FISH 신호를 얻기 위해서만 이식된 조직을 4% 포름알데히드에 고정하는 것이 중요합니다. Bouin의 고정액에 난소 피질 조직을 고정하는 것은 실험실에서 일상적으로 사용되며, 표준 HE 염색과 결합하면 우수한 결과를 얻을 수 있지만, FISH 이전에 Bouin으로 조직을 고정하면 해석하기 어려운 약하고 흐릿한 형광 신호가 발생합니다.
이 프로토콜은 난소 세포의 X 염색체 함량을 결정하는 데 성공적인 것으로 입증되었지만 여전히 몇 가지 한계가 있습니다. 한 가지 한계는 이러한 방법이 수치 수차가 있는 여성의 난소 세포를 분석하는 데만 사용할 수 있다는 것입니다. 수치 수차는 반복적인 시퀀스(21)를 지향하는 프로브를 사용하여 검출할 수 있다. 이 프로브는 중심체 영역에서 여러 반복 염기쌍 서열을 혼성화하여 강력한 혼성화 신호를 생성합니다. 대조적으로, 구조적 수차는 고유한 단일 시퀀스에 대한 프로브를 사용해야만 감지할 수 있습니다. 이러한 프로브는 반수체 게놈에서 한 번만 발생하는 서열에 혼성화되어 수치 수차에 비해 훨씬 덜 강렬한 FISH 신호를 생성합니다. 이러한 상대적으로 약한 FISH 신호로 인해 구조적 이상이 있는 여성의 난소 세포의 X 염색체 함량을 적절하게 측정하기가 어렵습니다.
둘째, 이식되지 않은 조직에서 작은 모낭의 난 모세포의 FISH 신호는 감수 분열 I22의 전단계에서 4 개의 자매 염색체가 근접하기 때문에 분석하기가 어렵습니다. 난모세포에는 단 하나의 강력한 혼성화 신호만 존재하므로 X 염색체 함량을 결정하기 위해 난모세포의 신호 수를 단순히 계산하는 것은 불가능합니다. 대신, 염색체 X와 18개의 FISH 신호의 표면 비율을 사용하여 이러한 세포의 X 염색체 함량을 결정해야 합니다. 이것은 난모세포에 FISH 신호가 명확하게 존재하는 경우에만 확실하게 결정될 수 있습니다.
또한, 이식된 조직의 조직학적 섹션에 있는 작은 난포에는 적절하게 분석할 수 있는 과립구 세포가 거의 없기 때문에 이식된 조직의 FISH는 이차 및 전방 난포에서 과립구 세포의 X 염색체 함량을 측정하는 데만 사용할 수 있습니다. 또한, 난모세포의 X 염색체 함량은 난모세포의 직경이 크기 때문에 이 방법을 사용하여 정확하게 측정할 수 없습니다.
마지막으로, 난소 세포나 난소 피질 조직을 얻기 위해 침습적 수술이 필요하기 때문에 남성 배우자에 비해 여성 배우자를 얻는 것은 여전히 어렵습니다. 따라서 이러한 방법은 연구 환경에서 적용될 가능성이 가장 높습니다.
결론적으로, X 염색체 이상이 있는 여성의 비이식 및 이식된 난소 피질 조직의 난소 세포에 대한 FISH 분석은 이 특정 그룹에서 난소 세포의 X 염색체 함량에 대한 통찰력을 얻는 독특하고 유용한 기술입니다. 이러한 기술은 X 염색체 이상이 있는 여성의 난소 피질 조직의 냉동 보존이 가능하며 냉동 보존된 원시 난포가 2차 및 전방 난포로 성장할 수 있음을 보여줍니다. 그러나 두 방법 모두 X 염색체 이상이 있는 여성에 대한 향후 연구를 용이하게 하기 위한 것이며 임상 실습에서 X 염색체 이상이 있는 여성의 생식 결과를 선별하기 위한 진단 도구로 사용하도록 설계되지 않았다는 점을 명심해야 합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 Marjo van Brakel, Dominique Smeets, Guillaume van de Zande, Patricia van Cleef 및 Milan Intezar의 전문 지식과 기술 지원에 감사드립니다. 자금 출처: Merck Serono (A16-1395), Goodlife 및 Ferring.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
참고문헌
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유