Method Article
Esplorazione delle aberrazioni cromosomiche X nelle cellule ovariche utilizzando l'ibridazione fluorescenza in situ
In questo articolo
Riepilogo
Questo articolo presenta due metodi basati sull'ibridazione fluorescenza in situ per determinare il contenuto cromosomico X delle cellule ovariche nel tessuto della corteccia ovarica non innestato e innestato da femmine con aberrazioni cromosomiche X.
Abstract
Milioni di persone in tutto il mondo si occupano di questioni riguardanti la fertilità. La riduzione della fertilità, o addirittura l'infertilità, può essere dovuta a molte cause diverse, tra cui disturbi genetici, di cui le anomalie cromosomiche sono le più comuni. L'ibridazione fluorescenza in situ (FISH) è un metodo ben noto e frequentemente utilizzato per rilevare aberrazioni cromosomiche negli esseri umani. La FISH viene utilizzata principalmente per l'analisi di anomalie cromosomiche negli spermatozoi di maschi con aberrazioni cromosomiche numeriche o strutturali. Inoltre, questa tecnica viene spesso applicata anche nelle femmine per rilevare aberrazioni cromosomiche X che sono note per causare disgenesia ovarica. Tuttavia, mancano ancora informazioni sul contenuto cromosomico X delle cellule ovariche di femmine con aberrazioni cromosomiche X nei linfociti e/o nelle cellule buccali.
Lo scopo di questo studio è quello di far progredire la ricerca di base sulle aberrazioni cromosomiche X nelle femmine, presentando due metodi basati sulla FISH per identificare il contenuto cromosomico X delle cellule ovariche. In primo luogo, viene descritto un metodo per determinare il contenuto cromosomico X di cellule ovariche isolate (ovociti, cellule granulosa e cellule stromali) nel tessuto della corteccia ovarica non innestato da femmine con aberrazioni cromosomiche X. Il secondo metodo è diretto a valutare l'effetto delle aberrazioni cromosomiche sulla follicologenesi determinando il contenuto cromosomico X delle cellule ovariche di follicoli secondari e antrali di nuova formazione nel tessuto ovarico, da femmine con aberrazioni cromosomiche X dopo innesto a lungo termine in topi immunocompromessi. Entrambi i metodi potrebbero essere utili nella ricerca futura per ottenere informazioni sul potenziale riproduttivo delle femmine con aberrazioni cromosomiche X.
Introduzione
L'infertilità è un problema di salute del sistema riproduttivo maschile o femminile, che colpisce circa 186 milioni di individui in età riproduttiva in tutto il mondo1. In almeno il 35% delle coppie infertili, l'infertilità è causata da un disturbo del sistema riproduttivo femminile2. Ci sono molti fattori che possono causare infertilità femminile, come fattori genetici, anomalie del tratto genitale, disfunzione endocrina, malattie infiammatorie e trattamento iatrogeno3.
Le anomalie genetiche sono presenti in circa il 10% delle femmine infertili 4,5. Di tutte le anomalie genetiche, le aberrazioni del cromosoma X sono la causa più comune di disgenesia ovarica2. Diversi studi hanno riportato che le aberrazioni cromosomiche X nelle femmine con sindrome di Turner (TS) o sindrome Triple X sono associate a insufficienza ovarica prematura a causa di una perdita accelerata di cellule germinali o oogenesi compromessa 6,7,8.
Le aberrazioni del cromosoma X possono essere suddivise in: 1) aberrazioni numeriche, in cui il numero di cromosomi X è diverso ma i cromosomi X sono intatti; e 2) aberrazioni strutturali, in cui il cromosoma X ha guadagnato o perso materiale genetico 3,9. Le aberrazioni numeriche del cromosoma X sono più comuni delle anomalie strutturali e sono spesso causate da errori spontanei durante la divisione cellulare 3,9. Quando un tale errore si verifica durante la meiosi, può portare a gameti aneuploidi e, infine, alla prole con aberrazioni cromosomiche in tutte le cellule. Quando i difetti cromosomici insorgono nelle cellule somatiche a causa di errori che si verificano durante la mitosi nelle prime fasi dell'ontogenesi, possono portare al mosaicismo. In questi individui sono presenti sia cellule con contenuto cromosomico X normale che cellule con aberrazioni cromosomiche X.
Nel 1980, una tecnica citogenetica chiamata ibridazione fluorescenza in situ (FISH) è stata sviluppata per visualizzare e localizzare specifiche sequenze di acido nucleico sui cromosomi 10,11 in metafase e interfase. Questa tecnica utilizza sonde di DNA marcate con fluorescenza per legarsi a una sequenza specifica nel cromosoma, che può quindi essere visualizzata utilizzando un microscopio a fluorescenza.
Al giorno d'oggi, la FISH è ampiamente utilizzata come strumento diagnostico clinico ed è considerata il gold standard nel rilevare le aberrazioni cromosomiche10. Nel campo della medicina riproduttiva, l'analisi FISH sugli spermatozoi è stata utilizzata per ottenere informazioni sul contenuto cromosomico X degli spermatozoi nei maschi con aberrazioni cromosomiche numeriche o strutturali nelle cellule somatiche12,13,14. Questi studi hanno dimostrato che i maschi con aberrazioni cromosomiche avevano maggiori probabilità di avere una maggiore frequenza di spermatozoi aneuploidi presenti nel loro sperma rispetto ai maschi con cariotipi normali12,13,14.
A differenza degli spermatozoi, si sa molto poco sul contenuto cromosomico X delle cellule ovariche (inclusi ovociti, cellule granulosa/teca e cellule stromali) in individui con aberrazione cromosomica, così come le possibili conseguenze dell'aneuploidia di queste cellule sul loro potenziale riproduttivo. Una ragione importante per le scarse informazioni sul cariotipo delle cellule ovariche rispetto agli spermatozoi è il fatto che le donne devono sottoporsi a una procedura invasiva come una puntura del follicolo o un intervento chirurgico per ottenere ovociti o tessuto della corteccia ovarica. I gameti femminili sono, quindi, difficili da ottenere per scopi di ricerca.
Attualmente, uno studio di intervento osservazionale è in corso nei Paesi Bassi per esplorare l'efficacia della crioconservazione del tessuto ovarico nelle giovani donne con TS15. Un frammento del tessuto della corteccia ovarica della paziente era disponibile per identificare il contenuto cromosomico X delle cellule ovariche16,17. Come parte dello studio, è stato sviluppato un nuovo metodo basato sulla FISH del tessuto dissociato della corteccia ovarica per determinare se le aberrazioni cromosomiche sono presenti nelle cellule ovariche nelle femmine portatrici di un'aberrazione cromosomica nelle cellule somatiche non ovariche, come i linfociti o le cellule buccali. Inoltre, è stato determinato anche l'effetto dell'aneuploidia nelle cellule ovariche sulla follicologenesi. A tal fine, è stato modificato un protocollo FISH stabilito che consente l'analisi delle sezioni istologiche del tessuto della corteccia ovarica dopo follicologenesi indotta artificialmente durante lo xenotrapianto a lungo termine in topi immunocompromessi. In questo studio, presentiamo due metodi basati sulla FISH per determinare il contenuto cromosomico X nelle cellule ovariche nel tessuto della corteccia ovarica non innestato e innestato in femmine con aberrazioni cromosomiche X, con l'obiettivo di migliorare la scienza di base su questo argomento.
Protocollo
Il protocollo di studio TurnerFertility è stato approvato dal Comitato centrale per la ricerca che coinvolge soggetti umani (NL57738.000.16). In questo studio, è stato ottenuto il tessuto della corteccia ovarica di 93 femmine con TS. I materiali che richiedono precauzioni di sicurezza sono elencati nella Tabella 1.
Tabella 1: Precauzioni di sicurezza.
| Materiale | Azzardo | ||
| Acido acetico | Gravi ustioni cutanee e irritazione del sistema respiratorio | ||
| Collagenasi | Irritante per gli occhi, il sistema respiratorio e la pelle | ||
| DAPI | Irritante per gli occhi, il sistema respiratorio e la pelle | ||
| DNasi I | Irritante per gli occhi, il sistema respiratorio e la pelle | ||
| Etanolo | Altamente infiammabile | ||
| Formaldeide | Tossico dopo inalazione, ingestione e contatto con la pelle | ||
| Formammide (nelle sonde a fluorescenza) | Può danneggiare il nascituro | ||
| Liberate | Irritante per gli occhi, il sistema respiratorio e la pelle | ||
| Metanolo | Altamente infiammabile, tossico per inalazione, ingestione e contatto con la pelle | ||
| Nonidet P40 | Irritante per la pelle o gli occhi | ||
| Pepsina | Irritante per gli occhi, il sistema respiratorio e la pelle | ||
| Proteinasi K | Difficoltà respiratorie dopo l'inalazione | ||
| Xilene | Altamente infiammabile, tossico dopo l'inalazione e il contatto con la pelle. Evitare il contatto con gli occhi. | ||
Tabella 1: Materiali che richiedono precauzioni di sicurezza.
1. FISH su singole cellule isolate della corteccia ovarica
- Dissociazione del tessuto della corteccia ovarica per ottenere singole cellule
- Tagliare il tessuto della corteccia ovarica crioconservato / scongelato in piccoli pezzi di circa 1 mm x 1 mm x 1 mm usando un bisturi.
- Digerire enzimaticamente i frammenti di tessuto in 4 mL di terreno L15 preriscaldato (37 °C) contenente 0,1 mg/mL di miscela enzimatica di dissociazione tissutale, 10 μg/mL di DNasi I e 1 mg/mL di collagenasi I da C. histolyticum per un massimo di 75 minuti a 37 °C. Pipet la digestione si mescola su e giù ogni 15 minuti.
- Interrompere la digestione enzimatica aggiungendo 4 ml di L15 freddo integrato con siero bovino fetale al 10% (FBS). Lavare il tessuto dissociato una volta con 8 ml di terreno L15 freddo mediante centrifugazione a 500 x g e risospendere in 500 μL di terreno L15 senza vortice per evitare danni alle cellule.
- Trasferire la sospensione cellulare contenente in gran parte singole cellule stromali e piccoli follicoli (ovociti circondati da un singolo strato di cellule della granulosa) in una capsula di Petri di plastica ed esaminare la sospensione cellulare sotto uno stereomicroscopio (ingrandimento 100x).
- Prelevare manualmente i piccoli follicoli (<50 μm) utilizzando una pipetta di plastica da 75 μm e trasferire i follicoli in una goccia di mezzo L15 integrata con FBS al 10% a 4 °C per prevenire l'aggregazione dei follicoli. Eseguire il prelievo del follicolo per un massimo di 30 minuti. Per migliorare la diffusione delle cellule follicolari prima dell'analisi FISH, trasferire i follicoli purificati in una soluzione di tripsina allo 0,06%, 1 mg/ml di acido etilendiamminotetraacetico (EDTA) e 1 mg/ml di glucosio e incubare per 20 minuti a 37 °C.
- Ottenere cellule stromali ovariche dalla sospensione cellulare della corteccia utilizzando una pipetta di plastica da 75 μm, prestando particolare attenzione per evitare la contaminazione con piccoli follicoli.
- Analisi FISH di singole cellule ovariche
- Trasferire i follicoli ovarici trattati (raccomandato n = 5-20) con tripsina/EDTA/glucosio o cellule stromali (n > 1.000) in goccioline di 5 μL di 0,15 mM KCl/15 μL di soluzione salina tamponata fosfato di Dulbecco (DPBS) su un vetrino e incubare per 20 minuti a 37 °C.
- Asciugare e prefissare i vetrini in 300 μL di 0,05 mM KCl/7,5% acido acetico/22,5% metanolo per 2 minuti a temperatura ambiente (RT). Coprire i vetrini con metanolo/acido acetico (3:1) per 2 minuti a RT per finalizzare la fissazione.
- Preparare 20 volte il citrato di sodio standard (SSC) aggiungendo 876 g di cloruro di sodio e 441 g di citrato trisodico diidrato in 5 L di acqua distillata. Quindi, aggiungere 100 ml di 20x SSC a 900 mL di acqua demineralizzata (demi) per ottenere 2x SSC. Lavare il campione in 2x SSC a 73 °C, coprirlo con 100 μL di proteinasi K al 2% e sigillarlo con un vetrino. Incubare i vetrini per 10 minuti a 37 °C nella stazione di ibridazione.
- Rimuovere il vetrino e lavare i vetrini per 5 minuti in DPBS a RT. Fissare il campione per 5 minuti con formaldeide all'1% a RT. In questa fase, il materiale non è ancora completamente attaccato ai vetrini e non deve quindi essere posizionato su una piattaforma vibrante.
- Lavare i vetrini per 5 minuti in DPBS a RT, seguiti da disidratazione nel successivo 70%, 80%, 90% e 100% etanolo per 2 minuti ciascuno. Asciugare all'aria il campione disidratato e ibridarlo con sonde marcate con fluorescenza.
- Selezionare una sonda centromero specifica per il cromosoma X e un'altra sonda centromerica specifica del cromosoma come controllo per determinare il contenuto cromosomico X delle cellule ovariche. In questo caso, vengono utilizzate sonde centromeriche specifiche per il cromosoma X (CEP X [DXZ1]) direttamente marcate con fluorocromo SpectrumGreen e cromosoma 18 (CEP 18 [D18Z1]) direttamente marcate con fluorocromo SpectrumOrange.
- Aggiungere 1 μL di CEP X, 1 μL di CEP 18 e 18 μL del tampone di ibridazione al campione e sigillare con un coprivetrino incollato ai vetrini per evitare l'evaporazione della sonda durante l'ibridazione. Trasferire i vetrini alla stazione di ibridazione per la denaturazione a 73 °C per 3 minuti, seguita dall'ibridazione durante un'incubazione notturna a 37 °C.
- Rimuovere il coprislip e l'eventuale colla residua dal vetrino dopo l'ibridazione. Lavare i vetrini in 0,4x SSC/0,3% Tween-20 a 72 °C per 2 minuti, quindi incubazione per 1 min in 2x SSC/0,1% Tween-20 a RT.
- Disidratare i vetrini con successive incubazioni di 2 minuti in etanolo al 70%, 80%, 90% e 100% e asciugare all'aria al buio. Coprire i vetrini con un supporto di montaggio contenente 4′,6-diamidino-2-fenilindolo (DAPI). Conservare a -20 °C per almeno 10 minuti prima dell'analisi al microscopio a fluorescenza.
- Imaging
- Esaminare i segnali per il cromosoma X con un microscopio a fluorescenza collegato a un software di elaborazione delle immagini.
- Innanzitutto, selezionare DAPI fluorocromatici.
- Acquisisci un'immagine selezionando Nuova cella > Live > Capture con ingrandimento 630x. Apparirà una nuova finestra con la soglia. Impostare la barra blu della soglia su 0 per ridurre a icona lo sfondo e la barra rossa al massimo (255) per rendere i segnali più luminosi. Fare clic su Accetta.
- Apparirà una nuova finestra con un suggerimento per più scuro/più luminoso (12), raggio (3) e profondità (1). Utilizzare i valori suggeriti o modificarli se non soddisfatti.
- In secondo luogo, selezionare fluorochrome SpectrumOrange e fare clic su Capture.
- Impostare la barra blu della soglia su 0 per ridurre a icona lo sfondo e la barra rossa al massimo (255) per rendere i segnali più luminosi. Fare clic su Accetta.
- La finestra con il miglioramento apparirà con un suggerimento per più scuro / più luminoso (-11), raggio (2,7) e profondità (0,6). Utilizzare i valori suggeriti o modificarli se non soddisfatti.
- Infine, seleziona fluorochrome SpectrumGreen e fai clic su Capture.
- Impostare la barra blu della soglia su 0 per ridurre a icona lo sfondo e la barra rossa al massimo (255) per rendere i segnali più luminosi. Fare clic su Accetta.
- La finestra con il miglioramento apparirà con un suggerimento per più scuro / più luminoso (0), raggio (3) e profondità (0). Utilizzare i valori suggeriti o modificarli se non soddisfatti. Salvare l'immagine in un file appena creato.
NOTA: Le cellule somatiche sono state valutate solo quando erano visibili due segnali del cromosoma 18 di controllo. Nella maggior parte degli ovociti, è stato possibile rilevare un solo segnale per ciascun cromosoma.
- Innanzitutto, selezionare DAPI fluorocromatici.
- Conservare i vetrini al buio a 4 °C dopo l'analisi per evitare la perdita di segnali.
- Esaminare i segnali per il cromosoma X con un microscopio a fluorescenza collegato a un software di elaborazione delle immagini.
2. FISH su sezioni di paraffina di tessuto della corteccia ovarica innestata
NOTA: Un frammento di tessuto della corteccia ovarica crioconservato/scongelato di 18 femmine con TS è stato xenotrapiantato in topi immunodeficienti combinati gravi (SCID) per 5 mesi. La procedura di xenotrapimento è stata descritta in precedenza ed è stata condotta presso l'Université Catholique de Louvain (Bruxelles, Belgio) seguendo le linee guida locali del Comitato per la ricerca sugli animali in materia di benessere degli animali (riferimento 2014/UCL/MD/007)18,19.
- Selezione di sezioni di tessuto della corteccia ovarica xenotrapiantata contenente follicoli
- Fissare il tessuto della corteccia ovarica xenotrapiantata in formaldeide al 4% e incorporare il tessuto in paraffina. Tagliare i blocchi con un bisturi per rimuovere la paraffina extra e tagliare il blocco di paraffina a 4 μm di spessore su un microtomo di rotazione.
- Selezionare ogni settima sezione del nastro di paraffina per la colorazione con ematossilina ed eosina (HE) per determinare quali sezioni contengono follicoli. Mettere la sezione a bagnomaria a 40-45 °C e montarla su vetrini da microscopio immunoistochimico.
- Deparaffinizzazione e colorazione HE
- Mettere i vetrini su una stufa per 10 minuti a 60 °C, quindi immergere i vetrini in xilene al 100% per 5 minuti. Non è necessario posizionare le diapositive direttamente sul fornello. Idratare le sezioni per 15 s in etanolo al 100%, seguito da 2 x 15 s in etanolo al 96%. Risciacquare gli scivoli in acqua di rubinetto per 2 minuti.
- Macchiare i vetrini in ematossilina per 10 minuti e successivamente sciacquare brevemente i vetrini con acqua di rubinetto. Immergere brevemente i vetrini in una soluzione di bicarbonato (100 g di solfato di magnesio e 10 g di bicarbonato di sodio in 5 L di acqua distillata). Risciacquare gli scivoli in acqua di rubinetto per 5 minuti.
- Controcolorare i vetrini con eosina per 4 minuti e disidratare i vetrini tre volte con etanolo al 100%, seguito da xilene. Coprire le macchie HE sui vetrini e valutare le sezioni HE al microscopio ottico per selezionare le sezioni con follicoli (ingrandimento 100x).
- Pre-trattamento e ibridazione di sezioni di paraffina per DNA FISH
- Selezionare le nuove sezioni che giacciono prima o dopo la sezione che conteneva i follicoli dal nastro di paraffina. Montare una sezione su un vetrino. Asciugare le sezioni di paraffina per almeno 45 minuti su un fornello a 56 °C. Non è necessario posizionare le diapositive direttamente sul fornello.
- Deparaffinizzare le sezioni in xilene per 10 min. Immergere i vetrini in etanolo al 99,5% e sciacquarli per 5 minuti in acqua di rubinetto. Pretrattare i vetrini con la soluzione di prelievo target (pH basso) per 10 minuti a 96 °C. Dopo il raffreddamento, sciacquare i vetrini in acqua distillata.
- Trattare i vetrini per 5 minuti con acido cloridrico 0,01 M, seguito da digestione della pepsina (200 U/ml) per 15 minuti a 37 °C. Risciacquare nuovamente i vetrini in acido cloridrico 0,01 M e successivamente in PBS.
- Fissare i vetrini in formaldeide all'1% / PBS per 5 minuti. Risciacquare brevemente i vetrini in PBS e poi di nuovo in acqua demi. Disidratare i vetrini in etanolo al 99,5% e lasciarli asciugare all'aria.
- Selezionare una sonda centromera specifica per il cromosoma X e un'altra sonda centromerica specifica del cromosoma come controllo per determinare il contenuto cromosomico X delle cellule della granulosa. Qui, il cromosoma 18 viene utilizzato come controllo.
- Applicare 5 μL di sonda CEP 18 (D18Z1) direttamente etichettata con fluorocromo SpectrumGreen e sonda CEP X (DXZ1) direttamente etichettata con fluorocromo SpectrumRed sui vetrini pretrattati. Applicare un coprivetrino e sigillare l'area con colla fotografica. Posizionare i vetrini in un ibridatore per la denaturazione a 80 °C per 10 minuti e l'ibridazione durante la notte a 37 °C.
- Il giorno successivo, sciacquare i vetrini per 5 minuti in 2x SSC a 42 °C, quindi con un risciacquo di 2 minuti e 1 min in 0,3% Nonidet P40 a 73 °C. Rinfrescare il 2x SSC e risciacquare nuovamente i vetrini per 5 minuti a temperatura ambiente. Coprire la cuvetta in modo che le sezioni siano tenute al buio.
- Risciacquare brevemente i vetrini in acqua distillata. Disidratare i vetrini in etanolo al 99,5% e lasciarli asciugare nuovamente all'aria. Infine, montare le guide con una soluzione contenente DAPI e supporto di montaggio.
- Imaging
- Analizza i risultati al microscopio a fluorescenza con ingrandimento 630x. Aprire il software di elaborazione delle immagini sul computer. Selezionare FISH come profilo.
- Controllare se l'emissione DAPI è impostata a 431 nm e l'eccitazione a 359 nm, l'emissione rossa del Texas a 613 nm e l'eccitazione a 595 nm e l'emissione FITC a 519 nm e l'eccitazione a 495 nm.
- Acquisire un'immagine selezionando Live > Capture Single Image. Ottimizza la qualità dell'immagine regolando l'esposizione e il guadagno spostando il cursore Esposizione e il cursore guadagno nel menu Immagine a sinistra (ad esempio, esposizione: 212 ms e guadagno: 7,9). L'esposizione e il guadagno richiesti possono variare a seconda dell'immagine; Osservare le modifiche durante questo processo per ottenere un'immagine ottimizzata. Salvare l'immagine in un file appena creato.
- Conservare i vetrini al buio a 4 °C dopo l'analisi per evitare la perdita di segnali.
Risultati
FISH su cellule ovariche isolate prima dell'innesto
Il tessuto crioconservato della corteccia ovarica di femmine con 45,X/46,XX (paziente A) o 45,X/46,XX/47,XXX (paziente B) TS è stato utilizzato per illustrare i risultati utilizzando questo protocollo. Nel paziente A, il 50% dei linfociti aveva un cariotipo 45,X e il 50% aveva 46,XX. Nel paziente B, il 38% dei linfociti era 45,X, il 28% era 46,XX e il 34% era 47,XXX. Le sonde centromeri-specifiche per il cromosoma X (verde) e il cromosoma 18 come controllo (rosso) sono state utilizzate per determinare il contenuto cromosomico X di singole cellule della granulosa, cellule stromali e ovociti isolati dal tessuto della corteccia ovarica di pazienti TS senza precedente xenotrapianto (Figura 1).
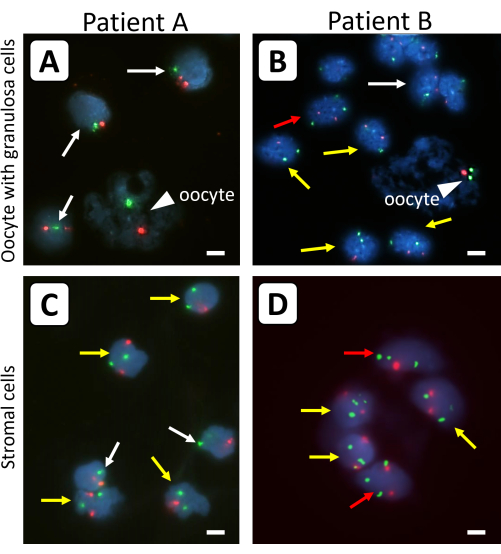
Figura 1: Analisi FISH di cellule ovariche isolate dal tessuto della corteccia ovarica prima dell'innesto. Gli ovociti (punte di freccia) e le cellule della granulosa da singoli follicoli primordiali (A,B) e (C,D) le cellule stromali circostanti sono stati analizzati con sonde fluorescenti specifiche per il cromosoma X (segnali verdi) e il cromosoma 18 di controllo (segnali rossi). Le frecce bianche indicano 45,X linee di cella, le frecce gialle indicano 46,XX linee cellulari e le frecce rosse indicano 47,XXX linee di celle. Non tutti i segnali fluorescenti sono sullo stesso piano di messa a fuoco. Le barre rappresentano 10 μm. L'ingrandimento dei segnali FISH è stato fissato a 630x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Le differenze tra i singoli follicoli primordiali che sono stati trattati con e senza tripsina prima della FISH sono mostrate nella Figura 2. Utilizzando la tripsina prima dell'analisi FISH, la massa cellulare della granulosa e gli ovociti erano meno raggruppati, consentendo l'analisi del contenuto cromosomico X delle singole cellule della granulosa e degli ovociti. Il DNA degli ovociti può essere facilmente distinto da quello delle cellule della granulosa circostanti a causa della forma irregolare, delle dimensioni e dell'aspetto diffuso del DNA degli ovociti. Inoltre, solo un forte segnale FISH per ciascun cromosoma è osservato negli ovociti di piccoli follicoli, a causa della stretta vicinanza dei quattro cromatidi fratelli in queste cellule. Il contenuto cromosomico X degli ovociti può essere determinato utilizzando il rapporto superficiale del segnale FISH per il cromosoma X e quello del cromosoma 18.

Figura 2: Piccoli follicoli trattati con e senza tripsina prima della FISH. (A) La digestione enzimatica del tessuto della corteccia ovarica ha provocato una sospensione di cellule in gran parte dissociate, ma lasciando i follicoli primordiali, costituiti da un ovocita intatto circondato da un singolo strato di cellule della granulosa (punte di freccia nel pannello A). (B) I piccoli follicoli sono stati selezionati manualmente dalla sospensione cellulare, ma hanno fornito difficoltà nell'interpretare i segnali dopo la FISH a causa dell'aggregazione delle cellule della granulosa (C). (D,E) Un'ulteriore digestione dei follicoli isolati con tripsina prima della FISH ha portato le singole cellule della granulosa a contrarsi in una morfologia sferica sulla superficie dei follicoli e avevano maggiori probabilità di dissociarsi dal follicolo per diventare accessibili per l'analisi FISH. I segnali FISH derivati dagli ovociti sono indicati da frecce. Le barre nere rappresentano 100 μm e le barre bianche rappresentano 10 μm. L'ingrandimento dei segnali FISH è stato fissato a 630x. Il pannello D è stato riprodotto con il permesso di Peek et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Analisi FISH di cellule di granulosa su sezioni di paraffina di tessuto della corteccia ovarica innestata
I follicoli secondari e antrali sono risultati meno suscettibili alla digestione enzimatica, il che rende il metodo precedentemente descritto di dissociazione tissutale per ottenere singole cellule ovariche non adatto alla crescita di follicoli trovati nel tessuto ovarico dopo xenotrapimento a lungo termine. Pertanto, il protocollo FISH è stato ottimizzato utilizzando sezioni istologiche da 4 μm per determinare il contenuto cromosomico X delle cellule della granulosa dei follicoli secondari e antrali nel tessuto della corteccia ovarica dopo l'innesto (Figura 3). In questo contesto, è improbabile che il segnale FISH del cromosoma X o del cromosoma di controllo negli ovociti venga catturato in una singola sezione di 4 μm, a causa del grande diametro degli ovociti nei follicoli in crescita.
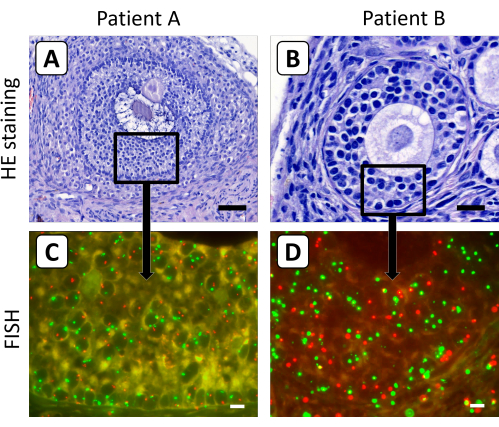
Figura 3: Colorazione istologica e FISH di sezioni di tessuto della corteccia ovarica dopo xenotrapianto. (A,B) La colorazione dell'ematossilina/eosina ha mostrato follicoli secondari e antrali morfologicamente normali nel tessuto della corteccia ovarica dopo 5 mesi di xenotrapianto. (C,D) Il contenuto cromosomico X delle cellule della granulosa di questi follicoli è stato determinato mediante analisi FISH. In questa figura, il cromosoma X è mostrato in rosso e il cromosoma 18 in verde. La barra nel pannello A rappresenta 50 μm, la barra nel pannello B rappresenta 20 μm e le barre nei pannelli C e D rappresentano 10 μm. L'ingrandimento dei segnali FISH è stato fissato a 630x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Come primo passo, sono stati eseguiti esperimenti con diverse tecniche di fissazione dei tessuti per determinare quale metodo si traduce nei migliori segnali FISH. L'analisi FISH è stata eseguita su tessuto innestato che è stato fissato sia nella soluzione di Bouin e successivamente immerso in formaldeide al 4%, sia su tessuto innestato che è stato fissato solo in formaldeide al 4%. Il tessuto innestato che è stato fissato per la prima volta in Bouin ha mostrato una foschia verde sull'immagine, rendendo difficile contare con precisione il numero di segnali FISH (Figura 4).

Figura 4: Tessuto della corteccia ovarica innestato fissato solo nella soluzione di Bouin e formaldeide. (A) La fissazione del tessuto della corteccia ovarica innestata nella soluzione di Bouin ha provocato segnali fluorescenti sfocati e in gran parte oscurati nelle cellule follicolari a causa di una foschia verde. (B) Il tessuto della corteccia ovarica fissato nella formaldeide forniva solo eccellenti segnali fluorescenti facili da interpretare. Le barre rappresentano 10 μm. L'ingrandimento dei segnali FISH è stato fissato a 630x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Per determinare il contenuto cromosomico X delle cellule granulari dei follicoli nelle sezioni istologiche, non è possibile contare semplicemente i segnali FISH delle cellule della granulosa. Parte dei cromosomi di una singola cellula della granulosa può essere persa in una certa sezione istologica, a causa del sezionamento del tessuto. Pertanto, è necessario determinare prima la percentuale di segnali FISH persi a causa del sezionamento prima di determinare in definitiva la perdita del contenuto cromosomico X della popolazione cellulare della granulosa a causa di aneuploidia nei follicoli secondari e antrali di nuova formazione dopo l'innesto del tessuto.
La percentuale di segnali FISH persi a causa del sezionamento può essere calcolata determinando il numero di segnali FISH per cellula granulosa del cromosoma di controllo non aneuploide 18. Si prevede che la stessa percentuale del cromosoma X venga persa a causa del sezionamento. Qualsiasi ulteriore riduzione del numero di segnali FISH del cromosoma X nella popolazione cellulare della granulosa è dovuta all'aneuploidia. Tuttavia, l'utilizzo dei segnali FISH di un cromosoma di controllo per determinare la perdita cromosomica X dovuta all'aneuploidia richiede che la sensibilità di rilevamento dei segnali FISH del cromosoma X e del cromosoma di controllo sia molto simile. È stata quindi determinata la sensibilità di rilevazione di entrambe le sonde FISH nelle cellule della granulosa dei follicoli in crescita nelle sezioni istologiche di individui 46,XX non aneuploidi. Quando il rapporto tra i segnali FISH del cromosoma X e del cromosoma di controllo è vicino a 1, si può presumere che la sensibilità di rilevamento di entrambe le sonde sia in effetti molto simile e che le sonde FISH possano quindi essere utilizzate per determinare il livello di aneuploidia nella popolazione cellulare della granulosa dei follicoli in crescita nelle sezioni istologiche del tessuto ovarico dopo xenotrapianto.
Esempio
Quando si analizza il numero di segnali del cromosoma 18 in 130 cellule della granulosa di un follicolo da un'ovaia di un individuo 46,XX, ci si aspetta che siano presenti 260 segnali. Tuttavia, in una sezione di 4 μm di queste cellule, sono stati osservati solo 204 segnali del cromosoma 18. Ciò indica che il 21,5% dei segnali viene perso a causa del sezionamento ((260-204)/260 x 100 = 21,5%). Il numero di segnali del cromosoma 18 per cellula della granulosa è quindi ridotto a 204/130 = 1,57 a causa del sezionamento.
Successivamente, viene analizzato il numero di cromosomi X nelle cellule della granulosa di un follicolo antrale dopo l'innesto nel tessuto ovarico di una femmina con TS. In totale, sono stati contati 191 segnali per il cromosoma X e 199 segnali per il cromosoma 18. Il numero di cellule della granulosa può essere determinato dividendo il numero totale di segnali per il cromosoma 18 per il numero di segnali del cromosoma 18 per cellula della granulosa (199/1,57 = 127 cellule della granulosa). Infine, la percentuale di cellule 45,X della granulosa può essere determinata dividendo la differenza nei segnali del cromosoma 18 e del cromosoma X con il numero di cellule della granulosa (cioè, [199-191]/127 x 100 = il 6% delle cellule della granulosa sono 45,X, e il 94% di queste cellule sono 46, XX).
È interessante notare che, nei pazienti con una linea cellulare 47,XXX, è possibile determinare solo la percentuale minima di cellule della granulosa con un cariotipo 47,XXX, poiché un mix di cellule granulari 45,X e 47,XXX ha lo stesso numero di segnali cromosomici X delle cellule della granulosa 46,XX.
Discussione
L'analisi FISH è una tecnica ben nota per rilevare aberrazioni cromosomiche X nei linfociti o nelle cellule buccali di maschi e femmine10. Diversi studi hanno descritto la FISH su gameti di maschi con aberrazioni cromosomiche X, ma mancano ancora informazioni dettagliate ottenute dalla FISH su cellule ovariche di femmine con aberrazioni cromosomiche X14. Questo articolo presenta nuovi metodi basati sulla FISH per determinare se l'aneuploidia è presente nelle cellule ovariche del tessuto della corteccia ovarica non innestato e innestato da femmine con aberrazioni cromosomiche X.
La sfida principale del protocollo per l'isolamento delle singole cellule ovariche nel tessuto della corteccia ovarica non innestato risiede nella digestione enzimatica del tessuto, che richiede una certa pratica in anticipo. Al fine di ottenere segnali FISH accurati di cellule ovariche sufficienti, è importante seguire rigorosamente i passaggi relativi alla digestione enzimatica, ai tempi di incubazione e alle temperature indicate. Deviare dal protocollo può causare una perdita sostanziale di cellule ovariche durante il processo, e questo dovrebbe essere evitato soprattutto nelle pazienti che hanno già una bassa riserva ovarica. Un altro passo fondamentale in questo metodo è quello di trattare i follicoli primordiali purificati con tripsina per evitare che gli ovociti e la massa cellulare della granulosa si aggreghino, il che preclude l'analisi delle singole cellule. Senza trattamento con tripsina, il numero di singole cellule di granulosa che possono essere analizzate in modo affidabile dalla FISH è gravemente ridotto.
L'analisi FISH sul tessuto della corteccia ovarica recuperato dopo un innesto a lungo termine richiede una tecnica diversa, poiché solo i piccoli follicoli sono risultati sufficientemente suscettibili alla digestione enzimatica necessaria per ottenere singole cellule ovariche. Inoltre, simile all'autotrapianto del tessuto della corteccia ovarica, molti follicoli si perdono dopo l'innesto a causa dell'ipossia e della mancanza di nutrienti prima che l'innesto sia sufficientemente rivascolarizzato dall'ospite20. Si prevede quindi che il numero di follicoli dopo l'innesto sia notevolmente inferiore rispetto a prima dell'innesto. Per questa tecnica FISH utilizzata per le sezioni istologiche, è importante fissare il tessuto innestato in formaldeide al 4% solo per ottenere segnali FISH ottimali. La fissazione del tessuto della corteccia ovarica nel fissativo di Bouin viene abitualmente utilizzata in laboratorio e, mentre questo dà risultati eccellenti se combinato con la colorazione standard HE, il tessuto di fissazione con Bouin prima della FISH porta a segnali fluorescenti deboli e sfocati che sono difficili da interpretare.
Sebbene questo protocollo abbia dimostrato di avere successo nel determinare il contenuto cromosomico X delle cellule ovariche, ha ancora alcune limitazioni. Una limitazione è che questi metodi possono essere utilizzati solo per analizzare le cellule ovariche delle femmine con aberrazioni numeriche. Le aberrazioni numeriche possono essere rilevate utilizzando sonde dirette a sequenze ripetitive21. Queste sonde ibridano più sequenze di coppie di basi ripetute nella regione del centromero, con conseguenti forti segnali di ibridazione. Al contrario, le aberrazioni strutturali possono essere rilevate solo utilizzando sonde contro singole sequenze uniche. Queste sonde si ibridano a sequenze che si verificano solo una volta nel genoma aploide, risultando in un segnale FISH considerevolmente meno intenso rispetto alle aberrazioni numeriche. A causa di questi segnali FISH relativamente deboli, è difficile determinare correttamente il contenuto cromosomico X delle cellule ovariche nelle femmine con aberrazioni strutturali.
In secondo luogo, i segnali FISH degli ovociti di piccoli follicoli nel tessuto non innestato sono difficili da analizzare, a causa della stretta vicinanza dei quattro cromatidi fratelli nella profase della meiosi I22. Solo un forte segnale di ibridazione sarà presente negli ovociti, e quindi non è possibile contare semplicemente il numero di segnali negli ovociti per determinare il contenuto cromosomico X. Invece, il rapporto superficiale del cromosoma X e dei segnali 18 FISH dovrebbe essere utilizzato per determinare il contenuto cromosomico X in queste cellule. Questo può essere determinato in modo affidabile solo se i segnali FISH negli ovociti sono chiaramente presenti.
Inoltre, la FISH sul tessuto innestato può essere utilizzata solo per determinare il contenuto cromosomico X delle cellule della granulosa dai follicoli secondari e antrali, poiché i piccoli follicoli nelle sezioni istologiche del tessuto innestato hanno solo poche cellule della granulosa che possono essere analizzate correttamente. Inoltre, il contenuto cromosomico X degli ovociti non può essere determinato con precisione utilizzando questo metodo a causa del grande diametro degli ovociti.
Infine, rimane difficile ottenere gameti femminili rispetto ai gameti maschili perché è necessaria una chirurgia invasiva per ottenere cellule ovariche o tessuto della corteccia ovarica. Pertanto, è più probabile che questi metodi vengano applicati in un contesto di ricerca.
In conclusione, l'analisi FISH di cellule ovariche di tessuto della corteccia ovarica non innestato e innestato da femmine con aberrazioni cromosomiche X è una tecnica unica e utile per ottenere informazioni sul contenuto cromosomico X delle cellule ovariche in questo gruppo specifico. Queste tecniche dimostrano che la crioconservazione del tessuto della corteccia ovarica di femmine con aberrazioni cromosomiche X è possibile e che i follicoli primordiali crioconservati sono in grado di crescere fino a follicoli secondari e antrali. Tuttavia, va tenuto presente che entrambi i metodi hanno lo scopo di facilitare la ricerca futura nelle femmine con aberrazioni cromosomiche X e non sono progettati per essere utilizzati come strumento diagnostico per lo screening degli esiti riproduttivi delle femmine con aberrazioni cromosomiche X nella pratica clinica.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano Marjo van Brakel, Dominique Smeets, Guillaume van de Zande, Patricia van Cleef e Milan Intezar per la loro competenza e assistenza tecnica. Fonti di finanziamento: Merck Serono (A16-1395), Goodlife e Ferring.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
Riferimenti
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon