Method Article
Erforschung von X-Chromosomen-Aberrationen in Ovarialzellen durch Fluoreszenz-in-situ-Hybridisierung
In diesem Artikel
Zusammenfassung
In diesem Artikel werden zwei Methoden vorgestellt, die auf der Fluoreszenz-in-situ-Hybridisierung basieren, um den X-chromosomalen Gehalt von Ovarialzellen in nicht transplantiertem und transplantiertem Ovarialrindengewebe von Frauen mit X-Chromosomenaberrationen zu bestimmen.
Zusammenfassung
Millionen von Menschen weltweit beschäftigen sich mit Fragen der Fruchtbarkeit. Eine verminderte Fruchtbarkeit oder sogar Unfruchtbarkeit kann auf viele verschiedene Ursachen zurückzuführen sein, einschließlich genetischer Störungen, von denen Chromosomenanomalien die häufigsten sind. Die Fluoreszenz-in-situ-Hybridisierung (FISH) ist eine bekannte und häufig eingesetzte Methode zum Nachweis von Chromosomenaberrationen beim Menschen. FISH wird hauptsächlich für die Analyse von Chromosomenanomalien in den Spermien von Männern mit numerischen oder strukturellen Chromosomenaberrationen verwendet. Darüber hinaus wird diese Technik auch häufig bei Frauen angewendet, um X-Chromosomenaberrationen zu erkennen, von denen bekannt ist, dass sie eine ovarielle Dysgenesie verursachen. Es fehlen jedoch noch Informationen über den X-Chromosomen-Gehalt von Eierstockzellen von Frauen mit X-Chromosomenaberrationen in Lymphozyten und/oder Wangenzellen.
Ziel dieser Studie ist es, die Grundlagenforschung zu X-Chromosomenaberrationen bei Frauen voranzutreiben, indem zwei auf FISH basierende Methoden zur Bestimmung des X-chromosomalen Gehalts von Ovarialzellen vorgestellt werden. Zunächst wird eine Methode beschrieben, mit der der X-Chromosomengehalt von isolierten Ovarialzellen (Eizellen, Granulosazellen und Stromazellen) in nicht transplantiertem Ovarialrindengewebe von Frauen mit X-Chromosomenaberrationen bestimmt werden kann. Die zweite Methode zielt darauf ab, die Wirkung von Chromosomenaberrationen auf die Follikulogenese zu bewerten, indem der X-Chromosomengehalt von Eierstockzellen neu gebildeter sekundärer und antraler Follikel im Eierstockgewebe von Weibchen mit X-Chromosomenaberrationen nach Langzeittransplantation in immungeschwächte Mäuse bestimmt wird. Beide Methoden könnten in der zukünftigen Forschung hilfreich sein, um Einblicke in das Fortpflanzungspotenzial von Frauen mit X-Chromosomenaberrationen zu erhalten.
Einleitung
Unfruchtbarkeit ist ein Gesundheitsproblem des männlichen oder weiblichen Fortpflanzungssystems, von dem weltweit etwa 186 Millionen Menschen im gebärfähigen Alter betroffen sind1. Bei mindestens 35 % der unfruchtbaren Paare wird die Unfruchtbarkeit durch eine Störung des weiblichen Fortpflanzungssystems verursacht2. Es gibt viele Faktoren, die weibliche Unfruchtbarkeit verursachen können, wie z. B. genetische Faktoren, Anomalien des Genitaltrakts, endokrine Dysfunktion, entzündliche Erkrankungen und iatrogene Behandlung3.
Genetische Anomalien liegen bei etwa 10 % der unfruchtbaren Frauen vor 4,5. Von allen genetischen Anomalien sind X-Chromosomen-Aberrationen die häufigste Ursache für die Ovarialdysgenesie2. Mehrere Studien haben berichtet, dass X-Chromosomenaberrationen bei Frauen mit Turner-Syndrom (TS) oder Triple-X-Syndrom mit vorzeitiger Ovarialinsuffizienz aufgrund eines beschleunigten Verlusts von Keimzellen oder einer gestörten Oogenese assoziiert sind 6,7,8.
Aberrationen des X-Chromosoms können unterteilt werden in: 1) numerische Aberrationen, bei denen die Anzahl der X-Chromosomen unterschiedlich ist, aber die X-Chromosomen intakt sind; und 2) strukturelle Aberrationen, bei denen das X-Chromosom genetisches Material gewonnen oder verloren hat 3,9. Numerische Aberrationen des X-Chromosoms sind häufiger als strukturelle Anomalien und werden häufig durch spontane Fehler bei der Zellteilung verursacht 3,9. Wenn ein solcher Fehler während der Meiose auftritt, kann er zu aneuploiden Gameten und schließlich zu Nachkommen mit Chromosomenaberrationen in allen Zellen führen. Wenn Chromosomendefekte in somatischen Zellen als Folge von Fehlern während der Mitose in frühen Stadien der Ontogenese auftreten, kann dies zu Mosaizismus führen. Bei diesen Personen sind sowohl Zellen mit normalem X-Chromosomengehalt als auch Zellen mit X-Chromosomenaberrationen vorhanden.
In den 1980er Jahren wurde eine zytogenetische Technik namens Fluoreszenz-in-situ-Hybridisierung (FISH) entwickelt, um spezifische Nukleinsäuresequenzen auf Metaphase- und Interphase-Chromosomen sichtbar zu machen und zu lokalisieren 10,11. Bei dieser Technik werden fluoreszenzmarkierte DNA-Sonden verwendet, um an eine bestimmte Sequenz im Chromosom zu binden, die dann mit einem Fluoreszenzmikroskop sichtbar gemacht werden kann.
Heutzutage ist FISH als klinisches Diagnoseinstrument weit verbreitet und gilt als Goldstandard bei der Erkennung von Chromosomenaberrationen10. Im Bereich der Reproduktionsmedizin wurde die FISH-Analyse an Spermien eingesetzt, um Einblicke in den X-chromosomalen Gehalt von Spermien bei Männern mit numerischen oder strukturellen Chromosomenaberrationen in somatischen Zellen zu erhalten12,13,14. Diese Studien zeigten, dass Männer mit Chromosomenaberrationen mit größerer Wahrscheinlichkeit eine höhere Häufigkeit von aneuploiden Spermien in ihrem Sperma aufwiesen als Männer mit normalen Karyotypen12,13,14.
Im Gegensatz zu den Spermien ist nur sehr wenig über den X-chromosomalen Gehalt von Eierstockzellen (einschließlich Eizellen, Granulosa/Theka-Zellen und Stromazellen) bei Personen mit einer Chromosomenaberration sowie über die möglichen Folgen einer Aneuploidie dieser Zellen auf ihr Fortpflanzungspotenzial bekannt. Ein wichtiger Grund für die geringen Informationen über den Karyotyp von Eierstockzellen im Vergleich zu Spermien ist die Tatsache, dass sich Frauen einem invasiven Eingriff wie einer Follikelpunktion oder einer Operation unterziehen müssen, um Eizellen oder Gewebe der Eierstockrinde zu gewinnen. Weibliche Gameten sind daher für Forschungszwecke nur schwer zu beschaffen.
Derzeit wird in den Niederlanden eine Interventionsstudie durchgeführt, um die Wirksamkeit der Kryokonservierung von Eierstockgewebe bei jungen Frauen mit TS15 zu untersuchen. Ein Fragment des Gewebes der Ovarialrinde der Patientin stand zur Verfügung, um den X-chromosomalen Gehalt der Ovarialzellen zu bestimmen16,17. Im Rahmen der Studie wurde eine neuartige Methode entwickelt, die auf FISH von dissoziiertem Ovarialrindengewebe basiert, um festzustellen, ob Chromosomenaberrationen in Ovarialzellen bei Frauen vorhanden sind, die eine Chromosomenaberration in nicht-ovariellen somatischen Zellen wie Lymphozyten oder Wangenzellen aufweisen. Darüber hinaus wurde auch der Effekt der Aneuploidie in Ovarialzellen auf die Follikulogenese bestimmt. Zu diesem Zweck wurde ein etabliertes FISH-Protokoll modifiziert, das die Analyse histologischer Schnitte von Ovarialrindengewebe nach künstlich induzierter Follikulogenese während der Langzeit-Xenotransplantation bei immungeschwächten Mäusen ermöglicht. In dieser Studie stellen wir zwei auf FISH basierende Methoden vor, um den X-chromosomalen Gehalt in Ovarialzellen in nicht transplantiertem und transplantiertem Ovarialrindengewebe bei Frauen mit X-Chromosomenaberrationen zu bestimmen, mit dem Ziel, die Grundlagenforschung zu diesem Thema zu verbessern.
Protokoll
Das Studienprotokoll von TurnerFertility wurde vom Zentralausschuss für Forschung am Menschen genehmigt (NL57738.000.16). In dieser Studie wurde das Gewebe der Ovarialrinde von 93 Frauen mit TS gewonnen. Materialien, für die Sicherheitsvorkehrungen erforderlich sind, sind in Tabelle 1 aufgeführt.
Tabelle 1: Sicherheitsvorkehrungen.
| Material | Gefahr | ||
| Essigsäure | Schwere Hautverbrennungen und Reizungen der Atemwege | ||
| Kollagenase | Reizt Augen, Atemwege und Haut | ||
| DAPI | Reizt Augen, Atemwege und Haut | ||
| DNase I | Reizt Augen, Atemwege und Haut | ||
| Ethanol | Leichtentzündlich | ||
| Formaldehyd | Giftig nach Einatmen, Verschlucken und Hautkontakt | ||
| Formamid (in Fluoreszenzsonden) | Kann dem ungeborenen Kind schaden | ||
| Liberase | Reizt Augen, Atemwege und Haut | ||
| Methanol | Leicht entzündlich, giftig durch Einatmen, Verschlucken und Hautkontakt | ||
| Nonidet P40 | Reizt die Haut oder die Augen | ||
| Pepsin | Reizt Augen, Atemwege und Haut | ||
| Proteinase K | Atembeschwerden nach dem Einatmen | ||
| Xylol | Leicht entzündlich, giftig nach Einatmen und Hautkontakt. Vermeiden Sie den Kontakt mit den Augen. | ||
Tabelle 1: Materialien, die Sicherheitsvorkehrungen erfordern.
1. FISH auf isolierten einzelnen Zellen der Eierstockrinde
- Dissoziation von Gewebe der Ovarialrinde, um einzelne Zellen zu erhalten
- Schneiden Sie das kryokonservierte/aufgetaute Gewebe der Eierstockrinde mit einem Skalpell in kleine Stücke von ca. 1 mm x 1 mm x 1 mm.
- Die Gewebefragmente werden in 4 ml vorgewärmtem (37 °C) L15-Medium, das 0,1 mg/ml Gewebedissoziationsenzymmischung, 10 μg/ml DNase I und 1 mg/ml Kollagenase I aus C. histolyticum enthält, für maximal 75 Minuten bei 37 °C enzymatisch verdaut. Pipetieren Sie die Verdauungsmischung alle 15 Minuten auf und ab.
- Stoppen Sie die enzymatische Verdauung, indem Sie 4 ml kaltes L15 hinzufügen, das mit 10 % fötalem Kälberserum (FBS) ergänzt wird. Waschen Sie das dissoziierte Gewebe einmal mit 8 ml kaltem L15-Medium durch Zentrifugation bei 500 x g und resuspendieren Sie es in 500 μl L15-Medium ohne Vortex, um eine Schädigung der Zellen zu vermeiden.
- Die Zellsuspension, die größtenteils einzelne Stromazellen und kleine Follikel (Eizellen, die von einer einzigen Schicht von Granulosazellen umgeben sind) enthält, wird in eine Kunststoff-Petrischale überführt und die Zellsuspension unter einem Stereomikroskop (100-fache Vergrößerung) untersucht.
- Nehmen Sie die kleinen Follikel (<50 μm) manuell mit einer 75-μm-Kunststoffpipette auf und übertragen Sie die Follikel in ein Tröpfchen L15-Medium, das mit 10 % FBS bei 4 °C angereichert ist, um die Aggregation von Follikeln zu verhindern. Führen Sie die Follikelentnahme für maximal 30 Minuten durch. Um die Ausbreitung der Follikelzellen vor der FISH-Analyse zu verbessern, werden die gereinigten Follikel in eine Lösung aus 0,06 % Trypsin, 1 mg/ml Ethylendiamintetraessigsäure (EDTA) und 1 mg/ml Glukose überführt und 20 Minuten bei 37 °C inkubiert.
- Mit einer 75-μm-Kunststoffpipette werden die ovariellen Stromazellen aus der Suspension der Kortexzellen gewonnen, wobei besonders darauf zu achten ist, dass eine Kontamination mit kleinen Follikeln vermieden wird.
- FISH-Analyse einzelner Eierstockzellen
- Die behandelten Ovarialfollikel (empfohlen n = 5-20) mit Trypsin/EDTA/Glukose- oder Stromazellen (n > 1.000) werden in Tröpfchen von 5 μl 0,15 mM KCl/15 μl der phosphatgepufferten Kochsalzlösung (DPBS) von Dulbecco auf einen Objektträger übertragen und 20 min bei 37 °C inkubiert.
- Trocknen und fixieren Sie die Objektträger in 300 μl 0,05 mM KCl/7,5 % Essigsäure/22,5 % Methanol für 2 min bei Raumtemperatur (RT). Decken Sie die Objektträger 2 Minuten lang bei RT mit Methanol/Essigsäure (3:1) ab, um die Fixierung abzuschließen.
- Stellen Sie 20x Standard-Natriumcitrat (SSC) her, indem Sie 876 g Natriumchlorid und 441 g Trinatriumcitrat-Dihydrat in 5 l destilliertes Wasser geben. Als nächstes fügen Sie 100 ml des 20x SSC zu 900 ml demineralisiertem (Demi-)Wasser hinzu, um 2x SSC zu erhalten. Waschen Sie die Probe in 2x SSC bei 73 °C, bedecken Sie sie mit 100 μl 2%iger Proteinase K und verschließen Sie sie mit einem Deckglas. Inkubieren Sie die Objektträger für 10 min bei 37 °C in der Hybridisierungsstation.
- Entfernen Sie das Deckglas und waschen Sie die Objektträger 5 Minuten lang in DPBS bei RT. Fixieren Sie die Probe 5 Minuten lang mit 1 % Formaldehyd bei RT. Zu diesem Zeitpunkt ist das Material noch nicht vollständig auf den Objektträgern befestigt und sollte daher nicht auf eine Schüttelplattform gelegt werden.
- Waschen Sie die Objektträger 5 Minuten lang in DPBS bei RT, gefolgt von einer anschließenden Dehydrierung von 70 %, 80 %, 90 % und 100 % Ethanol für jeweils 2 Minuten. Trocknen Sie die dehydrierte Probe an der Luft und hybridisieren Sie sie mit fluoreszenzmarkierten Sonden.
- Wählen Sie eine zentromerspezifische Sonde für Chromosom X und eine andere chromosomenspezifische zentromerische Sonde als Kontrolle aus, um den X-Chromosomengehalt von Ovarialzellen zu bestimmen. In diesem Fall werden zentromerspezifische Sonden für Chromosom X (CEP X [DXZ1]) direkt markiert mit Fluorochrom SpectrumGreen und Chromosom 18 (CEP 18 [D18Z1]) direkt markiert mit Fluorochrom SpectrumOrange verwendet.
- Geben Sie 1 μl CEP X, 1 μl CEP 18 und 18 μl des Hybridisierungspuffers in die Probe und verschließen Sie sie mit einem Deckglas, das auf die Objektträger geklebt wird, um ein Verdampfen der Sonde während der Hybridisierung zu verhindern. Die Objektträger werden zur Denaturierung bei 73 °C für 3 min in die Hybridisierungsstation überführt, gefolgt von der Hybridisierung während einer Inkubation über Nacht bei 37 °C.
- Entfernen Sie das Deckglas und den restlichen Kleber nach der Hybridisierung vom Objektträger. Waschen Sie die Objektträger in 0,4x SSC/0,3% Tween-20 bei 72 °C für 2 min, gefolgt von einer Inkubation für 1 min in 2x SSC/0,1% Tween-20 bei RT.
- Dehydrieren Sie die Objektträger durch anschließende 2-minütige Inkubationszeit in 70 %, 80 %, 90 % und 100 % Ethanol und trocknen Sie sie im Dunkeln an der Luft. Decken Sie die Objektträger mit einem Eindeckmedium ab, das 4′,6-diamidino-2-phenylindol (DAPI) enthält. Vor der fluoreszenzmikroskopischen Analyse mindestens 10 Minuten bei -20 °C aufbewahren.
- Bildgebung
- Untersuchen Sie das/die Signal(e) für das X-Chromosom mit einem Fluoreszenzmikroskop, das mit einer Bildverarbeitungssoftware verbunden ist.
- Wählen Sie zunächst Fluorochrom-DAPI aus.
- Nehmen Sie ein Bild auf, indem Sie "Neue Zelle" auswählen > Live > Capture bei 630-facher Vergrößerung. Es erscheint ein neues Fenster mit dem Schwellenwert. Setzen Sie den blauen Balken des Schwellenwerts auf 0, um den Hintergrund zu minimieren, und den roten Balken auf Maximum (255), um die Signale heller zu machen. Klicken Sie auf Akzeptieren.
- Es erscheint ein neues Fenster mit Verbesserung mit einem Vorschlag für dunkler/heller (12), Radius (3) und Tiefe (1). Verwenden Sie die vorgeschlagenen Werte oder passen Sie sie an, wenn Sie nicht zufrieden sind.
- Wählen Sie zweitens Fluorochrome SpectrumOrange und klicken Sie auf Aufnehmen.
- Setzen Sie den blauen Balken des Schwellenwerts auf 0, um den Hintergrund zu minimieren, und den roten Balken auf Maximum (255), um die Signale heller zu machen. Klicken Sie auf Akzeptieren.
- Das Fenster mit der Verbesserung wird mit einem Vorschlag für dunkler/heller (-11), Radius (2,7) und Tiefe (0,6) angezeigt. Verwenden Sie die vorgeschlagenen Werte oder passen Sie sie an, wenn Sie nicht zufrieden sind.
- Wählen Sie abschließend Fluorochrome SpectrumGreen aus und klicken Sie auf Capture.
- Setzen Sie den blauen Balken des Schwellenwerts auf 0, um den Hintergrund zu minimieren, und den roten Balken auf Maximum (255), um die Signale heller zu machen. Klicken Sie auf Akzeptieren.
- Das Fenster mit der Verbesserung wird mit einem Vorschlag für dunkler/heller (0), Radius (3) und Tiefe (0) angezeigt. Verwenden Sie die vorgeschlagenen Werte oder passen Sie sie an, wenn Sie nicht zufrieden sind. Speichern Sie das Bild in einer neu erstellten Datei.
HINWEIS: Somatische Zellen wurden nur ausgewertet, wenn zwei Signale des Kontrollchromosoms 18 sichtbar waren. In den meisten Eizellen konnte nur ein Signal für jedes Chromosom nachgewiesen werden.
- Wählen Sie zunächst Fluorochrom-DAPI aus.
- Lagern Sie die Objektträger nach der Analyse im Dunkeln bei 4 °C, um Signalverluste zu vermeiden.
- Untersuchen Sie das/die Signal(e) für das X-Chromosom mit einem Fluoreszenzmikroskop, das mit einer Bildverarbeitungssoftware verbunden ist.
2. FISH auf Paraffinschnitten von transplantiertem Gewebe der Eierstockrinde
HINWEIS: Ein Fragment des kryokonservierten/aufgetauten Gewebes der Ovarialrinde von 18 Frauen mit TS wurde 5 Monate lang in schwer kombinierte immundefiziente (SCID) Mäuse xenotransplantiert. Das Verfahren der Xenotransplantation wurde bereits beschrieben und an der Université Catholique de Louvain (Brüssel, Belgien) gemäß den lokalen Richtlinien des Ausschusses für Tierversuche zum Tierschutz durchgeführt (Referenz 2014/UCL/MD/007)18,19.
- Selektion von Abschnitten des xenotransplantierten Gewebes der Eierstockrinde, das Follikel enthält
- Fixieren Sie xenotransplantiertes Gewebe der Eierstockrinde in 4% Formaldehyd und betten Sie das Gewebe in Paraffin ein. Schneiden Sie die Blöcke mit einem Skalpell ab, um überschüssiges Paraffin zu entfernen, und schneiden Sie den Paraffinblock auf einem Rotationsmikrotom auf eine Dicke von 4 μm.
- Wählen Sie jeden siebten Abschnitt des Paraffinbandes für die Hämatoxylin- und Eosinfärbung (HE) aus, um zu bestimmen, welche Abschnitte Follikel enthalten. Legen Sie den Schnitt in ein Wasserbad bei 40-45 °C und montieren Sie ihn auf immunhistochemische Objektträger.
- Entparaffinierung und HE-Färbung
- Stellen Sie die Objektträger für 10 Minuten bei 60 °C auf einen Herd und tauchen Sie die Objektträger anschließend 5 Minuten lang in 100%iges Xylol. Es ist nicht notwendig, die Objektträger direkt auf den Herd zu legen. Hydratisieren Sie die Abschnitte 15 s lang in 100 % Ethanol, gefolgt von 2 x 15 s in 96 % Ethanol. Spülen Sie die Objektträger 2 Minuten lang mit Leitungswasser ab.
- Färben Sie die Objektträger 10 Minuten lang in Hämatoxylin und spülen Sie die Objektträger anschließend kurz in Leitungswasser ab. Tauchen Sie die Objektträger kurz in eine Bikarbonatlösung (100 g Magnesiumsulfat und 10 g Natriumbicarbonat in 5 l destilliertem Wasser). Spülen Sie die Objektträger 5 Minuten lang mit Leitungswasser ab.
- Die Objektträger 4 Minuten lang mit Eosin gegenfärben und die Objektträger dreimal mit 100 % Ethanol dehydrieren, gefolgt von Xylol. Deckglas der HE-Färbungen auf den Objektträgern und bewerten Sie die HE-Schnitte unter einem Lichtmikroskop, um die Schnitte mit Follikeln auszuwählen (100-fache Vergrößerung).
- Vorbehandlung und Hybridisierung von Paraffinschnitten für DNA-FISH
- Wählen Sie neue Schnitte aus, die vor oder nach dem Schnitt liegen, der Follikel aus dem Paraffinband enthielt. Montieren Sie einen Abschnitt auf einem Glasobjektträger. Trocknen Sie die Paraffinabschnitte mindestens 45 Minuten lang auf einem Herd bei 56 °C. Es ist nicht notwendig, die Objektträger direkt auf den Herd zu legen.
- Die Abschnitte 10 Minuten lang in Xylol entparaffinieren. Tauchen Sie die Objektträger in 99,5%iges Ethanol und spülen Sie sie 5 Minuten lang mit Leitungswasser ab. Behandeln Sie die Objektträger 10 Minuten lang bei 96 °C mit Ziel-Rückhollösung (niedriger pH-Wert) vor. Spülen Sie die Objektträger nach dem Abkühlen in destilliertem Wasser ab.
- Behandeln Sie die Objektträger 5 min lang mit 0,01 M Salzsäure, gefolgt von einem Pepsinaufschluss (200 U/ml) für 15 min bei 37 °C. Spülen Sie die Objektträger erneut in 0,01 M Salzsäure und anschließend in PBS.
- Fixieren Sie die Objektträger 5 Minuten lang in 1% Formaldehyd/PBS. Spülen Sie die Objektträger kurz in PBS und dann wieder in Halbwasser ab. Die Objektträger in 99,5%igem Ethanol dehydrieren und an der Luft trocknen lassen.
- Wählen Sie eine zentromerspezifische Sonde für Chromosom X und eine andere chromosomenspezifische zentromerische Sonde als Kontrolle, um den X-Chromosomengehalt von Granulosazellen zu bestimmen. Dabei wird das Chromosom 18 als Kontrolle verwendet.
- Tragen Sie 5 μl der Sonde CEP 18 (D18Z1), die direkt mit Fluorochrom SpectrumGreen markiert ist, und die Sonde CEP X (DXZ1), die direkt mit Fluorochrom SpectrumRed markiert ist, auf die vorbehandelten Objektträger auf. Bringen Sie ein Deckglas an und versiegeln Sie die Stelle mit Fotokleber. Legen Sie die Objektträger zur Denaturierung bei 80 °C für 10 Minuten und zur Hybridisierung über Nacht bei 37 °C in einen Hybridisator.
- Am nächsten Tag spülen Sie die Objektträger 5 Minuten lang in 2x SSC bei 42 °C aus, gefolgt von einer 2-minütigen und einer 1-minütigen Spülung in 0,3 % Nonidet P40 bei 73 °C. Frischen Sie die 2x SSC auf und spülen Sie die Objektträger erneut 5 Minuten lang bei Raumtemperatur aus. Decken Sie die Küvette so ab, dass die Abschnitte im Dunkeln bleiben.
- Spülen Sie die Objektträger kurz in destilliertem Wasser ab. Die Objektträger in 99,5%igem Ethanol dehydrieren und erneut an der Luft trocknen lassen. Montieren Sie die Objektträger abschließend mit einer Lösung, die DAPI und Eindeckmedium enthält.
- Bildgebung
- Analysieren Sie die Ergebnisse unter einem Fluoreszenzmikroskop bei 630-facher Vergrößerung. Öffnen Sie die Bildbearbeitungssoftware auf dem Computer. Wählen Sie FISH als Profil aus.
- Überprüfen Sie, ob die DAPI-Emission auf 431 nm und die Anregung auf 359 nm, die Texas-Rot-Emission auf 613 nm und die Anregung auf 595 nm und die FITC-Emission auf 519 nm und die Anregung auf 495 nm eingestellt ist.
- Erfassen Sie ein Bild, indem Sie Live > Einzelbild aufnehmen auswählen. Optimieren Sie die Bildqualität, indem Sie die Belichtung und Verstärkung anpassen, indem Sie den Belichtungsregler und den Verstärkungsregler im Bildmenü auf der linken Seite verschieben (z. B. Belichtung: 212 ms und Verstärkung: 7,9). Die erforderliche Belichtung und Verstärkung kann je nach Bild variieren. Beobachten Sie die Veränderungen während dieses Prozesses, um ein optimiertes Bild zu erhalten. Speichern Sie das Bild in einer neu erstellten Datei.
- Lagern Sie die Objektträger nach der Analyse im Dunkeln bei 4 °C, um Signalverluste zu vermeiden.
Ergebnisse
FISH auf isolierten Eierstockzellen vor der Transplantation
Kryokonserviertes Ovarialrindengewebe von Frauen mit 45,X/46,XX (Patientin A) oder 45,X/46,XX/47,XXX (Patientin B) TS wurde verwendet, um die Ergebnisse mit diesem Protokoll zu veranschaulichen. Bei Patient A wiesen 50% der Lymphozyten einen 45,X-Karyotyp und 50% einen 46,XX-Karyotyp auf. Bei Patient B waren 38% der Lymphozyten 45,X, 28% 46,XX und 34% 47,XXX. Zentromerspezifische Sonden für Chromosom X (grün) und Chromosom 18 als Kontrolle (rot) wurden verwendet, um den X-Chromosomengehalt einzelner Granulosazellen, Stromazellen und Eizellen zu bestimmen, die aus dem Gewebe der Ovarialrinde von TS-Patientinnen ohne vorherige Xenotransplantation isoliert wurden (Abbildung 1).
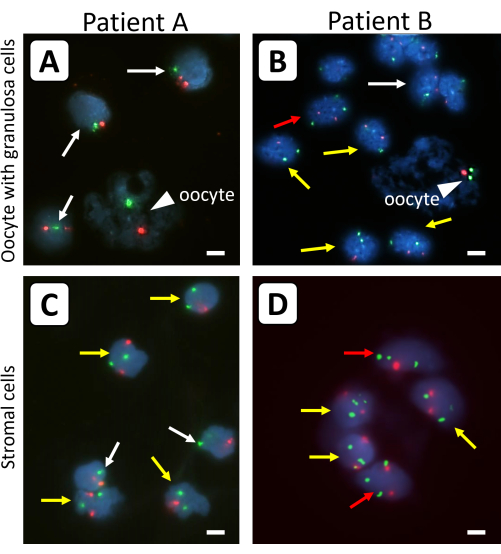
Abbildung 1: FISH-Analyse von isolierten Ovarialzellen aus dem Gewebe der Ovarialrinde vor der Transplantation. Eizellen (Pfeilspitzen) und Granulosazellen aus einzelnen primordialen Follikeln (A,B) und (C,D) der umgebenden Stromazellen wurden mit fluoreszenzspezifischen Sonden auf Chromosom X (grüne Signale) und Kontrollchromosom 18 (rote Signale) untersucht. Weiße Pfeile stehen für 45,X Zelllinien, gelbe Pfeile für 46,XX Zelllinien und rote Pfeile für 47,XX Zelllinien. Nicht alle Fluoreszenzsignale befinden sich in der gleichen Fokusebene. Die Balken repräsentieren 10 μm. Die Vergrößerung der FISH-Signale wurde auf 630x eingestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Unterschiede zwischen einzelnen Primordialfollikeln, die vor FISH mit und ohne Trypsin behandelt wurden, sind in Abbildung 2 dargestellt. Durch die Verwendung von Trypsin vor der FISH-Analyse waren die Zellmasse der Granulosa und die Eizellen weniger verklumpt, was die Analyse des X-Chromosomengehalts einzelner Granulosazellen und Eizellen ermöglichte. Die DNA von Eizellen kann aufgrund der unregelmäßigen Form, Größe und des diffusen Aussehens der DNA aus den Eizellen leicht von der der umgebenden Granulosazellen unterschieden werden. Darüber hinaus wird in den Eizellen kleiner Follikel nur ein starkes FISH-Signal für jedes Chromosom beobachtet, was auf die Nähe der vier Schwesterchromatiden in diesen Zellen zurückzuführen ist. Der X-Chromosomengehalt von Eizellen kann bestimmt werden, indem das Oberflächenverhältnis des FISH-Signals für Chromosom X zu dem von Chromosom 18 verwendet wird.

Abbildung 2: Kleine Follikel, die vor der Behandlung mit und ohne Trypsin behandelt wurden. (A) Die enzymatische Verdauung des Gewebes der Ovarialrinde führte zu einer Suspension weitgehend dissoziierter Zellen, wobei die primordialen Follikel übrig blieben, die aus einer intakten Eizelle bestanden, die von einer einzigen Schicht von Granulosazellen umgeben war (Pfeilspitzen in Tafel A). (B) Kleine Follikel wurden von Hand aus der Zellsuspension ausgewählt, stellten jedoch aufgrund der Verklumpung der Granulosazellen Schwierigkeiten bei der Interpretation von Signalen nach FISH dar (C). (D,E) Eine zusätzliche Verdauung der isolierten Follikel mit Trypsin vor der FISH führte dazu, dass sich einzelne Granulosazellen auf der Oberfläche der Follikel zu einer kugelförmigen Morphologie zusammenzogen und mit größerer Wahrscheinlichkeit vom Follikel dissoziierten, um für die FISH-Analyse zugänglich zu werden. Von Eizellen abgeleitete FISH-Signale sind durch Pfeile gekennzeichnet. Schwarze Balken stehen für 100 μm und weiße Balken für 10 μm. Die Vergrößerung der FISH-Signale wurde auf 630x eingestellt. Panel D wurde mit Genehmigung von Peek et al. reproduziert.16. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
FISH-Analyse von Granulosazellen auf Paraffinschnitten von transplantiertem Gewebe der Ovarialrinde
Es wurde festgestellt, dass sekundäre und antrale Follikel weniger anfällig für enzymatische Verdauung sind, was die zuvor beschriebene Methode der Gewebedissoziation, um einzelne Ovarialzellen zu erhalten, nicht für die Züchtung von Follikeln geeignet macht, die sich nach langfristiger Xenotransplantation im Ovarialgewebe befinden. Daher wurde das FISH-Protokoll unter Verwendung histologischer Schnitte von 4 μm optimiert, um den X-chromosomalen Gehalt von Granulosazellen von sekundären und antralen Follikeln im Gewebe der Ovarialrinde nach der Transplantation zu bestimmen (Abbildung 3). In diesem Fall ist es aufgrund des großen Durchmessers der Eizellen in den wachsenden Follikeln unwahrscheinlich, dass das FISH-Signal des X-Chromosoms oder des Kontrollchromosoms in den Eizellen in einem einzigen 4 μm-Abschnitt erfasst wird.
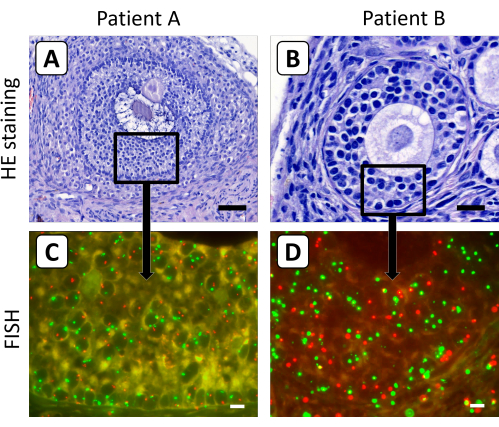
Abbildung 3: Histologische und FISH-Färbung von Gewebeschnitten der Ovarialrinde nach Xenotransplantation. (A,B) Die Hämatoxylin/Eosin-Färbung zeigte morphologisch normale sekundäre und antrale Follikel im Gewebe der Ovarialrinde nach 5-monatiger Xenotransplantation. (C,D) Der X-chromosomale Gehalt der Granulosazellen dieser Follikel wurde mittels FISH-Analyse bestimmt. In dieser Abbildung ist Chromosom X rot und Chromosom 18 grün dargestellt. Der Balken in Panel A steht für 50 μm, der Stab in Panel B für 20 μm und die Balken in den Panels C und D für 10 μm. Die Vergrößerung der FISH-Signale wurde auf 630x eingestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
In einem ersten Schritt wurden Experimente mit verschiedenen Fixierungstechniken der Gewebe durchgeführt, um festzustellen, welche Methode zu den besten FISH-Signalen führt. Die FISH-Analyse wurde an transplantiertem Gewebe durchgeführt, das sowohl in Bouin-Lösung fixiert und anschließend in 4%iges Formaldehyd getaucht wurde, als auch an transplantiertem Gewebe, das nur in 4%igem Formaldehyd fixiert war. Transplantiertes Gewebe, das zuerst in Bouin's fixiert wurde, zeigte einen grünen Schleier auf dem Bild, was es schwierig machte, die Anzahl der FISH-Signale genau zu zählen (Abbildung 4).

Abbildung 4: Gepfropftes Gewebe der Ovarialrinde, das nur in Bouin-Lösung und Formaldehyd fixiert ist. (A) Die Fixierung von transplantiertem Ovarialrindengewebe in Bouin-Lösung führte zu verschwommenen und weitgehend verdeckten Fluoreszenzsignalen in Follikelzellen aufgrund eines grünen Dunstes. (B) Das in Formaldehyd fixierte Gewebe der Eierstockrinde lieferte nur hervorragende Fluoreszenzsignale, die leicht zu interpretieren waren. Die Balken repräsentieren 10 μm. Die Vergrößerung der FISH-Signale wurde auf 630x eingestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Um den X-Chromosomen-Gehalt von Granulosazellen von Follikeln in histologischen Schnitten zu bestimmen, ist es nicht möglich, einfach die FISH-Signale von Granulosazellen zu zählen. Ein Teil der Chromosomen einer einzelnen Granulosazelle kann in einem bestimmten histologischen Schnitt durch die Durchtrennung des Gewebes verloren gehen. Daher ist es notwendig, zunächst den Prozentsatz der FISH-Signale zu bestimmen, die durch die Schnittierung verloren gehen, bevor schließlich der Verlust des X-chromosomalen Inhalts der Granulosazellpopulation aufgrund von Aneuploidie in neu gebildeten sekundären und antralen Follikeln nach der Transplantation des Gewebes bestimmt wird.
Der prozentuale Anteil der verlorenen FISH-Signale aufgrund von Schnitten kann berechnet werden, indem die Anzahl der FISH-Signale pro Granulosazelle des nicht-aneuploiden Kontrollchromosoms 18 bestimmt wird. Es wird erwartet, dass der gleiche Prozentsatz des X-Chromosoms durch die Teilung verloren geht. Jede zusätzliche Verringerung der Anzahl der X-Chromosomen-FISH-Signale in der Granulosazellpopulation ist auf Aneuploidie zurückzuführen. Die Verwendung von FISH-Signalen eines Kontrollchromosoms zur Bestimmung des X-Chromosomenverlusts aufgrund von Aneuploidie erfordert jedoch, dass die Detektionsempfindlichkeit der FISH-Signale des X-Chromosoms und des Kontrollchromosoms sehr ähnlich ist. Die Nachweissensitivität beider FISH-Sonden in Granulosazellen wachsender Follikel in histologischen Schnitten von nicht-aneuploiden 46,XX-Individuen wurde daher bestimmt. Wenn das Verhältnis von Chromosom X/Kontrollchromosom FISH-Signalen nahe 1 liegt, kann davon ausgegangen werden, dass die Nachweisempfindlichkeit beider Sonden tatsächlich sehr ähnlich ist und dass die FISH-Sonden somit verwendet werden können, um den Grad der Aneuploidie in der Granulosazellpopulation wachsender Follikel in histologischen Schnitten des Eierstockgewebes nach Xenotransplantation zu bestimmen.
Beispiel
Bei der Analyse der Anzahl der Chromosom-18-Signale in 130 Granulosazellen eines Follikels aus einem Eierstock eines 46,XX-Individuums wird erwartet, dass 260 Signale vorhanden sind. In einem 4 μm großen Schnitt dieser Zellen wurden jedoch nur 204 Chromosom 18 Signale beobachtet. Dies bedeutet, dass 21,5 % der Signale durch Schnitte verloren gehen ((260-204)/260 x 100 = 21,5 %). Die Anzahl der Chromosom-18-Signale pro Granulosazelle reduziert sich daher durch Schnitte auf 204/130 = 1,57.
Als nächstes wird die Anzahl der X-Chromosomen in Granulosazellen eines Antralfollikels nach der Transplantation in Eierstockgewebe einer Frau mit TS analysiert. Insgesamt wurden 191 Signale für Chromosom X und 199 Signale für Chromosom 18 gezählt. Die Anzahl der Granulosazellen kann bestimmt werden, indem die Gesamtzahl der Signale für Chromosom 18 durch die Anzahl der Chromosom 18-Signale pro Granulosazelle dividiert wird (199/1,57 = 127 Granulosazellen). Schließlich kann der Prozentsatz der 45,X-Granulosazellen bestimmt werden, indem die Differenz der Chromosom-18- und Chromosom-X-Signale durch die Anzahl der Granulosazellen dividiert wird (d. h. [199-191]/127 x 100 = 6% der Granulosazellen sind 45,X, und 94% dieser Zellen sind 46, XX).
Bemerkenswert ist, dass bei Patienten mit einer 47,XXX-Zelllinie nur der minimale Prozentsatz von Granulosazellen mit einem 47,XXX-Karyotyp bestimmt werden kann, da eine Mischung aus 45,X- und 47,XXX-Granulosazellen die gleiche Anzahl von X-Chromosomensignalen aufweist wie 46,XX-Granulosazellen.
Diskussion
Die FISH-Analyse ist eine bekannte Technik zum Nachweis von X-Chromosomenaberrationen in Lymphozyten oder Wangenzellen sowohl von Männern als auch von Frauen10. Mehrere Studien haben FISH an Gameten von Männern mit X-Chromosomenaberrationen beschrieben, aber es fehlen noch detaillierte Informationen, die FISH an Eierstockzellen von Frauen mit X-Chromosomenaberrationen gewonnen hat14. In diesem Artikel werden neue Methoden vorgestellt, die auf FISH basieren, um festzustellen, ob Aneuploidie in den Eierstockzellen von nicht transplantiertem und transplantiertem Ovarialrindengewebe von Frauen mit X-Chromosomenaberrationen vorhanden ist.
Die größte Herausforderung des Protokolls zur Isolierung einzelner Ovarialzellen in nicht transplantiertem Ovarialrindengewebe liegt in der enzymatischen Verdauung des Gewebes, die vorher etwas Übung erfordert. Um genaue FISH-Signale von ausreichend Eierstockzellen zu erhalten, ist es wichtig, die Schritte bezüglich enzymatischer Verdauung, Inkubationszeiten und angezeigter Temperaturen genau zu befolgen. Eine Abweichung vom Protokoll kann während des Prozesses zu einem erheblichen Verlust von Eierstockzellen führen, was insbesondere bei Patientinnen, die bereits über eine geringe ovarielle Reserve verfügen, vermieden werden sollte. Ein weiterer wichtiger Schritt bei dieser Methode ist die Behandlung der gereinigten Primordialfollikel mit Trypsin, um zu verhindern, dass Eizellen und die Zellmasse der Granulosa verklumpen, was die Analyse einzelner Zellen ausschließt. Ohne Behandlung mit Trypsin ist die Anzahl der einzelnen Granulosazellen, die mit FISH zuverlässig analysiert werden können, stark reduziert.
Die FISH-Analyse von Gewebe der Ovarialrinde, das nach einer Langzeittransplantation gewonnen wurde, erfordert eine andere Technik, da nur kleine Follikel ausreichend empfänglich für die enzymatische Verdauung sind, die für die Gewinnung einzelner Eierstockzellen erforderlich ist. Darüber hinaus gehen ähnlich wie bei der Autotransplantation von Gewebe der Eierstockrinde viele Follikel nach der Transplantation aufgrund von Hypoxie und Nährstoffmangel verloren, bevor das Transplantat vom Wirt ausreichend revaskularisiert wird20. Es ist daher zu erwarten, dass die Anzahl der Follikel nach der Transplantation deutlich geringer ist als vor der Transplantation. Für diese FISH-Technik, die für histologische Schnitte verwendet wird, ist es wichtig, das transplantierte Gewebe nur in 4%igem Formaldehyd zu fixieren, um optimale FISH-Signale zu erhalten. Die Fixierung von Gewebe der Eierstockrinde im Bouin-Fixiermittel wird routinemäßig im Labor eingesetzt, und während dies in Kombination mit der Standard-HE-Färbung hervorragende Ergebnisse liefert, führt die Fixierung von Gewebe mit Bouin-Gewebe vor der FISH zu schwachen und verschwommenen Fluoreszenzsignalen, die schwer zu interpretieren sind.
Obwohl sich dieses Protokoll bei der Bestimmung des X-Chromosomengehalts von Eierstockzellen als erfolgreich erwiesen hat, weist es immer noch einige Einschränkungen auf. Eine Einschränkung besteht darin, dass mit diesen Methoden nur die Eierstockzellen von Frauen mit numerischen Aberrationen analysiert werden können. Numerische Aberrationen können durch die Verwendung von Sonden, die auf sich wiederholende Sequenzen21 gerichtet sind, detektiert werden. Diese Sonden hybridisieren mehrere sich wiederholende Basenpaarsequenzen in der Zentromerregion, was zu starken Hybridisierungssignalen führt. Im Gegensatz dazu können strukturelle Aberrationen nur durch den Einsatz von Sonden gegen eindeutige Einzelsequenzen detektiert werden. Diese Sonden hybridisieren zu Sequenzen, die nur einmal im haploiden Genom vorkommen, was zu einem deutlich weniger intensiven FISH-Signal im Vergleich zu numerischen Aberrationen führt. Aufgrund dieser relativ schwachen FISH-Signale ist es schwierig, den X-chromosomalen Gehalt von Eierstockzellen bei Frauen mit strukturellen Aberrationen richtig zu bestimmen.
Zweitens sind FISH-Signale von Eizellen kleiner Follikel in nicht-transplantiertem Gewebe aufgrund der engen Nähe der vier Schwesterchromatiden in der Prophase der Meiose I schwer zu analysieren22. Es wird nur ein starkes Hybridisierungssignal in den Eizellen vorhanden sein, und daher ist es nicht möglich, einfach die Anzahl der Signale in den Eizellen zu zählen, um den X-Chromosomengehalt zu bestimmen. Stattdessen sollte das Oberflächenverhältnis von Chromosom X und 18 FISH-Signalen verwendet werden, um den X-Chromosomengehalt in diesen Zellen zu bestimmen. Dies kann nur dann sicher bestimmt werden, wenn die FISH-Signale in den Eizellen eindeutig vorhanden sind.
Darüber hinaus kann FISH auf transplantiertem Gewebe nur zur Bestimmung des X-Chromosomengehalts von Granulosazellen aus sekundären und antralen Follikeln verwendet werden, da kleine Follikel in histologischen Schnitten von transplantiertem Gewebe nur wenige Granulosazellen aufweisen, die richtig analysiert werden können. Hinzu kommt, dass der X-Chromosomen-Gehalt der Eizellen aufgrund des großen Durchmessers der Eizellen mit dieser Methode nicht genau bestimmt werden kann.
Schließlich ist es nach wie vor schwierig, weibliche Gameten im Vergleich zu männlichen Gameten zu gewinnen, da ein invasiver chirurgischer Eingriff erforderlich ist, um Eierstockzellen oder Gewebe der Eierstockrinde zu gewinnen. Daher werden diese Methoden am ehesten in einem Forschungsumfeld angewendet.
Zusammenfassend lässt sich sagen, dass die FISH-Analyse von Eierstockzellen von nicht transplantiertem und transplantiertem Ovarialrindengewebe von Frauen mit X-Chromosomenaberrationen eine einzigartige und nützliche Technik ist, um einen Einblick in den X-chromosomalen Gehalt von Eierstockzellen in dieser speziellen Gruppe zu erhalten. Diese Techniken zeigen, dass die Kryokonservierung von Gewebe der Ovarialrinde von Frauen mit X-Chromosomenaberrationen möglich ist und dass kryokonservierte Primordialfollikel in der Lage sind, zu sekundären und antralen Follikeln zu wachsen. Es sollte jedoch beachtet werden, dass beide Methoden dazu gedacht sind, die zukünftige Forschung an Frauen mit X-Chromosomenaberrationen zu erleichtern, und nicht als diagnostisches Instrument zum Screening der Fortpflanzungsergebnisse von Frauen mit X-Chromosomenaberrationen in der klinischen Praxis gedacht sind.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Marjo van Brakel, Dominique Smeets, Guillaume van de Zande, Patricia van Cleef und Milan Intezar für ihr Fachwissen und ihre technische Unterstützung. Finanzierungsquellen: Merck Serono (A16-1395), Goodlife und Ferring.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
Referenzen
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten