Method Article
Exploración de las aberraciones cromosómicas X en células ováricas mediante el uso de hibridación fluorescente in situ
En este artículo
Resumen
Este artículo presenta dos métodos basados en la hibridación fluorescente in situ para determinar el contenido cromosómico X de las células ováricas en tejido de la corteza ovárica no injertado e injertado de mujeres con aberraciones cromosómicas X.
Resumen
Millones de personas en todo el mundo se ocupan de cuestiones relacionadas con la fertilidad. La reducción de la fertilidad, o incluso la infertilidad, puede deberse a muchas causas diferentes, incluidos los trastornos genéticos, de los cuales las anomalías cromosómicas son las más comunes. La hibridación fluorescente in situ (FISH) es un método bien conocido y utilizado con frecuencia para detectar aberraciones cromosómicas en humanos. FISH se utiliza principalmente para el análisis de anomalías cromosómicas en los espermatozoides de varones con aberraciones cromosómicas numéricas o estructurales. Además, esta técnica también se aplica con frecuencia en mujeres para detectar aberraciones cromosómicas X que se sabe que causan disgenesia ovárica. Sin embargo, todavía falta información sobre el contenido cromosómico X de las células ováricas de mujeres con aberraciones cromosómicas X en linfocitos y/o células bucales.
El objetivo de este estudio es avanzar en la investigación básica sobre las aberraciones cromosómicas X en mujeres, mediante la presentación de dos métodos basados en FISH para identificar el contenido cromosómico X de las células ováricas. Primero, se describe un método para determinar el contenido cromosómico X de células ováricas aisladas (ovocitos, células de la granulosa y células del estroma) en tejido de corteza ovárica no injertado de mujeres con aberraciones cromosómicas X. El segundo método está dirigido a evaluar el efecto de las aberraciones cromosómicas en la foliculogénesis mediante la determinación del contenido cromosómico X de las células ováricas de los folículos secundarios y antrales recién formados en el tejido ovárico, de hembras con aberraciones cromosómicas X después de un injerto a largo plazo en ratones inmunocomprometidos. Ambos métodos podrían ser útiles en futuras investigaciones para obtener información sobre el potencial reproductivo de las mujeres con aberraciones cromosómicas X.
Introducción
La infertilidad es un problema de salud del sistema reproductor masculino o femenino, que afecta a aproximadamente 186 millones de personas en edad reproductiva en todo el mundo1. En al menos el 35% de las parejas infértiles, la infertilidad es causada por un trastorno del sistema reproductor femenino2. Hay muchos factores que pueden causar infertilidad femenina, como factores genéticos, anomalías del tracto genital, disfunción endocrina, enfermedades inflamatorias y tratamiento iatrogénico3.
Las anomalías genéticas están presentes en aproximadamente 10% de las hembras infértiles 4,5. De todas las anomalías genéticas, las aberraciones del cromosoma X son la causa más común de disgenesia ovárica2. Varios estudios han reportado que las aberraciones cromosómicas X en mujeres con síndrome de Turner (ST) o síndrome Triple X están asociadas con insuficiencia ovárica prematura debido a una pérdida acelerada de células germinales o alteración de la ovogénesis 6,7,8.
Las aberraciones del cromosoma X se pueden dividir en: 1) aberraciones numéricas, en las que el número de cromosomas X es diferente pero los cromosomas X están intactos; y 2) aberraciones estructurales, en las que el cromosoma X ha ganado o perdido material genético 3,9. Las aberraciones numéricas del cromosoma X son más comunes que las anomalías estructurales y a menudo son causadas por errores espontáneos durante la división celular 3,9. Cuando tal error ocurre durante la meiosis, puede conducir a gametos aneuploides y, en última instancia, a descendencia con aberraciones cromosómicas en todas las células. Cuando surgen defectos cromosómicos en las células somáticas como resultado de errores que ocurren durante la mitosis en las primeras etapas de la ontogénesis, puede conducir al mosaicismo. En estos individuos, tanto las células con contenido cromosómico X normal como las células con aberraciones cromosómicas X están presentes.
En la década de 1980, se desarrolló una técnica citogenética llamada hibridación fluorescente in situ (FISH) para visualizar y localizar secuencias específicas de ácidos nucleicos en los cromosomas de metafase e interfase10,11. Esta técnica utiliza sondas de ADN marcadas con fluorescencia para unirse a una secuencia específica en el cromosoma, que luego se puede visualizar mediante el uso de un microscopio de fluorescencia.
Hoy en día, el FISH es ampliamente utilizado como herramienta de diagnóstico clínico y es considerado el estándar de oro en la detección de aberraciones cromosómicas10. En el campo de la medicina reproductiva, el análisis FISH en espermatozoides se ha utilizado para obtener información sobre el contenido cromosómico X de los espermatozoides en varones con aberraciones cromosómicas numéricas o estructurales en células somáticas12,13,14. Estos estudios mostraron que los varones con aberraciones cromosómicas tenían más probabilidades de tener una mayor frecuencia de espermatozoides aneuploides presentes en su semen en comparación con los hombres con cariotipos normales12,13,14.
A diferencia de los espermatozoides, se sabe muy poco sobre el contenido cromosómico X de las células ováricas (incluidos los ovocitos, las células granulosa/teca y las células del estroma) en individuos con una aberración cromosómica, así como las posibles consecuencias de la aneuploidía de estas células en su potencial reproductivo. Una razón importante para la escasa información sobre el cariotipo de las células ováricas en comparación con los espermatozoides es el hecho de que las mujeres tienen que someterse a un procedimiento invasivo como una punción del folículo o una cirugía para obtener ovocitos o tejido de la corteza ovárica. Los gametos femeninos son, por lo tanto, difíciles de obtener con fines de investigación.
Actualmente, se está realizando un estudio de intervención observacional en los Países Bajos para explorar la eficacia de la criopreservación del tejido ovárico en mujeres jóvenes con ST15. Un fragmento del tejido de la corteza ovárica de la paciente estaba disponible para identificar el contenido cromosómico X de las células ováricas16,17. Como parte del estudio, se desarrolló un nuevo método basado en FISH de tejido de corteza ovárica disociado para determinar si las aberraciones cromosómicas están presentes en las células ováricas en mujeres portadoras de una aberración cromosómica en células somáticas no ováricas, como linfocitos o células bucales. Además, también se determinó el efecto de la aneuploidía en las células ováricas sobre la foliculogénesis. Con este fin, se modificó un protocolo FISH establecido que permite el análisis de secciones histológicas de tejido de la corteza ovárica después de la foliculogénesis inducida artificialmente durante el xenotrasplante a largo plazo en ratones inmunocomprometidos. En este estudio, presentamos dos métodos basados en FISH para determinar el contenido cromosómico X en células ováricas en tejido de corteza ovárica no injertado e injertado en mujeres con aberraciones cromosómicas X, con el objetivo de mejorar la ciencia básica sobre este tema.
Protocolo
El protocolo del estudio TurnerFertility ha sido aprobado por el Comité Central de Investigación con Seres Humanos (NL57738.000.16). En este estudio, se obtuvo el tejido de la corteza ovárica de 93 mujeres con ST. Los materiales que requieren precauciones de seguridad se enumeran en la Tabla 1.
Tabla 1: Precauciones de seguridad.
| Material | Peligro | ||
| Ácido acético | Quemaduras graves en la piel e irritación del sistema respiratorio | ||
| Colagenasa | Irritante para los ojos, el sistema respiratorio y la piel | ||
| DAPI | Irritante para los ojos, el sistema respiratorio y la piel | ||
| DNasa I | Irritante para los ojos, el sistema respiratorio y la piel | ||
| Etanol | Altamente inflamable | ||
| Formaldehído | Tóxico después de la inhalación, ingestión y contacto con la piel | ||
| Formamida (en sondas de fluorescencia) | Puede dañar al feto | ||
| Liberase | Irritante para los ojos, el sistema respiratorio y la piel | ||
| Metanol | Altamente inflamable, tóxico por inhalación, ingestión y contacto con la piel | ||
| Nonidet P40 | Irritante para la piel o los ojos | ||
| Pepsina | Irritante para los ojos, el sistema respiratorio y la piel | ||
| Proteinasa K | Dificultades respiratorias después de la inhalación | ||
| Xileno | Altamente inflamable, tóxico después de la inhalación y el contacto con la piel. Evite el contacto con los ojos. | ||
Tabla 1: Materiales que requieren precauciones de seguridad.
1. FISH en células aisladas individuales de la corteza ovárica
- Disociación del tejido de la corteza ovárica para obtener células individuales
- Cortar el tejido de la corteza ovárica criopreservado/descongelado en trozos pequeños de aproximadamente 1 mm x 1 mm x 1 mm con un bisturí.
- Digerir enzimáticamente los fragmentos de tejido en 4 ml de medio L15 precalentado (37 °C) que contiene 0,1 mg/ml de mezcla enzimática de disociación tisular, 10 μg/ml de DNasa I y 1 mg/ml de colagenasa I de C. histolyticum durante un máximo de 75 min a 37 °C. Pipet la digestión se mezcla arriba y abajo cada 15 min.
- Detenga la digestión enzimática agregando 4 ml de L15 frío suplementado con 10% de suero bovino fetal (FBS). Lavar el tejido disociado una vez con 8 mL de medio L15 frío por centrifugación a 500 x g y resuspender en 500 μL de medio L15 sin vórtice para evitar daños en las células.
- Transfiera la suspensión celular que contiene células estromales en gran parte individuales y folículos pequeños (ovocitos rodeados por una sola capa de células de granulosa) a una placa de Petri de plástico y examine la suspensión celular bajo un microscopio estereoscópico (aumento de 100x).
- Recoger los folículos pequeños (<50 μm) manualmente utilizando una pipeta de plástico de 75 μm y transferir los folículos a una gota de medio L15 suplementada con FBS al 10% a 4 °C para evitar la agregación de folículos. Realice la recogida del folículo durante un máximo de 30 min. Para mejorar la diseminación de las células foliculares antes del análisis de FISH, transfiera los folículos purificados a una solución de tripsina al 0,06%, 1 mg/ml de ácido etilendiaminotetraacético (EDTA) y 1 mg/ml de glucosa e incubar durante 20 min a 37 °C.
- Obtener células del estroma ovárico de la suspensión de células cortex utilizando una pipeta de plástico de 75 μm, teniendo especial cuidado para evitar la contaminación con folículos pequeños.
- Análisis FISH de células ováricas individuales
- Transfiera los folículos ováricos tratados (recomendado n = 5-20) con tripsina/EDTA/glucosa o células estromales (n > 1.000) a gotitas de 5 μL de 0,15 mM KCl/15 μL de solución salina tamponada con fosfato (DPBS) de Dulbecco en un portaobjetos e incubar durante 20 min a 37 °C.
- Secar y prefijar los portaobjetos en 300 μL de 0,05 mM de KCl/7,5% de ácido acético/22,5% de metanol durante 2 min a temperatura ambiente (RT). Cubra los portaobjetos con metanol/ácido acético (3:1) durante 2 minutos en RT para finalizar la fijación.
- Hacer 20 veces citrato de sodio estándar (SSC) añadiendo 876 g de cloruro de sodio y 441 g de citrato trisódico dihidratado en 5 L de agua destilada. Luego, agregue 100 ml de 20x SSC a 900 mL de agua desmineralizada (demi) para obtener 2x SSC. Lavar la muestra en 2x SSC a 73 °C, cubrirla con 100 μL de proteinasa K al 2% y sellarla con un cubreobjetos. Incubar los portaobjetos durante 10 min a 37 °C en la estación de hibridación.
- Retire el cubreobjetos y lave los portaobjetos durante 5 minutos en DPBS a RT. Fije la muestra durante 5 minutos con formaldehído al 1% en RT. En esta etapa, el material aún no está completamente unido a los portaobjetos de vidrio y, por lo tanto, no debe colocarse en una plataforma de agitación.
- Lave los portaobjetos durante 5 minutos en DPBS a RT, seguido de deshidratación en 70%, 80%, 90% y 100% de etanol durante 2 minutos cada uno. Seque al aire la muestra deshidratada e hibridarla con sondas marcadas con fluorescencia.
- Seleccione una sonda específica del centrómero para el cromosoma X y otra sonda centromérica específica del cromosoma como control para determinar el contenido cromosómico X de las células ováricas. En este caso, se utilizan sondas específicas del centrómero para el cromosoma X (CEP X [DXZ1]) marcado directamente con fluorocromo SpectrumGreen y el cromosoma 18 (CEP 18 [D18Z1]) marcado directamente con fluorocromo SpectrumOrange.
- Agregue 1 μL de CEP X, 1 μL de CEP 18 y 18 μL del tampón de hibridación a la muestra y selle con un cubreobjetos pegado a los portaobjetos para evitar la evaporación de la sonda durante la hibridación. Transfiera los portaobjetos a la estación de hibridación para su desnaturalización a 73 °C durante 3 min, seguida de hibridación durante una incubación nocturna a 37 °C.
- Retire el cubreobjetos y cualquier pegamento restante del portaobjetos después de la hibridación. Lavar los portaobjetos en 0,4x SSC/0,3% Tween-20 a 72 °C durante 2 min, seguido de la incubación durante 1 min en 2x SSC/0,1% Tween-20 en RT.
- Deshidratar los portaobjetos mediante incubaciones posteriores de 2 minutos en etanol al 70%, 80%, 90% y 100% y secar al aire en la oscuridad. Cubra los portaobjetos con un medio de montaje que contenga 4′,6-diamidino-2-fenilindol (DAPI). Conservar a -20 °C durante al menos 10 min antes del análisis por microscopía de fluorescencia.
- Imagenológico
- Examine la(s) señal(es) del cromosoma X con un microscopio de fluorescencia conectado a un software de procesamiento de imágenes.
- Primero, seleccione fluorocromo DAPI.
- Adquiera una imagen seleccionando Nueva celda > Captura de > en vivo con un aumento de 630x. Aparecerá una nueva ventana con el umbral. Establezca la barra azul del umbral en 0 para minimizar el fondo y la barra roja en el máximo (255) para que las señales sean más brillantes. Haga clic en Aceptar.
- Aparecerá una nueva ventana con mejoras con una sugerencia para más oscuro/más brillante (12), radio (3) y profundidad (1). Utilice los valores sugeridos o ajústelos si no está satisfecho.
- En segundo lugar, seleccione fluorochrome SpectrumOrange y haga clic en Capturar.
- Establezca la barra azul del umbral en 0 para minimizar el fondo y la barra roja en el máximo (255) para que las señales sean más brillantes. Haga clic en Aceptar.
- La ventana con mejora aparecerá con una sugerencia para más oscuro/más brillante (-11), radio (2.7) y profundidad (0.6). Utilice los valores sugeridos o ajústelos si no está satisfecho.
- Finalmente, seleccione fluorochrome SpectrumGreen y haga clic en Capturar.
- Establezca la barra azul del umbral en 0 para minimizar el fondo y la barra roja en el máximo (255) para que las señales sean más brillantes. Haga clic en Aceptar.
- La ventana con mejora aparecerá con una sugerencia para más oscuro/más brillante (0), radio (3) y profundidad (0). Utilice los valores sugeridos o ajústelos si no está satisfecho. Guarde la imagen en un archivo recién creado.
NOTA: Las células somáticas solo se evaluaron cuando dos señales del cromosoma control 18 eran visibles. En la mayoría de los ovocitos, solo se pudo detectar una señal para cada cromosoma.
- Primero, seleccione fluorocromo DAPI.
- Conservar los portaobjetos en la oscuridad a 4 °C después del análisis para evitar la pérdida de señales.
- Examine la(s) señal(es) del cromosoma X con un microscopio de fluorescencia conectado a un software de procesamiento de imágenes.
2. FISH en secciones de parafina de tejido injertado de la corteza ovárica
NOTA: Un fragmento de tejido de la corteza ovárica criopreservado/descongelado de 18 hembras con ST fue xenoinjertado en ratones inmunodeficientes combinados severos (SCID) durante 5 meses. El procedimiento de xenoinjerto ha sido descrito previamente y se llevó a cabo en la Université Catholique de Louvain (Bruselas, Bélgica) siguiendo las directrices locales del Comité de Investigación Animal con respecto al bienestar animal (referencia 2014/UCL/MD/007)18,19.
- Selección de secciones de tejido de la corteza ovárica xenoinjertado que contienen folículos
- Fijar el tejido de la corteza ovárica xenoinjertado en formaldehído al 4% e incrustar el tejido en parafina. Recorte los bloques con un bisturí para eliminar la parafina adicional y corte el bloque de parafina a 4 μm de espesor en un micrótomo de rotación.
- Seleccione cada séptima sección de la cinta de parafina para la tinción de hematoxilina y eosina (HE) para determinar qué secciones contienen folículos. Poner la sección en un baño maría a 40-45 °C y montarla en portaobjetos de microscopio inmunohistoquímico.
- Desparafinización y tinción HE
- Coloque los toboganes en una estufa durante 10 minutos a 60 ° C, y luego sumerja los toboganes en 100% de xileno durante 5 minutos. No es necesario colocar los toboganes directamente sobre la estufa. Hidratar las secciones durante 15 s en etanol al 100%, seguido de 2 x 15 s en etanol al 96%. Enjuague los toboganes con agua del grifo durante 2 minutos.
- Manche los portaobjetos con hematoxilina durante 10 minutos y luego enjuague brevemente los portaobjetos con agua del grifo. Sumerja brevemente los portaobjetos en una solución de bicarbonato (100 g de sulfato de magnesio y 10 g de bicarbonato de sodio en 5 L de agua destilada). Enjuague los toboganes con agua del grifo durante 5 minutos.
- Contramanche los portaobjetos con eosina durante 4 minutos y deshidrate los portaobjetos tres veces con etanol al 100%, seguido de xileno. Cubra las tinciones de HE en los portaobjetos y evalúe las secciones de HE bajo un microscopio óptico para seleccionar las secciones con folículos (aumento de 100x).
- Pretratamiento e hibridación de secciones de parafina para DNA FISH
- Seleccione nuevas secciones que se encuentren antes o después de la sección que contenía folículos de la cinta de parafina. Monte una sección en una diapositiva de vidrio. Secar las secciones de parafina durante al menos 45 minutos en una estufa a 56 °C. No es necesario colocar los toboganes directamente sobre la estufa.
- Desparafinar las secciones en xileno durante 10 min. Sumerja los portaobjetos en etanol al 99,5% y enjuáguelos durante 5 minutos en agua del grifo. Pretratar los portaobjetos con la solución de recuperación del objetivo (pH bajo) durante 10 min a 96 °C. Después de enfriar, enjuague los portaobjetos con agua destilada.
- Tratar los portaobjetos durante 5 min con ácido clorhídrico 0,01 M, seguido de digestión de pepsina (200 U/ml) durante 15 min a 37 °C. Enjuagar de nuevo los portaobjetos en ácido clorhídrico 0,01 M y posteriormente en PBS.
- Fijar los portaobjetos en formaldehído/PBS al 1% durante 5 min. Enjuague los portaobjetos brevemente en PBS, y luego nuevamente en agua demi. Deshidrate los portaobjetos en etanol al 99,5% y déjelos secar al aire.
- Seleccione una sonda específica del centrómero para el cromosoma X y otra sonda centromérica específica del cromosoma como control para determinar el contenido cromosómico X de las células de la granulosa. Aquí, el cromosoma 18 se utiliza como control.
- Aplique 5 μL de sonda CEP 18 (D18Z1) directamente marcada con fluorocromo SpectrumGreen y sonda CEP X (DXZ1) directamente marcada con fluorocromo SpectrumRed en los portaobjetos pretratados. Aplique un cubreobjetos y selle el área con pegamento fotográfico. Colocar los portaobjetos en un hibridador para su desnaturalización a 80 °C durante 10 min y hibridación durante la noche a 37 °C.
- Al día siguiente, enjuague los portaobjetos durante 5 minutos en 2x SSC a 42 °C, seguido de un enjuague de 2 minutos y 1 minuto en Nonidet P40 al 0,3% a 73 °C. Actualice el 2x SSC y enjuague las diapositivas nuevamente durante 5 minutos a temperatura ambiente. Cubra la cubeta para que las secciones se mantengan en la oscuridad.
- Enjuague brevemente los portaobjetos con agua destilada. Deshidrate los portaobjetos en etanol al 99,5% y déjelos secar al aire nuevamente. Finalmente, monte las guías con una solución que contenga DAPI y medio de montaje.
- Imagenológico
- Analice los resultados bajo un microscopio de fluorescencia con un aumento de 630x. Abra el software de procesamiento de imágenes en la computadora. Seleccione FISH como perfil.
- Compruebe si la emisión DAPI se establece en 431 nm y la excitación en 359 nm, la emisión roja de Texas en 613 nm y la excitación en 595 nm, y la emisión FITC en 519 nm y la excitación en 495 nm.
- Adquiera una imagen seleccionando Live > Capture Single Image (Capturar imagen única). Optimice la calidad de la imagen ajustando la exposición y la ganancia moviendo el control deslizante Exposición y el control deslizante Ganancia en el menú Imagen de la izquierda (por ejemplo, exposición: 212 ms y ganancia: 7,9). La exposición y ganancia requeridas pueden variar según la imagen; Observe los cambios durante este proceso para obtener una imagen optimizada. Guarde la imagen en un archivo recién creado.
- Conservar los portaobjetos en la oscuridad a 4 °C después del análisis para evitar la pérdida de señales.
Resultados
FISH en células ováricas aisladas antes del injerto
Se utilizó tejido criopreservado de la corteza ovárica de mujeres con TS 45,X/46,XX (paciente A) o 45,X/46,XX/47,XXX (paciente B) para ilustrar los resultados utilizando este protocolo. En el paciente A, el 50% de los linfocitos tenían un cariotipo 45,X y el 50% tenían 46,XX. En el paciente B, el 38% de los linfocitos fueron 45,X, el 28% 46,XX y el 34% 47,XXX. Se utilizaron sondas específicas del centrómero para el cromosoma X (verde) y el cromosoma 18 como control (rojo) para determinar el contenido cromosómico X de células individuales de la granulosa, células estromales y ovocitos aislados del tejido de la corteza ovárica de pacientes con ST sin xenotrasplante previo (Figura 1).
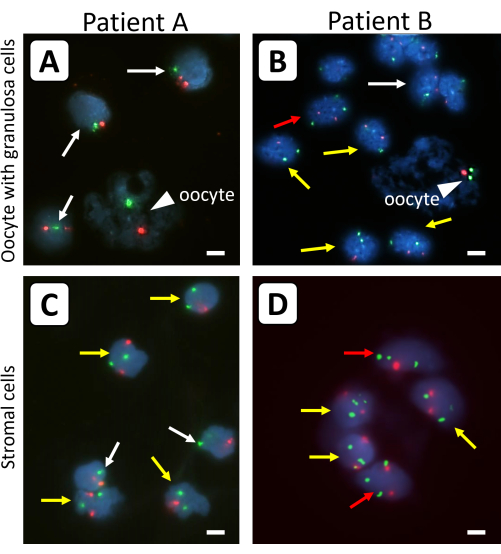
Figura 1: Análisis FISH de células ováricas aisladas del tejido de la corteza ovárica antes del injerto. Los ovocitos (puntas de flecha) y las células de la granulosa de los folículos primordiales únicos (A, B) y (C, D) de las células estromales circundantes se analizaron con sondas fluorescentes específicas para el cromosoma X (señales verdes) y el cromosoma control 18 (señales rojas). Las flechas blancas indican 45,X líneas celulares, las flechas amarillas indican 46,XX líneas celulares y las flechas rojas indican 47,XXX líneas celulares. No todas las señales fluorescentes están en el mismo plano de enfoque. Las barras representan 10 μm. El aumento de las señales FISH se estableció en 630x. Haga clic aquí para ver una versión más grande de esta figura.
Las diferencias entre los folículos primordiales individuales que fueron tratados con y sin tripsina antes de FISH se muestran en la Figura 2. Al usar tripsina antes del análisis FISH, la masa celular de la granulosa y los ovocitos estaban menos agrupados, lo que permitió el análisis del contenido cromosómico X de las células individuales de la granulosa y los ovocitos. El ADN de los ovocitos se puede distinguir fácilmente del de las células de la granulosa circundantes debido a la forma irregular, el tamaño y la apariencia difusa del ADN de los ovocitos. Además, solo se observa una señal FISH fuerte para cada cromosoma en los ovocitos de los folículos pequeños, debido a la proximidad de las cuatro cromátidas hermanas en estas células. El contenido cromosómico X de los ovocitos se puede determinar utilizando la relación superficial de la señal FISH para el cromosoma X a la del cromosoma 18.

Figura 2: Folículos pequeños tratados con y sin tripsina antes de FISH. (A) La digestión enzimática del tejido de la corteza ovárica dio lugar a una suspensión de células en gran parte disociadas pero dejando los folículos primordiales, que consisten en un ovocito intacto rodeado por una sola capa de células de la granulosa (puntas de flecha en el panel A). (B) Los folículos pequeños se seleccionaron a mano de la suspensión celular, pero proporcionaron dificultades para interpretar las señales después de FISH debido a la aglutinación de las células de la granulosa (C). (D,E) La digestión adicional de los folículos aislados con tripsina antes de FISH dio como resultado que las células individuales de la granulosa se contrajeran en una morfología esférica en la superficie de los folículos y tenían más probabilidades de disociarse del folículo para ser accesibles para el análisis de FISH. Las señales FISH derivadas de ovocitos se indican con flechas. Las barras negras representan 100 μm y las barras blancas representan 10 μm. El aumento de las señales FISH se estableció en 630x. El Panel D ha sido reproducido con permiso de Peek et al.16. Haga clic aquí para ver una versión más grande de esta figura.
Análisis FISH de células de la granulosa en secciones de parafina de tejido de corteza ovárica injertado
Se encontró que los folículos secundarios y antrales son menos susceptibles a la digestión enzimática, lo que hace que el método descrito anteriormente de disociación tisular para obtener células ováricas individuales no sea adecuado para los folículos en crecimiento que se encuentran en el tejido ovárico después de un xenoinjerto a largo plazo. Por lo tanto, el protocolo FISH se optimizó utilizando secciones histológicas de 4 μm para determinar el contenido cromosómico X de las células de la granulosa de los folículos secundarios y antrales en el tejido de la corteza ovárica después del injerto (Figura 3). En este contexto, es poco probable que la señal FISH del cromosoma X o del cromosoma control en los ovocitos se capture en una sola sección de 4 μm, debido al gran diámetro de los ovocitos en los folículos en crecimiento.
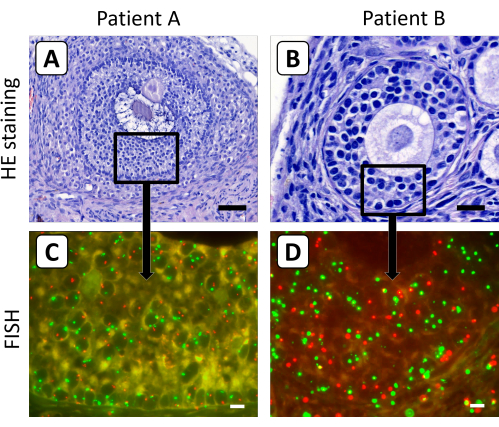
Figura 3: Tinción histológica y FISH de secciones de tejido de la corteza ovárica después del xenotrasplante. (A,B) La tinción de hematoxilina/eosina mostró folículos secundarios y antrales morfológicamente normales en el tejido de la corteza ovárica después de 5 meses de xenoinjerto. (C,D) El contenido cromosómico X de las células de la granulosa de estos folículos se determinó mediante análisis FISH. En esta figura, el cromosoma X se muestra en rojo y el cromosoma 18 en verde. La barra en el panel A representa 50 μm, la barra en el panel B representa 20 μm y las barras en los paneles C y D representan 10 μm. El aumento de las señales FISH se estableció en 630x. Haga clic aquí para ver una versión más grande de esta figura.
Como primer paso, se realizaron experimentos con diferentes técnicas de fijación de los tejidos para determinar qué método da como resultado las mejores señales de FISH. El análisis de FISH se realizó en tejido injertado que se fijó en la solución de Bouin y posteriormente se sumergió en formaldehído al 4%, y en tejido injertado que se fijó solo en formaldehído al 4%. El tejido injertado que se fijó por primera vez en Bouin mostró una neblina verde en la imagen, lo que dificulta contar con precisión el número de señales FISH (Figura 4).

Figura 4: Tejido de la corteza ovárica injertado fijado en solución de Bouin y formaldehído solamente. (A) La fijación de tejido de corteza ovárica injertada en la solución de Bouin dio como resultado señales fluorescentes borrosas y en gran parte oscurecidas en las células foliculares debido a una neblina verde. (B) El tejido de la corteza ovárica que estaba fijado en formaldehído solo proporcionaba excelentes señales fluorescentes que eran fáciles de interpretar. Las barras representan 10 μm. El aumento de las señales FISH se estableció en 630x. Haga clic aquí para ver una versión más grande de esta figura.
Para determinar el contenido cromosómico X de las células de la granulosa de los folículos en secciones histológicas, no es posible simplemente contar las señales FISH de las células de la granulosa. Parte de los cromosomas de una célula granulosa individual puede perderse en una determinada sección histológica, debido a la sección del tejido. Por lo tanto, es necesario determinar primero el porcentaje de señales FISH perdidas debido a la sección antes de determinar finalmente la pérdida del contenido cromosómico X de la población de células de la granulosa debido a la aneuploidía en los folículos secundarios y antrales recién formados después del injerto del tejido.
El porcentaje de señales FISH perdidas debido a la sección se puede calcular determinando el número de señales FISH por célula de la granulosa del cromosoma control no aneuploide 18. Se espera que el mismo porcentaje del cromosoma X se pierda debido a la sección. Cualquier reducción adicional en el número de señales FISH del cromosoma X en la población de células de la granulosa se debe a la aneuploidía. Sin embargo, el uso de señales FISH de un cromosoma control para determinar la pérdida del cromosoma X debido a aneuploidía requiere que la sensibilidad de detección de las señales FISH del cromosoma X y el cromosoma de control sea muy similar. Por lo tanto, se determinó la sensibilidad de detección de ambas sondas FISH en células de la granulosa de folículos en crecimiento en secciones histológicas de individuos no aneuploides 46,XX. Cuando la relación entre las señales FISH del cromosoma X y el cromosoma control es cercana a 1, se puede suponer que la sensibilidad de detección de ambas sondas es realmente muy similar, y que las sondas FISH pueden usarse para determinar el nivel de aneuploidía en la población de células de la granulosa de folículos en crecimiento en secciones histológicas de tejido ovárico después del xenotrasplante.
Ejemplo
Al analizar el número de señales del cromosoma 18 en 130 células de la granulosa de un folículo de un ovario de un individuo 46,XX, se espera que 260 señales estén presentes. Sin embargo, en una sección de 4 μm de estas células, solo se observaron 204 señales del cromosoma 18. Esto indica que el 21,5% de las señales se pierden debido a la sección ((260-204)/260 x 100 = 21,5%). Por lo tanto, el número de señales del cromosoma 18 por célula de la granulosa se reduce a 204/130 = 1,57 debido a la sección.
A continuación, se analiza el número de cromosomas X en las células de la granulosa de un folículo antral después del injerto en el tejido ovárico de una mujer con ST. En total, se contaron 191 señales para el cromosoma X y 199 señales para el cromosoma 18. El número de células de la granulosa se puede determinar dividiendo el número total de señales para el cromosoma 18 por el número de señales del cromosoma 18 por célula de la granulosa (199/1,57 = 127 células de la granulosa). Finalmente, el porcentaje de 45,X células de la granulosa se puede determinar dividiendo la diferencia en las señales del cromosoma 18 y del cromosoma X con el número de células de la granulosa (es decir, [199-191]/127 x 100 = 6% de las células de la granulosa son 45,X, y el 94% de estas células son 46, XX).
Cabe destacar que, en pacientes con una línea celular 47,XXX, sólo es posible determinar el porcentaje mínimo de células de la granulosa con un cariotipo 47,XXX, ya que una mezcla de células de la granulosa 45,X y 47,XXX tiene el mismo número de señales del cromosoma X que las células de la granulosa 46,XX.
Discusión
El análisis FISH es una técnica bien conocida para detectar aberraciones cromosómicas X en linfocitos o células bucales tanto de hombres como de mujeres10. Varios estudios han descrito FISH en gametos de varones con aberraciones cromosómicas X, pero todavía falta información detallada obtenida por FISH en células ováricas de mujeres con aberraciones cromosómicas X14. Este artículo presenta nuevos métodos basados en FISH para determinar si la aneuploidía está presente en las células ováricas del tejido de la corteza ovárica no injertado e injertado de mujeres con aberraciones cromosómicas X.
El principal desafío del protocolo para el aislamiento de células ováricas individuales en tejido de corteza ovárica no injertado radica en la digestión enzimática del tejido, que requiere cierta práctica previa. Para obtener señales FISH precisas de suficientes células ováricas, es importante seguir estrictamente los pasos relacionados con la digestión enzimática, los tiempos de incubación y las temperaturas indicadas. Desviarse del protocolo puede causar una pérdida sustancial de células ováricas durante el proceso, y esto debe evitarse especialmente en pacientes que ya tienen una reserva ovárica baja. Otro paso crítico en este método es tratar los folículos primordiales purificados con tripsina para evitar que los ovocitos y la masa de células de la granulosa se aglutinen, lo que impide el análisis de células individuales. Sin tratamiento con tripsina, el número de células individuales de la granulosa que pueden ser analizadas de manera confiable por FISH se reduce severamente.
El análisis FISH en el tejido de la corteza ovárica recuperado después del injerto a largo plazo requiere una técnica diferente, ya que solo se encontró que los folículos pequeños eran lo suficientemente susceptibles a la digestión enzimática que es necesaria para obtener células ováricas individuales. Además, similar al autotrasplante de tejido de la corteza ovárica, muchos folículos se pierden después del injerto debido a la hipoxia y la falta de nutrientes antes de que el injerto sea suficientemente revascularizado por el huésped20. Por lo tanto, se espera que el número de folículos después del injerto sea considerablemente menor que antes del injerto. Para esta técnica FISH utilizada para secciones histológicas, es importante fijar el tejido injertado en formaldehído al 4% solo para obtener señales óptimas de FISH. La fijación del tejido de la corteza ovárica en el fijador de Bouin se usa rutinariamente en el laboratorio, y aunque esto da excelentes resultados cuando se combina con la tinción estándar de HE, la fijación del tejido con Bouin antes de FISH conduce a señales fluorescentes débiles y borrosas que son difíciles de interpretar.
Aunque este protocolo ha demostrado ser exitoso en la determinación del contenido cromosómico X de las células ováricas, todavía tiene algunas limitaciones. Una limitación es que estos métodos solo se pueden usar para analizar las células ováricas de mujeres con aberraciones numéricas. Las aberraciones numéricas pueden detectarse mediante el uso de sondas dirigidas a secuencias repetitivas21. Estas sondas hibridan múltiples secuencias repetitivas de pares de bases en la región del centrómero, lo que resulta en fuertes señales de hibridación. Por el contrario, las aberraciones estructurales solo se pueden detectar mediante el uso de sondas contra secuencias únicas únicas. Estas sondas se hibridan a secuencias que solo ocurren una vez en el genoma haploide, lo que resulta en una señal FISH considerablemente menos intensa en comparación con las aberraciones numéricas. Debido a estas señales FISH relativamente débiles, es difícil determinar adecuadamente el contenido cromosómico X de las células ováricas en mujeres con aberraciones estructurales.
En segundo lugar, las señales FISH de ovocitos de folículos pequeños en tejido no injertado son difíciles de analizar, debido a la proximidad de las cuatro cromátidas hermanas en la profase de la meiosis I22. Solo una señal de hibridación fuerte estará presente en los ovocitos y, por lo tanto, no es posible simplemente contar el número de señales en los ovocitos para determinar el contenido del cromosoma X. En cambio, la relación superficial de las señales del cromosoma X y 18 FISH debe usarse para determinar el contenido cromosómico X en estas células. Esto solo se puede determinar de manera confiable si las señales FISH en los ovocitos están claramente presentes.
Además, el FISH en tejido injertado solo se puede usar para determinar el contenido cromosómico X de las células de la granulosa de los folículos secundarios y antrales, ya que los folículos pequeños en las secciones histológicas del tejido injertado solo tienen unas pocas células de la granulosa que se pueden analizar adecuadamente. Además, el contenido cromosómico X de los ovocitos no se puede determinar con precisión utilizando este método debido al gran diámetro de los ovocitos.
Finalmente, sigue siendo difícil obtener gametos femeninos en comparación con los gametos masculinos porque se requiere cirugía invasiva para obtener células ováricas o tejido de la corteza ovárica. Por lo tanto, es más probable que estos métodos se apliquen en un entorno de investigación.
En conclusión, el análisis FISH de células ováricas de tejido de corteza ovárica no injertado e injertado de mujeres con aberraciones cromosómicas X es una técnica única y útil para obtener información sobre el contenido cromosómico X de las células ováricas en este grupo específico. Estas técnicas muestran que la criopreservación del tejido de la corteza ovárica de mujeres con aberraciones cromosómicas X es posible, y que los folículos primordiales criopreservados son capaces de crecer a folículos secundarios y antrales. Sin embargo, debe tenerse en cuenta que ambos métodos están destinados a facilitar la investigación futura en mujeres con aberraciones cromosómicas X, y no están diseñados para ser utilizados como una herramienta de diagnóstico para detectar los resultados reproductivos de las mujeres con aberraciones cromosómicas X en la práctica clínica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a Marjo van Brakel, Dominique Smeets, Guillaume van de Zande, Patricia van Cleef y Milan Intezar por su experiencia y asistencia técnica. Fuentes de financiación: Merck Serono (A16-1395), Goodlife y Ferring.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid | Biosolve BV | 0001070602BS | |
| Centrifuge 1200 | Hettich Universal | 4140 | |
| Collagenase I | Sigma | 131470 | |
| Coverslip | VWR | 0631-0146 | |
| DAPI | Vector | H-1200 | |
| DNase I | Roche | 10104159001 | |
| Dulbecco’s Phosphate Buffered Saline | Lonza | BE17-513Q | |
| EDTA | Merck | 108421 | |
| Eosin-Y | Sigma | 1159350100 | |
| Ethanol | EMSURE | 1009832500 | |
| Fetal Bovine Serum (FBS) | Life technology | 10100147 | |
| Fluorescence microscope for sections DM4 B | Leica Microsystems | ||
| Fluorescence microscope scope A1 | Zeiss AXIO | ||
| Fluorescent labeled probes for dissociated cells | Abbott Diagnostics | CEPX (DXZ1) 05J1023 CEP18 (D18Z1) 05J0818 | |
| Fluorescent labeled probes for tissue sections | Abbott Diagnostics | CEP X (DXZ1 05J08-023 CEP 18 (D18Z1) 05J10-028 | |
| Formaldehyde | Sigma | 252549 | |
| Glucose | Merck | 108337 | |
| Glue (Fixogum) | Leica Microsystems | LK071A | |
| Hematoxylin | Sigma | 1159380025 | |
| Hybridization buffer | Abott Diagnostics | 32-804826/06J67-001 | |
| Hybridization Station | Dako | S2451 | |
| Hydrochloric acid | Merck | 1003171000 | |
| Image processing software individual ovarian cortex cells (Cytovision 7.7) | Leica Biosystems | ||
| Image processing software on paraffine sections | Leica Application Suitex (3.7.5.24914) | ||
| Immunohitochemistry microscope slides | Dako | K802021-2 | |
| L15 | Lonza | 12-700Q | |
| Liberase DH | Roche | 05 401 151 001 | |
| Light microscope | Zeiss West Germany | ||
| Magnesium sulphate | Merck | A335586 | |
| Methanol | Honeywell | 14262-1L | |
| Mounting medium | Vectashield, Vector | H-1000 | |
| Nonidet P40 | Sigma | 7385-1L | |
| Paraffin | Poth Hile | 2712.20.10 | |
| Pepsin | Sigma | P7000-25G | |
| Phosphate-Buffered Saline (PBS) | Gibco | 11530546 | |
| Plastic pipette | CooperSurgical | 7-72-4075/1 | |
| Potassium chloride | Merck | 1049361000 | |
| Proteinase K | Qiagen | 19131 | |
| Rotation microtome HM 355S | Thermo sceintific | ||
| Scalpel | Dahlhausen | 11.000.00.515 | |
| Slide for FISH on dissociated cells | Thermo scientific | J1810AM1JZ | |
| Sodium bicarbonate | Sigma | 55761-500G | |
| Standard Sodium Citrate (SSC) | Fisher Scientific, Invitrogen | 10515203 | |
| Stereomicroscope IX 70 | Olympus | ||
| Target Retrieval Solution | Dako | GV80511-2 | |
| Trypsin | Sigma | T4799 | |
| Tween-20 | ThermoFisher | 85113 | |
| Xylene | BOOM | 760518191000 |
Referencias
- Vander Borght, M., Wyns, C. Fertility and infertility: Definition and epidemiology. Clinical Biochemistry. 62, 2-10 (2018).
- Yatsenko, S. A., Rajkovic, A. Genetics of human female infertility. Biology of Reproduction. 101 (3), 549-566 (2019).
- Yahaya, T. O., et al. Chromosomal abnormalities predisposing to infertility, testing, and management: a narrative review. Bulletin of the National Research Centre. 45 (1), 65(2021).
- Foresta, C., Ferlin, A., Gianaroli, L., Dallapiccola, B. Guidelines for the appropriate use of genetic tests in infertile couples. European Journal of Human Genetics. 10 (5), 303-312 (2002).
- Heard, E., Turner, J. Function of the sex chromosomes in mammalian fertility. Cold Spring Harbor Perspectives in Biology. 3 (10), 002675(2011).
- Reynaud, K., et al. Number of ovarian follicles in human fetuses with the 45,X karyotype. Fertility and Sterility. 81 (4), 1112-1119 (2004).
- Otter, M., Schrander-Stumpel, C. T., Curfs, L. M. Triple X syndrome: a review of the literature. European Journal of Human Genetics. 18 (3), 265-271 (2010).
- Modi, D. N., Sane, S., Bhartiya, D. Accelerated germ cell apoptosis in sex chromosome aneuploid fetal human gonads. Molecular Human Reproduction. 9 (4), 219-225 (2003).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Huber, D., von Voithenberg, L. V., Kaigala, G. V. Fluorescence in situ hybridization (FISH): History, limitations and what to expect from micro-scale FISH. Micro and Nano Engineering. 1, 15-24 (2018).
- Hu, L., et al. Fluorescence in situ hybridization (FISH): an increasingly demanded tool for biomarker research and personalized medicine. Biomarker Research. 2 (1), 3(2014).
- Hwang, K., Weedin, J. W., Lamb, D. J. The use of fluorescent in situ hybridization in male infertility. Therapeutic Advances in Urology. 2 (4), 157-169 (2010).
- Ramasamy, R., Besada, S., Lamb, D. J. Fluorescent in situ hybridization of human sperm: diagnostics, indications, and therapeutic implications. Fertility and Sterility. 102 (6), 1534-1539 (2014).
- Chatziparasidou, A., Christoforidis, N., Samolada, G., Nijs, M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia. 47 (8), 847-860 (2015).
- Schleedoorn, M., et al. TurnerFertility trial: PROTOCOL for an observational cohort study to describe the efficacy of ovarian tissue cryopreservation for fertility preservation in females with Turner syndrome. BMJ Open. 9 (12), 030855(2019).
- Peek, R., et al. Ovarian follicles of young patients with Turner's syndrome contain normal oocytes but monosomic 45,X granulosa cells. Human Reproduction. 34 (9), 1686-1696 (2019).
- Nadesapillai, S., et al. Why are some patients with 45,X Turner syndrome fertile? A young girl with classical 45,X Turner syndrome and a cryptic mosaicism in the ovary. Fertility and Sterility. 115 (5), 1280-1287 (2021).
- Dolmans, M. M., et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 116 (16), 2908-2914 (2010).
- Dath, C., et al. Xenotransplantation of human ovarian tissue to nude mice: comparison between four grafting sites. Human Reproduction. 25 (7), 1734-1743 (2010).
- Cacciottola, L., Donnez, J., Dolmans, M. M. Ovarian tissue damage after grafting: systematic review of strategies to improve follicle outcomes. Reproductive BioMedicine Online. 43 (3), 351-369 (2021).
- Bishop, R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 3 (1), 85-95 (2010).
- Burgoyne, P. S., Mahadevaiah, S. K., Turner, J. M. The consequences of asynapsis for mammalian meiosis. Nature Reviews Genetics. 10 (3), 207-216 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados