Method Article
Cultivo de Linfócitos em Microgravidade Simulada utilizando Sistema de Cultura de Células Rotativas
Neste Artigo
Resumo
Este é um guia passo a passo para o uso de um sistema de cultura de células rotativas comercialmente disponível para cultivar linfócitos em microgravidade simulada usando vasos de cultura descartáveis especializados. Este método de cultura pode ser aplicado a qualquer cultura celular do tipo suspensão.
Resumo
Dadas as limitações atuais da realização de pesquisas biológicas no espaço, existem algumas opções para submeter a cultura de células à microgravidade simulada (SMG) na Terra. Essas opções variam em seus métodos, princípios e adequação para uso com cultura de células em suspensão. Aqui, um método de cultura celular é descrito para submeter linfócitos a microgravidade simulada usando um sistema de cultura de células rotativas comercialmente disponível, também conhecido como clinostato 2D ou dispositivo de vaso de parede rotativa (RWV). Este método de cultura de células utiliza o princípio da anulação vetorial gravitacional em média no tempo para simular a microgravidade girando as células em um eixo horizontal. As células cultivadas neste sistema podem ser colhidas e utilizadas em diferentes ensaios experimentais para avaliar os efeitos da microgravidade simulada sobre a função e fisiologia celular. A técnica de cultivo pode variar ligeiramente dependendo do tipo ou linhagem celular utilizada, mas o método aqui descrito pode ser aplicado a qualquer cultura celular do tipo suspensão.
Introdução
Foi demonstrado que o voo espacial impacta muitos aspectos da fisiologia humana, incluindo o sistema imunológico. Muitos estudos têm demonstrado evidências de desregulação imunológica como resultado de voo espacial in vivo e exposição à microgravidade simulada (SMG) in vitro 1,2,3,4. Um aspecto importante do ambiente espacial que impacta a fisiologia humana é a microgravidade. A microgravidade refere-se à "ausência de gravidade" experimentada devido às baixas forças gravitacionais no ambiente espacial5. À medida que a humanidade se prepara para missões espaciais mais longas à Lua e a Marte, mais pesquisas precisam ser conduzidas para mitigar sérios riscos à saúde dos astronautas.
Condições reais de microgravidade para a pesquisa científica podem ser alcançadas no espaço a bordo da Estação Espacial Internacional (ISS) ou em nanossatélites lançados em órbita; No entanto, essas opções podem ser incrivelmente caras e complexas de orquestrar. Dadas as limitações atuais da realização de pesquisas biológicas no espaço, existem várias opções para induzir microgravidade real e SMG na Terra. Existem operações em grande escala que podem produzir curtos períodos de microgravidade real na Terra, incluindo torres de queda, voo parabólico e foguetes de sondagem. No entanto, esses métodos não são excessivamente adequados para estudar os efeitos da microgravidade em sistemas biológicos, em grande parte devido aos seus curtos períodos de tratamento de microgravidade (isto é, segundos a 20 min). Esses métodos são discutidos mais detalhadamente em outras publicações 5,6. As opções que são adequadas para cultura de células biológicas incluem dispositivos de pequena escala, como clinostatos 2D ou dispositivos de vasos de parede rotativa (RWV) e clinostatos 3D ou máquinas de posicionamento aleatório (RPM). Esses dispositivos podem ser instalados dentro de incubadoras de cultura celular mantidas a 37 °C e 5% CO2, e eles giram a cultura celular em um eixo horizontal (2D) ou em dois eixos perpendiculares (3D)5. No entanto, é importante enfatizar que esses métodos de cultivo produzem SMG em oposição à microgravidade real, que é mais viável no espaço para contextos de pesquisa biológica.
O objetivo do presente trabalho é delinear os passos para submeter linfócitos à SMG usando um dispositivo RWV comercialmente disponível (Tabela de Materiais), que se enquadra na classificação clinostat 2D. Embora haja um protocolo geral disponível do fabricante para operar este dispositivo, o artigo atual visa cobrir as etapas de solução de problemas e otimização com mais detalhes. Este artigo também aborda a teoria por trás de como este dispositivo funciona para produzir SMG em cultura de células em suspensão, especificamente com linfócitos. Nesse contexto, cultura de células em suspensão refere-se a células crescendo livremente em meios de cultura suplementados, sem aderir a nenhum andaime adicional. Muitos tipos celulares são cultivados em cultura de células em suspensão, incluindo linfócitos. Os linfócitos são células do sistema imune, incluindo as células T, B e Natural Killer (NK), que residem nos órgãos linfoides e na corrente sanguínea7.
O clinostato RWV 2D aqui descrito opera com base no princípio da anulação do vetor gravitacional em média no tempo 5,6,8,9, pelo qual o vetor gravitacional é randomizado através da rotação da cultura celular em um eixo horizontal. Isto é conseguido combinando a velocidade de rotação do vaso de cultura com a velocidade de sedimentação das células. Desde que a velocidade de rotação do vaso de cultura seja bem compatível com a velocidade de sedimentação das células, as células são mantidas em queda livre e incapazes de sedimentar, como experimentado no ambiente espacial. Após uma fase inicial de aceleração, o meio no vaso de cultura finalmente atinge a "rotação do corpo sólido" ao longo do tempo. Essa rotação horizontal também induz fluxo laminar no vaso de cultura celular. Isso cria um ambiente de "baixo cisalhamento", dado que a tensão de cisalhamento induzida nas células pelo fluxo laminar é muito menor do que a do fluxo turbulento. No entanto, dado que o clinostato não é um sistema perfeito, há alguns pequenos movimentos de fluido laminar introduzidos, que infligem estresse de cisalhamento mínimo nas células. Como tal, as células suspensas no meio são arrastadas por esse fluxo durante a rotação. Durante a rotação horizontal, o vetor gravitacional atua sobre as células e as coloca em uma trajetória oscilante, conforme visualizado na Figura 1. Outra pequena fonte de tensão de cisalhamento é causada pela "queda" das células através do meio, causando fluxo laminar ao redor das células. À medida que o vaso de cultura gira em um eixo horizontal, o vetor gravitacional experimentado pelas células também gira. Com o tempo, esse vetor de gravidade giratório faz médias para se aproximar de zero; esse fenômeno é chamado de anulação do vetor gravitacional tempo-médio e induz um estado de SMG 5,6,8,9. Esse dispositivo tem sido utilizado para estudar os efeitos da SMG em diversos tipos de células, algumas das quais são abordadas emreferências10,11,12. Mais exemplos podem ser encontrados no site do fabricante do dispositivo.
Este dispositivo RWV usa "vasos de alta taxa de aspecto" (HARVs) especializados disponíveis através do fabricante do dispositivo. Esses HARVs contêm 10 mL de cultura celular cada; no entanto, HARVs de 50 mL também estão disponíveis. HARVs de 10 mL ou 50 mL podem ser usados dependendo de quantas células são necessárias para completar quaisquer ensaios experimentais a jusante, o que é descrito mais adiante na seção de discussão. Os HARVs são feitos de policarbonato e incluem uma membrana de oxigenação de silicone para permitir a troca gasosa durante a cultura celular. Isso mantém o pH do meio celular e permite uma respiração celular eficiente. Há uma porta de enchimento principal e duas portas de seringa tampadas na face do navio (Figura 2A). Depois de carregar a cultura celular através da porta de enchimento principal, duas seringas são carregadas no recipiente para ajudar na remoção de bolhas. Ao usar os vasos de 10 mL, duas seringas de 3 mL funcionam bem. Uma seringa é acoplada ao dispositivo vazia, com a seringa completamente deprimida, e a outra é anexada preenchida com 3 mL de cultura celular (Figura 2E). Estes são usados em combinação para remover bolhas do vaso, o que é importante para manter o tratamento SMG. Em geral, é aconselhável configurar dois controles negativos, que podem ser chamados de controle "Flask" e controle "1G". O controle "Flask" corresponde às células que são cultivadas em um frasco padrão de cultura de células de suspensão T25. O controle 1G corresponde às células que são cultivadas no vaso de cultura especializado de 10 mL, que é simplesmente colocado na incubadora (ou seja, sem ser submetido ao tratamento SMG). Consulte a seção Discussão para obter mais detalhes sobre controles.
O método aqui descrito é apropriado para qualquer pesquisador que pretenda estudar os efeitos da SMG em linfócitos, com foco específico em células NK utilizando a linhagem celular NK9213. Os resultados desses estudos podem nos ajudar a entender melhor e mitigar os efeitos adversos dos voos espaciais no sistema imunológico humano.
Protocolo
NOTA: As seguintes etapas devem ser concluídas dentro de um armário de segurança biológica estéril.
1. Preparação dos vasos para cultura celular
- Retire os recipientes de cultura das embalagens plásticas. Rotular cada recipiente na borda de acordo com o tipo/linha celular que está sendo usado, se é o controle (1G) ou o tratamento (SMG), e qualquer outra informação relevante.
- Estabilize o navio e abra a porta de enchimento cuidadosamente, sem tocar na tampa da porta de enchimento peg/O-ring. Coloque a tampa em uma almofada de etanol, com o pino / O-ring voltado para cima, enquanto o recipiente está sendo preenchido. Não retire as tampas das portas da seringa.
NOTA: Se o pino/O-ring for tocado acidentalmente, borrife o pino da tampa com etanol a 70% e deixe-o descansar (virado para cima) por alguns instantes enquanto enche o recipiente. Quando estiver pronto para fechar a porta de enchimento novamente, pegue a tampa com um lenço de papel fresco para secar completamente a tampa antes de colocá-la de volta no navio. - Carregar o recipiente com 10 mL do meio completo apropriado para a cultura celular usando uma pipeta sorológica estéril e colocar cuidadosamente a tampa de volta no orifício de enchimento.
NOTA: Aqui, foi utilizada a linhagem celular NK92 NK, que foi cultivada em meio GM1, conforme previamente validado em ensaio clínico utilizando células NK92 como terapia celular14. O meio de cultura utilizado depende da linhagem celular ou do tipo celular a ser cultivado. Por favor, verifique o site do fornecedor para a receita de mídia correta para a linha celular ou tipo de célula que está sendo usado. - Certifique-se de que as tampas das portas da seringa e a porta de enchimento estão bem fechadas e coloque os recipientes cheios numa incubadora de 37 °C e 5% de CO2 enquanto realiza as etapas subsequentes para preparar os recipientes para cultura celular.
NOTA: Esta etapa de priming ajuda a minimizar a formação de bolhas grandes para facilitar a expulsão de bolhas mais tarde na Etapa 6.
2. Preparação da cultura de células estoque para a instalação do tratamento SMG
- Quando não estiverem em uso, armazenar as células de interesse a uma temperatura inferior a -130 °C ou, idealmente, em uma fase de vapor de nitrogênio líquido.
- Pelo menos 1 semana antes de estabelecer o tratamento planejado, descongele as células e cultive-as usando a receita apropriada de meio de cultura celular encontrada no site do fornecedor. Planeje quantas células são necessárias para configurar o tratamento (detalhes abaixo nas etapas subsequentes) e certifique-se de iniciar as culturas cedo o suficiente para permitir proliferação e adaptação suficientes à cultura.
- Armazenar a cultura celular em uma incubadora a 37 °C, 5% CO2 . Mais detalhes sobre a prática padrão de cultura de células são abordados em outra publicação15.
- No dia da instalação planejada do tratamento com SMG, determinar a concentração inicial e a viabilidade da cultura celular inicial.
- Use o método preferido para determinar a concentração da cultura celular inicial (por exemplo, hemocitômetro, ViCell, citometria de fluxo, etc.). Tome nota da concentração celular viável (células por mL) e viabilidade (%) das células, garantindo que a viabilidade seja idealmente maior que 85%. Um protocolo para o uso do hemocitômetro pode ser encontradoem outra publicação16.
- Determinar a densidade/concentração de semeadura celular apropriada da cultura celular para tratamento de SMG, considerando a faixa de concentração celular ideal do tipo/linhagem celular em particular, seu tempo de duplicação e a duração do tratamento com SMG. Consulte a seção Discussão para maiores elaborações.
NOTA: Pela experiência, o intervalo de concentração ideal para células NK92 é entre 0,3 x 10 6- 1,2 x 106 células/mL. Geralmente, essas células têm um tempo de duplicação de 48-72 h e são alimentadas a cada 2-3 dias como tal. Dado que a duração do tratamento foi de 72 h, as células foram semeadas na extremidade inferior de sua faixa ótima em 0,4-0,5 x 106 células/mL. O fornecedor também recomenda essa densidade de semeadura ao iniciar a cultura celular inicial a partir de um frasco fresco de células NK92. - Determinar o volume de cultura de células estoque necessário para configurar o tratamento e os controles.
NOTA: São necessários 10 mL de cultura celular por grupo experimental. Se três grupos experimentais forem estabelecidos (isto é, um tratamento: "SMG" e dois controles negativos: "Flask" e "1G"), outros 10 mL de cultura celular são suficientes para aloquotar em um tubo de 15 mL usado para carregar as seringas HARV. São 40 mL no total, que podem flutuar dependendo do desenho experimental específico. - Determine o número de células necessárias para configurar o tratamento.
- Calcular o número total de células necessárias multiplicando a densidade de semeadura escolhida (células/mL) pelo volume total necessário (mL).
NOTA: A partir da experiência com NK92, 40 mL de cultura de células-estoque são preparados conforme detalhado acima em uma concentração de semeadura de 0,4-0,5 x 106 células/mL. Como tal, 16-20 x 106 células NK92 são necessárias para completar a configuração de tratamento típica. Para a linhagem celular NK92, usar um pouco mais de células é melhor do que um pouco menos células para manter a alta viabilidade durante todo o tratamento.
- Calcular o número total de células necessárias multiplicando a densidade de semeadura escolhida (células/mL) pelo volume total necessário (mL).
- Determine o volume da cultura celular inicial a ser desdobrada.
- Dado que a concentração celular é representada como células/mL, divida o número total de células (células) necessárias para o experimento pela concentração inicial medida da cultura celular (células/mL).
NOTA: Por exemplo, se forem necessárias 16 x 10 6 células e a concentração inicial da cultura for de 0,8 x 106 células/mL, 20 mL da cultura devem ser girados.
- Dado que a concentração celular é representada como células/mL, divida o número total de células (células) necessárias para o experimento pela concentração inicial medida da cultura celular (células/mL).
- Faça a cultura de células estoque final.
- Centrifugar o número adequado de células a 300 x g durante 8 min num tubo cónico de 50 ml.
- Despeje cuidadosamente o sobrenadante em um recipiente de resíduos e agite suavemente o tubo para ressuspender o pellet no pequeno volume restante.
- Ressuspender as células no volume adequado de meio completo aquecido (37 °C) para levar a cultura à densidade de semeadura desejada. Esse volume foi calculado na Etapa 2.6.
- Tampe com segurança o tubo de 50 mL e inverta-o suavemente algumas vezes para misturar completamente a suspensão celular.
NOTA: Se mais de 50 mL forem necessários para configurar o experimento completo, é melhor centrifugar o número total de células necessárias em um tubo cônico de 50 mL e ressuspendê-lo na metade do volume necessário. Em seguida, misture bem e faça uma diluição de 1:2 em um tubo cônico separado de 50 mL. Por exemplo, se 100 mL for necessário em 0,4 x 10 6 células/mL, gire 40 x 106 células em um tubo de 50 mL, ressuspenda em 50 mL de meio, transfira 25 mL para outro tubo de 50 mL e, em seguida, complete ambos com 25 mL de meio fresco.
3. Navios de carregamento com cultura de células de reserva
- Recupere os vasos preparados para o meio da incubadora.
- Se estiver a ser utilizado um controlo "Flask", carregar um balão de cultura de suspensão T25 com 10 ml de cultura celular a partir da amostra acima preparada. Além disso, adicione 10 mL de cultura de células estoque a um tubo cônico separado de 15 mL, que será usado para carregar as seringas.
- Desparafuse as tampas das portas da seringa para retirá-las do recipiente e certifique-se de que as torneiras estejam na posição aberta (Figura 2C).
- Estabilize o navio e abra a porta de enchimento cuidadosamente, sem tocar na tampa da porta de enchimento peg/O-ring. Coloque a tampa em uma almofada de etanol, com o pino / O-ring voltado para cima, enquanto o recipiente está sendo preenchido. Desaperte cuidadosamente as tampas das portas da seringa.
- Certifique-se de que as torneiras estejam na posição aberta (Figura 2C). Despeje cuidadosamente o meio do recipiente em um recipiente de resíduos, remova o meio usando uma pipeta sorológica ou aspira-o usando uma pipeta de vidro estéril Pasteur conectada ao sistema de vácuo, sem tocar na membrana de oxigenação.
- Feche bem o tubo cônico de 50 mL que contém a cultura de células estoque e inverta-o suavemente algumas vezes para misturar completamente o conteúdo.
- Retirar 10 mL de estoque de cultura celular do tubo de 50 mL com uma pipeta sorológica estéril fresca. Pegue o navio e incline-o de modo que o porto de enchimento esteja em direção ao topo e, em seguida, distribua cuidadosamente o estoque de cultura de células no navio através do porto de enchimento.
OBS: Tenha cuidado e observe o volume para que a cultura não se espalhe pelas portas da seringa enquanto inclina o recipiente. - Procure encher a embarcação até o topo do lábio do porto de enchimento sem derramar; Incline o vaso de volta para baixo enquanto ele está sendo preenchido para evitar derramamentos. Tenha cuidado para não tocar a membrana de oxigenação com a pipeta, pois ela é muito frágil.
NOTA: O processo de enchimento do recipiente pode levar alguma prática; Seja paciente e vá devagar. Se uma película de bolhas se formar na abertura do porto de enchimento, isso interferirá no carregamento do navio. Se isso acontecer, bata suavemente no recipiente para quebrar o selo criado pela película de bolhas. - Uma vez que o navio esteja carregado, coloque cuidadosamente a tampa da porta de enchimento novamente, garantindo que não toque no pino/O-ring.
- Coloque sobre as seringas.
NOTA: Existem duas portas de seringa na face do recipiente (Figura 2A). Um segurará uma seringa vazia e o outro segurará uma seringa cheia de cultura celular (Figura 2E).- Primeiro, conecte a seringa vazia de 3 mL a uma das portas da seringa, garantindo que a seringa esteja totalmente pressionada.
NOTA: Bombeie as seringas algumas vezes antes de prendê-las ao recipiente, pois elas estão um pouco apertadas no início. Faça isso dentro do armário de segurança biológica para manter a esterilidade. - Feche bem o tubo cônico de 15 mL com 10 mL de cultura de células aliquotadas e inverta-o suavemente algumas vezes para misturar completamente o conteúdo.
- Em seguida, semi-submergir cuidadosamente a segunda seringa de 3 mL na cultura celular e fazer alguma cultura. Para minimizar a bolha de ar na parte superior da seringa, distribua-a completamente de volta para o tubo e, em seguida, retire 3 mL da cultura.
- Fixe a seringa cheia à porta da seringa restante e higienize cuidadosamente as seringas e a porta de enchimento com uma almofada de etanol. Não obter etanol na membrana de oxigenação. Agora, a embarcação está pronta para se livrar das bolhas.
NOTA: A segunda seringa cheia para o segundo vaso é mais difícil de carregar dada a profundidade do tubo de 15 mL. Ajuda a inclinar o tubo enquanto enche a seringa para manter a vedação entre a seringa que está sendo preenchida e a cultura celular. - Repita as etapas 3.3-3.10 para os vasos restantes. Se houver uma quantidade ligeiramente insuficiente de cultura celular no tubo cônico de 50 mL para o último vaso (por exemplo, 9,5 mL em vez de 10 mL), recupere a quantidade restante do tubo cônico de 15 mL usado para carregar as seringas.
NOTA: As etapas a seguir não precisam ocorrer dentro de um armário de segurança biológica estéril, pois o recipiente agora é um sistema fechado e estéril.
- Primeiro, conecte a seringa vazia de 3 mL a uma das portas da seringa, garantindo que a seringa esteja totalmente pressionada.
4. Remoção de bolhas dos recipientes
NOTA: Bolhas são inevitáveis dentro deste setup e devem ser consistentemente removidas durante todo o tratamento (Figura 3). Consulte a seção Discussão para obter mais detalhes sobre isso.
- Certifique-se de que as torneiras das portas da seringa estão na posição fechada (Figura 2D) para limitar a migração de células e bolhas das seringas para os recipientes. Isso é especialmente importante mais tarde durante o tratamento (discutido abaixo). Para coletar as bolhas iniciais, vire o vaso de cabeça para baixo e bata na lateral dele algumas vezes.
- Vire rapidamente o vaso de volta para cima e, em seguida, em um leve ângulo voltado para longe para que as bolhas flutuem para o lado ascendente do vaso (Figura 3B).
- Manobrar as bolhas sob a porta com a seringa vazia e vê-las começar a entrar na porta. Abra ambas as torneiras da porta da seringa (Figura 2C).
- Bata suavemente no recipiente para incentivar as bolhas a flutuar até a seringa vazia. Sugue lentamente as bolhas maiores com a seringa vazia, enquanto deprime cuidadosamente a seringa cheia, para manter a pressão no vaso para que a membrana de oxigenação não estoure.
NOTA: Bolhas maiores precisarão ser sugadas, enquanto pequenas bolhas e microbolhas podem ser encorajadas a flutuar até a seringa, manobrando-as para as portas da seringa e batendo suavemente no recipiente. Após algumas horas de tratamento, é muito importante minimizar a "contaminação cruzada" entre as células das seringas e as células do vaso de cultura. Isso ocorre porque as células das seringas não recebem a mesma quantidade de oxigenação ou exposição à SMG que as células do vaso. - Repita as etapas 4.2-4.4 algumas vezes para garantir que todas as bolhas sejam removidas. Remova todas as bolhas, incluindo microbolhas, dos vasos.
NOTA: As bolhas podem ser facilmente vistas através da membrana de oxigenação (parte de trás do vaso) quando o vaso está apontado para uma fonte de luz (janela, luz, etc.). Ao executar as etapas 4.2 e 4.3, observe as bolhas que se movem da parte de trás do recipiente para ajudar a visualizar as bolhas mais difíceis de ver. - Quando as bolhas tiverem sido efetivamente removidas, feche as torneiras da porta da seringa. Mantenha as seringas ligadas durante o tratamento para permitir a remoção subsequente da bolha, garantindo que o volume em ambas as seringas seja aproximadamente igual.
5. Fixação do recipiente à base rotativa
- Limpe cuidadosamente a superfície da base giratória e do cabo de fita com etanol 70%.
- Verifique se o cabo de fita incluído está conectado à fonte de alimentação. Coloque a base giratória na incubadora e prenda o cabo de fita à base. Certifique-se de que a fonte de alimentação seja mantida perto, mas fora da incubadora. A Figura 4 mostra a base giratória e a fonte de alimentação para contextualizar.
- Conecte o recipiente de tratamento SMG alinhando as roscas do vaso ao pino giratório e girando suavemente o pino giratório na base no sentido anti-horário. Certifique-se de que o recipiente está preso de forma segura. Certifique-se de que a incubadora mantenha perto de 100% de umidade enchendo a bandeja de água com água suficiente autoclavada de osmose reversa (RO).
- Escolha uma velocidade de rotação apropriada (rpm). Ajuste a velocidade de rotação para corresponder à velocidade de sedimentação das células, de modo que as células não "caiam pela mídia", mas acabem girando em um pequeno caminho orbital. Esse fenômeno é visualizado como um diagrama esquemático na Figura 1.
NOTA: A empresa recomenda iniciar a rotação a 8-10 rpm para linfócitos. Nesse caso, as células NK92 foram giradas a 11 rpm, como demonstrado em trabalho anterior17. Dependendo do tamanho da célula, o rpm deve ser aumentado para células maiores e diminuído para células menores. O mesmo padrão se aplica se as células usadas tendem a se aglomerar durante o cultivo. Consulte a seção Discussão para obter mais detalhes sobre isso.
6. Tratamento
- Escolha uma duração de tratamento apropriada para a aplicação da pesquisa, que pode depender de quais parâmetros de função/fisiologia celular estão sendo avaliados. Consulte a seção Discussão para obter mais detalhes sobre isso.
NOTA: Neste caso, as células NK92 foram submetidas a um tratamento SMG de 72 h, baseado em resultados de estudos anteriores18,19. Bolhas inevitavelmente se formarão ao longo do tratamento e precisarão ser removidas. A rotação pode ser brevemente interrompida e reiniciada para facilitar isso. Consulte a Etapa 7.1 para saber como remover com segurança o vaso SMG. - No primeiro dia de início do tratamento, verifique a formação de bolhas a cada poucas horas, repetindo os passos 4.2-4.6. Após o primeiro dia, verificar os vasos conforme necessário (pelo menos uma vez por dia), repetindo os passos 4.2-4.6, até o final do tratamento.
7. Colheita de células dos vasos
- Uma vez decorrido o tempo de tratamento planejado, pare a rotação e desmonte o aparelho. Remova o recipiente de tratamento SMG segurando suavemente o recipiente parado enquanto gira o pino giratório do dispositivo no sentido horário.
- Traga o frasco de controle, o recipiente de controle 1G e o recipiente SMG tratado para um gabinete de segurança biológica estéril.
- Pegue cada vaso (1G e SMG apenas; não o Flask) e vire-o de cabeça para baixo para que ele fique virado para baixo e bata suavemente nele para colocar todas as células em suspensão. Em seguida, vire o navio de lado com a porta de enchimento em direção ao fundo e bata novamente na embarcação para encorajar as células em direção à porta de enchimento para uma aspiração eficiente.
- Manuseie cada embarcação individualmente. Desparafuse as seringas das duas portas e elimine-as nos resíduos de risco biológico. Abra as torneiras nas portas da seringa.
- Remover cuidadosamente a tampa do orifício de enchimento e extrair o conteúdo usando uma pipeta sorológica estéril de 10 mL, inclinando o recipiente à medida que ele está sendo esvaziado. Distribuir o conteúdo dos grupos "Flask", "1G" e "SMG" em tubos cônicos de 15 mL rotulados individualmente.
- Feche cada tubo e inverta-os suavemente algumas vezes para garantir que estão devidamente misturados. Use o método preferido para determinar a concentração e a viabilidade da cultura celular resultante para se preparar para uso em ensaios experimentais subsequentes.
Resultados
Esse método de cultivo é considerado bem-sucedido se 1) a proliferação das células for aproximadamente consistente entre os grupos controle (e idealmente todos os grupos experimentais), 2) a proliferação for apropriada dada a densidade de semeadura, o tempo de tratamento e o tempo de duplicação do tipo/linhagem celular, e 3) a viabilidade das células colhidas for de 85% ou mais (Tabela 1 ). Idealmente, as células resultantes deveriam ser tão saudáveis quanto seriam em cultura celular padrão, especialmente para uso em experimentos e ensaios subsequentes (ou seja, viabilidade de 85% ou mais). Este método de cultura é considerado malsucedido se o oposto for verdadeiro, em que as células resultantes ou morrem, diferem substancialmente em proliferação entre os grupos de controle, ou têm viabilidade subótima em torno de 70% ou menos (Tabela 1). A proliferação no grupo de tratamento com SMG pode ou não diferir em comparação com os controles, dependendo de como o tratamento com SMG afeta a fisiologia celular. No entanto, isso não foi um problema até o momento, e a proliferação celular foi aproximadamente igual entre os grupos controle e tratamento (Tabela 1). Como mencionado anteriormente, esses parâmetros são importantes para o sucesso de ensaios e experimentos a jusante, e as células resultantes dos dois grupos controle devem ter desempenho relativamente semelhante.
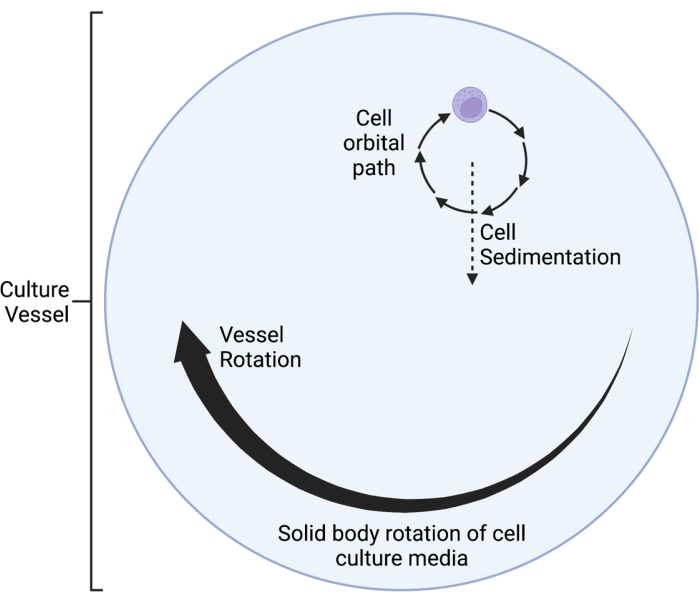
Figura 1: Diagrama esquemático da trajetória orbital localizada das células cultivadas dentro do vaso simulado de microgravidade (SMG) durante a operação. O clinostato RWV 2D aqui descrito opera com base no princípio da anulação do vetor gravitacional em média no tempo 5,6,8,9, pelo qual o vetor gravitacional é randomizado através da rotação da cultura celular em um eixo horizontal. Isto é conseguido combinando a velocidade de rotação do vaso de cultura com a velocidade de sedimentação das células. Após uma fase inicial de aceleração, o meio no vaso de cultura finalmente atinge a "rotação do corpo sólido" ao longo do tempo. Essa rotação horizontal também induz fluxo laminar no vaso de cultura celular. Isso cria um ambiente de "baixo cisalhamento", dado que a tensão de cisalhamento induzida nas células pelo fluxo laminar é muito menor do que a do fluxo turbulento. No entanto, dado que o clinostato não é um sistema perfeito, há alguns pequenos movimentos de fluido laminar introduzidos, que infligem estresse de cisalhamento mínimo nas células. Como tal, as células suspensas no meio são arrastadas por esse fluxo durante a rotação. Durante a rotação horizontal, o vetor gravitacional atua sobre as células e as coloca em uma trajetória oscilante, que é visualizada aqui. À medida que o vaso de cultura gira em um eixo horizontal, o vetor gravitacional experimentado pelas células também gira. Com o tempo, esse vetor de gravidade giratório faz médias para se aproximar de zero; esse fenômeno é chamado de "anulação do vetor gravitacional em média no tempo" e induz um estado de SMG 5,6,8,9. Essa Figura foi modificada de Castro et al., 201120. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.

Figura 2: Vaso de alta proporção (HARV) de 10 mL. (A) Vista panorâmica do HARV, mostrando a porta de enchimento principal e duas portas de seringa. (B) Parte posterior do HARV mostrando a porta rosqueada para conectar o HARV à base rotativa e à membrana de oxigenação. (C) Vista lateral do HARV mostrando portas de seringa abertas (tampadas). (D) Vista lateral do HARV mostrando portas de seringa fechadas (tampadas). (E) Vista lateral do HARV mostrando as duas seringas de 3 mL acopladas; A seringa esquerda é preenchida com cultura celular e a seringa direita está vazia. Clique aqui para ver uma versão maior desta figura.

Figura 3: Bolhas no HARV. (A) Vista panorâmica do HARV, mostrando bolhas a serem eliminadas da cultura celular. (B) Vista lateral do HARV, mostrando as mesmas bolhas. Observe como as bolhas variam de tamanho; microbolhas também devem ser removidas. Clique aqui para ver uma versão maior desta figura.

Figura 4: Base giratória e fonte de alimentação do dispositivo RWV . (A) Vista frontal da base giratória, mostrando quatro estacas giratórias que podem acomodar até quatro vasos de cultura. (B) Vista traseira da base giratória, mostrando a entrada para o cabo de fita (não ilustrado) que liga a base e a fonte de alimentação. (C) Vista frontal da fonte de alimentação mantida em cima da incubadora. Observe o botão liga/desliga à esquerda e o seletor de ajuste de rpm à direita. A fonte de alimentação é conectada à tomada mais próxima (geralmente na parte traseira da incubadora) e inclui uma entrada para que o cabo de fita se conecte à base giratória. A fonte de alimentação fica fora da incubadora. A base é colocada dentro da incubadora (37 °C, 5% CO2) durante a operação, e o cabo de fita é alimentado através da porta da incubadora e conectado à fonte de alimentação. O cabo de fita não interfere na vedação da incubadora. Quando a base giratória não estiver em uso, ela deve ser mantida fora da incubadora, armazenada com segurança em uma bancada ou prateleira de laboratório. Consulte a Tabela de Materiais para obter os detalhes do dispositivo comercial usado. Clique aqui para ver uma versão maior desta figura.
| # | Viabilidade inicial | Densidade de células de semeadura/mL | Viabilidade Final (F) | Viabilidade Final (1G) | Viabilidade Final (SMG) | Células Conc (F) finais/mL | Células Conc (1G)/mL | Células End Conc (SMG)/mL | Anotações | |||||
| Viabilidade de partida e densidade de semeadura subótimas (resultado negativo) | 1 | 79% | 0,2 x 106 | 67% | 60% | 60% | 0,10 x 106 | 0,075 x 106 | 0,071 x 106 | A baixa densidade de semeadura e a viabilidade inicial subótima levaram à morte celular ao longo do período de tratamento | ||||
| 2 | 73% | 0,2 x 106 | 43% | 63% | 70% | 0,071 x 106 | 0,081 x 106 | 0,085 x 106 | ||||||
| Viabilidade de partida e densidade de semeadura ideais (resultado positivo) | 3 | 93% | 0,4 x 106 | 93% | 93% | 96% | 1,2 x 106 | 1,1 x 106 | 1,5 x 106 | A densidade de semeadura adequada e a viabilidade inicial ideal levaram ao crescimento e viabilidade celular saudáveis durante todo o tratamento | ||||
| 4 | 92% | 0,4 x 106 | 92% | 92% | 94% | 0,81 x 106 | 0,80 x 106 | 0,70 x 106 | ||||||
Tabela 1: Gráfico de comparação mostrando tratamentos simulados de microgravidade (SMG) malsucedidos e bem-sucedidos. A viabilidade inicial da NK92 e as densidades de semeadura foram comparadas com a viabilidade final e as concentrações finais resultantes após um tratamento SMG de 72 h em uma incubadora de cultura celular a 37 °C suplementada com 5% de CO2. Dois casos de desfechos negativos e dois casos de resultados positivos foram comparados. Para comparação, note que a faixa de concentração ótima da linhagem celular NK92 utilizada foi entre 0,3 x 10 6 células/mL e 1,2 x 106 células/mL, com um tempo de duplicação de cerca de 2-3 dias.
Discussão
À medida que a humanidade se prepara para missões espaciais mais longas à Lua e a Marte, mais pesquisas precisam ser conduzidas para mitigar sérios riscos à saúde dos astronautas. Um aspecto importante do ambiente espacial que impacta a fisiologia humana é a microgravidade. Aqui, um método de cultura celular foi descrito para submeter linfócitos à SMG usando um sistema de cultura de células rotativas comercialmente disponível.
Esse protocolo contém algumas etapas críticas que talvez precisem ser otimizadas dependendo do tipo de célula ou linha usada. Estes incluem 1) escolher uma densidade de semeadura apropriada dependendo do tempo de duplicação das células e duração do tratamento com SMG, e 2) determinar uma duração ideal do tratamento, velocidade de rotação e controles apropriados. A escolha de uma densidade de semeadura que esteja na faixa intermediária de concentrações celulares apropriadas para o tipo ou linhagem celular que está sendo estudada deve ser suficiente. No entanto, a escolha de uma densidade de semeadura muito baixa pode levar a uma baixa proliferação e viabilidade celular (Tabela 1), e a escolha de uma densidade muito alta pode levar à depleção prematura de nutrientes e baixa viabilidade celular. A densidade de semeadura escolhida também depende do tempo de duplicação das células que estão sendo estudadas; células com menor tempo de duplicação podem ser semeadas em menor densidade, e aquelas com maior tempo de duplicação podem precisar ser semeadas em maior densidade. A densidade de semeadura e a duração do tratamento também dependem de quantas células são necessárias para completar os ensaios experimentais subsequentes. Pela experiência, semear células NK92 altamente viáveis (90%+) a 0,4-0,5 x 10 6 células/mL em vasos de 10 mL (ou seja, 4-5 milhões de células por grupo experimental; faixa ideal para a linhagem celular = 0,3 x 10 6-1,2 x 106 células/mL, tempo de duplicação = 2-3 dias) e tratá-las por 72 h produziu cerca de 8-15 milhões de células (Tabela 1). Como tal, os vasos de 10 mL foram apropriados para a coleta de células para ensaios funcionais (3 x 10 6 células) e células de coleta para qPCR (1 x 10 6 células) e western blot (2 x 10 6-6 x 10 6 células). Os sobrenadantes também podem ser coletados para análise de componentes secretores. No entanto, vasos de 50 mL também estão disponíveis e podem ser usados quando é necessário maior rendimento celular. Ao usar vasos de 50 mL, seringas maiores também precisam ser usadas.
A determinação de uma duração de tratamento adequada também dependerá do tipo/linhagem celular utilizada. Se houver estudos prévios, eles devem ser encaminhados para a escolha de uma duração adequada do tratamento para começar. Poucos estudos utilizaram dispositivos RWV para cultura de células NK, sendo aqui referenciados17,18,19. A partir daí, os resultados do tratamento ou quão bem as células proliferaram e sua viabilidade, e seu desempenho em ensaios experimentais subsequentes, devem ser examinados. Pode ser possível estender a duração do tratamento para além de 72 h removendo a cultura celular dos vasos em um tubo, centrifugando e ressuspendendo as células em 10 mL de meio de cultura completo quente e fresco, substituindo-as nos vasos e reiniciando a rotação. No entanto, isso pode introduzir confundimentos devido à exposição à hipergravidade através da centrifugação, e dividir/diluir as células pode ser necessário para garantir que as células sejam mantidas dentro de sua faixa de concentração ideal. Se alguma molécula estimulatória (por exemplo, LPS, citocinas, etc.) for usada, recomenda-se que elas sejam adicionadas em uma concentração apropriada à receita completa do meio antes de configurar o tratamento com SMG.
Definir uma velocidade de rotação adequada (rpm) também é fundamental para manter o tratamento de microgravidade simulado. A empresa recomenda começar com uma velocidade de rotação entre 8 e 10 rpm ao cultivar linfócitos. Por experiência, uma velocidade de 11 rpm funcionou bem para garantir que as células NK92 sejam mantidas em suspensão e foi usada em um estudo anterior com células NK17. Dependendo dos padrões de crescimento do tipo/linha celular que está sendo usado, a velocidade de rotação pode precisar ser aumentada para explicar a aglomeração celular. Isso levaria ao aumento da sedimentação das células devido ao aumento da massa. Para um tratamento ideal da SMG, a velocidade de rotação do vaso de cultura deve ser ajustada para corresponder à velocidade de sedimentação das células 5,6,8,9. Em outras palavras, células ou aglomerados celulares não devem ser vistos caindo através da mídia, e eles devem permanecer relativamente estacionários.
Neste contexto, é uma boa prática tentar dois controles negativos, comparando células cultivadas em um frasco de cultura T25 padrão ("Flask") e células cultivadas no HARV especializado, mas não submetidas a SMG (ou seja, apenas colocadas na incubadora; "1G"). Idealmente, o desempenho celular e os resultados em ensaios experimentais a jusante entre os dois controles negativos devem ser comparáveis. Quaisquer inconsistências devem ser observadas. Para a maioria dos ensaios, a melhor comparação é provavelmente entre o controle "1G" e o tratamento com SMG; no entanto, incluir os controles "Flask" e "1G" pode ser benéfico para comparação suficiente e otimização inicial.
As principais limitações desse protocolo incluem 1) a formação de bolhas durante a cultura celular, 2) a extensão da SMG e 3) a possível duração do tratamento. É crucial monitorar a formação de bolhas durante todo o tratamento da SMG. Mesmo microbolhas minúsculas podem se acumular, crescer e levar à formação de bolhas maiores altamente disruptivas. Essas bolhas maiores interrompem a dinâmica do fluido de baixo cisalhamento dentro do vaso de cultura, causando aumento da turbulência à medida que o fluxo de fluido é desviado ao redor da bolha21. Em última análise, isso interrompe completamente a condição SMG. Esse fenômeno é amplamente discutido e visualizado por Phelan ecols.21. Além disso, é importante ter em mente que este dispositivo produz SMG e não microgravidade real como experimentado a bordo da ISS6. No entanto, estudos têm demonstrado efeitos semelhantes da SMG produzida por esse dispositivo em comparação com os efeitos da microgravidade real de estudos realizados no ISS 1,5,6.
Existem métodos alternativos para submeter a cultura celular à SMG. Estes incluem o uso de clinostatos 3D ou Random Positioning Machines (RPM) e levitação diamagnética. Os clinostatos 3D giram a cultura celular em dois eixos perpendiculares na mesma velocidade, enquanto os RPMs giram em dois eixos perpendiculares, sendo que tanto a velocidade quanto a direcionalidade da rotação são randomizadas 5,6. Portanto, em comparação com clinostatos 2D ou dispositivos RWV, os RPMs são mais complexos, o que introduz vários benefícios e desvantagens. Em primeiro lugar, o grau de microgravidade que pode ser alcançado em uma RPM pode ser modulado para simular gravidade parcial, como a experimentada na Lua (0,16 g) e em Marte (0,33 g)6. No entanto, a complexidade adicional de direções e velocidades de rotação aleatórias pode introduzir movimentos bruscos e forças acelerativas, especialmente em direção às áreas externas do vaso de cultura, potencialmente levando a confundimentos nos dados. A levitação diamagnética expõe as amostras a fortes campos magnéticos repulsivos para neutralizar o peso da água em amostras biológicas, como forma de neutralizar a gravidade. No entanto, o forte campo magnético gerado para isso também pode impactar negativamente as células, introduzindo confundimentos aos dados 5,6. Esses métodos são discutidos mais detalhadamente em outra publicação 5,6.
Em conclusão, o sistema de cultura de células rotativas comercialmente disponível discutido aqui é uma plataforma relativamente fácil de usar e acessível para cientistas que procuram estudar os efeitos da SMG em linfócitos. Embora existam limitações para este método de cultura celular, ele continua sendo uma opção viável para a cultura de linfócitos e potencialmente outras culturas de células em suspensão em microgravidade simulada.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Este trabalho é apoiado pela Agência Espacial Canadense (CSA), bolsa de pesquisa (17ILSRA3, Immuno Profile). Os autores gostariam de reconhecer e agradecer ao Dr. Roxanne Fournier (Universidade de Toronto), ao Dr. Randal Gregg (Lincoln Memorial University) e à Preteesh Mylabathula (Universidade do Arizona) por sua ajuda com a solução inicial de problemas deste protocolo.
Materiais
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
Referências
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941 (2021).
- Choukèr, A., Ullrich, O. . The Immune System in Space: Are we Prepared. , (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437 (2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68 (2020).
- Murphy, K., Weaver, C. . Janeway's Immunobiology 9th Edition. , (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022)
- Counting cells using a hemocytometer. Abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6 (2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados