Method Article
גידול לימפוציטים במיקרו-כבידה מדומה באמצעות מערכת תרבית תאים סיבובית
In This Article
Summary
זהו מדריך שלב אחר שלב לשימוש במערכת תרבית תאים סיבובית זמינה מסחרית לתרבית לימפוציטים במיקרו-כבידה מדומה באמצעות כלי תרבית חד-פעמיים מיוחדים. שיטת גידול זו יכולה להיות מיושמת על כל תרבית תאים מסוג תרחיף.
Abstract
בהתחשב במגבלות הנוכחיות של ביצוע מחקר ביולוגי בחלל, קיימות מספר אפשרויות לחשיפת תרבית תאים למיקרו-כבידה מדומה (SMG) על כדור הארץ. אפשרויות אלה נבדלות זו מזו בשיטותיהן, בעקרונותיהן ובהתאמתן לשימוש בתרבית תאי תרחיף. כאן, מתוארת שיטת תרבית תאים לחשיפת לימפוציטים למיקרו-כבידה מדומה באמצעות מערכת תרבית תאים סיבובית זמינה מסחרית, הידועה גם בשם קלינוסטט דו-ממדי או מכשיר כלי קיר מסתובב (RWV). שיטת תרבית תאים זו משתמשת בעיקרון של ביטול וקטור הכבידה הממוצע בזמן כדי לדמות מיקרו-כבידה על ידי סיבוב התאים על ציר אופקי. התאים המגודלים בתרבית במערכת זו ניתנים לקציר ולשימוש בניסויים רבים ושונים כדי להעריך את ההשפעות של מיקרו-כבידה מדומה על תפקוד התאים והפיזיולוגיה. טכניקת הטיפוח עשויה להשתנות מעט בהתאם לסוג התא או לקו שבו נעשה שימוש, אך השיטה המתוארת כאן עשויה להיות מיושמת על כל תרבית תאים מסוג תרחיף.
Introduction
הוכח כי טיסות לחלל משפיעות על היבטים רבים של הפיזיולוגיה האנושית, כולל מערכת החיסון. מחקרים רבים הוכיחו עדויות לחוסר ויסות חיסוני כתוצאה מטיסה לחלל in vivo וחשיפה למיקרו-כבידה מדומה (SMG) במבחנה 1,2,3,4. היבט מרכזי אחד של סביבת החלל המשפיע על הפיזיולוגיה האנושית הוא מיקרו-כבידה. מיקרו-כבידה מתייחסת ל"חוסר משקל" הנחווה עקב כוחות כבידה נמוכים בסביבת החלל5. ככל שהאנושות מתכוננת למשימות חלל ארוכות יותר לירח ולמאדים, יש צורך במחקר נוסף כדי להפחית סיכונים בריאותיים חמורים לאסטרונאוטים.
תנאי מיקרו-כבידה אמיתיים למחקר מדעי יכולים להיות מושגים בחלל על סיפון תחנת החלל הבינלאומית (ISS) או בננו-לוויינים המשוגרים למסלול; עם זאת, אפשרויות אלה יכולות להיות יקרות ומורכבות להפליא לתזמור. בהתחשב במגבלות הנוכחיות של ביצוע מחקר ביולוגי בחלל, קיימות מספר אפשרויות לגרימת מיקרו-כבידה אמיתית ו-SMG על כדור הארץ. קיימות פעולות בקנה מידה גדול שיכולות לייצר פרקי זמן קצרים של מיקרו-כבידה אמיתית על כדור הארץ, כולל מגדלי נפילה, טיסה פרבולית ורקטות קול. עם זאת, שיטות אלה אינן מתאימות יתר על המידה לחקר ההשפעות של מיקרו-כבידה על מערכות ביולוגיות, בעיקר בשל פרקי הזמן הקצרים של טיפול במיקרו-כבידה (כלומר, שניות עד 20 דקות). שיטות אלה נידונות ביתר פירוט במקומות אחרים 5,6. אפשרויות המתאימות לתרבית תאים ביולוגית כוללות התקנים בקנה מידה קטן כגון קלינוסטט דו-ממדי או התקני כלי קיר מסתובבים (RWV) וקלינוסטטים תלת-ממדיים או מכונות מיקום אקראיות (RPM). התקנים אלה יכולים להיות מוקמים בתוך אינקובטורים של תרביות תאים המתוחזקים בטמפרטורה של 37°C ו-5% CO2, והם מסובבים את תרבית התאים על ציר אופקי (2D) או על שני צירים ניצבים (3D)5. עם זאת, חשוב להדגיש כי שיטות גידול אלה מייצרות SMG בניגוד למיקרו-כבידה אמיתית, המושגת ביותר במרחב להקשרים של מחקר ביולוגי.
מטרת המאמר הנוכחי היא להתוות את השלבים לחשיפת לימפוציטים ל-SMG באמצעות מכשיר RWV זמין מסחרית (Table of Materials), אשר נופל תחת סיווג קלינוסטט דו-ממדי. אמנם קיים פרוטוקול כללי זמין מהיצרן להפעלת מכשיר זה, אך המאמר הנוכחי נועד לכסות את שלבי פתרון הבעיות והאופטימיזציה בפירוט רב יותר. מאמר זה מכסה גם את התיאוריה מאחורי איך המכשיר הזה עובד כדי לייצר SMG בתרבית תאי השעיה, במיוחד עם לימפוציטים. בהקשר זה, תרבית תאי תרחיף מתייחסת לתאים הגדלים בחופשיות בתרבית משלימה, ללא היצמדות לפיגומים נוספים. סוגי תאים רבים גדלים בתרבית תאי תרחיף, כולל לימפוציטים. לימפוציטים הם תאים של מערכת החיסון, כולל תאי T, B והרג טבעי (NK), השוכנים באיברי הלימפה ובזרם הדם7.
קלינוסטט RWV 2D המתואר כאן פועל על עקרון ביטול וקטור הכבידה הממוצע בזמן 5,6,8,9, לפיו וקטור הכבידה מחולק באופן אקראי באמצעות סיבוב של תרבית התא על ציר אופקי. זה מושג על ידי התאמת מהירות הסיבוב של כלי התרבית למהירות השקיעה של התאים. כל עוד מהירות הסיבוב של כלי התרבית מותאמת היטב למהירות השקיעה של התאים, התאים נשמרים בנפילה חופשית ואינם מסוגלים לשקוע, כפי שחווים בסביבת החלל. לאחר שלב ההאצה הראשוני, המדיה בכלי התרבית מגיעה בסופו של דבר ל"סיבוב גוף מוצק" לאורך זמן. סיבוב אופקי זה גורם גם לזרימה למינרית בכלי תרבית התא. זה יוצר סביבה "נמוכה גזירה", בהתחשב בכך שלחץ הגזירה המושרה על התאים על ידי זרימה למינרית הוא הרבה פחות מזה של זרימה טורבולנטית. עם זאת, בהתחשב בכך שהקלינוסטט אינו מערכת מושלמת, מוצגות כמה תנועות נוזל למינריות קטנות, אשר גורמות ללחץ גזירה מינימלי על התאים. ככאלה, התאים המרחפים במדיה נגררים על ידי זרימה זו במהלך הסיבוב. במהלך סיבוב אופקי, וקטור הכבידה פועל על התאים ומביא אותם למסלול מתנודד, כפי שניתן לראות באיור 1. מקור קטן נוסף של לחץ גזירה נגרם על ידי התאים "נופלים" דרך התקשורת, מה שגורם לזרימה למינרית סביב התאים. כאשר כלי התרבית מסתובב על ציר אופקי, וקטור הכבידה שחווים התאים מסתובב גם כן. עם הזמן, וקטור הכבידה המסתובב הזה מתקרב בממוצע לאפס; תופעה זו נקראת ביטול וקטור כבידה ממוצע זמן וגורמת למצב של SMG 5,6,8,9. מכשיר זה שימש לחקר ההשפעות של SMG על סוגים רבים של תאים, שחלקם מכוסים בהפניות10,11,12. דוגמאות נוספות ניתן למצוא באתר האינטרנט של יצרן המכשיר.
התקן RWV זה משתמש ב"כלי יחס גובה-רוחב גבוה" (HARVs) מיוחדים הזמינים דרך יצרן המכשיר. HARV אלה מחזיקים 10 מ"ל של תרבית תאים כל אחד; עם זאת, 50 מ"ל HARV זמינים גם. ניתן להשתמש ב- HARV של 10 מ"ל או 50 מ"ל בהתאם למספר התאים הדרושים כדי להשלים כל בדיקה ניסיונית במורד הזרם, המתוארת בהמשך פרק הדיון. ה-HARV עשויים מפוליקרבונט וכוללים קרום חמצון סיליקון כדי לאפשר חילופי גזים במהלך תרבית תאים. זה שומר על ה- pH של המדיה התאית ומאפשר נשימה תאית יעילה. יש פתח מילוי ראשי ושתי יציאות מזרק מכוסים על פני הספינה (איור 2A). לאחר טעינת תרבית התאים דרך פתח המילוי הראשי, שני מזרקים נטענים על הכלי כדי לסייע בהסרת הבועות. בעת שימוש בכלי 10 מ"ל, שני מזרקים 3 מ"ל לעבוד טוב. מזרק אחד מחובר למכשיר ריק, כאשר המזרק מדוכא לחלוטין, והשני מחובר מלא ב-3 מ"ל של תרבית תאים (איור 2E). אלה משמשים בשילוב כדי להסיר בועות מן הכלי, אשר חשוב לשמירה על הטיפול SMG. באופן כללי, מומלץ להגדיר שני פקדים שליליים, אשר ניתן לכנות את פקד "Flask" ואת "1G" פקד. בקרת "Flask" מתאימה לתאים הגדלים בצלוחית תרבית תאי תרחיף T25 סטנדרטית. בקרת 1G מתאימה לתאים הגדלים בכלי התרבות המיוחד של 10 מ"ל, אשר פשוט ממוקם באינקובטור (כלומר, מבלי להיות נתון לטיפול SMG). עיין בסעיף דיון לקבלת פרטים נוספים על פקדים.
השיטה המתוארת כאן מתאימה לכל חוקר המעוניין לחקור את ההשפעות של SMG על לימפוציטים, עם התמקדות ספציפית בתאי NK באמצעות קו תאי NK9213. התוצאות ממחקרים אלה עשויות לעזור לנו להבין טוב יותר ולמתן את ההשפעות השליליות של טיסה לחלל על מערכת החיסון האנושית.
Protocol
הערה: יש להשלים את השלבים הבאים בתוך ארון בטיחות ביולוגי סטרילי.
1. הכנת כלי דם לתרבית תאים
- הוציאו את כלי התרבות מאריזות הפלסטיק. תייגו כל כלי על השפה בהתאם לסוג התא / הקו בו נעשה שימוש, האם מדובר בבקרה (1G) או בטיפול (SMG), וכל מידע רלוונטי אחר.
- ייצב את הכלי ופתח את פתח המילוי בזהירות, מבלי לגעת בפתח פתח המילוי יתד/טבעת O. הניחו את הפקק על כרית אתנול, כאשר טבעת היתד/O פונה כלפי מעלה, בזמן שהכלי מתמלא. אין להסיר את הפקקים מיציאות המזרק.
הערה: אם נגעו בטעות בטבעת היתד/O, רססו את יתד הפקק באתנול 70% והניחו לו לשבת (עם הפנים כלפי מעלה) למשך מספר רגעים תוך כדי מילוי הכלי. כאשר אתם מוכנים לסגור שוב את פתח המילוי, הרימו את המכסה עם מגבון נייר טרי כדי לייבש היטב את המכסה לפני שתחזירו אותו לכלי. - לטעון את הכלי עם 10 מ"ל של מדיה מלאה המתאימה עבור תרבית התא באמצעות פיפטה סרולוגית סטרילית, בזהירות להניח את המכסה בחזרה על יציאת המילוי.
הערה: כאן, קו תאי NK92 NK שימש, אשר היה בתרבית מדיה GM1, כפי שאומת בעבר בניסוי קליני באמצעות תאי NK92 כתרפיה תאית14. מדיית התרבית שבה נעשה שימוש תלויה בקו התא או בסוג התא המתורבת בתרבית. בדוק באתר האינטרנט של הספק את מתכון המדיה הנכון עבור קו התא או סוג התא שבשימוש. - ודא כי מכסי יציאת המזרק ויציאת המילוי סגורים היטב, ומקם את הכלים המלאים באינקובטור CO2 של 37 מעלות צלזיוס, 5% תוך ביצוע השלבים הבאים כדי להכין את הכלים לתרבית תאים.
הערה: שלב ראשוני זה עוזר למזער היווצרות בועות גדולות כדי להקל על סילוק בועות מאוחר יותר בשלב 6.
2. הכנת תרבית תאי מלאי למערך הטיפול ב-SMG
- כאשר אינם בשימוש, לאחסן את התאים המעניינים בטמפרטורה נמוכה מ -130 ° C או, באופן אידיאלי, בשלב אדי חנקן נוזלי.
- לפחות שבוע לפני הגדרת הטיפול המתוכנן, הפשירו את התאים ותרבו אותם באמצעות מתכון תרבית התאים המתאים שנמצא באתר האינטרנט של הספק. תכננו כמה תאים דרושים כדי להגדיר את הטיפול (פרטים בהמשך השלבים הבאים) וודאו להתחיל את התרביות מוקדם מספיק כדי לאפשר התרבות מספקת והסתגלות לתרבית.
- אחסנו את תרבית התאים באינקובטור של 37°C, 5% CO2 . פרטים נוספים על פרקטיקת תרבית תאים סטנדרטית מכוסים במקום אחר15.
- ביום של מערך הטיפול המתוכנן ב- SMG, לקבוע את הריכוז ההתחלתי ואת הכדאיות של תרבית התאים הראשונית.
- השתמש בשיטה המועדפת לקביעת ריכוז תרבית התאים הראשונית (למשל, המוציטומטר, ViCell, ציטומטריית זרימה וכו '). שימו לב לריכוז התא הבר-קיימא (תאים למ"ל) ולכדאיות (%) של התאים, וודאו שהכדאיות גבוהה באופן אידיאלי מ-85%. פרוטוקול לשימוש בהמוציטומטר ניתן למצוא במקום אחר16.
- לקבוע את צפיפות/ריכוז זריעת התאים המתאימים לטיפול ב-SMG על ידי התחשבות בטווח ריכוז התאים האופטימלי של סוג/קו התא המסוים, זמן ההכפלה שלהם ומשך הטיפול ב-SMG. אנא עיין בסעיף הדיון להרחבה נוספת.
הערה: מניסיון, טווח הריכוז האופטימלי עבור תאי NK92 הוא בין 0.3 x 10 6- 1.2 x 106 תאים/מ"ל. בדרך כלל, תאים אלה יש זמן הכפלה של 48-72 שעות והם מוזנים כל 2-3 ימים ככזה. בהתחשב בכך שאורך הטיפול היה 72 שעות, התאים נזרעו בקצה התחתון של הטווח האופטימלי שלהם ב 0.4-0.5 x 106 תאים / מ"ל. הספק ממליץ גם על צפיפות זריעה זו בעת התחלת תרבית התאים הראשונית מבקבוקון טרי של תאי NK92. - קבע את נפח תרבית תאי המלאי הדרוש להגדרת הטיפול והבקרות.
הערה: 10 מ"ל של תרבית תאים נדרשים לכל קבוצת ניסוי. אם מוקמות שלוש קבוצות ניסוי (כלומר, טיפול אחד: "SMG", ושתי בקרות שליליות: "Flask" ו- "1G"), 10 מ"ל נוספים של תרבית תאים מספיקים כדי להיכנס לצינור של 15 מ"ל המשמש לטעינת מזרקי HARV. זה 40 מ"ל בסך הכל, אשר עשוי להשתנות בהתאם לתכנון הניסוי הספציפי. - לקבוע את מספר התאים הדרושים כדי להגדיר את הטיפול.
- חשב את מספר התאים הכולל הדרוש על-ידי הכפלת צפיפות הזריעה שנבחרה (תאים/מ"ל) בנפח הכולל הדרוש (מ"ל).
הערה: מניסיון עם NK92, 40 מ"ל של תרבית תאי מלאי מוכנים כמפורט לעיל בריכוז זריעה של 0.4-0.5 x 106 תאים / מ"ל. ככזה, 16-20 x 106 תאי NK92 נדרשים כדי להשלים את מערך הטיפול הטיפוסי. עבור קו התאים NK92, שימוש במעט יותר תאים עדיף על מעט פחות תאים כדי לשמור על כדאיות גבוהה לאורך הטיפול.
- חשב את מספר התאים הכולל הדרוש על-ידי הכפלת צפיפות הזריעה שנבחרה (תאים/מ"ל) בנפח הכולל הדרוש (מ"ל).
- קבע את נפח תרבית התאים הראשונית לסחרור.
- בהינתן שריכוז התאים מיוצג כתאים/מ"ל, חלק את המספר הכולל של תאים (תאים) הדרושים לניסוי בריכוז ההתחלתי הנמדד של תרבית התא (תאים/מ"ל).
הערה: לדוגמה, אם נדרשים 16 x 106 תאים והריכוז ההתחלתי של התרבית הוא 0.8 x 106 תאים / מ"ל, יש לסובב 20 מ"ל של התרבית כלפי מטה.
- בהינתן שריכוז התאים מיוצג כתאים/מ"ל, חלק את המספר הכולל של תאים (תאים) הדרושים לניסוי בריכוז ההתחלתי הנמדד של תרבית התא (תאים/מ"ל).
- בצע את תרבית תאי המלאי הסופית.
- צנטריפוגה את מספר התאים המתאים ב 300 x גרם במשך 8 דקות בצינור חרוטי 50 מ"ל.
- שפכו בזהירות את הסופרנאטנט למיכל פסולת, והעבירו בעדינות את הצינור כדי להשהות מחדש את הגלולה בנפח שאריות קטן.
- השהה מחדש את התאים בנפח המתאים של מדיה שלמה מחוממת (37 ° C) כדי להביא את התרבית לצפיפות הזריעה הרצויה. אמצעי אחסון זה חושב בשלב 2.6.
- סגור היטב את הצינור בנפח 50 מ"ל והפוך אותו בעדינות מספר פעמים כדי לערבב היטב את מתלה התא.
הערה: אם יש צורך ביותר מ-50 מ"ל כדי להגדיר את הניסוי המלא, עדיף לצנטריפוגה את המספר הכולל של התאים הדרושים בצינור חרוטי של 50 מ"ל ולהשהות אותו מחדש במחצית מהנפח הדרוש. לאחר מכן, מערבבים היטב ומבצעים דילול של 1:2 בצינור חרוטי נפרד של 50 מ"ל. לדוגמה, אם יש צורך ב- 100 מ"ל ב- 0.4 x 10 6 תאים / מ"ל, סובב כלפי מטה 40 x 106 תאים בצינור של 50 מ"ל, השהה מחדש ב- 50 מ"ל של מדיה, העבר 25 מ"ל לצינור אחר של 50 מ"ל ולאחר מכן מלא את שניהם ב- 25 מ"ל של מדיה טרייה.
3. העמסת כלי שיט בתרבית תאי מלאי
- הוציאו את כלי השיט מהאינקובטור.
- אם נעשה שימוש בבקרת "צלוחיות", טען בקבוק תרבית תרחיף T25 עם 10 מ"ל של תרבית תאים מהמלאי שהוכן לעיל. כמו כן, הוסף 10 מ"ל של תרבית תאי מלאי לצינור חרוטי נפרד של 15 מ"ל, שישמש לטעינת המזרקים.
- פתחו את פקקי יציאת המזרק כדי להסיר אותם מכלי השיט ולוודא שהסטופקוקים נמצאים במצב פתוח (איור 2C).
- ייצב את הכלי ופתח את פתח המילוי בזהירות, מבלי לגעת בפתח פתח המילוי יתד/טבעת O. הניחו את הפקק על כרית אתנול, כאשר טבעת היתד/O פונה כלפי מעלה, בזמן שהכלי מתמלא. פתח בזהירות את הפקקים מיציאות המזרק.
- ודאו שהסטופקוקים נמצאים במצב פתוח (איור 2C). יוצקים בזהירות את המדיה מהכלי למיכל פסולת, מוציאים את המדיה באמצעות פיפטה סרולוגית, או שואפים אותה באמצעות פיפטת פסטר זכוכית סטרילית המחוברת למערכת הוואקום, מבלי לגעת בקרום החמצון.
- סגור היטב את הצינור החרוטי 50 מ"ל המכיל את תרבית תאי המניות והפוך אותו בעדינות כמה פעמים כדי לערבב היטב את התוכן.
- צייר 10 מ"ל של מלאי תרבית תאים מצינור 50 מ"ל עם פיפטה סרולוגית סטרילית טרייה. הרימו את הכלי והטו אותו כך שפתח המילוי יהיה כלפי מעלה ולאחר מכן הוציאו בזהירות את מלאי תרביות התאים לתוך הכלי דרך פתח המילוי.
הערה: היזהר וצפה בעוצמת הקול כדי שהתרבית לא תישפך דרך יציאות המזרק בעת הטיית הכלי. - המטרה היא למלא את הכלי עד לראש השפה של פתח המילוי מבלי להישפך; הטו את הכלי בחזרה כלפי מטה בזמן שהוא מתמלא כדי למנוע שפיכה. היזהר לא לגעת בקרום החמצון עם פיפטה כפי שהוא שביר מאוד.
הערה: תהליך מילוי כלי השיט עשוי לקחת קצת תרגול; היו סבלניים ולכו לאט. אם נוצר סרט בועות בפתח פתח פתח יציאת המילוי, הדבר יפריע לטעינת כלי השיט. אם זה קורה, פגע בעדינות בכלי כדי לשבור את האטם שנוצר על ידי סרט הבועה. - לאחר העמסת הכלי, הניחו בזהירות את מכסה פתח המילוי בחזרה, וודאו שאין לגעת ביתד/טבעת O.
- מניחים על המזרקים.
הערה: יש שתי יציאות מזרק על פני הכלי (איור 2A). אחד יחזיק מזרק ריק, והשני יחזיק מזרק מלא בתרבית תאים (איור 2E).- ראשית, חבר את המזרק הריק 3 מ"ל לאחת מיציאות המזרק, וודא שהמזרק מדוכא לחלוטין.
הערה: יש לשאוב את המזרקים מספר פעמים לפני חיבורם לכלי מכיוון שהם מעט הדוקים בהתחלה. עשו זאת בתוך ארון הבטיחות הביולוגי כדי לשמור על סטריליות. - סגור היטב את הצינור החרוטי 15 מ"ל עם 10 מ"ל של תרבית תאים aliquoted ולהפוך אותו בעדינות כמה פעמים כדי לערבב היטב את התוכן.
- לאחר מכן, בזהירות חצי לטבול את השני 3 מ"ל מזרק בתרבית התא ולצייר קצת תרבית. כדי למזער את בועת האוויר בחלק העליון של המזרק, לחלוטין לחלק את זה בחזרה לתוך הצינור, ולאחר מכן לצייר 3 מ"ל של התרבית.
- חברו את המזרק המלא ליציאת המזרק הנותרת, וחטאו בזהירות את המזרקים ומסביב לשקע המילוי בעזרת פד אתנול. אין לקבל אתנול על קרום החמצון. עכשיו הספינה מוכנה להיפטר בועות.
הערה: המזרק השני המלא עבור הכלי השני קשה יותר לטעון בהתחשב בעומק של צינור 15 מ"ל. זה עוזר להטות את הצינור תוך כדי מילוי המזרק כדי לשמור על האטימה בין המזרק להיות מלא לבין תרבית התא. - חזור על שלבים 3.3-3.10 עבור הכלים הנותרים. אם נותרה כמות מעט לא מספקת של תרבית תאים בצינור החרוטי של 50 מ"ל עבור הכלי האחרון (למשל, 9.5 מ"ל במקום 10 מ"ל), לשחזר את הכמות הנותרת מהצינור החרוטי 15 מ"ל המשמש לטעינת המזרקים.
הערה: השלבים הבאים אינם צריכים להתבצע בתוך ארון בטיחות ביולוגי סטרילי, מכיוון שכלי השיט הוא כעת מערכת סגורה וסטרילית.
- ראשית, חבר את המזרק הריק 3 מ"ל לאחת מיציאות המזרק, וודא שהמזרק מדוכא לחלוטין.
4. הסרת בועות מהכלים
הערה: בועות הן בלתי נמנעות בתוך מערך זה, ויש להסיר אותן באופן עקבי במהלך הטיפול (איור 3). אנא עיין בסעיף הדיון לקבלת פרטים נוספים על כך.
- ודאו שפקקי יציאת המזרקים נמצאים במצב סגור (איור 2D) כדי להגביל את נדידת התאים והבועות מהמזרקים לתוך כלי הדם. זה חשוב במיוחד בהמשך הטיפול (נדון בהמשך). כדי לאסוף את הבועות הראשוניות, להפוך את הכלי הפוך ולהכות בצד של זה כמה פעמים.
- הפכו במהירות את הכלי לאחור כך שיפנה כלפי מעלה, ואז בזווית קלה כשפניו כלפי חוץ, כך שכל הבועות יצופו לצד העולה של הכלי (איור 3B).
- תמרנו את הבועות מתחת לנמל עם המזרק הריק וצפו בהן מתחילות להיכנס לנמל. פתחו את שני פקקי היציאה של המזרק (איור 2C).
- הכו בעדינות בכלי כדי לעודד את הבועות לצוף אל תוך המזרק הריק. לאט למצוץ את הבועות הגדולות עם מזרק ריק, תוך לחיצה בזהירות על המזרק המלא, כדי לשמור על הלחץ בכלי כך קרום חמצון לא להתפוצץ.
הערה: יהיה צורך לשאוב בועות גדולות יותר, בעוד שניתן לעודד בועות קטנות ומיקרו-בועות לצוף לתוך המזרק על ידי תמרונן לתוך יציאות המזרק ופגיעה עדינה בכלי השיט. לאחר מספר שעות של טיפול, חשוב מאוד למזער את "הזיהום הצולב" בין התאים במזרקים לבין התאים בכלי התרבית. הסיבה לכך היא שהתאים במזרקים אינם מקבלים את אותה כמות של חמצון או חשיפה ל- SMG כמו התאים בכלי הדם. - חזור על שלבים 4.2-4.4 כמה פעמים כדי לוודא שכל הבועות הוסרו. הסר את כל הבועות כולל מיקרו-בועות מכלי הדם.
הערה: ניתן לראות בקלות את הבועות דרך קרום החמצון (גב הכלי) כאשר הכלי מכוון למקור אור (חלון, אור וכו '). בעת ביצוע שלבים 4.2 ו -4.3, התבונן בבועות הנעות מגב הכלי כדי לעזור לדמיין את הבועות הקשות יותר לראייה. - לאחר הסרת הבועות ביעילות, סגור את פקקי יציאת המזרק. יש להשאיר את המזרקים דולקים במהלך הטיפול כדי לאפשר הסרת בועות לאחר מכן, ולהבטיח שהנפח בשני המזרקים יהיה שווה בקירוב.
5. חיבור הכלי לבסיס המסתובב
- נגב בזהירות את פני השטח של הבסיס המסתובב וכבל הסרט עם 70% אתנול.
- ודא שכבל רצועת הכלים המצורף מחובר לספק הכוח. מניחים את הבסיס המסתובב באינקובטור ומחברים את כבל הסרט לבסיס. ודא שספק הכוח נשמר בקרבת האינקובטור אך מחוצה לו. איור 4 מתאר את הבסיס המסתובב ואת ספק הכוח להקשר.
- חבר את כלי הטיפול SMG על ידי יישור חוטי הכלי ליתד המסתובבת וסיבוב עדין של היתד המסתובבת על הבסיס נגד כיוון השעון. ודא שכלי השיט מחובר היטב. ודא כי האינקובטור שומר על קרוב ל -100% לחות על ידי מילוי מגש המים בכמות מספקת של מים באוסמוזה הפוכה (RO) אוטוקלאבית.
- בחר מהירות סיבוב (סל"ד) מתאימה. התאימו את מהירות הסיבוב כך שתתאים למהירות השקיעה של התאים, כך שהתאים לא "ייפלו דרך המדיה" כלל אלא יסתובבו בסופו של דבר במסלול מסלול קטן. תופעה זו מוצגת כתרשים סכמטי באיור 1.
הערה: החברה ממליצה להתחיל את הסיבוב ב 8-10 סל"ד עבור לימפוציטים. במקרה זה, תאי NK92 סובבו במהירות 11 סל"ד, כפי שהודגם במאמר קודם17. בהתאם לגודל התא, יש להגדיל את הסל"ד עבור תאים גדולים יותר ולהקטין עבור תאים קטנים יותר. אותה תבנית חלה אם התאים המשמשים נוטים להתקבץ במהלך התרבית. אנא עיין בסעיף הדיון לקבלת פרטים נוספים על כך.
6. טיפול
- בחר אורך טיפול מתאים ליישום המחקר, אשר עשוי להיות תלוי אילו פרמטרים של תפקוד התא / פיזיולוגיה נבדקים. אנא עיין בסעיף הדיון לקבלת פרטים נוספים על כך.
הערה: במקרה זה, תאי NK92 היו נתונים לטיפול SMG של 72 שעות, בהתבסס על תוצאות ממחקרים קודמים18,19. בועות ייווצרו באופן בלתי נמנע במהלך הטיפול ויהיה צורך להסירן. ניתן לעצור את הסיבוב לזמן קצר ולהפעיל אותו מחדש כדי להקל על כך. ראה שלב 7.1 כיצד להסיר בבטחה את כלי ה- SMG. - ביום הראשון של הגדרת הטיפול, בדוק היווצרות בועות כל כמה שעות על ידי חזרה על שלבים 4.2-4.6. לאחר היום הראשון, בדוק את כלי הדם לפי הצורך (לפחות פעם ביום), חזור על שלבים 4.2-4.6, עד לסיום הטיפול.
7. קצירת תאים מהכלים
- לאחר שחלף אורך הטיפול המתוכנן, עצרו את הסיבוב ופרקו את המנגנון. הסר את כלי הטיפול SMG על ידי החזקת כלי הדם בעדינות נייח תוך סיבוב היתד המסתובבת של המכשיר בכיוון השעון.
- הביאו את בקבוק הבקרה, שלטו בכלי 1G והשתמשו בכלי SMG מטופל לארון בטיחות ביולוגי סטרילי.
- קחו כל כלי (1G ו-SMG בלבד; לא את ה-Flask) והפכו אותו כך שיפנה כלפי מטה והכו בו בעדינות כדי להכניס את כל התאים להשעיה. לאחר מכן, סובב את הכלי על צדו עם פתח המילוי לכיוון החלק התחתון והכה שוב בכלי כדי לעודד את התאים לכיוון פתח המילוי לשאיפה יעילה.
- טפל בכל כלי בנפרד. שחררו את המזרקים משתי היציאות והשליכו אותם לפסולת המסוכנת ביולוגית. פתח את הסטופקוקים ביציאות המזרק.
- בזהירות להסיר את מכסה יציאת מילוי ולצייר את התוכן באמצעות פיפטה סרולוגית סטרילית 10 מ"ל, להטות את הכלי כפי שהוא מתרוקן. הוציאו את התוכן של קבוצות "Flask", "1G" ו- "SMG" לתוך צינורות חרוטיים 15 מ"ל המסומנים בנפרד.
- סגור כל צינור והפוך אותם בעדינות כמה פעמים כדי לוודא שהם מעורבבים כראוי. השתמש בשיטה המועדפת לקביעת הריכוז והכדאיות של תרבית התאים המתקבלת כדי להתכונן לשימוש בבדיקות הניסוי הבאות.
תוצאות
שיטת גידול זו נחשבת מוצלחת אם 1) התפשטות התאים עקבית בקירוב בין קבוצות הביקורת (ובאופן אידיאלי כל קבוצות הניסוי), 2) ההתרבות מתאימה בהתחשב בצפיפות הזריעה, משך הטיפול וזמן ההכפלה של סוג התא/קו, ו-3) הכדאיות של התאים שנקטפו היא 85% ומעלה (טבלה 1 ). באופן אידיאלי, התאים המתקבלים צריכים להיות בריאים כפי שהיו בתרבית תאים סטנדרטית, במיוחד לשימוש בניסויים ובבדיקות הבאות (כלומר, כדאיות של 85% ומעלה). שיטת גידול זו נחשבת כלא מוצלחת אם ההפך הוא הנכון, לפיה התאים המתקבלים מתים, שונים באופן משמעותי בהתרבות בין קבוצות הביקורת, או שיש להם כדאיות תת-אופטימלית סביב 70% או פחות (טבלה 1). התרבות בקבוצת הטיפול ב-SMG עשויה להשתנות או לא להשתנות בהשוואה לבקרות, בהתאם לאופן שבו הטיפול ב-SMG משפיע על הפיזיולוגיה התאית. עם זאת, זו לא הייתה בעיה עד כה, והתפשטות התאים הייתה שווה בקירוב בין קבוצות הביקורת והטיפול (טבלה 1). כאמור, פרמטרים אלה חשובים להצלחת הבדיקות והניסויים במורד הזרם, והתאים המתקבלים משתי קבוצות הביקורת אמורים לתפקד באופן דומה יחסית.
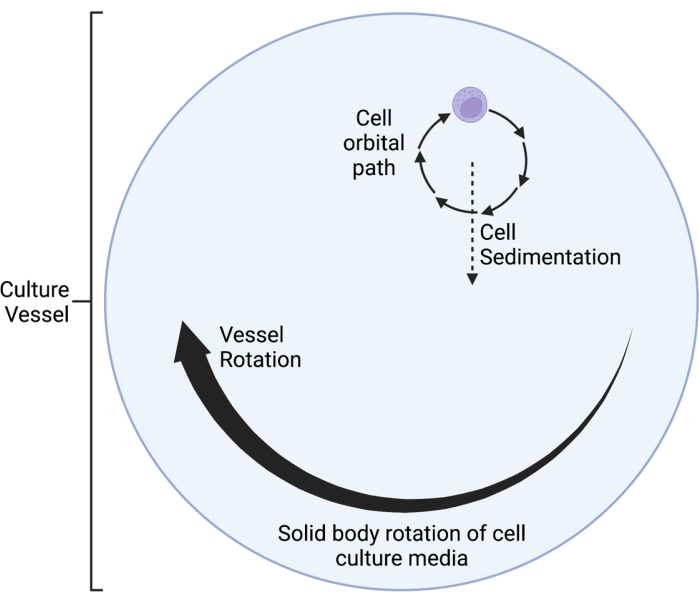
איור 1: דיאגרמה סכמטית של מסלול המסלול המקומי של התאים שגודלו בתרבית בתוך כלי המיקרו-כבידה המדומה (SMG) במהלך הפעולה. קלינוסטט RWV 2D המתואר כאן פועל על עקרון ביטול וקטור הכבידה הממוצע בזמן 5,6,8,9, לפיו וקטור הכבידה מחולק באופן אקראי באמצעות סיבוב של תרבית התא על ציר אופקי. זה מושג על ידי התאמת מהירות הסיבוב של כלי התרבית למהירות השקיעה של התאים. לאחר שלב ההאצה הראשוני, המדיה בכלי התרבית מגיעה בסופו של דבר ל"סיבוב גוף מוצק" לאורך זמן. סיבוב אופקי זה גורם גם לזרימה למינרית בכלי תרבית התא. זה יוצר סביבה "נמוכה גזירה", בהתחשב בכך שלחץ הגזירה המושרה על התאים על ידי זרימה למינרית הוא הרבה פחות מזה של זרימה טורבולנטית. עם זאת, בהתחשב בכך שהקלינוסטט אינו מערכת מושלמת, מוצגות כמה תנועות נוזל למינריות קטנות, אשר גורמות ללחץ גזירה מינימלי על התאים. ככאלה, התאים המרחפים במדיה נגררים על ידי זרימה זו במהלך הסיבוב. במהלך סיבוב אופקי, וקטור הכבידה פועל על התאים ומביא אותם למסלול מתנודד, אשר מוצג כאן. כאשר כלי התרבית מסתובב על ציר אופקי, וקטור הכבידה שחווים התאים מסתובב גם כן. עם הזמן, וקטור הכבידה המסתובב הזה מתקרב בממוצע לאפס; תופעה זו נקראת "ביטול וקטור הכבידה הממוצע בזמן", והיא גורמת למצב של SMG 5,6,8,9. נתון זה שונה מ Castro et al., 201120. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: כלי בעל יחס גובה-רוחב גבוה (HARV) של 10 מ"ל. (A) מבט ממעוף הציפור על ה-HARV, המראה את יציאת המילוי הראשית ושתי יציאות מזרק. (B) גב ה-HARV המציג את יציאת ההברגה לחיבור ה-HARV לבסיס הסיבובי ולקרום החמצון. (C) מבט צדדי על ה-HARV המציג יציאות מזרק פתוחות (מכסות). (D) מבט צדדי על ה-HARV המציג יציאות מזרק סגורות (מכסות). (ה) מבט צדדי על ה-HARV המציג את שני מזרקי 3 מ"ל המחוברים; המזרק השמאלי מלא בתרבית תאים והמזרק הימני ריק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: בועות ב-HARV. (A) מבט ממעוף הציפור על ה-HARV, המראה בועות שיש לסלק מתרבית התא. (B) מבט צדדי על ה-HARV, המראה את אותן בועות. שימו לב כיצד הבועות משתנות בגודלן; יש להסיר גם מיקרו-בועות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: בסיס מסתובב וספק כוח של התקן RWV . (A) מבט קדמי על הבסיס המסתובב, המראה ארבעה יתדות מסתובבות שיכולות להכיל עד ארבעה כלי תרבית. (B) מבט לאחור על הבסיס המסתובב, המציג את הקלט עבור כבל הסרט (לא בתמונה) המקשר בין הבסיס לספק הכוח. (ג) מבט קדמי על ספק הכוח המוחזק על גבי האינקובטור. שימו לב למתג ההפעלה/כיבוי משמאל ולחוגת הכוונון בסל"ד מימין. ספק הכוח מחובר לשקע הקרוב ביותר (בדרך כלל בגב האינקובטור) וכולל קלט לחיבור כבל הסרט לבסיס המסתובב. ספק הכוח נשאר מחוץ לאינקובטור. הבסיס ממוקם בתוך האינקובטור (37 מעלות צלזיוס, 5% CO2) במהלך הפעולה, וכבל הסרט מוזן דרך דלת האינקובטור ומחובר לספק הכוח. כבל הסרט אינו מפריע לחותם האינקובטור. כאשר הבסיס המסתובב אינו בשימוש, יש לשמור אותו מחוץ לאינקובטור, לאחסן בבטחה על ספסל מעבדה או מדף. עיין בטבלת החומרים לקבלת פרטי המכשיר המסחרי שבו נעשה שימוש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| # | כדאיות התחלתית | תאי צפיפות זריעה/מ"ל | כדאיות סופית (F) | כדאיות קצה (1G) | כדאיות קצה (SMG) | תאי End Conc (F)/מ"ל | תאי End Conc (1G)/מ"ל | תאי End Conc (SMG)/מ"ל | הערות | |||||
| כדאיות התחלתית תת-אופטימלית וצפיפות זריעה (תוצאה שלילית) | 1 | 79% | 0.2 x 106 | 67% | 60% | 60% | 0.10 x 106 | 0.075 x 106 | 0.071 x 106 | צפיפות זריעה נמוכה וכדאיות התחלתית תת-אופטימלית הובילו למוות תאים במהלך תקופת הטיפול | ||||
| 2 | 73% | 0.2 x 106 | 43% | 63% | 70% | 0.071 x 106 | 0.081 x 106 | 0.085 x 106 | ||||||
| כדאיות התחלתית אופטימלית וצפיפות זריעה (תוצאה חיובית) | 3 | 93% | 0.4 x 106 | 93% | 93% | 96% | 1.2 x 106 | 1.1 x 106 | 1.5 x 106 | צפיפות זריעה מתאימה וכדאיות התחלתית אופטימלית הובילו לצמיחת תאים בריאה ולכדאיות לאורך כל הטיפול | ||||
| 4 | 92% | 0.4 x 106 | 92% | 92% | 94% | 0.81 x 106 | 0.80 x 106 | 0.70 x 106 | ||||||
טבלה 1: טבלת השוואה המציגה טיפולים לא מוצלחים ומוצלחים במיקרו-כבידה מדומה (SMG). הכדאיות ההתחלתית וצפיפויות הזריעה של NK92 הושוו לכדאיות הסופית ולריכוזי הקצה שהתקבלו לאחר טיפול SMG של 72 שעות באינקובטור תרבית תאים של 37 מעלות צלזיוס בתוספת 5% CO2. הושוו שני מקרים של תוצאות שליליות ושני מקרים של תוצאות חיוביות. לשם השוואה, שימו לב שטווח הריכוז האופטימלי של קו התאים NK92 בו נעשה שימוש היה בין 0.3 x 10 6 תאים/מ"ל לבין 1.2 x 106 תאים/מ"ל, עם זמן הכפלה של כ-2-3 ימים.
Discussion
ככל שהאנושות מתכוננת למשימות חלל ארוכות יותר לירח ולמאדים, יש צורך במחקר נוסף כדי להפחית סיכונים בריאותיים חמורים לאסטרונאוטים. היבט מרכזי אחד של סביבת החלל המשפיע על הפיזיולוגיה האנושית הוא מיקרו-כבידה. כאן, תוארה שיטת תרבית תאים לחשיפת לימפוציטים ל- SMG באמצעות מערכת תרבית תאים סיבובית זמינה מסחרית.
פרוטוקול זה מכיל כמה שלבים קריטיים שייתכן שיהיה צורך למטב בהתאם לסוג התא או לקו שבו נעשה שימוש. אלה כוללים 1) בחירת צפיפות זריעה מתאימה בהתאם לזמן ההכפלה של התאים ואורך הטיפול ב- SMG, ו -2) קביעת אורך טיפול אופטימלי, מהירות סיבוב ובקרות מתאימות. בחירת צפיפות זריעה בטווח הביניים של ריכוזי תאים מתאימים לסוג התא או לקו הנחקר צריכה להספיק. עם זאת, בחירה בצפיפות זריעה נמוכה מדי עלולה להוביל להתרבות תאים נמוכה ולכדאיות נמוכה (טבלה 1), ובחירה בצפיפות גבוהה מדי עלולה להוביל לדלדול מוקדם מדי של חומרי מזון וליכולת קיום נמוכה של תאים. צפיפות הזריעה שנבחרה תלויה גם בזמן ההכפלה של התאים הנחקרים; תאים עם זמן הכפלה קצר יותר עשויים להיזרע בצפיפות נמוכה יותר, ואלה עם זמן הכפלה ארוך יותר עשויים להזדקק לזרע בצפיפות גבוהה יותר. צפיפות הזריעה ואורך הטיפול תלויים גם במספר התאים הדרושים כדי להשלים את הבדיקות הניסיוניות הבאות. מניסיון, זריעת תאי NK92 בעלי יכולת קיימא גבוהה (90%+) ב-0.4-0.5 x 10 6 תאים/מ"ל בכלי דם של 10 מ"ל (כלומר, 4-5 מיליון תאים לכל קבוצת ניסוי; טווח אופטימלי לקו התאים = 0.3 x 10 6-1.2 x 106 תאים/מ"ל, זמן הכפלה = 2-3 ימים) וטיפול בהם במשך 72 שעות הניב בערך 8-15 מיליון תאים (טבלה 1). ככאלה, כלי 10 מ"ל התאימו לקצירת תאים הן לבדיקות פונקציונליות (3 x 10 6 תאים) והן לאיסוף תאים עבור qPCR (1 x 106 תאים) וכתם מערבי (2 x 10 6-6 x 10 6 תאים). ניתן לאסוף סופרנאטנטים גם לניתוח רכיבי הפרשה. עם זאת, 50 מ"ל כלי זמין גם ניתן להשתמש כאשר תפוקת תאים גדולה יותר נדרש. בעת שימוש 50 מ"ל כלי, מזרקים גדולים יותר גם צריך לשמש.
קביעת אורך הטיפול המתאים תהיה תלויה גם בסוג התא / קו בו נעשה שימוש. אם קיימים מחקרים קודמים, יש להפנות אליהם על מנת לבחור משך טיפול מתאים מלכתחילה. כמה מחקרים השתמשו במכשירי RWV לתרבית תאי NK, והם מוזכרים כאן17,18,19. משם, יש לבחון את תוצאות הטיפול או עד כמה התאים התרבו ואת יכולת הקיום שלהם, ואת הביצועים שלהם בבדיקות הניסוי הבאות. ייתכן שניתן יהיה להאריך את משך הטיפול מעבר ל-72 שעות על ידי הוצאת תרבית התאים מכלי הדם לתוך צינור, צנטריפוגה ולאחר מכן השעיה מחדש של התאים ב-10 מ"ל של תרבית שלמה חמה ורעננה, החלפתם בכלי הדם והפעלה מחדש של הסיבוב. עם זאת, זה עלול לגרום לבלבול עקב חשיפה להיפר-כבידה באמצעות צנטריפוגה, ופיצול/דילול התאים עשוי להיות נחוץ כדי להבטיח שהתאים נשמרים בטווח הריכוז האופטימלי שלהם. אם יש להשתמש במולקולות מעוררות כלשהן (כגון LPS, ציטוקינים וכו'), מומלץ להוסיף אותן בריכוז מתאים למתכון המדיה המלא לפני תחילת הטיפול ב-SMG.
הגדרת מהירות סיבוב מתאימה (סל"ד) היא גם המפתח לשמירה על טיפול מיקרו-כבידה מדומה. החברה ממליצה להתחיל במהירות סיבוב בין 8 ל -10 סל"ד בעת גידול לימפוציטים. מניסיון, מהירות של 11 סל"ד עבדה היטב כדי להבטיח שתאי NK92 יישמרו בתרחיף ונעשה בה שימוש במחקר תאי NK17 בעבר. בהתאם לדפוסי הגידול של סוג התא / הקו שבו נעשה שימוש, ייתכן שיהיה צורך להגדיל את מהירות הסיבוב כדי להסביר את התגבשות התא. זה יוביל לשקיעה מוגברת של התאים עקב מסה מוגברת. לקבלת טיפול SMG אופטימלי, יש להתאים את מהירות הסיבוב של כלי התרבית כך שתתאים למהירות השקיעה של התאים 5,6,8,9. במילים אחרות, אין לראות תאים או גושי תאים נופלים דרך התקשורת, והם צריכים להישאר נייחים יחסית.
בהקשר זה, מומלץ לנסות שתי בקרות שליליות על ידי השוואת תאים שגדלו בבקבוק תרבית T25 סטנדרטי ("Flask") ותאים שגדלו ב- HARV המיוחד אך לא היו נתונים ל- SMG (כלומר, רק ממוקמים באינקובטור; "1G"). באופן אידיאלי, ביצועי התאים והתוצאות במבחני ניסוי במורד הזרם בין שתי הבקרות השליליות צריכים להיות דומים. יש לציין כל חוסר עקביות. עבור רוב הבדיקות, ההשוואה הטובה ביותר היא ככל הנראה בין בקרת "1G" לבין טיפול SMG; עם זאת, הכללת פקדי "Flask" ו- "1G" עשויה להועיל להשוואה מספקת ולאופטימיזציה ראשונית.
המגבלות העיקריות של פרוטוקול זה כוללות 1) היווצרות בועות במהלך תרבית תאים, 2) היקף SMG, 3) משך הטיפול האפשרי. חיוני לעקוב אחר היווצרות הבועות במהלך הטיפול ב-SMG. אפילו מיקרו-בועות זעירות יכולות להצטבר, לגדול ולהוביל להיווצרותן של בועות גדולות שמשבשות מאוד. בועות גדולות אלה קוטעות את דינמיקת הנוזלים בעלי הגזירה הנמוכה בתוך כלי התרבית, וגורמות למערבולות מוגברות כאשר זרימת הנוזל מוסטת סביב בועה21. בסופו של דבר, זה משבש לחלוטין את מצב SMG. תופעה זו נידונה באריכות והודגמה על ידי Phelan et al21. בנוסף, חשוב לזכור כי מכשיר זה מייצר SMG ולא מיקרו-כבידה אמיתית כפי שנחווה על סיפון ISS6. עם זאת, מחקרים הראו השפעות דומות של SMG המיוצר על ידי מכשיר זה בהשוואה להשפעות של מיקרו-כבידה אמיתית ממחקרים שבוצעו בתחנת החלל הבינלאומית 1,5,6.
קיימות שיטות חלופיות לחשיפת תרבית תאים ל-SMG. אלה כוללים שימוש בקלינוסטטים תלת-ממדיים או מכונות מיקום אקראיות (RPM) וריחוף דיאמגנטי. קלינוסטטים תלת-ממדיים מסובבים תרבית תאים על שני צירים ניצבים באותה מהירות, בעוד סל"ד מסתובב על שני צירים ניצבים, כאשר הן המהירות והן כיווניות הסיבוב אקראיות 5,6. לכן, בהשוואה לקלינוסטטים דו-ממדיים או מכשירי RWV, סל"ד מורכבים יותר, מה שמציג מספר יתרונות וחסרונות. ראשית, ניתן לווסת את מידת המיקרו-כבידה שניתן להשיג בסל"ד כדי לדמות כבידה חלקית, כמו זו הנחווית על הירח (0.16 גרם) ומאדים (0.33 גרם)6. עם זאת, המורכבות הנוספת של כיווני סיבוב אקראיים ומהירויות עשויה להכניס תנועה קופצנית וכוחות תאוצה, במיוחד לכיוון האזורים החיצוניים של כלי התרבית, מה שעלול להוביל לבלבול בנתונים. ריחוף דיאמגנטי חושף דגימות לשדות מגנטיים דוחים חזקים כדי לנטרל את משקל המים בדגימות ביולוגיות, כדרך לנטרל את כוח הכבידה. עם זאת, השדה המגנטי החזק שנוצר לשם כך עלול גם להשפיע לרעה על התאים, ולכן מציג בלבול לנתונים 5,6. שיטות אלה נידונות ביתר פירוט במקומות אחרים 5,6.
לסיכום, מערכת תרביות התאים הסיבובית הנדונה כאן היא פלטפורמה קלה יחסית לשימוש ונגישה עבור מדענים המעוניינים לחקור את ההשפעות של SMG על לימפוציטים. אמנם יש מגבלות לשיטת תרבית תאים זו, אך היא נותרה אפשרות מעשית לגידול לימפוציטים ואולי תרביות תאי תרחיף אחרות במיקרו-כבידה מדומה.
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכת על ידי סוכנות החלל הקנדית (CSA), מענק מחקר (17ILSRA3, פרופיל חיסוני). המחברים רוצים להכיר ולהודות לד"ר רוקסן פורנייה (אוניברסיטת טורונטו), ד"ר רנדל גרג (אוניברסיטת לינקולן ממוריאל) ופרטש מילבאטולה (אוניברסיטת אריזונה) על עזרתם בפתרון הבעיות הראשוני של פרוטוקול זה.
Materials
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
References
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941 (2021).
- Choukèr, A., Ullrich, O. . The Immune System in Space: Are we Prepared. , (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437 (2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68 (2020).
- Murphy, K., Weaver, C. . Janeway's Immunobiology 9th Edition. , (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022)
- Counting cells using a hemocytometer. Abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6 (2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved