Method Article
回転細胞培養システムを用いた模擬微小重力下でのリンパ球の培養
要約
市販の回転細胞培養システムを用いて、専用の使い捨て培養容器を用いて模擬微小重力下でリンパ球を培養するためのステップバイステップガイドです。この培養方法は、いずれの浮遊型細胞培養にも適用することができる。
要約
宇宙で生物学的研究を行うことの現在の限界を考えると、細胞培養を地球上のシミュレートされた微小重力(SMG)にさらすためのいくつかの選択肢があります。これらのオプションは、方法、原理、および浮遊細胞培養での使用への適合性が異なります。ここでは、2Dクリノスタットまたは回転壁容器(RWV)装置としても知られる市販の回転細胞培養システムを用いて、リンパ球を模擬微小重力に供するための細胞培養方法について説明する。この細胞培養法は、時間平均重力ベクトル無効化の原理を利用して、細胞を水平軸上で回転させることによって微小重力をシミュレートします。このシステムで培養された細胞を回収し、細胞機能と生理機能に対するシミュレートされた微小重力の影響を評価するために、さまざまな実験アッセイで利用することができます。培養技術は、使用する細胞種や系統によって若干異なる場合がありますが、ここで説明する方法は、どのような浮遊型細胞培養にも適用できます。
概要
宇宙飛行は、免疫系を含む人間の生理学の多くの側面に影響を与えることが示されています。多くの研究は、in vivoでの宇宙飛行およびin vitroでのシミュレートされた微小重力(SMG)への曝露の結果としての免疫調節不全の証拠を示しています 1,2,3,4。人間の生理学に影響を与える宇宙環境の主要な側面の1つは、微小重力です。微小重力とは、宇宙環境における低い重力によって経験される「無重力」を指します5。人類が月と火星へのより長い宇宙ミッションの準備をするにつれて、宇宙飛行士の深刻な健康リスクを軽減するためにより多くの研究が行われる必要があります。
科学研究のための実際の微小重力条件は、国際宇宙ステーション(ISS)に搭載された宇宙または軌道に打ち上げられた超小型衛星で達成することができます。ただし、これらのオプションは、調整に非常にコストがかかり、複雑になる可能性があります。宇宙で生物学的研究を行うことの現在の限界を考えると、地球上で実際の微小重力とSMGを誘発するためのいくつかの選択肢が存在します。ドロップタワー、放物線飛行、観測ロケットなど、地球上で短期間の実際の微小重力を生み出すことができる大規模な操作が存在します。しかしながら、これらの方法は、主にそれらの短期間の微小重力処理(すなわち、数秒から20分)のために、生物学的システムに対する微小重力の影響を研究するのにあまり適していない。これらの方法については、他の場所でより詳細に説明されています5,6。生物学的細胞培養に適したオプションには、2Dクリノスタットまたは回転壁容器(RWV)デバイス、3Dクリノスタットまたはランダムポジショニングマシン(RPM)などの小規模デバイスが含まれます。これらのデバイスは、37°Cおよび5%CO2に維持された細胞培養インキュベーター内に設置することができ、水平軸(2D)または2つの垂直軸(3D)5のいずれかで細胞培養を回転させます。ただし、これらの培養方法は、生物学的研究のコンテキストで宇宙で最も実現可能な実際の微小重力とは対照的に、SMGを生成することを強調することが重要です。
現在の論文の目的は、2Dクリノスタット分類に該当する市販のRWVデバイス(材料表)を使用してリンパ球をSMGにさらすための手順を概説することです。このデバイスを操作するための一般的なプロトコルは製造元から入手できますが、現在の記事では、トラブルシューティングと最適化の手順をより詳細に説明することを目的としています。この記事では、このデバイスが浮遊細胞培養、特にリンパ球でSMGを生成するためにどのように機能するかの背後にある理論についても説明します。これに関連して、浮遊細胞培養とは、追加の足場に付着することなく、補充された培養培地中で自由に増殖する細胞を指す。リンパ球を含む多くの細胞型が浮遊細胞培養で増殖します。リンパ球は、T、B、およびナチュラルキラー(NK)細胞を含む免疫系の細胞であり、リンパ器官および血流に存在する7。
ここで説明するRWV 2Dクリノスタットは、時間平均重力ベクトル無効化5,6,8,9の原理に基づいて動作し、重力ベクトルは細胞培養物を水平軸上で回転させることによってランダム化される。これは、培養容器の回転速度を細胞の沈降速度に一致させることによって達成される。培養容器の回転速度が細胞の沈降速度とよく一致している限り、細胞は自由落下に保たれ、宇宙環境で経験したように沈降することはできません。最初のスピードアップ段階の後、培養容器内の培地は最終的に時間の経過とともに「固体回転」に達します。この水平回転はまた、細胞培養容器内の層流を誘導する。これは、層流によって細胞に誘発されるせん断応力が乱流のせん断応力よりもはるかに小さいことを考えると、「低せん断」環境を作り出します。ただし、クリノスタットが完全なシステムではないことを考えると、細胞に与えるせん断応力を最小限に抑える小さな層流運動が導入されています。そのため、培地に浮遊している細胞は、回転中にこの流れによって引きずられます。水平回転中、重力ベクトルは細胞に作用し、図1に示すように細胞を振動軌道に導きます。せん断応力の別の小さな原因は、細胞が培地を通って「落下」し、細胞の周囲に層流を引き起こすことによって引き起こされます。培養容器が水平軸を中心に回転すると、細胞が経験する重力ベクトルも回転します。時間の経過とともに、この回転する重力ベクトルは平均してゼロに近づきます。この現象は時間平均重力ベクトル無効化と呼ばれ、SMG 5,6,8,9の状態を誘発する。この装置は、多くの種類の細胞に対するSMGの影響を研究するために使用されており、そのうちのいくつかは参考文献10、11、12でカバーされています。その他の例は、デバイスの製造元の Web サイトにあります。
このRWVデバイスは、デバイスメーカーから入手できる特殊な「高アスペクト比船舶」(HARV)を使用しています。これらのHARVはそれぞれ10 mLの細胞培養を保持します。ただし、50mLのHARVも入手可能です。10 mLまたは50 mLのHARVは、ダウンストリームの実験アッセイを完了するために必要な細胞数に応じて使用できます。HARVはポリカーボネート製で、細胞培養中のガス交換を可能にするシリコーン酸素化膜を備えています。これにより、細胞培地のpHが維持され、効率的な細胞呼吸が可能になります。容器の表面には、メイン充填ポートと2つのキャップ付きシリンジポートがあります(図2A)。細胞培養物をメイン充填ポートにロードした後、2つのシリンジを容器にロードして、気泡の除去を支援します。10 mL容器を使用する場合は、2つの3 mLシリンジがうまく機能します。一方のシリンジを空のデバイスに取り付け、シリンジを完全に押し下げ、もう一方のシリンジを3 mLの細胞培養液で満たして取り付けます(図2E)。これらは、SMG処理を維持するために重要な容器から気泡を除去するために組み合わせて使用されます。一般に、「フラスコ」コントロールと「1G」コントロールと呼ばれる2つのネガティブコントロールを設定することをお勧めします。「フラスコ」コントロールは、標準的なT25浮遊細胞培養フラスコ中で増殖される細胞に対応する。1Gコントロールは、インキュベーターに入れるだけの特殊な10 mL培養容器内で増殖する細胞に対応します(つまり、SMG処理を受けることなく)。コントロールの詳細については、「ディスカッション」セクションを参照してください。
ここで説明する方法は、NK92細胞株13を使用してNK細胞に特に焦点を当てて、リンパ球に対するSMGの影響を研究しようとしている研究者に適しています。これらの研究の結果は、宇宙飛行が人間の免疫系に及ぼす悪影響をよりよく理解し、軽減するのに役立つ可能性があります。
プロトコル
注意: 次の手順は、滅菌生物学的安全キャビネット内で完了する必要があります。
1.細胞培養用容器の調製
- プラスチック包装から培養容器を取り出します。使用されている細胞タイプ/ライン、コントロール(1G)か治療(SMG)か、およびその他の関連情報に応じて、リムの各血管にラベルを付けます。
- 容器を安定させ、充填ポートキャップのペグ/ Oリングに触れずに、充填ポートを慎重に開きます。容器が満たされている間、ペグ/ Oリングを上に向けて、キャップをエタノールパッドに置きます。シリンジポートからキャップを取り外さないでください。
注意: ペグ/ Oリングに誤って触れた場合は、キャップペグに70%エタノールをスプレーし、容器に充填している間、数分間(上向きに)放置します。充填ポートを再び閉じる準備ができたら、新しい紙のワイプでキャップを持ち上げて完全に乾かしてから、容器に戻します。 - 滅菌血清学的ピペットを使用して、細胞培養に適した完全培地10 mLを容器にロードし、キャップを充填ポートに慎重に戻します。
注:ここでは、NK92細胞を細胞療法として使用する臨床試験で以前に検証されたように、GM1培地で培養されたNK92 NK細胞株を使用しました14。使用する培地は、培養する細胞株または細胞の種類によって異なります。使用されている細胞株または細胞タイプの正しい培地レシピについては、サプライヤーのウェブサイトを確認してください。 - シリンジポートキャップと充填ポートがしっかりと閉じていることを確認し、充填された容器を37°C、5%CO2 インキュベーターに入れながら、細胞培養のために容器をプライミングする後続の手順を実行します。
注意: このプライミングステップは、大きな気泡の形成を最小限に抑え、ステップ6の後半で気泡の排出を容易にするのに役立ちます。
2. SMG処理セットアップのためのストック細胞培養の準備
- 使用しないときは、目的のセルを-130°Cより低い温度で、または理想的には液体窒素気相で保管してください。
- 計画された処理を設定する少なくとも1週間前に、細胞を解凍し、サプライヤーのウェブサイトにある適切な細胞培養培地レシピを使用して培養します。処理のセットアップに必要な細胞数を計画し(詳細は以下のステップで説明します)、十分な増殖と培養への適応を可能にするのに十分な早めに培養を開始するようにしてください。
- 細胞培養物を37°C、5%CO2 インキュベーターに保存した。標準的な細胞培養慣行の詳細については、他の場所で説明されています15。
- 計画されたSMG処理セットアップの日に、初期細胞培養の開始濃度と生存率を決定します。
- 初期細胞培養の濃度を決定するための好ましい方法(例えば、血球計算盤、ViCell、フローサイトメトリーなど)を使用する。細胞の生細胞濃度(mLあたりの細胞数)と生存率(%)に注意し、生存率が理想的には85%を超えていることを確認してください。血球計算盤を使用するためのプロトコルは、他の場所で見つけることができます16。
- 特定の細胞タイプ/株の最適な細胞濃度範囲、それらの倍加時間、およびSMG処理の長さを考慮して、SMG処理のための細胞培養の適切な細胞播種密度/濃度を決定します。詳細については、ディスカッションのセクションを参照してください。
注:経験から、NK92細胞の最適な濃度範囲は0.3 x 10 6-1.2 x10 6細胞/ mLの間です。一般に、これらの細胞は48〜72時間の倍加時間を有し、そのように2〜3日ごとに給餌される。処理時間が72時間であったことを考えると、細胞は、0.4〜0.5 x 106細胞/ mLの最適範囲の下端に播種されました。サプライヤーはまた、NK92細胞の新鮮なバイアルから最初の細胞培養を開始するときに、この播種密度を推奨しています。 - 処理とコントロールのセットアップに必要なストック細胞培養の量を決定します。
注:実験グループごとに10 mLの細胞培養が必要です。3つの実験グループ(すなわち、1つの処理:「SMG」、および2つの陰性対照:「フラスコ」および「1G」)が設定されている場合、HARVシリンジをロードするために使用される15mLチューブに分注するには、さらに10mLの細胞培養で十分です。これは合計40mLであり、特定の実験デザインによって変動する可能性があります。 - 処理のセットアップに必要な細胞数を決定します。
- 選択したシード密度(細胞/ mL)に必要な総容量(mL)を掛けて、必要な細胞の総数を計算します。
注:NK92の経験から、40 mLのストック細胞培養物を上記のように0.4-0.5 x 106 細胞/ mLの播種濃度で調製します。そのため、典型的な治療セットアップを完了するには、16-20 x 106 NK92 細胞が必要です。NK92細胞株の場合、治療全体を通して高い生存率を維持するために、わずかに多くの細胞を使用することは、わずかに少ない細胞よりも優れています。
- 選択したシード密度(細胞/ mL)に必要な総容量(mL)を掛けて、必要な細胞の総数を計算します。
- スピンダウンする初期細胞培養の量を決定します。
- 細胞濃度が細胞/mLで表される場合、実験に必要な細胞(細胞)の総数を、細胞培養の測定開始濃度(細胞/mL)で割ります。
注:たとえば、16 x 10 6細胞が必要で、培養の開始濃度が0.8 x 106細胞/mLの場合、培養液20 mLをスピンダウンする必要があります。
- 細胞濃度が細胞/mLで表される場合、実験に必要な細胞(細胞)の総数を、細胞培養の測定開始濃度(細胞/mL)で割ります。
- 最終的なストック細胞培養を行います。
- 適切な数の細胞を300 x g で50 mLのコニカルチューブで8分間遠心分離します。
- 上清を廃棄物容器に注意深く注ぎ、チューブをそっとフリックして、残りの少量のペレットを再懸濁します。
- 加温した(37°C)完全培地の適切な容量に細胞を再懸濁して、培養物を所望の播種密度にします。このボリュームは、ステップ2.6で計算されました。
- 50 mLチューブにしっかりと蓋をし、数回静かに反転させて細胞懸濁液を完全に混合します。
注:完全な実験をセットアップするために50 mLを超える必要がある場合は、50 mLのコニカルチューブに必要な細胞の総数を遠心分離し、必要な量の半分で再懸濁するのが最善です。次に、よく混合し、別の50 mLコニカルチューブで1:2に希釈します。例えば、0.4 x 10 6 cells/mLで100 mLが必要な場合は、50 mLチューブで40 x 106細胞をスピンダウンし、50 mLの培地に再懸濁し、25 mLを別の50 mLチューブに移してから、両方に25 mLの新鮮な培地を補充します。
3. ストック細胞培養容器の積み込み
- 培地プライミングされた容器をインキュベーターから取り出します。
- 「フラスコ」コントロールを使用している場合は、上記で調製したストックから10 mLの細胞培養液をT25浮遊培養フラスコにロードします。また、10 mLのストック細胞培養液を、シリンジのロードに使用する別の15 mLコニカルチューブに追加します。
- シリンジポートキャップを緩めて容器から取り外し、活栓が開位置にあることを確認します(図2C)。
- 容器を安定させ、充填ポートキャップのペグ/ Oリングに触れずに、充填ポートを慎重に開きます。容器が満たされている間、ペグ/ Oリングを上に向けて、キャップをエタノールパッドに置きます。シリンジポートからキャップを慎重に緩めます。
- 活栓が開位置にあることを確認します(図2C)。容器から廃棄物容器に培地を慎重に注ぎ出すか、血清学的ピペットを使用して培地を除去するか、酸素化膜に触れることなく、真空システムに取り付けられた滅菌ガラスパスツールピペットを使用して吸引します。
- ストック細胞培養物が入っている50 mLのコニカルチューブをしっかりと閉じ、数回静かに反転させて内容物を完全に混合します。
- 新鮮な滅菌血清学的ピペットを使用して、50 mLチューブから10 mLの細胞培養ストックを引き出します。容器を手に取り、充填ポートが上を向くように傾けてから、充填ポートから細胞培養ストックを容器に慎重に分注します。
注意: 容器を傾けている間に培養物がシリンジポートからこぼれないように注意して音量に注意してください。 - こぼさずに容器を充填ポートのリップの上部まで充填することを目指します。こぼれないように、容器が満たされているときに容器を下に傾けます。ピペットで酸素化膜は非常に壊れやすいので触れないように注意してください。
注意: 容器の充填プロセスにはある程度の練習が必要な場合があります。辛抱強く、ゆっくりと進んでください。充填口の開口部に気泡膜が形成されると、容器の積み込みが妨げられます。このような場合は、容器をそっと叩いて、バブルフィルムによって作成されたシールを破ってください。 - 容器が積み込まれたら、ペグ/ Oリングに触れないように、充填ポートキャップを慎重に元に戻します。
- 注射器の上に置きます。
注意: 容器の表面には2つのシリンジポートがあります(図2A)。1つは空のシリンジを保持し、もう1つは細胞培養物で満たされたシリンジを保持します(図2E)。- まず、3 mLの空のシリンジをシリンジポートの1つに取り付け、シリンジが完全に押し下げられていることを確認します。
注意: シリンジは最初は少しきついので、容器に取り付ける前に数回ポンプで送ります。無菌性を維持するために、生物学的安全キャビネット内でこれを行います。 - 15 mLのコニカルチューブを10 mLの分注した細胞培養液でしっかりと閉じ、数回静かに反転させて内容物を完全に混合します。
- 次に、2番目の3 mLシリンジを細胞培養液に注意深く半沈め、培養液を吸い上げます。シリンジ上部の気泡を最小限に抑えるには、これをチューブに完全に分注してから、3 mLの培養液を吸引します。
- 充填されたシリンジを残りのシリンジポートに取り付け、シリンジと充填ポートの周囲をエタノールパッドで慎重に消毒します。酸素化膜にエタノールが付着しないでください。これで、船は泡を取り除く準備が整いました。
注:2番目の容器用の2番目の充填シリンジは、15mLチューブの深さを考えると、ロードがより困難です。シリンジを充填しながらチューブを傾けて、充填されるシリンジと細胞培養との間のシールを維持するのに役立ちます。 - 残りの船舶に対して手順3.3〜3.10を繰り返します。最後の容器の50 mLコニカルチューブに残っている細胞培養量がわずかに不十分な場合(例:10 mLではなく9.5 mL)、シリンジのロードに使用した15 mLコニカルチューブから残りの量を回収します。
注:容器は密閉型の無菌システムであるため、以下の手順は無菌の生物学的安全キャビネット内で行う必要はありません。
- まず、3 mLの空のシリンジをシリンジポートの1つに取り付け、シリンジが完全に押し下げられていることを確認します。
4.容器から気泡を取り除く
注:この設定では気泡は避けられず、治療中一貫して除去する必要があります(図3)。詳細については、ディスカッションのセクションを参照してください。
- シリンジポートの活栓が閉位置にあることを確認し(図2D)、シリンジから血管への細胞と気泡の移動を制限します。これは、治療の後半で特に重要です(以下で説明します)。最初の泡を集めるには、容器をひっくり返して、その側面を数回叩きます。
- 容器をすばやく裏返して上向きにし、次に反対側を向いてわずかな角度で、気泡がすべて容器の上側に浮くようにします(図3B)。
- 空の注射器でポートの下の泡を操作し、それらがポートに入り始めるのを見てください。両方のシリンジポート活栓を開きます(図2C)。
- 容器をそっと叩いて、泡が空の注射器に浮き上がるようにします。空のシリンジで大きな気泡をゆっくりと吸い上げ、シリンジ全体を慎重に押し下げて、酸素化膜が破裂しないように容器内の圧力を維持します。
注:大きな気泡は吸い上げる必要がありますが、小さな気泡やマイクロバブルは、シリンジポートに操作して容器にそっと当たることで、シリンジに浮き上がるように促すことができます。数時間の処理後、シリンジ内の細胞と培養容器内の細胞との間の「交差汚染」を最小限に抑えることが非常に重要です。これは、注射器内の細胞が血管内の細胞と同じ量の酸素化またはSMGへの曝露を受けないためです。 - 手順4.2〜4.4を数回繰り返して、すべての気泡が除去されていることを確認します。マイクロバブルを含むすべての気泡を容器から取り除きます。
注:容器が光源(窓、光など)に向けられている場合、気泡は酸素化膜(容器の背面)を通して簡単に見ることができます。ステップ4.2と4.3を実行するときは、容器の後ろから移動する気泡を見て、見づらい気泡を視覚化します。 - 気泡が効果的に除去されたら、シリンジポート活栓を閉じます。治療中はシリンジをオンのままにして、その後の気泡除去を可能にし、両方のシリンジの容量がほぼ等しくなるようにします。
5.容器を回転ベースに取り付ける
- 回転ベースとリボンケーブルの表面を70%エタノールで慎重に拭きます。
- 付属のリボン ケーブルが電源装置に接続されていることを確認します。回転ベースをインキュベーターに入れ、リボンケーブルをベースに取り付けます。電源がインキュベーターの近くで外側にあることを確認してください。 図4 は、コンテキスト用の回転ベースと電源を示しています。
- 容器の糸を回転ペグに合わせ、ベースの回転ペグを反時計回りにゆっくりと回して、SMG処理容器を取り付けます。容器がしっかりと取り付けられていることを確認してください。インキュベーターが十分なオートクレーブ処理された逆浸透(RO)水で水トレイを満たし、湿度を100%近くに維持していることを確認してください。
- 適切な回転速度(rpm)を選択してください。細胞の沈降速度に合わせて回転速度を調整し、細胞が「媒体を通り抜ける」のではなく、小さな軌道経路で回転するようにします。この現象は、 図1の模式図として視覚化されています。
注:同社は、リンパ球の回転を8〜10 rpmで開始することをお勧めします。この場合、NK92細胞は、以前の論文17で実証されたように、11rpmで回転した。セルサイズに応じて、rpmは大きなセルの場合は増加し、小さなセルの場合は減少する必要があります。使用する細胞が培養中に凝集する傾向がある場合も、同じパターンが適用されます。詳細については、ディスカッションのセクションを参照してください。
6.治療
- 研究アプリケーションに適した治療期間を選択してください, これは、アッセイされている細胞機能/生理学のどのパラメーターに依存する可能性があります.詳細については、ディスカッションのセクションを参照してください。
注:この場合、NK92細胞は、以前の研究の結果に基づいて、72時間のSMG処理を受けました18,19。気泡は治療中に必然的に形成され、除去する必要があります。これを容易にするために、回転を一時的に停止して再開することができます。SMG船舶を安全に取り外す方法については、ステップ7.1を参照してください。 - 処理設定の初日に、手順4.2〜4.6を繰り返して、数時間ごとに気泡の形成を確認します。初日の後、必要に応じて血管をチェックし(少なくとも1日1回)、治療が終了するまでステップ4.2〜4.6を繰り返します。
7.血管から細胞を採取する
- 計画した処理時間が経過したら、回転を停止し、装置を分解します。装置の回転ペグを時計回りに回しながら容器を静かに静止させて、SMG治療容器を取り外します。
- コントロールフラスコ、コントロール1G容器、および処理されたSMG容器を滅菌生物学的安全キャビネットに入れます。
- 各容器(フラスコではなく、1GとSMGのみ)を取り、逆さまにして下向きにし、そっと叩いてすべての細胞を懸濁させます。次に、充填口を下に向けて容器を横向きにし、容器をもう一度叩いて細胞を充填口に向かって促し、効率的な吸引を実現します。
- 各容器を個別に取り扱います。シリンジを2つのポートから外し、バイオハザード廃棄物に処分します。シリンジポートの活栓を開きます。
- 充填ポートキャップを慎重に取り外し、滅菌済みの10 mL血清学的ピペットを使用して内容物を吸引し、容器を空にしながら傾けます。「フラスコ」、「1G」、および「SMG」グループの内容物を、個別にラベル付けされた15mLコニカルチューブに分注します。
- 各チューブを閉じ、数回静かに反転させて、適切に混合されていることを確認します。得られた細胞培養物の濃度および生存率を決定するための好ましい方法を使用して、後続の実験アッセイ内での使用のために調製する。
結果
この培養方法は、1)細胞の増殖が対照群(理想的にはすべての実験群)間でほぼ一貫していること、2)播種密度、処理期間、および細胞の種類/株の倍加時間を考慮して増殖が適切であり、3)採取した細胞の生存率が85%以上である場合に成功と見なされます(表1).理想的には、得られた細胞は、特にその後の実験およびアッセイで使用するために、標準的な細胞培養の場合と同じくらい健康でなければなりません(すなわち、生存率85%以上)。この培養方法は、逆の場合に失敗したと見なされ、その結果、得られた細胞は死滅するか、対照群間で増殖が大幅に異なるか、または約70%以下の生存率が最適ではありません(表1)。SMG治療群における増殖は、SMG治療が細胞生理機能にどのように影響するかに応じて、対照と比較して異なる場合とそうでない場合がある。しかし、これは今日まで問題ではなく、細胞増殖は対照群と治療群でほぼ同等でした(表1)。前述のように、これらのパラメータは下流のアッセイと実験の成功にとって重要であり、2つの対照群から得られた細胞は比較的同じように機能するはずです。
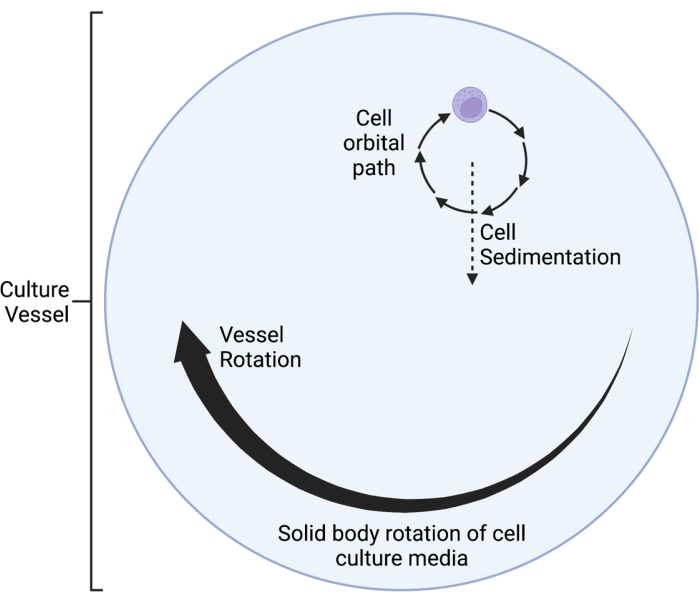
図1:操作中にシミュレートされた微小重力(SMG)容器内で培養された細胞の局在軌道経路の概略図。ここで説明するRWV 2Dクリノスタットは、時間平均重力ベクトル無効化5,6,8,9の原理に基づいて動作し、重力ベクトルは細胞培養物を水平軸上で回転させることによってランダム化される。これは、培養容器の回転速度を細胞の沈降速度に一致させることによって達成される。最初のスピードアップ段階の後、培養容器内の培地は最終的に時間の経過とともに「固体回転」に達します。この水平回転はまた、細胞培養容器内の層流を誘導する。これは、層流によって細胞に誘発されるせん断応力が乱流のせん断応力よりもはるかに小さいことを考えると、「低せん断」環境を作り出します。ただし、クリノスタットが完全なシステムではないことを考えると、細胞に与えるせん断応力を最小限に抑える小さな層流運動が導入されています。そのため、培地に浮遊している細胞は、回転中にこの流れによって引きずられます。水平回転中、重力ベクトルは細胞に作用し、それらを振動軌道に導きます。培養容器が水平軸を中心に回転すると、細胞が経験する重力ベクトルも回転します。時間の経過とともに、この回転する重力ベクトルは平均してゼロに近づきます。この現象は「時間平均重力ベクトル無効化」と呼ばれ、SMG5,6,8,9の状態を誘発します。この図は、Castro et al., 201120から修正されている。BioRender.com で作成。この図の拡大版を表示するには、ここをクリックしてください。

図2:10 mL高アスペクト比容器(HARV)。 (A)HARVの鳥瞰図、メイン充填ポートと2つのシリンジポートを示す。(B)HARVを回転ベースと酸素化膜に接続するためのねじ込み式ポートを示すHARVの背面。(C)開いているシリンジポート(キャップ付き)を示すHARVの側面図。(D)閉じたシリンジポート(キャップ付き)を示すHARVの側面図。(E)取り付けられた2つの3mLシリンジを示すHARVの側面図。左のシリンジは細胞培養物で満たされ、右のシリンジは空です。 この図の拡大版を表示するには、ここをクリックしてください。

図3:HARV内の気泡。 (A)HARVの鳥瞰図、細胞培養物から除去される気泡を示す。(b)同じ気泡を示すHARVの側面図。バブルのサイズがどのように異なるかに注意してください。マイクロバブルも除去する必要があります。この図の拡大版を表示するには、ここをクリックしてください。

図4:RWVデバイスの回転ベースと電源 。 (A)最大4つの培養容器を収容できる4つの回転ペグを示す回転ベースの正面図。(B)ベースと電源をつなぐリボンケーブル(写真には示されていません)の入力を示す回転ベースの背面図。(C)インキュベーターの上部に保持されている電源の正面図。左側のオン/オフスイッチと右側のrpm調整ダイヤルに注意してください。電源は最も近いコンセント(通常はインキュベーターの背面)に差し込まれ、回転ベースに接続するためのリボンケーブルの入力が含まれています。電源はインキュベーターの外側にとどまります。動作中、ベースをインキュベーター(37°C、5%CO2)の内側に配置し、リボンケーブルをインキュベータードアから供給して電源に接続します。リボンケーブルはインキュベーターシールに干渉しません。回転ベースを使用しないときは、インキュベーターの外に保管し、実験台または棚に安全に保管してください。使用する商用デバイスの詳細については、 材料表 を参照してください。 この図の拡大版を表示するには、ここをクリックしてください。
| # | 実行可能性の開始 | 播種密度セル/mL | エンド サビリティ (F) | エンドサビリティ(1G) | エンド サビリティ (SMG) | エンドコンク(F)細胞/mL | エンドコンク(1G)細胞/mL | エンドコンク(SMG)細胞/mL | 筆記 | |||||
| 最適ではない開始生存率と播種密度(否定的な結果) | 1 | 79% | 0.2×106 | 67% | 60% | 60% | 0.10×106 | 0.075×106 | 0.071×106 | 低い播種密度と最適ではない開始生存率は、処理期間中に細胞死をもたらしました | ||||
| 2 | 73% | 0.2×106 | 43% | 63% | 70% | 0.071×106 | 0.081×106 | 0.085×106 | ||||||
| 最適な開始生存率と播種密度(肯定的な結果) | 3 | 93% | 0.4×106 | 93% | 93% | 96% | 1.2×106 | 1.1×106 | 1.5×106 | 適切な播種密度と最適な開始生存率は、治療全体を通して健康な細胞増殖と生存率をもたらしました | ||||
| 4 | 92% | 0.4×106 | 92% | 92% | 94% | 0.81×106 | 0.80×106 | 0.70×106 | ||||||
表1:失敗したシミュレーション微小重力(SMG)処理と成功したシミュレーションマイクログラビティ(SMG)治療を示す比較チャート。 NK92開始生存率および播種密度を、5%CO2を添加した37°C細胞培養インキュベーター中で72時間SMG処理した後に得られた終末生存率および終末濃度と比較した。陰性転帰の2つの事例と陽性転帰の2例を比較した。比較のために、使用したNK92細胞株の最適濃度範囲は0.3 x 10 6細胞/ mLから1.2 x 106細胞/ mLの間であり、倍加時間は約2〜3日であることに注意してください。
ディスカッション
人類が月と火星へのより長い宇宙ミッションの準備をするにつれて、宇宙飛行士の深刻な健康リスクを軽減するためにより多くの研究が行われる必要があります。人間の生理学に影響を与える宇宙環境の主要な側面の1つは、微小重力です。ここでは、市販の回転細胞培養系を用いてリンパ球をSMGに供する細胞培養方法を説明した。
このプロトコルには、使用する細胞の種類や株に応じて最適化する必要があるいくつかの重要なステップが含まれています。これらには、1)細胞の倍加時間とSMG処理の長さに応じて適切な播種密度を選択すること、および2)最適な処理長、回転速度、および適切なコントロールを決定することが含まれます。研究対象の細胞タイプまたは株に適した細胞濃度の中間範囲にある播種密度を選択するだけで十分です。ただし、低すぎる播種密度を選択すると、細胞の増殖と生存率が低くなり(表1)、高すぎる密度を選択すると、栄養素の枯渇が早まり、細胞の生存率が低下する可能性があります。選択された播種密度は、研究されている細胞の倍加時間にも依存します。倍加時間が短い細胞はより低い密度で播種することができ、倍加時間が長い細胞はより高い密度で播種する必要があるかもしれません。播種密度および処理の長さは、その後の実験アッセイを完了するために必要な細胞数にも依存する。経験から、生存率の高い(90%+)NK92細胞を10 mL容器に0.4-0.5 x 106細胞/mLで播種し(すなわち、実験群あたり4〜500万細胞;細胞株の最適範囲= 0.3 x 10 6-1.2 x10 6細胞/mL、倍加時間= 2-3日)、それらを72時間処理すると、約8〜1500万個の細胞が得られました(表1)。そのため、10 mL容器は、機能アッセイ(3 x 10 6細胞)およびqPCR(1 x 10 6細胞)およびウェスタンブロット(2 x 10 6-6 x 10 6細胞)の両方の細胞回収に適していました。分泌成分の分析のために上清を収集することもできます。ただし、50 mLの容器も用意されており、より高い細胞収量が必要な場合に使用できます。50 mL容器を使用する場合は、より大きなシリンジも使用する必要があります。
適切な治療期間の決定は、使用する細胞の種類/株によっても異なります。以前の研究が存在する場合は、最初に適切な治療期間を選択するためにそれらを参照する必要があります。いくつかの研究は、NK細胞を培養するためにRWVデバイスを使用しており、ここで参照されています17,18,19。そこから、治療結果または細胞がどれだけうまく増殖したか、それらの生存率、およびその後の実験アッセイにおけるそれらの性能を調べる必要があります。細胞培養物を容器からチューブに移し、遠心分離してから10 mLの温かく新鮮な完全培養培地に細胞を再懸濁し、容器に入れて回転を再開することにより、処理期間を72時間を超えて延長できる場合があります。ただし、遠心分離による過重力への曝露により交絡因子が発生する可能性があり、細胞を最適な濃度範囲内に保つために細胞の分割/希釈が必要になる場合があります。刺激分子(LPS、サイトカインなど)を使用する場合は、SMG治療を設定する前に、これらを適切な濃度で完全な培地レシピに添加することをお勧めします。
適切な回転数(rpm)を設定することも、模擬微小重力処理を維持するための鍵です。同社は、リンパ球を培養する際に8〜10rpmの回転数から始めることを推奨しています。経験から、11rpmの速度は、NK92細胞が懸濁状態に保たれることを確実にするためにうまく機能し、過去のNK細胞研究17で使用されてきました。使用する細胞の種類/株の成長パターンによっては、細胞の凝集を考慮して回転速度を上げる必要がある場合があります。これは、質量の増加による細胞の沈降の増加につながります。最適なSMG処理のためには、培養容器の回転速度を細胞の沈降速度と一致するように調整しなければならない5、6、8、9。言い換えれば、細胞または細胞塊は培地を通って落下するのを見るべきではなく、それらは比較的静止したままであるべきである。
これに関連して、標準的なT25培養フラスコ(「フラスコ」)で増殖した細胞と、特殊なHARVで増殖したがSMGを受けていない細胞(すなわち、インキュベーターに入れたばかりの細胞)を比較することにより、2つのネガティブコントロールを試すことをお勧めします。"1G")。理想的には、2つのネガティブコントロール間の下流の実験アッセイにおける細胞性能と結果は同等でなければなりません。不整合がある場合は注意が必要です。ほとんどのアッセイでは、「1G」コントロールとSMG処理の間で最良の比較が行われる可能性があります。ただし、「フラスコ」コントロールと「1G」コントロールの両方を含めると、十分な比較と初期最適化に役立つ場合があります。
このプロトコルの主な制限には、1)細胞培養中の気泡形成、2)SMGの程度、および3)可能な治療期間が含まれます。SMG治療全体を通して気泡形成を監視することが重要です。ごくわずかなマイクロバブルでさえ、蓄積、成長し、非常に破壊的なより大きなバブルの形成につながる可能性があります。これらの大きな気泡は、培養容器内の低せん断流体ダイナミクスを中断し、流体の流れが気泡21の周りで偏向されるにつれて乱流を増加させる。最終的に、これはSMG状態を完全に混乱させます。この現象は詳細に議論され、Phelanらによって視覚化されています21。さらに、このデバイスは、ISS6で経験したような実際の微小重力ではなく、SMGを生成することを覚えておくことが重要です。それにもかかわらず、研究は、ISS 1,5,6で行われた研究からの実際の微小重力の影響と比較して、この装置によって生成されたSMGの同様の効果を示しています。
細胞培養をSMGに供するための代替方法が存在します。これらには、3Dクリノスタットまたはランダムポジショニングマシン(RPM)および反磁性浮上の使用が含まれます。3Dクリノスタットは細胞培養物を2つの垂直軸上で同じ速度で回転させ、RPMは2つの垂直軸上で回転するため、回転の速度と方向性の両方がランダム化されます5,6。したがって、2DクリノスタットやRWVデバイスと比較して、RPMはより複雑であり、いくつかの長所と短所があります。まず、RPMで達成できる微小重力の程度を変調して、月(0.16 g)や火星(0.33 g)6で経験するような部分重力をシミュレートすることができます。ただし、ランダム化された回転方向と速度が複雑になると、特に培養容器の外側の領域に向かってジャーク運動と加速力が導入され、データの混乱につながる可能性があります。反磁性浮上は、重力を打ち消す方法として、生物学的サンプル中の水の重量を打ち消すために、サンプルを強い反発磁場にさらします。しかし、そうするために生成される強い磁場も細胞に悪影響を与える可能性があり、したがってデータに交絡因子を導入する可能性があります5,6。これらの方法については、他の場所でより詳細に議論されています5,6。
結論として、ここで説明する市販の回転細胞培養システムは、リンパ球に対するSMGの影響を研究しようとしている科学者にとって、比較的使いやすくアクセスしやすいプラットフォームです。この細胞培養方法には制限がありますが、模擬微小重力下でリンパ球や他の浮遊細胞培養を培養するための実行可能な選択肢です。
開示事項
著者には利益相反はありません。
謝辞
この研究は、カナダ宇宙庁(CSA)の研究助成金(17ILSRA3、免疫プロファイル)によってサポートされています。著者は、このプロトコルの初期トラブルシューティングに協力してくれたRoxanne Fournier博士(トロント大学)、Randal Gregg博士(リンカーン記念大学)、Preteesh Mylabathula博士(アリゾナ大学)に感謝し、感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
参考文献
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941 (2021).
- Choukèr, A., Ullrich, O. . The Immune System in Space: Are we Prepared. , (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437 (2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68 (2020).
- Murphy, K., Weaver, C. . Janeway's Immunobiology 9th Edition. , (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022)
- Counting cells using a hemocytometer. Abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6 (2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved