Method Article
Cultivo de linfocitos en microgravedad simulada utilizando un sistema de cultivo celular rotativo
En este artículo
Resumen
Esta es una guía paso a paso para usar un sistema de cultivo celular rotativo disponible comercialmente para cultivar linfocitos en microgravedad simulada utilizando recipientes de cultivo desechables especializados. Este método de cultivo se puede aplicar a cualquier cultivo celular de tipo suspensión.
Resumen
Dadas las limitaciones actuales de la realización de investigaciones biológicas en el espacio, existen algunas opciones para someter el cultivo celular a microgravedad simulada (SMG) en la Tierra. Estas opciones varían en sus métodos, principios e idoneidad para su uso con cultivo celular en suspensión. Aquí, se describe un método de cultivo celular para someter linfocitos a microgravedad simulada utilizando un sistema de cultivo celular rotativo disponible comercialmente, también conocido como clinostato 2D o dispositivo de vaso de pared giratoria (RWV). Este método de cultivo celular utiliza el principio de anulación del vector de gravedad promediado en el tiempo para simular la microgravedad girando las células sobre un eje horizontal. Las células cultivadas en este sistema se pueden cosechar y utilizar en muchos ensayos experimentales diferentes para evaluar los efectos de la microgravedad simulada en la función celular y la fisiología. La técnica de cultivo puede variar ligeramente dependiendo del tipo de célula o línea que se utilice, pero el método descrito aquí se puede aplicar a cualquier cultivo celular de tipo suspensión.
Introducción
Se ha demostrado que los vuelos espaciales afectan muchos aspectos de la fisiología humana, incluido el sistema inmunológico. Muchos estudios han demostrado evidencia de desregulación inmune como resultado de vuelos espaciales in vivo y exposición a microgravedad simulada (SMG) in vitro1,2,3,4. Un aspecto importante del entorno espacial que afecta la fisiología humana es la microgravedad. La microgravedad se refiere a la "ingravidez" experimentada debido a las bajas fuerzas gravitacionales en el entorno espacial5. A medida que la humanidad se prepara para misiones espaciales más largas a la Luna y Marte, se necesita realizar más investigación para mitigar los graves riesgos para la salud de los astronautas.
Se pueden lograr condiciones reales de microgravedad para la investigación científica en el espacio a bordo de la Estación Espacial Internacional (ISS) o en nanosatélites lanzados en órbita; Sin embargo, estas opciones pueden ser increíblemente costosas y complejas de orquestar. Dadas las limitaciones actuales de la realización de investigaciones biológicas en el espacio, existen varias opciones para inducir microgravedad real y SMG en la Tierra. Existen operaciones a gran escala que pueden producir períodos cortos de microgravedad real en la Tierra, incluidas torres de caída, vuelo parabólico y cohetes de sondeo. Sin embargo, estos métodos no son demasiado adecuados para estudiar los efectos de la microgravedad en los sistemas biológicos, en gran parte debido a sus cortos períodos de tratamiento en microgravedad (es decir, segundos a 20 minutos). Estos métodos se discuten con mayor detalle en otra parte 5,6. Las opciones que son adecuadas para el cultivo celular biológico incluyen dispositivos a pequeña escala como clinostatos 2D o dispositivos de recipiente de pared giratoria (RWV) y clinostatos 3D o máquinas de posicionamiento aleatorio (RPM). Estos dispositivos pueden instalarse dentro de incubadoras de cultivo celular mantenidas a 37 °C y 5% deCO2, y giran el cultivo celular sobre un eje horizontal (2D) o sobre dos ejes perpendiculares (3D)5. Sin embargo, es importante enfatizar que estos métodos de cultivo producen SMG en oposición a la microgravedad real, que se logra de manera más factible en el espacio para contextos de investigación biológica.
El objetivo del presente documento es describir los pasos para someter los linfocitos a SMG utilizando un dispositivo RWV (Tabla de materiales) disponible comercialmente, que cae bajo la clasificación de clinostatos 2D. Si bien existe un protocolo general disponible del fabricante para operar este dispositivo, el artículo actual tiene como objetivo cubrir los pasos de solución de problemas y optimización con más detalle. Este artículo también cubre la teoría detrás de cómo funciona este dispositivo para producir SMG en cultivo celular en suspensión, específicamente con linfocitos. En este contexto, el cultivo celular en suspensión se refiere a las células que crecen libremente en medios de cultivo suplementados, sin adherirse a ningún andamiaje adicional. Muchos tipos de células se cultivan en cultivo celular en suspensión, incluidos los linfocitos. Los linfocitos son células del sistema inmunitario, incluidas las células T, B y asesinas naturales (NK), que residen en los órganos linfoides y en el torrente sanguíneo7.
El clinostato RWV 2D descrito aquí opera según el principio de anulación del vector de gravedad promediado en el tiempo 5,6,8,9, por el cual el vector de gravedad se aleatoriza mediante la rotación del cultivo celular en un eje horizontal. Esto se logra haciendo coincidir la velocidad de rotación del recipiente de cultivo con la velocidad de sedimentación de las células. Mientras la velocidad de rotación del recipiente de cultivo se adapte bien a la velocidad de sedimentación de las células, las células se mantienen en caída libre y no pueden sedimentar, como se experimenta en el entorno espacial. Después de una fase inicial de aceleración, el medio en el recipiente de cultivo finalmente alcanza la "rotación del cuerpo sólido" con el tiempo. Esta rotación horizontal también induce el flujo laminar en el vaso de cultivo celular. Esto crea un ambiente de "bajo cizallamiento", dado que el esfuerzo cortante inducido en las células por el flujo laminar es mucho menor que el del flujo turbulento. Sin embargo, dado que el clinostato no es un sistema perfecto, se introducen algunos pequeños movimientos de fluido laminar, que infligen un esfuerzo cortante mínimo en las células. Como tal, las células suspendidas en el medio son arrastradas por este flujo durante la rotación. Durante la rotación horizontal, el vector de gravedad actúa sobre las células y las lleva a una trayectoria oscilante, como se visualiza en la Figura 1. Otra pequeña fuente de esfuerzo cortante es causada por las células que "caen" a través de los medios, causando un flujo laminar alrededor de las células. A medida que el vaso de cultivo gira sobre un eje horizontal, el vector de gravedad experimentado por las células también gira. Con el tiempo, este vector de gravedad giratorio promedia acercarse a cero; este fenómeno se denomina anulación del vector de gravedad promediada en el tiempo e induce un estado de SMG 5,6,8,9. Este dispositivo se ha utilizado para estudiar los efectos de SMG en muchos tipos de células, algunas de las cuales están cubiertas en las referencias10,11,12. Se pueden encontrar más ejemplos en el sitio web del fabricante del dispositivo.
Este dispositivo RWV utiliza "recipientes de alta relación de aspecto" (HARV) especializados disponibles a través del fabricante del dispositivo. Estos HARV contienen 10 ml de cultivo celular cada uno; sin embargo, también hay disponibles 50 ml de HARV. Se pueden usar HARV de 10 ml o 50 ml dependiendo de cuántas células se necesiten para completar cualquier ensayo experimental posterior, que se describe más adelante en la sección de discusión. Los HARV están hechos de policarbonato e incluyen una membrana de oxigenación de silicona para permitir el intercambio de gases durante el cultivo celular. Esto mantiene el pH de los medios celulares y permite una respiración celular eficiente. Hay un puerto de llenado principal y dos puertos de jeringa tapados en la cara del recipiente (Figura 2A). Después de cargar el cultivo celular a través del puerto de llenado principal, se cargan dos jeringas en el recipiente para ayudar con la eliminación de burbujas. Cuando se usan los vasos de 10 ml, dos jeringas de 3 ml funcionan bien. Una jeringa se conecta al dispositivo vacía, con la jeringa completamente presionada, y la otra se conecta llena con 3 ml de cultivo celular (Figura 2E). Estos se utilizan en combinación para eliminar las burbujas del vaso, lo cual es importante para mantener el tratamiento SMG. En general, se recomienda configurar dos controles negativos, que pueden denominarse control "Flask" y control "1G". El control "Flask" corresponde a las células que se cultivan en un matraz de cultivo celular en suspensión T25 estándar. El control 1G corresponde a células que se cultivan en el recipiente de cultivo especializado de 10 ml, que simplemente se coloca en la incubadora (es decir, sin ser sometido al tratamiento SMG). Consulte la sección Discusión para obtener más detalles sobre los controles.
El método descrito aquí es apropiado para cualquier investigador que busque estudiar los efectos de SMG en los linfocitos, con un enfoque específico en las células NK mediante el uso de la línea celular NK9213. Los resultados de estos estudios pueden ayudarnos a comprender mejor y mitigar los efectos adversos de los vuelos espaciales en el sistema inmunológico humano.
Protocolo
NOTA: Los siguientes pasos deben completarse dentro de un gabinete de seguridad biológica estéril.
1. Preparación de vasos para cultivo celular
- Saque los recipientes de cultivo del embalaje de plástico. Etiquete cada recipiente en el borde de acuerdo con el tipo / línea de celda que se está utilizando, ya sea el control (1G) o el tratamiento (SMG), y cualquier otra información relevante.
- Estabilice el recipiente y abra el puerto de llenado con cuidado, sin tocar la clavija / junta tórica de la tapa del puerto de llenado. Coloque la tapa en una almohadilla de etanol, con la clavija / junta tórica hacia arriba, mientras se llena el recipiente. No retire las tapas de los puertos de la jeringa.
NOTA: Si la clavija / junta tórica se toca accidentalmente, rocíe la clavija de la tapa con etanol al 70% y déjela reposar (mirando hacia arriba) por unos momentos mientras llena el recipiente. Cuando esté listo para cerrar el puerto de llenado nuevamente, recoja la tapa con una toallita de papel nuevo para secar completamente la tapa antes de volver a colocarla en el recipiente. - Cargue el recipiente con 10 ml del medio completo apropiado para el cultivo celular utilizando una pipeta serológica estéril y vuelva a colocar cuidadosamente la tapa en el puerto de llenado.
NOTA: Aquí se utilizó la línea celular NK92 NK, que fue cultivada en medios GM1, como se validó previamente en un ensayo clínico utilizando células NK92 como terapia celular14. Los medios de cultivo utilizados dependen de la línea celular o el tipo de célula que se cultiva. Consulte el sitio web del proveedor para obtener la receta de medios correcta para la línea celular o el tipo de celda que se utiliza. - Asegúrese de que las tapas del puerto de la jeringa y el puerto de llenado estén bien cerrados, y coloque los recipientes llenos en una incubadora de 37 °C, 5% deCO2 mientras realiza los pasos posteriores para preparar los recipientes para el cultivo celular.
NOTA: Este paso de cebado ayuda a minimizar la formación de burbujas grandes para facilitar la expulsión de burbujas más adelante en el paso 6.
2. Preparación del cultivo de células madre para la configuración del tratamiento SMG
- Cuando no estén en uso, almacenar las células de interés a una temperatura inferior a -130 °C o, idealmente, en una fase de vapor de nitrógeno líquido.
- Al menos 1 semana antes de establecer el tratamiento planificado, descongele las células y críquelas utilizando la receta de medios de cultivo celular adecuada que se encuentra en el sitio web del proveedor. Planifique cuántas células se necesitan para establecer el tratamiento (detalles a continuación en los pasos posteriores) y asegúrese de comenzar los cultivos lo suficientemente temprano como para permitir una proliferación y adaptación suficientes al cultivo.
- Almacenar el cultivo celular en una incubadora deCO2 al 5% a 37 °C. Más detalles sobre la práctica estándar de cultivo celular se tratan en otra parte15.
- El día de la configuración planificada del tratamiento SMG, determine la concentración inicial y la viabilidad del cultivo celular inicial.
- Utilice el método preferido para determinar la concentración del cultivo celular inicial (por ejemplo, hemocitómetro, ViCell, citometría de flujo, etc.). Tome nota de la concentración celular viable (células por ml) y la viabilidad (%) de las células, asegurando que la viabilidad sea idealmente superior al 85%. Un protocolo para usar un hemocitómetro se puede encontrar en otra parte16.
- Determinar la densidad/concentración de siembra celular apropiada del cultivo celular para el tratamiento con SMG considerando el rango óptimo de concentración celular del tipo/línea celular particular, su tiempo de duplicación y la duración del tratamiento con SMG. Consulte la sección Discusión para obtener más detalles.
NOTA: Por experiencia, el rango de concentración óptimo para las células NK92 es entre 0,3 x 10 6- 1,2 x 106 células/ml. Generalmente, estas células tienen un tiempo de duplicación de 48-72 h y se alimentan cada 2-3 días como tales. Dado que la duración del tratamiento fue de 72 h, las células se sembraron en el extremo inferior de su rango óptimo a 0,4-0,5 x 106 células/ml. El proveedor también recomienda esta densidad de siembra al iniciar el cultivo celular inicial a partir de un vial fresco de células NK92. - Determinar el volumen de cultivo de células madre que se necesita para configurar el tratamiento y los controles.
NOTA: Se necesitan 10 ml de cultivo celular por grupo experimental. Si se establecen tres grupos experimentales (es decir, un tratamiento: "SMG" y dos controles negativos: "Flask" y "1G"), otros 10 ml de cultivo celular son suficientes para alícuota en un tubo de 15 ml utilizado para cargar las jeringas HARV. Esto es 40 ml en total, que puede fluctuar dependiendo del diseño experimental específico. - Determine el número de células necesarias para establecer el tratamiento.
- Calcule el número total de celdas necesarias multiplicando la densidad de siembra elegida (células/ml) por el volumen total necesario (ml).
NOTA: A partir de la experiencia con NK92, se preparan 40 ml de cultivo de células madre como se detalla anteriormente a una concentración de siembra de 0,4-0,5 x 106 células/ml. Como tal, se necesitan 16-20 x 106 células NK92 para completar la configuración típica del tratamiento. Para la línea celular NK92, usar un poco más de células es mejor que un poco menos de células para mantener una alta viabilidad durante todo el tratamiento.
- Calcule el número total de celdas necesarias multiplicando la densidad de siembra elegida (células/ml) por el volumen total necesario (ml).
- Determine el volumen de cultivo celular inicial para girar.
- Dado que la concentración celular se representa como células/ml, divida el número total de células (células) necesarias para el experimento por la concentración inicial medida del cultivo celular (células/ml).
NOTA: Por ejemplo, si se necesitan 16 x 10 6 células y la concentración inicial del cultivo es de 0,8 x 106 células/ml, se deben hilar 20 ml del cultivo.
- Dado que la concentración celular se representa como células/ml, divida el número total de células (células) necesarias para el experimento por la concentración inicial medida del cultivo celular (células/ml).
- Realice el cultivo celular de stock final.
- Centrifugar el número apropiado de células a 300 x g durante 8 min en un tubo cónico de 50 ml.
- Vierta cuidadosamente el sobrenadante en un recipiente de desechos y mueva suavemente el tubo para resuspender el pellet en el pequeño volumen sobrante.
- Resuspender las células en el volumen apropiado de medios completos calentados (37 °C) para llevar el cultivo a la densidad de siembra deseada. Este volumen se calculó en el paso 2.6.
- Tapa firmemente el tubo de 50 ml e invierta suavemente varias veces para mezclar bien la suspensión celular.
NOTA: Si se necesitan más de 50 ml para configurar el experimento completo, es mejor centrifugar el número total de células necesarias en un tubo cónico de 50 ml y resuspenderlo en la mitad del volumen necesario. Luego, mezcle bien y haga una dilución 1: 2 en un tubo cónico separado de 50 ml. Por ejemplo, si se necesitan 100 ml a 0,4 x 10 6 células/ml, gire 40 x 106 células en un tubo de 50 ml, resuspenda en 50 ml de medio, transfiera 25 ml a otro tubo de 50 ml y luego rellene ambos con 25 ml de medios frescos.
3. Carga de recipientes con cultivo de células madre
- Recupere los recipientes cebados con medios de la incubadora.
- Si se utiliza un control de "matraz", cargar un matraz de cultivo en suspensión T25 con 10 ml de cultivo celular del material preparado anteriormente. Además, agregue 10 ml de cultivo de células madre a un tubo cónico separado de 15 ml, que se utilizará para cargar las jeringas.
- Desenrosque las tapas de los puertos de la jeringa para retirarlas del recipiente y asegúrese de que las llaves de paso estén en posición abierta (Figura 2C).
- Estabilice el recipiente y abra el puerto de llenado con cuidado, sin tocar la clavija / junta tórica de la tapa del puerto de llenado. Coloque la tapa en una almohadilla de etanol, con la clavija / junta tórica hacia arriba, mientras se llena el recipiente. Desenrosque con cuidado las tapas de los puertos de la jeringa.
- Asegúrese de que las llaves de paso estén en la posición abierta (Figura 2C). Vierta cuidadosamente el medio del recipiente en un contenedor de residuos, retire el medio con una pipeta serológica o aspire con una pipeta Pasteur de vidrio estéril conectada al sistema de vacío, sin tocar la membrana de oxigenación.
- Cierre herméticamente el tubo cónico de 50 ml que contiene el cultivo de células madre e invierta suavemente varias veces para mezclar bien el contenido.
- Extraiga 10 ml de material de cultivo celular del tubo de 50 ml con una pipeta serológica estéril fresca. Levante el recipiente e inclínelo de modo que el puerto de llenado esté hacia la parte superior y luego dispense cuidadosamente el material de cultivo celular en el recipiente a través del puerto de llenado.
NOTA: Tenga cuidado y observe el volumen para que el cultivo no se derrame a través de los puertos de la jeringa mientras inclina el recipiente. - Trate de llenar el recipiente hasta la parte superior del borde del puerto de llenado sin derramarse; Incline el recipiente hacia abajo mientras se llena para evitar derrames. Tenga cuidado de no tocar la membrana de oxigenación con la pipeta, ya que es muy frágil.
NOTA: El proceso de llenado del recipiente puede requerir algo de práctica; Sea paciente y vaya despacio. Si se forma una película de burbujas en la abertura del puerto de llenado, esto interferirá con la carga del recipiente. Si esto sucede, golpee suavemente el recipiente para romper el sello creado por la película de burbujas. - Una vez que el recipiente esté cargado, vuelva a colocar con cuidado la tapa del puerto de llenado, asegurándose de no tocar la clavija / junta tórica.
- Colocar en las jeringas.
NOTA: Hay dos puertos de jeringa en la cara del recipiente (Figura 2A). Uno sostendrá una jeringa vacía y el otro sostendrá una jeringa llena de cultivo celular (Figura 2E).- Primero, conecte la jeringa vacía de 3 ml a uno de los puertos de la jeringa, asegurándose de que la jeringa esté completamente presionada.
NOTA: Bombee las jeringas varias veces antes de conectarlas al recipiente, ya que están un poco apretadas al principio. Haga esto dentro del gabinete de seguridad biológica para mantener la esterilidad. - Cierre herméticamente el tubo cónico de 15 ml con 10 ml de cultivo celular alícitado e invierta suavemente varias veces para mezclar bien el contenido.
- A continuación, semisumerga cuidadosamente la segunda jeringa de 3 ml en el cultivo celular y elabora un poco de cultivo. Para minimizar la burbuja de aire en la parte superior de la jeringa, dispense completamente en el tubo y luego extraiga 3 ml del cultivo.
- Conecte la jeringa llena al puerto de la jeringa restante y desinfecte cuidadosamente las jeringas y alrededor del puerto de llenado con una almohadilla de etanol. No obtenga etanol en la membrana de oxigenación. Ahora el recipiente está listo para deshacerse de las burbujas.
NOTA: La segunda jeringa llena para el segundo recipiente es más difícil de cargar dada la profundidad del tubo de 15 ml. Ayuda a inclinar el tubo mientras se llena la jeringa para mantener el sello entre la jeringa que se está llenando y el cultivo celular. - Repita los pasos 3.3-3.10 para los recipientes restantes. Si queda una cantidad ligeramente insuficiente de cultivo celular en el tubo cónico de 50 ml para el último vaso (p. ej., 9,5 ml en lugar de 10 ml), recupere la cantidad restante del tubo cónico de 15 ml utilizado para cargar las jeringas.
NOTA: No es necesario que los siguientes pasos se realicen dentro de un gabinete de seguridad biológica estéril, ya que el recipiente ahora es un sistema cerrado y estéril.
- Primero, conecte la jeringa vacía de 3 ml a uno de los puertos de la jeringa, asegurándose de que la jeringa esté completamente presionada.
4. Eliminación de burbujas de los recipientes
NOTA: Las burbujas son inevitables dentro de esta configuración y deben eliminarse constantemente durante todo el tratamiento (Figura 3). Consulte la sección Discusión para obtener más detalles sobre esto.
- Asegúrese de que las llaves de paso del puerto de la jeringa estén en la posición cerrada (Figura 2D) para limitar la migración de células y burbujas de las jeringas a los vasos. Esto es especialmente importante más adelante durante el tratamiento (discutido a continuación). Para recoger las burbujas iniciales, voltee el recipiente boca abajo y golpee el costado varias veces.
- Voltee rápidamente el recipiente hacia atrás para mirar hacia arriba y luego en un ligero ángulo hacia otro lado para que todas las burbujas floten hacia el lado hacia arriba del recipiente (Figura 3B).
- Maniobra las burbujas debajo del puerto con la jeringa vacía y observa cómo comienzan a entrar en el puerto. Abra ambas llaves de paso del puerto de la jeringa (Figura 2C).
- Golpee suavemente el recipiente para alentar a las burbujas a flotar en la jeringa vacía. Aspire lentamente las burbujas más grandes con la jeringa vacía, mientras presiona cuidadosamente la jeringa llena, para mantener la presión en el recipiente para que la membrana de oxigenación no se rompa.
NOTA: Será necesario aspirar burbujas más grandes, mientras que se puede alentar a las burbujas pequeñas y microburbujas a flotar en la jeringa maniobrando en los puertos de la jeringa y golpeando suavemente el recipiente. Después de unas horas de tratamiento, es muy importante minimizar la "contaminación cruzada" entre las células en las jeringas y las células en el vaso de cultivo. Esto se debe a que las células en las jeringas no reciben la misma cantidad de oxigenación o exposición a SMG que las células en el vaso. - Repita los pasos 4.2-4.4 varias veces para asegurarse de que se eliminan todas las burbujas. Retire todas las burbujas, incluidas las microburbujas, de los vasos.
NOTA: Las burbujas se pueden ver fácilmente a través de la membrana de oxigenación (parte posterior del recipiente) cuando el recipiente apunta a una fuente de luz (ventana, luz, etc.). Al realizar los pasos 4.2 y 4.3, observe las burbujas que se mueven desde la parte posterior del recipiente para ayudar a visualizar las burbujas más difíciles de ver. - Cuando las burbujas se hayan eliminado eficazmente, cierre las llaves de paso del puerto de la jeringa. Mantenga las jeringas puestas durante el tratamiento para permitir la posterior eliminación de burbujas, asegurando que el volumen en ambas jeringas sea aproximadamente igual.
5. Fijación del recipiente a la base giratoria
- Limpie cuidadosamente la superficie de la base giratoria y el cable de cinta con etanol al 70%.
- Asegúrese de que el cable de cinta incluido esté conectado a la fuente de alimentación. Coloque la base giratoria en la incubadora y fije el cable de cinta a la base. Asegúrese de que la fuente de alimentación se mantenga cerca pero fuera de la incubadora. La Figura 4 muestra la base giratoria y la fuente de alimentación para el contexto.
- Fije el recipiente de tratamiento SMG alineando las roscas del recipiente a la clavija giratoria y girando suavemente la clavija giratoria en la base en sentido contrario a las agujas del reloj. Asegúrese de que el recipiente esté bien sujeto. Asegúrese de que la incubadora mantenga una humedad cercana al 100% llenando la bandeja de agua con suficiente agua de ósmosis inversa (RO) en autoclave.
- Elija una velocidad de rotación adecuada (rpm). Ajuste la velocidad de rotación para que coincida con la velocidad de sedimentación de las células, de modo que las células no "caigan a través del medio" en absoluto, sino que terminen girando en una pequeña trayectoria orbital. Este fenómeno se visualiza como un diagrama esquemático en la Figura 1.
NOTA: La compañía recomienda comenzar la rotación a 8-10 rpm para los linfocitos. En este caso, las células NK92 se rotaron a 11 rpm, como se demostró en un artículo anterior17. Dependiendo del tamaño de la célula, las rpm deben aumentarse para las células más grandes y disminuir para las células más pequeñas. El mismo patrón se aplica si las células utilizadas tienden a agruparse durante el cultivo. Consulte la sección Discusión para obtener más detalles al respecto.
6. Tratamiento
- Elija una duración de tratamiento adecuada para la aplicación de investigación, que puede depender de qué parámetros de función / fisiología celular se están ensayando. Consulte la sección Discusión para obtener más detalles al respecto.
NOTA: En este caso, las células NK92 fueron sometidas a un tratamiento SMG de 72 h, basado en resultados de estudios previos18,19. Las burbujas se formarán inevitablemente durante todo el tratamiento y deberán eliminarse. La rotación se puede detener brevemente y reiniciar para facilitar esto. Consulte el paso 7.1 para saber cómo extraer de forma segura el recipiente SMG. - El primer día de configuración del tratamiento, verifique la formación de burbujas cada pocas horas repitiendo los pasos 4.2-4.6. Después del primer día, revise los vasos según sea necesario (al menos una vez al día), repitiendo los pasos 4.2-4.6, hasta el final del tratamiento.
7. Recolección de células de los vasos
- Una vez transcurrida la duración prevista del tratamiento, detenga la rotación y desmonte el aparato. Retire el recipiente de tratamiento SMG sosteniendo suavemente el recipiente estacionario mientras gira la clavija giratoria del dispositivo en el sentido de las agujas del reloj.
- Introduzca el matraz de control, el recipiente de control 1G y el recipiente SMG tratado en un armario de seguridad biológica estéril.
- Tome cada recipiente (solo 1G y SMG; no el Flask) y voltéelo boca abajo para que mire hacia abajo y golpee suavemente para que todas las celdas entren en suspensión. Luego, gire el recipiente de lado con el puerto de llenado hacia la parte inferior y golpee el recipiente nuevamente para alentar las celdas hacia el puerto de llenado para una aspiración eficiente.
- Maneje cada embarcación individualmente. Desenrosque las jeringas de los dos puertos y deséchelas en los residuos de riesgo biológico. Abra las llaves de paso en los puertos de la jeringa.
- Retire con cuidado la tapa del puerto de llenado y extraiga el contenido con una pipeta serológica estéril de 10 ml, inclinando el recipiente a medida que se vacía. Dispense el contenido de los grupos "Flask", "1G" y "SMG" en tubos cónicos de 15 ml etiquetados individualmente.
- Cierre cada tubo e invierta suavemente varias veces para asegurarse de que estén bien mezclados. Utilice el método preferido para determinar la concentración y viabilidad del cultivo celular resultante para prepararse para su uso en ensayos experimentales posteriores.
Resultados
Este método de cultivo se considera exitoso si 1) la proliferación de las células es aproximadamente consistente en todos los grupos de control (e idealmente en todos los grupos experimentales), 2) la proliferación es apropiada dada la densidad de siembra, la duración del tratamiento y el tiempo de duplicación del tipo / línea celular, y 3) la viabilidad de las células cosechadas es del 85% o más (Tabla 1 ). Idealmente, las células resultantes deberían estar tan sanas como lo serían en el cultivo celular estándar, especialmente para su uso en experimentos y ensayos posteriores (es decir, viabilidad del 85% o más). Este método de cultivo se considera infructuoso si ocurre lo contrario, por lo que las células resultantes mueren, difieren sustancialmente en la proliferación entre los grupos de control o tienen una viabilidad subóptima de alrededor del 70% o menos (Tabla 1). La proliferación en el grupo de tratamiento con SMG puede o no diferir en comparación con los controles, dependiendo de cómo el tratamiento con SMG afecta la fisiología celular. Sin embargo, esto no ha sido un problema hasta la fecha, y la proliferación celular fue aproximadamente igual en todos los grupos de control y tratamiento (Tabla 1). Como se mencionó anteriormente, estos parámetros son importantes para el éxito de los ensayos y experimentos posteriores, y las células resultantes de los dos grupos de control deberían funcionar de manera relativamente similar.
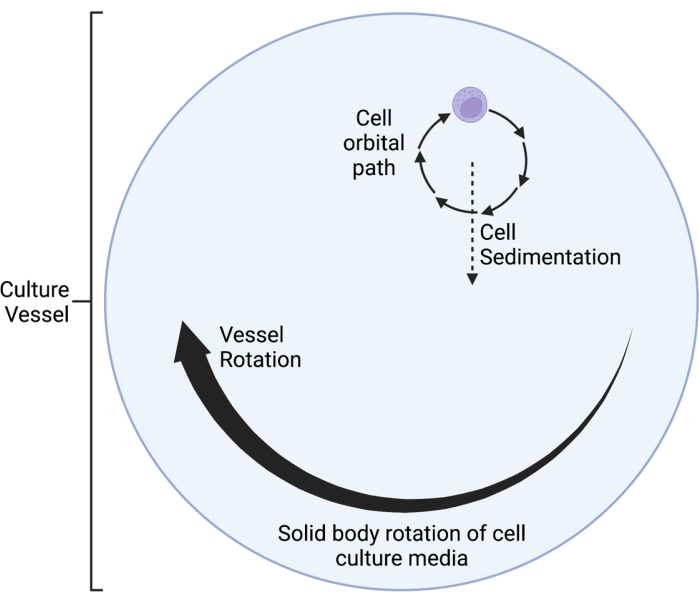
Figura 1: Diagrama esquemático de la trayectoria orbital localizada de las células cultivadas dentro del recipiente de microgravedad simulada (SMG) durante la operación. El clinostato RWV 2D descrito aquí opera según el principio de anulación del vector de gravedad promediado en el tiempo 5,6,8,9, por el cual el vector de gravedad se aleatoriza mediante la rotación del cultivo celular en un eje horizontal. Esto se logra haciendo coincidir la velocidad de rotación del recipiente de cultivo con la velocidad de sedimentación de las células. Después de una fase inicial de aceleración, el medio en el recipiente de cultivo finalmente alcanza la "rotación del cuerpo sólido" con el tiempo. Esta rotación horizontal también induce el flujo laminar en el vaso de cultivo celular. Esto crea un ambiente de "bajo cizallamiento", dado que el esfuerzo cortante inducido en las células por el flujo laminar es mucho menor que el del flujo turbulento. Sin embargo, dado que el clinostato no es un sistema perfecto, se introducen algunos pequeños movimientos de fluido laminar, que infligen un esfuerzo cortante mínimo en las células. Como tal, las células suspendidas en el medio son arrastradas por este flujo durante la rotación. Durante la rotación horizontal, el vector de gravedad actúa sobre las células y las lleva a una trayectoria oscilante, que se visualiza aquí. A medida que el vaso de cultivo gira sobre un eje horizontal, el vector de gravedad experimentado por las células también gira. Con el tiempo, este vector de gravedad giratorio promedia acercarse a cero; este fenómeno se denomina "anulación del vector de gravedad promediada en el tiempo" e induce un estado de SMG 5,6,8,9. Esta figura ha sido modificada de Castro et al., 201120. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Recipiente de alta relación de aspecto (HARV) de 10 ml. (A) Vista aérea del HARV, que muestra el puerto de llenado principal y dos puertos de jeringa. (B) Parte posterior del HARV que muestra el puerto atornillado para conectar el HARV a la base giratoria y a la membrana de oxigenación. (C) Vista lateral del HARV que muestra los puertos de jeringa abiertos (tapados). (D) Vista lateral del HARV que muestra los puertos cerrados de la jeringa (tapados). (E) Vista lateral del HARV que muestra las dos jeringas de 3 ml conectadas; La jeringa izquierda se llena con cultivo celular y la jeringa derecha está vacía. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Burbujas en el HARV. (A) Vista aérea del HARV, mostrando burbujas que deben eliminarse del cultivo celular. (B) Vista lateral del HARV, mostrando las mismas burbujas. Tenga en cuenta cómo las burbujas varían en tamaño; Las microburbujas también deben eliminarse. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Base giratoria y fuente de alimentación del dispositivo RWV . (A) Vista frontal de la base giratoria, que muestra cuatro clavijas giratorias que pueden acomodar hasta cuatro recipientes de cultivo. (B) Vista posterior de la base giratoria, que muestra la entrada para el cable de cinta (no en la imagen) que une la base y la fuente de alimentación. (C) Vista frontal de la fuente de alimentación mantenida en la parte superior de la incubadora. Tenga en cuenta el interruptor de encendido / apagado a la izquierda y el dial de ajuste de rpm a la derecha. La fuente de alimentación se conecta a la toma de corriente más cercana (generalmente en la parte posterior de la incubadora) e incluye una entrada para que el cable de cinta se conecte a la base giratoria. La fuente de alimentación permanece fuera de la incubadora. La base se coloca dentro de la incubadora (37 °C, 5%CO2) durante el funcionamiento, y el cable de cinta se alimenta a través de la puerta de la incubadora y se conecta a la fuente de alimentación. El cable de cinta no interfiere con el sello de la incubadora. Cuando la base giratoria no está en uso, debe mantenerse fuera de la incubadora, almacenada de forma segura en un banco o estante de laboratorio. Consulte la Tabla de materiales para obtener detalles del dispositivo comercial utilizado. Haga clic aquí para ver una versión más grande de esta figura.
| # | Viabilidad inicial | Densidad de siembra células/mL | Viabilidad final (F) | Viabilidad final (1G) | Viabilidad final (SMG) | Células conc (F) finales/ml | Conc final (1G) células/ml | Células Conc Finales (SMG)/ml | Notas | |||||
| Viabilidad inicial subóptima y densidad de siembra (resultado negativo) | 1 | 79% | 0,2 x 106 | 67% | 60% | 60% | 0,10 x 106 | 0,075 x 106 | 0,071 x 106 | La baja densidad de siembra y la viabilidad inicial subóptima condujeron a la muerte celular en el transcurso del período de tratamiento. | ||||
| 2 | 73% | 0,2 x 106 | 43% | 63% | 70% | 0,071 x 106 | 0,081 x 106 | 0,085 x 106 | ||||||
| Viabilidad inicial óptima y densidad de siembra (resultado positivo) | 3 | 93% | 0,4 x 106 | 93% | 93% | 96% | 1,2 x 106 | 1,1 x 106 | 1,5 x 106 | La densidad de siembra adecuada y la viabilidad inicial óptima condujeron a un crecimiento celular saludable y a la viabilidad durante todo el tratamiento. | ||||
| 4 | 92% | 0,4 x 106 | 92% | 92% | 94% | 0,81 x 106 | 0,80 x 106 | 0,70 x 106 | ||||||
Tabla 1: Tabla comparativa que muestra tratamientos de microgravedad simulada (SMG) exitosos y sin éxito. La viabilidad inicial y las densidades de siembra de NK92 se compararon con la viabilidad final resultante y las concentraciones finales después de un tratamiento SMG de 72 h en una incubadora de cultivo celular a 37 °C suplementada con 5% deCO2. Se compararon dos casos de resultados negativos y dos casos de resultados positivos. A modo de comparación, tenga en cuenta que el rango de concentración óptimo de la línea celular NK92 utilizada fue entre 0,3 x 10 6 células/ml y 1,2 x 106 células/ml, con un tiempo de duplicación de alrededor de 2-3 días.
Discusión
A medida que la humanidad se prepara para misiones espaciales más largas a la Luna y Marte, se necesita realizar más investigación para mitigar los graves riesgos para la salud de los astronautas. Un aspecto importante del entorno espacial que afecta la fisiología humana es la microgravedad. Aquí, se ha descrito un método de cultivo celular para someter linfocitos a SMG utilizando un sistema de cultivo celular rotativo disponible comercialmente.
Este protocolo contiene algunos pasos críticos que pueden necesitar ser optimizados dependiendo del tipo de celda o línea que se utiliza. Estos incluyen 1) elegir una densidad de siembra adecuada dependiendo del tiempo de duplicación de las células y la duración del tratamiento con SMG, y 2) determinar una duración óptima del tratamiento, la velocidad de rotación y los controles apropiados. Debería bastar con elegir una densidad de siembra que esté en el rango medio de concentraciones celulares apropiadas para el tipo o línea celular que se está estudiando. Sin embargo, elegir una densidad de siembra que sea demasiado baja puede conducir a una baja proliferación celular y viabilidad (Tabla 1), y elegir una densidad que sea demasiado alta puede conducir al agotamiento prematuro de nutrientes y a una baja viabilidad celular. La densidad de siembra elegida también depende del tiempo de duplicación de las células que se están estudiando; Las células con un tiempo de duplicación más corto pueden ser sembradas a una densidad más baja, y aquellas con un tiempo de duplicación más largo pueden necesitar ser sembradas a una densidad más alta. La densidad de siembra y la duración del tratamiento también dependen de cuántas células se necesitan para completar los ensayos experimentales posteriores. Por experiencia, la siembra de células NK92 altamente viables (90% +) a 0.4-0.5 x 10 6 células / ml en vasos de 10 ml (es decir, 4-5 millones de células por grupo experimental; rango óptimo para la línea celular = 0.3 x 10 6-1.2 x 106 células / ml, tiempo de duplicación = 2-3 días) y tratarlas durante 72 h ha producido aproximadamente 8-15 millones de células (Tabla 1). Como tal, los vasos de 10 ml fueron apropiados para la recolección de células tanto para ensayos funcionales (3 x 10 6 células) como para células recolectoras para qPCR (1 x 10 6 células) y Western blot (2 x 106-6 x 10 6 células). Los sobrenadantes también se pueden recolectar para el análisis de los componentes secretores. Sin embargo, también hay recipientes de 50 ml disponibles y se pueden usar cuando se requiere un mayor rendimiento celular. Cuando se usan vasos de 50 ml, también se deben usar jeringas más grandes.
La determinación de una duración de tratamiento adecuada también dependerá del tipo / línea celular que se utilice. Si existen estudios previos, se debe hacer referencia a ellos para elegir una duración de tratamiento adecuada para comenzar. Algunos estudios han utilizado dispositivos RWV para cultivar células NK, y se hace referencia aquí17,18,19. A partir de ahí, se deben examinar los resultados del tratamiento o qué tan bien proliferaron las células y su viabilidad, y su rendimiento en ensayos experimentales posteriores. Puede ser posible extender la duración del tratamiento más allá de 72 h retirando el cultivo celular de los vasos en un tubo, centrifugando y luego resuspendiendo las células en 10 ml de medios de cultivo completos calientes y frescos, reemplazándolos en los vasos y reiniciando la rotación. Sin embargo, esto puede introducir factores de confusión debido a la exposición a la hipergravedad a través de la centrifugación, y puede ser necesario dividir / diluir las células para garantizar que las células se mantengan dentro de su rango de concentración óptimo. Si se van a utilizar moléculas estimuladoras (por ejemplo, LPS, citoquinas, etc.), se recomienda que se agreguen a una concentración adecuada a la receta completa del medio antes de configurar el tratamiento SMG.
Establecer una velocidad de rotación adecuada (rpm) también es clave para mantener el tratamiento de microgravedad simulado. La compañía recomienda comenzar con una velocidad de rotación entre 8 y 10 rpm cuando se cultivan linfocitos. Por experiencia, una velocidad de 11 rpm ha funcionado bien para garantizar que las células NK92 se mantengan en suspensión y se ha utilizado en un estudio anterior de células NK17. Dependiendo de los patrones de crecimiento del tipo de célula / línea que se utiliza, puede ser necesario aumentar la velocidad de rotación para tener en cuenta la aglutinación celular. Esto conduciría a una mayor sedimentación de las células debido al aumento de la masa. Para un tratamiento óptimo con SMG, la velocidad de rotación del recipiente de cultivo debe ajustarse para que coincida con la velocidad de sedimentación de las células 5,6,8,9. En otras palabras, las células o grupos celulares no deben verse cayendo a través de los medios, y deben permanecer relativamente estacionarios.
En este contexto, es una buena práctica probar dos controles negativos comparando células cultivadas en un matraz de cultivo T25 estándar ("Flask") y células cultivadas en el HARV especializado pero no sometidas a SMG (es decir, simplemente colocadas en la incubadora; "1G"). Idealmente, el rendimiento celular y los resultados en los ensayos experimentales posteriores entre los dos controles negativos deberían ser comparables. Cualquier inconsistencia debe ser notada. Para la mayoría de los ensayos, la mejor comparación es probablemente entre el control "1G" y el tratamiento con SMG; sin embargo, incluir los controles "Flask" y "1G" puede ser beneficioso para una comparación suficiente y una optimización inicial.
Las principales limitaciones de este protocolo incluyen 1) la formación de burbujas durante el cultivo celular, 2) la extensión de SMG y 3) la posible duración del tratamiento. Es crucial controlar la formación de burbujas durante todo el tratamiento SMG. Incluso las microburbujas minúsculas pueden acumularse, crecer y conducir a la formación de burbujas más grandes altamente disruptivas. Estas burbujas más grandes interrumpen la dinámica de fluidos de bajo cizallamiento dentro del recipiente de cultivo, causando un aumento de la turbulencia a medida que el flujo de fluido se desvía alrededor de la burbuja21. En última instancia, esto interrumpe completamente la condición de SMG. Este fenómeno es discutido extensamente y visualizado por Phelan et al21. Además, es importante tener en cuenta que este dispositivo produce SMG y no microgravedad real como se experimenta a bordo de la ISS6. No obstante, los estudios han demostrado efectos similares de SMG producidos por este dispositivo en comparación con los efectos de microgravedad real de los estudios realizados en la ISS 1,5,6.
Existen métodos alternativos para someter el cultivo celular a SMG. Estos incluyen el uso de clinostatos 3D o máquinas de posicionamiento aleatorio (RPM) y levitación diamagnética. Los clinostatos 3D rotan el cultivo celular en dos ejes perpendiculares a la misma velocidad, mientras que las RPM giran en dos ejes perpendiculares, por lo que tanto la velocidad como la direccionalidad de la rotación se aleatorizan 5,6. Por lo tanto, en comparación con los clinostatos 2D o los dispositivos RWV, los RPM son más complejos, lo que introduce varios beneficios e inconvenientes. En primer lugar, el grado de microgravedad que se puede alcanzar en un RPM se puede modular para simular la gravedad parcial, como la experimentada en la Luna (0,16 g) y Marte (0,33 g)6. Sin embargo, la complejidad añadida de las direcciones y velocidades de rotación aleatorias puede introducir movimiento brusco y fuerzas de aceleración, especialmente hacia las áreas externas del recipiente de cultivo, lo que puede conducir a confusiones en los datos. La levitación diamagnética expone las muestras a fuertes campos magnéticos repulsivos para contrarrestar el peso del agua en muestras biológicas, como una forma de contrarrestar la gravedad. Sin embargo, el fuerte campo magnético generado para hacerlo también puede afectar negativamente a las células, introduciendo así factores de confusión en los datos 5,6. Estos métodos se discuten con más detalle en otra parte 5,6.
En conclusión, el sistema de cultivo celular rotativo disponible comercialmente discutido aquí es una plataforma relativamente fácil de usar y accesible para los científicos que buscan estudiar los efectos de SMG en los linfocitos. Si bien existen limitaciones para este método de cultivo celular, sigue siendo una opción viable para el cultivo de linfocitos y potencialmente otros cultivos celulares en suspensión en microgravedad simulada.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo cuenta con el apoyo de la Agencia Espacial Canadiense (CSA), beca de investigación (17ILSRA3, Immuno Profile). Roxanne Fournier (Universidad de Toronto), el Dr. Randal Gregg (Lincoln Memorial University) y Preteesh Mylabathula (Universidad de Arizona) por su ayuda con la solución de problemas iniciales de este protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
Referencias
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941 (2021).
- Choukèr, A., Ullrich, O. . The Immune System in Space: Are we Prepared. , (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437 (2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68 (2020).
- Murphy, K., Weaver, C. . Janeway's Immunobiology 9th Edition. , (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022)
- Counting cells using a hemocytometer. Abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6 (2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados