Method Article
Coltura di linfociti in microgravità simulata utilizzando un sistema di coltura cellulare rotante
In questo articolo
Riepilogo
Questa è una guida passo-passo per l'utilizzo di un sistema di coltura cellulare rotante disponibile in commercio per la coltura di linfociti in microgravità simulata utilizzando vasi di coltura monouso specializzati. Questo metodo di coltura può essere applicato a qualsiasi coltura cellulare di tipo sospensione.
Abstract
Dati gli attuali limiti della conduzione della ricerca biologica nello spazio, esistono alcune opzioni per sottoporre la coltura cellulare alla microgravità simulata (SMG) sulla Terra. Queste opzioni variano nei loro metodi, principi e idoneità per l'uso con colture cellulari in sospensione. Qui, viene descritto un metodo di coltura cellulare per sottoporre i linfociti a microgravità simulata utilizzando un sistema di coltura cellulare rotante disponibile in commercio, noto anche come clinostato 2D o dispositivo di vaso a parete rotante (RWV). Questo metodo di coltura cellulare utilizza il principio della nullificazione del vettore gravitazionale mediato nel tempo per simulare la microgravità ruotando le cellule su un asse orizzontale. Le cellule coltivate in questo sistema possono essere raccolte e utilizzate in molti saggi sperimentali diversi per valutare gli effetti della microgravità simulata sulla funzione cellulare e sulla fisiologia. La tecnica di coltura può variare leggermente a seconda del tipo di cellula o della linea utilizzata, ma il metodo qui descritto può essere applicato a qualsiasi coltura cellulare di tipo sospensione.
Introduzione
È stato dimostrato che il volo spaziale ha un impatto su molti aspetti della fisiologia umana, incluso il sistema immunitario. Molti studi hanno dimostrato prove di disregolazione immunitaria a seguito del volo spaziale in vivo e dell'esposizione alla microgravità simulata (SMG) in vitro 1,2,3,4. Un aspetto importante dell'ambiente spaziale che influisce sulla fisiologia umana è la microgravità. La microgravità si riferisce alla "assenza di peso" sperimentata a causa delle basse forze gravitazionali nell'ambiente spaziale5. Mentre l'umanità si prepara per missioni spaziali più lunghe sulla Luna e su Marte, è necessario condurre ulteriori ricerche per mitigare i gravi rischi per la salute degli astronauti.
Condizioni reali di microgravità per la ricerca scientifica possono essere raggiunte nello spazio a bordo della Stazione Spaziale Internazionale (ISS) o in nanosatelliti lanciati in orbita; Tuttavia, queste opzioni possono essere incredibilmente costose e complesse da orchestrare. Dati gli attuali limiti della conduzione della ricerca biologica nello spazio, esistono diverse opzioni per indurre la microgravità reale e SMG sulla Terra. Esistono operazioni su larga scala che possono produrre brevi periodi di microgravità reale sulla Terra, tra cui torri di lancio, volo parabolico e razzi sonda. Tuttavia, questi metodi non sono eccessivamente adatti per studiare gli effetti della microgravità sui sistemi biologici, in gran parte a causa dei loro brevi periodi di trattamento in microgravità (cioè secondi a 20 minuti). Questi metodi sono discussi più dettagliatamente altrove 5,6. Le opzioni adatte per la coltura cellulare biologica includono dispositivi su piccola scala come clinostati 2D o dispositivi di vasi rotanti a parete (RWV) e clinostati 3D o macchine di posizionamento casuale (RPM). Questi dispositivi possono essere installati all'interno di incubatori di colture cellulari mantenuti a 37 °C e al 5% di CO2 e ruotano la coltura cellulare su un asse orizzontale (2D) o su due assi perpendicolari (3D)5. Tuttavia, è importante sottolineare che questi metodi di coltura producono SMG in contrasto con la microgravità reale, che è più fattibile nello spazio per contesti di ricerca biologica.
L'obiettivo del presente documento è quello di delineare i passaggi per sottoporre i linfociti a SMG utilizzando un dispositivo RWV (Table of Materials) disponibile in commercio, che rientra nella classificazione 2D clinostat. Mentre esiste un protocollo generale disponibile dal produttore per il funzionamento di questo dispositivo, l'articolo corrente mira a coprire i passaggi di risoluzione dei problemi e ottimizzazione in modo più dettagliato. Questo articolo copre anche la teoria alla base di come funziona questo dispositivo per produrre SMG in coltura cellulare in sospensione, in particolare con i linfociti. In questo contesto, la coltura cellulare in sospensione si riferisce alle cellule che crescono liberamente in terreni di coltura integrati, senza aderire ad alcuna impalcatura aggiuntiva. Molti tipi di cellule vengono coltivati in coltura cellulare in sospensione, compresi i linfociti. I linfociti sono cellule del sistema immunitario, comprese le cellule T, B e Natural Killer (NK), che risiedono negli organi linfoidi e nel flusso sanguigno7.
Il clinostato RWV 2D qui descritto opera sul principio dell'annullamento del vettore gravitazionale mediato nel tempo 5,6,8,9, per cui il vettore gravitazionale è randomizzato attraverso la rotazione della coltura cellulare su un asse orizzontale. Ciò si ottiene abbinando la velocità di rotazione del recipiente di coltura alla velocità di sedimentazione delle cellule. Finché la velocità di rotazione del recipiente di coltura è ben abbinata alla velocità di sedimentazione delle cellule, le cellule sono mantenute in caduta libera e incapaci di sedimentare, come sperimentato nell'ambiente spaziale. Dopo una fase iniziale di accelerazione, il mezzo nel recipiente di coltura raggiunge la "rotazione del corpo solido" nel tempo. Questa rotazione orizzontale induce anche il flusso laminare nel vaso di coltura cellulare. Questo crea un ambiente "low shear", dato che lo sforzo di taglio indotto sulle celle dal flusso laminare è molto inferiore a quello del flusso turbolento. Tuttavia, dato che il clinostato non è un sistema perfetto, vengono introdotti alcuni piccoli movimenti del fluido laminare, che infliggono uno stress di taglio minimo alle cellule. Pertanto, le celle sospese nel supporto vengono trascinate da questo flusso durante la rotazione. Durante la rotazione orizzontale, il vettore gravitazionale agisce sulle celle e le porta in una traiettoria oscillante, come visualizzato nella Figura 1. Un'altra piccola fonte di stress da taglio è causata dalle cellule che "cadono" attraverso i media, causando il flusso laminare intorno alle cellule. Mentre il recipiente di coltura ruota su un asse orizzontale, ruota anche il vettore di gravità sperimentato dalle cellule. Nel corso del tempo, questo vettore di gravità rotante si avvicina in media allo zero; questo fenomeno è chiamato nullificazione del vettore gravitazionale mediato nel tempo e induce uno stato di SMG 5,6,8,9. Questo dispositivo è stato utilizzato per studiare gli effetti di SMG su molti tipi di cellule, alcune delle quali sono trattate nei riferimenti10,11,12. Altri esempi sono disponibili sul sito Web del produttore del dispositivo.
Questo dispositivo RWV utilizza "vasi ad alto rapporto d'aspetto" (HARV) specializzati disponibili tramite il produttore del dispositivo. Questi HARV contengono 10 ml di coltura cellulare ciascuno; tuttavia, sono disponibili anche HARV da 50 ml. Possono essere utilizzati HARV da 10 ml o 50 ml a seconda di quante cellule sono necessarie per completare qualsiasi test sperimentale a valle, che è descritto ulteriormente nella sezione di discussione. Gli HARV sono realizzati in policarbonato e includono una membrana di ossigenazione in silicone per consentire lo scambio di gas durante la coltura cellulare. Questo mantiene il pH del mezzo cellulare e consente una respirazione cellulare efficiente. C'è una porta di riempimento principale e due porte per siringhe con tappo sulla faccia del recipiente (Figura 2A). Dopo aver caricato la coltura cellulare attraverso la porta di riempimento principale, due siringhe vengono caricate sul recipiente per facilitare la rimozione delle bolle. Quando si usano i recipienti da 10 ml, due siringhe da 3 ml funzionano bene. Una siringa è attaccata al dispositivo vuota, con la siringa completamente premuta e l'altra è attaccata riempita con 3 ml di coltura cellulare (Figura 2E). Questi sono usati in combinazione per rimuovere le bolle dal vaso, che è importante per mantenere il trattamento SMG. In generale, si consiglia di impostare due controlli negativi, che possono essere indicati come il controllo "Flask" e il controllo "1G". Il controllo "Flask" corrisponde alle cellule che vengono coltivate in un pallone di coltura cellulare di sospensione T25 standard. Il controllo 1G corrisponde alle cellule che vengono coltivate nel recipiente di coltura specializzato da 10 ml, che viene semplicemente inserito nell'incubatore (cioè senza essere sottoposto al trattamento SMG). Si prega di consultare la sezione Discussione per ulteriori dettagli sui controlli.
Il metodo qui descritto è appropriato per qualsiasi ricercatore che desideri studiare gli effetti di SMG sui linfociti, con un focus specifico sulle cellule NK utilizzando la linea cellulare NK9213. I risultati di questi studi possono aiutarci a comprendere meglio e mitigare gli effetti negativi del volo spaziale sul sistema immunitario umano.
Protocollo
NOTA: I seguenti passaggi devono essere completati all'interno di un armadio di sicurezza biologica sterile.
1. Preparazione di vasi per la coltura cellulare
- Estrarre i recipienti di coltura dall'imballaggio di plastica. Etichettare ogni recipiente sul bordo in base al tipo/linea di cellula utilizzata, sia che si tratti del controllo (1G) o del trattamento (SMG) e di qualsiasi altra informazione pertinente.
- Stabilizzare il recipiente e aprire con attenzione la porta di riempimento, senza toccare il piolo / O-ring del tappo della porta di riempimento. Posizionare il tappo su un tampone di etanolo, con il piolo / O-ring rivolto verso l'alto, mentre il recipiente viene riempito. Non rimuovere i cappucci dalle porte della siringa.
NOTA: Se il piolo / O-ring viene toccato accidentalmente, spruzzare il piolo del tappo con etanolo al 70% e lasciarlo riposare (rivolto verso l'alto) per alcuni istanti mentre riempie il recipiente. Quando è pronto per chiudere nuovamente la porta di riempimento, raccogliere il tappo con una salvietta di carta fresca per asciugare accuratamente il tappo prima di rimetterlo sul recipiente. - Caricare il recipiente con 10 ml del mezzo completo appropriato per la coltura cellulare utilizzando una pipetta sierologica sterile e riposizionare con cautela il tappo sulla porta di riempimento.
NOTA: Qui, è stata utilizzata la linea cellulare NK92 NK, che è stata coltivata in terreni GM1, come precedentemente convalidato in uno studio clinico utilizzando cellule NK92 come terapia cellulare14. I terreni di coltura utilizzati dipendono dalla linea cellulare o dal tipo di cellula da coltivare. Si prega di controllare il sito Web del fornitore per la ricetta corretta del supporto per la linea cellulare o il tipo di cella utilizzato. - Assicurarsi che i tappi della porta della siringa e la porta di riempimento siano ben chiusi e posizionare i recipienti riempiti in un incubatore a 37 °C, 5% di CO2 mentre si eseguono le fasi successive per innescare i vasi per la coltura cellulare.
NOTA: questa fase di adescamento aiuta a ridurre al minimo la formazione di bolle di grandi dimensioni per facilitare l'espulsione delle bolle più avanti nel passaggio 6.
2. Preparazione della coltura di cellule di riserva per la configurazione del trattamento SMG
- Quando non sono in uso, conservare le celle di interesse ad una temperatura inferiore a -130 °C o, idealmente, in una fase di vapore di azoto liquido.
- Almeno 1 settimana prima di impostare il trattamento pianificato, scongelare le cellule e coltivarle utilizzando la ricetta appropriata del terreno di coltura cellulare che si trova sul sito Web del fornitore. Pianificare quante cellule sono necessarie per impostare il trattamento (dettagli di seguito nelle fasi successive) e assicurarsi di iniziare le colture abbastanza presto da consentire una proliferazione e un adattamento sufficienti alla coltura.
- Conservare la coltura cellulare in un incubatore a 37 °C, 5% CO2 . Ulteriori dettagli sulla pratica standard delle colture cellulari sono trattati altrove15.
- Il giorno della configurazione pianificata del trattamento SMG, determinare la concentrazione iniziale e la vitalità della coltura cellulare iniziale.
- Utilizzare il metodo preferito per determinare la concentrazione della coltura cellulare iniziale (ad esempio, emocitometro, ViCell, citometria a flusso, ecc.). Prendi nota della concentrazione cellulare vitale (cellule per ml) e della vitalità (%) delle cellule, assicurando che la vitalità sia idealmente superiore all'85%. Un protocollo per l'utilizzo di un emocitometro può essere trovato altrove16.
- Determinare la densità/concentrazione di semina cellulare appropriata della coltura cellulare per il trattamento con SMG considerando l'intervallo di concentrazione cellulare ottimale del particolare tipo / linea cellulare, il loro tempo di raddoppio e la durata del trattamento SMG. Si prega di fare riferimento alla sezione Discussione per ulteriori approfondimenti.
NOTA: Per esperienza, l'intervallo di concentrazione ottimale per le cellule NK92 è compreso tra 0,3 x 10 6- 1,2 x 106 celle / ml. Generalmente, queste cellule hanno un tempo di raddoppio di 48-72 h e vengono alimentate ogni 2-3 giorni come tali. Dato che la durata del trattamento era di 72 ore, le cellule sono state seminate all'estremità inferiore del loro intervallo ottimale a 0,4-0,5 x 106 cellule / ml. Il fornitore raccomanda anche questa densità di semina quando si inizia la coltura cellulare iniziale da una fiala fresca di cellule NK92. - Determinare il volume di coltura di cellule madre necessario per impostare il trattamento e i controlli.
NOTA: sono necessari 10 ml di coltura cellulare per gruppo sperimentale. Se vengono istituiti tre gruppi sperimentali (cioè un trattamento: "SMG" e due controlli negativi: "Flask" e "1G"), altri 10 mL di coltura cellulare sono sufficienti per aliquote in una provetta da 15 mL utilizzata per caricare le siringhe HARV. Si tratta di 40 ml in totale, che possono variare a seconda del disegno sperimentale specifico. - Determinare il numero di cellule necessarie per impostare il trattamento.
- Calcola il numero totale di celle necessarie moltiplicando la densità di semina scelta (celle / ml) per il volume totale necessario (ml).
NOTA: Dall'esperienza con NK92, vengono preparati 40 ml di coltura di cellule madre come descritto sopra ad una concentrazione di semina di 0,4-0,5 x 106 cellule/ml. Pertanto, sono necessarie 16-20 x 106 cellule NK92 per completare la tipica configurazione del trattamento. Per la linea cellulare NK92, utilizzare un po 'più di cellule è meglio di un numero leggermente inferiore di cellule per mantenere un'elevata vitalità durante il trattamento.
- Calcola il numero totale di celle necessarie moltiplicando la densità di semina scelta (celle / ml) per il volume totale necessario (ml).
- Determinare il volume della coltura cellulare iniziale da far ruotare.
- Dato che la concentrazione cellulare è rappresentata come cellule/ml, dividere il numero totale di cellule (cellule) necessarie per l'esperimento per la concentrazione iniziale misurata della coltura cellulare (cellule/ml).
NOTA: Ad esempio, se sono necessarie 16 x 10 6 cellule e la concentrazione iniziale della coltura è 0,8 x 106 cellule / ml, 20 ml della coltura devono essere ridotti.
- Dato che la concentrazione cellulare è rappresentata come cellule/ml, dividere il numero totale di cellule (cellule) necessarie per l'esperimento per la concentrazione iniziale misurata della coltura cellulare (cellule/ml).
- Effettuare la coltura finale di cellule di riserva.
- Centrifugare il numero appropriato di cellule a 300 x g per 8 minuti in una provetta conica da 50 ml.
- Versare con cautela il surnatante in un contenitore per rifiuti e sfiorare delicatamente il tubo per risospendere il pellet nel piccolo volume rimanente.
- Risospendere le cellule nel volume appropriato di mezzo completo riscaldato (37 °C) per portare la coltura alla densità di semina desiderata. Questo volume è stato calcolato nel passaggio 2.6.
- Tappare saldamente il tubo da 50 mL e capovolgerlo delicatamente alcune volte per miscelare accuratamente la sospensione cellulare.
NOTA: Se sono necessari più di 50 ml per impostare l'esperimento completo, è meglio centrifugare il numero totale di cellule necessarie in un tubo conico da 50 ml e risospenderlo a metà del volume necessario. Quindi, mescolare bene e fare una diluizione 1: 2 in un tubo conico separato da 50 ml. Ad esempio, se sono necessari 100 ml a 0,4 x 10 6 celle/ml, ruotare 40 x 106 celle in un tubo da 50 ml, risospendere in 50 ml di supporto, trasferire 25 ml in un altro tubo da 50 mL e quindi rabboccare entrambi con 25 ml di materiale fresco.
3. Carico di recipienti con colture di cellule di riserva
- Recupera i vasi adescati dai supporti dall'incubatore.
- Se si utilizza un controllo "Flask", caricare un pallone per colture in sospensione T25 con 10 mL di coltura cellulare dal materiale preparato sopra. Inoltre, aggiungere 10 ml di coltura di cellule madre in un tubo conico separato da 15 ml, che verrà utilizzato per caricare le siringhe.
- Svitare i tappi delle porte della siringa per rimuoverli dal recipiente e assicurarsi che i rubinetti di arresto siano in posizione aperta (Figura 2C).
- Stabilizzare il recipiente e aprire con attenzione la porta di riempimento, senza toccare il piolo / O-ring del tappo della porta di riempimento. Posizionare il tappo su un tampone di etanolo, con il piolo / O-ring rivolto verso l'alto, mentre il recipiente viene riempito. Svitare con cautela i tappi dalle porte della siringa.
- Assicurarsi che i rubinetti di arresto siano in posizione aperta (Figura 2C). Versare con cautela il materiale dal recipiente in un contenitore per rifiuti, rimuovere il fluido utilizzando una pipetta sierologica o aspirarlo utilizzando una pipetta Pasteur di vetro sterile fissata al sistema di vuoto, senza toccare la membrana di ossigenazione.
- Chiudere saldamente il tubo conico da 50 mL che contiene la coltura di cellule madre e capovolgerlo delicatamente alcune volte per miscelare accuratamente il contenuto.
- Prelevare 10 mL di materiale di coltura cellulare dalla provetta da 50 mL con una pipetta sierologica sterile fresca. Raccogliere il recipiente e inclinarlo in modo che la porta di riempimento sia verso l'alto, quindi erogare con attenzione lo stock di coltura cellulare nel recipiente attraverso la porta di riempimento.
NOTA: Prestare attenzione e controllare il volume in modo che la coltura non fuoriesca attraverso le porte della siringa mentre si inclina il recipiente. - Mirare a riempire il recipiente fino alla parte superiore del labbro della porta di riempimento senza versare; Inclinare la nave verso il basso mentre viene riempita per evitare fuoriuscite. Fare attenzione a non toccare la membrana di ossigenazione con la pipetta poiché è molto fragile.
NOTA: Il processo di riempimento del recipiente può richiedere un po 'di pratica; Sii paziente e vai piano. Se si forma un film a bolle all'apertura della porta di riempimento, ciò interferirà con il caricamento del recipiente. Se ciò accade, colpire delicatamente la nave per rompere il sigillo creato dal film a bolle. - Una volta caricato il recipiente, riposizionare con attenzione il tappo della porta di riempimento, assicurandosi di non toccare il piolo / O-ring.
- Posizionare sulle siringhe.
NOTA: Ci sono due porte per siringhe sulla parte anteriore del recipiente (Figura 2A). Uno terrà una siringa vuota e l'altro conterrà una siringa piena di coltura cellulare (Figura 2E).- Innanzitutto, collegare la siringa vuota da 3 mL a una delle porte della siringa, assicurandosi che la siringa sia completamente premuta.
NOTA: pompare le siringhe un paio di volte prima di attaccarle al recipiente poiché all'inizio sono un po 'strette. Fallo all'interno dell'armadio di sicurezza biologica per mantenere la sterilità. - Chiudere saldamente il tubo conico da 15 mL con 10 mL di coltura cellulare aliquotata e capovolgerlo delicatamente alcune volte per miscelare accuratamente il contenuto.
- Quindi, semi-immergere accuratamente la seconda siringa da 3 ml nella coltura cellulare e disegnare un po 'di coltura. Per ridurre al minimo la bolla d'aria nella parte superiore della siringa, erogarla completamente nel tubo, quindi aspirare 3 ml di coltura.
- Collegare la siringa riempita alla porta della siringa rimanente e disinfettare accuratamente le siringhe e intorno alla porta di riempimento con un tampone di etanolo. Non ottenere etanolo sulla membrana di ossigenazione. Ora la nave è pronta per liberarsi delle bolle.
NOTA: La seconda siringa riempita per il secondo recipiente è più difficile da caricare data la profondità del tubo da 15 ml. Aiuta a inclinare il tubo durante il riempimento della siringa per mantenere la tenuta tra la siringa da riempire e la coltura cellulare. - Ripetere i passaggi 3.3-3.10 per le navi rimanenti. Se nella provetta conica da 50 mL è rimasta una quantità leggermente insufficiente di coltura cellulare per l'ultimo recipiente (ad esempio, 9,5 mL invece di 10 ml), recuperare la quantità rimanente dal tubo conico da 15 mL utilizzato per caricare le siringhe.
NOTA: non è necessario che i seguenti passaggi si svolgano all'interno di un armadio di sicurezza biologica sterile, poiché il recipiente è ora un sistema chiuso e sterile.
- Innanzitutto, collegare la siringa vuota da 3 mL a una delle porte della siringa, assicurandosi che la siringa sia completamente premuta.
4. Rimozione delle bolle dai vasi
NOTA: le bolle sono inevitabili all'interno di questa configurazione e devono essere rimosse costantemente durante il trattamento (Figura 3). Si prega di fare riferimento alla sezione Discussione per maggiori dettagli su questo.
- Assicurarsi che i rubinetti di arresto della porta della siringa siano in posizione chiusa (Figura 2D) per limitare la migrazione di cellule e bolle dalle siringhe nei vasi. Ciò è particolarmente importante in seguito durante il trattamento (discusso di seguito). Per raccogliere le bolle iniziali, capovolgere la nave e colpire il lato di esso un paio di volte.
- Capovolgere rapidamente il recipiente verso l'alto e poi con una leggera angolazione rivolta verso l'esterno in modo che le bolle galleggino tutte verso l'alto del recipiente (Figura 3B).
- Manovra le bolle sotto la porta con la siringa vuota e guardale iniziare a entrare nella porta. Aprire entrambi i rubinetti di arresto della porta della siringa (Figura 2C).
- Colpire delicatamente il recipiente per incoraggiare le bolle a galleggiare nella siringa vuota. Aspirare lentamente le bolle più grandi con la siringa vuota, mentre si preme accuratamente la siringa piena, per mantenere la pressione nel recipiente in modo che la membrana di ossigenazione non scoppi.
NOTA: Le bolle più grandi dovranno essere aspirate, mentre piccole bolle e microbolle possono essere incoraggiate a galleggiare nella siringa manovrandole nelle porte della siringa e colpendo delicatamente il recipiente. Dopo alcune ore di trattamento, è molto importante ridurre al minimo la "contaminazione incrociata" tra le cellule nelle siringhe e le cellule nel recipiente di coltura. Questo perché le cellule nelle siringhe non ricevono la stessa quantità di ossigenazione o esposizione a SMG come fanno le cellule nel vaso. - Ripetere i passaggi 4.2-4.4 alcune volte per assicurarsi che tutte le bolle vengano rimosse. Rimuovere tutte le bolle, comprese le microbolle dai vasi.
NOTA: Le bolle possono essere facilmente viste attraverso la membrana di ossigenazione (parte posteriore del vaso) quando il vaso è rivolto verso una fonte di luce (finestra, luce, ecc.). Quando esegui i passaggi 4.2 e 4.3, osserva le bolle che si muovono dal retro del recipiente per aiutare a visualizzare le bolle più difficili da vedere. - Quando le bolle sono state efficacemente rimosse, chiudere i rubinetti della porta della siringa. Tenere le siringhe durante il trattamento per consentire la successiva rimozione delle bolle, assicurandosi che il volume in entrambe le siringhe sia approssimativamente uguale.
5. Fissaggio del recipiente alla base rotante
- Pulire accuratamente la superficie della base rotante e del cavo a nastro con etanolo al 70%.
- Assicurarsi che il cavo a nastro incluso sia collegato all'alimentatore. Posizionare la base rotante nell'incubatore e collegare il cavo a nastro alla base. Assicurarsi che l'alimentatore sia tenuto vicino ma all'esterno dell'incubatore. La Figura 4 illustra la base rotante e l'alimentatore per il contesto.
- Fissare il recipiente di trattamento SMG allineando i fili del recipiente al piolo rotante e ruotando delicatamente il piolo rotante sulla base in senso antiorario. Assicurarsi che la nave sia fissata saldamente. Assicurarsi che l'incubatore mantenga un'umidità vicina al 100% riempiendo il vassoio dell'acqua con sufficiente acqua autoclavata ad osmosi inversa (RO).
- Scegliere una velocità di rotazione (rpm) appropriata. Regolare la velocità di rotazione in modo che corrisponda alla velocità di sedimentazione delle cellule, in modo tale che le cellule non "cadano attraverso il mezzo" ma finiscano per ruotare in un piccolo percorso orbitale. Questo fenomeno è visualizzato come un diagramma schematico nella Figura 1.
NOTA: L'azienda consiglia di iniziare la rotazione a 8-10 rpm per i linfociti. In questo caso, le celle NK92 sono state ruotate a 11 rpm, come dimostrato in un precedente articolo17. A seconda della dimensione della cella, il numero di giri dovrebbe essere aumentato per le celle più grandi e diminuito per le celle più piccole. Lo stesso schema si applica se le cellule utilizzate tendono ad aggregarsi durante la coltivazione. Si prega di consultare la sezione Discussione per ulteriori dettagli su questo.
6. Trattamento
- Scegliere una durata di trattamento appropriata per l'applicazione di ricerca, che può dipendere da quali parametri della funzione / fisiologia cellulare vengono testati. Si prega di consultare la sezione Discussione per ulteriori dettagli su questo.
NOTA: In questo caso, le cellule NK92 sono state sottoposte a un trattamento SMG di 72 ore, sulla base dei risultati degli studi precedenti18,19. Le bolle si formeranno inevitabilmente durante il trattamento e dovranno essere rimosse. La rotazione può essere brevemente interrotta e riavviata per facilitare questo. Vedere il passaggio 7.1 per informazioni su come rimuovere in modo sicuro il recipiente SMG. - Il primo giorno di impostazione del trattamento, controllare la formazione di bolle ogni poche ore ripetendo i passaggi 4.2-4.6. Dopo il primo giorno, controllare i vasi se necessario (almeno una volta al giorno), ripetendo i passaggi 4.2-4.6, fino alla fine del trattamento.
7. Raccolta di cellule dalle navi
- Una volta trascorsa la durata prevista per il trattamento, arrestare la rotazione e smontare l'apparecchio. Rimuovere il recipiente di trattamento SMG tenendo delicatamente fermo il recipiente mentre si ruota il piolo rotante del dispositivo in senso orario.
- Portare il pallone di controllo, il recipiente di controllo 1G e il recipiente SMG trattato in un armadio di sicurezza biologica sterile.
- Prendi ogni vaso (solo 1G e SMG; non il pallone) e capovolgilo in modo che sia rivolto verso il basso e colpiscilo delicatamente per portare tutte le cellule in sospensione. Quindi, ruotare il recipiente su un lato con la porta di riempimento verso il basso e colpire nuovamente il recipiente per incoraggiare le celle verso la porta di riempimento per un'aspirazione efficiente.
- Maneggiare ogni nave individualmente. Svitare le siringhe dalle due porte e smaltirle nei rifiuti a rischio biologico. Aprire i rubinetti di arresto sulle porte della siringa.
- Rimuovere con cautela il tappo della porta di riempimento e aspirare il contenuto utilizzando una pipetta sierologica sterile da 10 ml, inclinando il recipiente mentre viene svuotato. Erogare il contenuto dei gruppi "Flask", "1G" e "SMG" in tubi conici da 15 mL etichettati singolarmente.
- Chiudere ogni tubo e capovolgerli delicatamente alcune volte per assicurarsi che siano correttamente miscelati. Utilizzare il metodo preferito per determinare la concentrazione e la vitalità della coltura cellulare risultante per prepararsi all'uso all'interno di successivi saggi sperimentali.
Risultati
Questo metodo di coltura è considerato efficace se 1) la proliferazione delle cellule è approssimativamente coerente tra i gruppi di controllo (e idealmente tutti i gruppi sperimentali), 2) la proliferazione è appropriata data la densità di semina, la durata del trattamento e il tempo di raddoppio del tipo / linea cellulare, e 3) la vitalità delle cellule raccolte è dell'85% o superiore (Tabella 1 ). Idealmente, le cellule risultanti dovrebbero essere sane come lo sarebbero in coltura cellulare standard, specialmente per l'uso in esperimenti e saggi successivi (cioè, vitalità 85% o superiore). Questo metodo di coltura è considerato fallimentare se è vero il contrario, per cui le cellule risultanti muoiono, differiscono sostanzialmente nella proliferazione tra i gruppi di controllo o hanno una vitalità subottimale intorno al 70% o inferiore (Tabella 1). La proliferazione nel gruppo di trattamento SMG può differire o meno rispetto ai controlli, a seconda di come il trattamento SMG influisce sulla fisiologia cellulare. Tuttavia, questo non è stato un problema fino ad oggi, e la proliferazione cellulare era approssimativamente uguale tra i gruppi di controllo e trattamento (Tabella 1). Come accennato in precedenza, questi parametri sono importanti per il successo dei saggi e degli esperimenti a valle e le cellule risultanti dai due gruppi di controllo dovrebbero funzionare in modo relativamente simile.
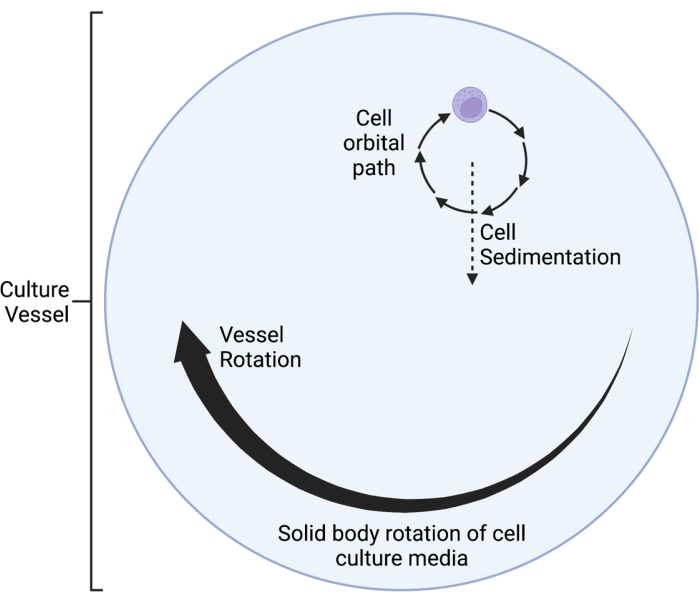
Figura 1: Diagramma schematico del percorso orbitale localizzato delle cellule coltivate all'interno del vaso in microgravità simulata (SMG) durante il funzionamento. Il clinostato RWV 2D qui descritto opera sul principio dell'annullamento del vettore gravitazionale mediato nel tempo 5,6,8,9, per cui il vettore gravitazionale è randomizzato attraverso la rotazione della coltura cellulare su un asse orizzontale. Ciò si ottiene abbinando la velocità di rotazione del recipiente di coltura alla velocità di sedimentazione delle cellule. Dopo una fase iniziale di accelerazione, il mezzo nel recipiente di coltura raggiunge la "rotazione del corpo solido" nel tempo. Questa rotazione orizzontale induce anche il flusso laminare nel vaso di coltura cellulare. Questo crea un ambiente "low shear", dato che lo sforzo di taglio indotto sulle celle dal flusso laminare è molto inferiore a quello del flusso turbolento. Tuttavia, dato che il clinostato non è un sistema perfetto, vengono introdotti alcuni piccoli movimenti del fluido laminare, che infliggono uno stress di taglio minimo alle cellule. Pertanto, le celle sospese nel supporto vengono trascinate da questo flusso durante la rotazione. Durante la rotazione orizzontale, il vettore gravitazionale agisce sulle cellule e le porta in una traiettoria oscillante, che viene visualizzata qui. Mentre il recipiente di coltura ruota su un asse orizzontale, ruota anche il vettore di gravità sperimentato dalle cellule. Nel corso del tempo, questo vettore di gravità rotante si avvicina in media allo zero; questo fenomeno è chiamato "annullamento del vettore di gravità mediato nel tempo" e induce uno stato di SMG 5,6,8,9. Questa figura è stata modificata da Castro et al., 201120. Creato con BioRender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: 10 mL High Aspect Ratio Vessel (HARV). (A) Vista a volo d'uccello dell'HARV, che mostra la porta di riempimento principale e due porte per siringhe. (B) Parte posteriore dell'HARV con la porta avvitabile per il collegamento dell'HARV alla base rotante e alla membrana di ossigenazione. (C) Vista laterale dell'HARV che mostra le porte aperte della siringa (tappato). (D) Vista laterale dell'HARV con le porte chiuse delle siringhe (con tappo). (E) Vista laterale dell'HARV che mostra le due siringhe da 3 mL attaccate; La siringa sinistra è riempita con coltura cellulare e la siringa destra è vuota. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Bolle nell'HARV. (A) Vista a volo d'uccello dell'HARV, che mostra le bolle da eliminare dalla coltura cellulare. (B) Vista laterale dell'HARV, che mostra le stesse bolle. Nota come le bolle variano di dimensioni; Anche le microbolle devono essere rimosse. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Base rotante e alimentazione del dispositivo RWV . (A) Vista frontale della base rotante, che mostra quattro pioli rotanti che possono ospitare fino a quattro recipienti di coltura. (B) Vista posteriore della base rotante, che mostra l'ingresso per il cavo a nastro (non nella foto) che collega la base e l'alimentatore. (C) Vista frontale dell'alimentatore tenuto sopra l'incubatore. Notare l'interruttore on/off a sinistra e la ghiera di regolazione rpm a destra. L'alimentatore è collegato alla presa più vicina (di solito sul retro dell'incubatore) e include un ingresso per il cavo a nastro da collegare alla base rotante. L'alimentazione rimane all'esterno dell'incubatore. La base viene posizionata all'interno dell'incubatore (37 °C, 5% CO2) durante il funzionamento e il cavo a nastro viene alimentato attraverso la porta dell'incubatore e collegato all'alimentazione. Il cavo a nastro non interferisce con la guarnizione dell'incubatore. Quando la base rotante non è in uso, deve essere conservata all'esterno dell'incubatore, conservata in modo sicuro su un banco da laboratorio o su uno scaffale. Fare riferimento alla tabella dei materiali per i dettagli del dispositivo commerciale utilizzato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| # | Viabilità iniziale | Densità di semina celle/mL | Fine vitalità (F) | Fine vitalità (1G) | Fine vitalità (SMG) | Cellule Conc (F) terminali/mL | End Conc (1G) cellule/mL | End Conc (SMG) cellule/mL | Note | |||||
| Vitalità iniziale e densità di semina non ottimali (esito negativo) | 1 | 79% | 0,2 x 106 | 67% | 60% | 60% | 0,10 x 106 | 0,075 x 106 | 0,071 x 106 | La bassa densità di semina e la vitalità iniziale non ottimale hanno portato alla morte cellulare nel corso del periodo di trattamento | ||||
| 2 | 73% | 0,2 x 106 | 43% | 63% | 70% | 0,071 x 106 | 0,081 x 106 | 0,085 x 106 | ||||||
| Viabilità di partenza ottimale e densità di semina (esito positivo) | 3 | 93% | 0,4 x 106 | 93% | 93% | 96% | 1,2 x 106 | 1,1 x 106 | 1,5 x 106 | Un'adeguata densità di semina e una vitalità iniziale ottimale hanno portato a una crescita e vitalità cellulare sana durante il trattamento | ||||
| 4 | 92% | 0,4 x 106 | 92% | 92% | 94% | 0,81 x 106 | 0,80 x 106 | 0,70 x 106 | ||||||
Tabella 1: Tabella comparativa che mostra i trattamenti di microgravità simulata (SMG) non riusciti e riusciti. La vitalità iniziale e le densità di semina di NK92 sono state confrontate con la vitalità finale risultante e le concentrazioni finali dopo un trattamento SMG di 72 ore in un incubatore di coltura cellulare a 37 °C integrato con CO2 al 5%. Sono stati confrontati due casi di esiti negativi e due casi di esiti positivi. Per confronto, si noti che l'intervallo di concentrazione ottimale della linea cellulare NK92 utilizzata era compreso tra 0,3 x 10 6 cellule / ml e 1,2 x 106 cellule / ml, con un tempo di raddoppio di circa 2-3 giorni.
Discussione
Mentre l'umanità si prepara per missioni spaziali più lunghe sulla Luna e su Marte, è necessario condurre ulteriori ricerche per mitigare i gravi rischi per la salute degli astronauti. Un aspetto importante dell'ambiente spaziale che influisce sulla fisiologia umana è la microgravità. Qui, è stato descritto un metodo di coltura cellulare per sottoporre i linfociti a SMG utilizzando un sistema di coltura cellulare rotante disponibile in commercio.
Questo protocollo contiene alcuni passaggi critici che potrebbero dover essere ottimizzati a seconda del tipo di cella o della linea utilizzata. Questi includono 1) la scelta di una densità di semina appropriata a seconda del tempo di raddoppio e della durata del trattamento SMG delle cellule e 2) la determinazione di una lunghezza di trattamento ottimale, della velocità di rotazione e dei controlli appropriati. La scelta di una densità di semina che sia nella gamma media delle concentrazioni cellulari appropriate per il tipo di cellula o la linea che viene studiata dovrebbe essere sufficiente. Tuttavia, la scelta di una densità di semina troppo bassa può portare a una bassa proliferazione cellulare e vitalità (Tabella 1), e la scelta di una densità troppo alta può portare a esaurimento prematuro dei nutrienti e bassa vitalità cellulare. La densità di semina scelta dipende anche dal tempo di raddoppio delle cellule che vengono studiate; Le cellule con un tempo di raddoppio più breve possono essere seminate a una densità inferiore e quelle con un tempo di raddoppio più lungo potrebbero dover essere seminate a una densità più elevata. La densità di semina e la durata del trattamento dipendono anche da quante cellule sono necessarie per completare i successivi saggi sperimentali. Dall'esperienza, la semina di cellule NK92 altamente vitali (90%+) a 0,4-0,5 x 10 6 cellule/ml in vasi da 10 mL (cioè 4-5 milioni di cellule per gruppo sperimentale; intervallo ottimale per la linea cellulare = 0,3 x 10 6-1,2 x 106 cellule/ml, tempo di raddoppio = 2-3 giorni) e il loro trattamento per 72 ore ha prodotto circa 8-15 milioni di cellule (Tabella 1). Pertanto, i vasi da 10 ml erano appropriati per la raccolta di cellule sia per saggi funzionali (3 x 10 6 cellule) che per cellule di raccolta per qPCR (1 x 10 6 cellule) e western blot (2 x 10 6-6 x 10 6 cellule). I surnatanti possono anche essere raccolti per l'analisi dei componenti secretori. Tuttavia, sono disponibili anche recipienti da 50 ml che possono essere utilizzati quando è richiesta una maggiore resa cellulare. Quando si utilizzano recipienti da 50 ml, è necessario utilizzare anche siringhe più grandi.
La determinazione di una lunghezza di trattamento appropriata dipenderà anche dal tipo / linea di cellula utilizzata. Se esistono studi precedenti, è necessario fare riferimento a tali studi per scegliere una durata di trattamento appropriata per iniziare. Alcuni studi hanno utilizzato dispositivi RWV per la coltura di cellule NK e sono citati qui17,18,19. Da lì, dovrebbero essere esaminati i risultati del trattamento o quanto bene le cellule proliferano e la loro vitalità e le loro prestazioni nei successivi saggi sperimentali. Potrebbe essere possibile estendere la durata del trattamento oltre le 72 ore rimuovendo la coltura cellulare dai vasi in un tubo, centrifugando e quindi risospendendo le cellule in 10 ml di terreno di coltura completo caldo e fresco, sostituendole nei recipienti e riavviando la rotazione. Tuttavia, ciò può introdurre confusioni dovute all'esposizione all'ipergravità attraverso la centrifugazione e può essere necessario dividere / diluire le cellule per garantire che le cellule siano mantenute entro il loro intervallo di concentrazione ottimale. Se devono essere utilizzate molecole stimolatorie (ad es. LPS, citochine, ecc.), si raccomanda di aggiungerle ad una concentrazione appropriata alla ricetta completa del terreno prima di impostare il trattamento SMG.
L'impostazione di una velocità di rotazione appropriata (rpm) è anche fondamentale per mantenere il trattamento di microgravità simulato. L'azienda raccomanda di iniziare con una velocità di rotazione compresa tra 8 e 10 giri / min durante la coltura dei linfociti. Per esperienza, una velocità di 11 rpm ha funzionato bene per garantire che le cellule NK92 siano mantenute in sospensione ed è stata utilizzata in un precedente studio sulle cellule NK17. A seconda dei modelli di crescita del tipo di cellula / linea utilizzata, potrebbe essere necessario aumentare la velocità di rotazione per tenere conto dell'aggregazione cellulare. Ciò porterebbe ad una maggiore sedimentazione delle cellule a causa dell'aumento della massa. Per un trattamento SMG ottimale, la velocità di rotazione del recipiente di coltura deve essere regolata in modo che corrisponda alla velocità di sedimentazione delle cellule 5,6,8,9. In altre parole, le cellule o i grumi di cellule non dovrebbero essere visti cadere attraverso i media e dovrebbero rimanere relativamente fermi.
In questo contesto, è buona norma provare due controlli negativi confrontando cellule coltivate in un pallone di coltura T25 standard ("Flask") e cellule coltivate nell'HARV specializzato ma non sottoposte a SMG (cioè, appena collocate nell'incubatore; "1G"). Idealmente, le prestazioni della cella e i risultati nei saggi sperimentali a valle tra i due controlli negativi dovrebbero essere comparabili. Eventuali incongruenze dovrebbero essere notate. Per la maggior parte dei test, il miglior confronto è probabilmente tra il controllo "1G" e il trattamento SMG; tuttavia, includere entrambi i controlli "Flask" e "1G" può essere utile per un confronto sufficiente e un'ottimizzazione iniziale.
I principali limiti di questo protocollo includono 1) la formazione di bolle durante la coltura cellulare, 2) l'estensione della SMG e 3) la possibile durata del trattamento. È fondamentale monitorare la formazione di bolle durante il trattamento SMG. Anche minuscole microbolle possono accumularsi, crescere e portare alla formazione di bolle più grandi altamente dirompenti. Queste bolle più grandi interrompono la fluidodinamica a basso taglio all'interno del contenitore di coltura, causando un aumento della turbolenza quando il flusso del fluido viene deviato attorno alla bolla21. In definitiva, questo sconvolge completamente la condizione SMG. Questo fenomeno è discusso a lungo e visualizzato da Phelan et al21. Inoltre, è importante tenere presente che questo dispositivo produce SMG e non microgravità reale come sperimentato a bordo della ISS6. Tuttavia, gli studi hanno mostrato effetti simili di SMG prodotto da questo dispositivo rispetto agli effetti di microgravità reale da studi condotti sulla ISS 1,5,6.
Esistono metodi alternativi per sottoporre la coltura cellulare a SMG. Questi includono l'uso di clinostati 3D o macchine di posizionamento casuale (RPM) e la levitazione diamagnetica. I clinostati 3D ruotano la coltura cellulare su due assi perpendicolari alla stessa velocità, mentre gli RPM ruotano su due assi perpendicolari, per cui sia la velocità che la direzionalità della rotazione sono randomizzate 5,6. Pertanto, rispetto ai clinostati 2D o ai dispositivi RWV, gli RPM sono più complessi, il che introduce diversi vantaggi e svantaggi. In primo luogo, il grado di microgravità che può essere raggiunto in un RPM può essere modulato per simulare la gravità parziale, come quella sperimentata sulla Luna (0,16 g) e su Marte (0,33 g)6. Tuttavia, la complessità aggiuntiva delle direzioni e delle velocità di rotazione randomizzate può introdurre movimenti a scatti e forze accelerative, specialmente verso le aree esterne del contenitore di coltura, portando potenzialmente a confusione nei dati. La levitazione diamagnetica espone i campioni a forti campi magnetici repulsivi per contrastare il peso dell'acqua nei campioni biologici, come un modo per contrastare la gravità. Tuttavia, il forte campo magnetico generato per farlo può anche avere un impatto negativo sulle cellule, introducendo quindi confusioni ai dati 5,6. Questi metodi sono discussi più dettagliatamente altrove 5,6.
In conclusione, il sistema di coltura cellulare rotante disponibile in commercio discusso qui è una piattaforma relativamente facile da usare e accessibile per gli scienziati che desiderano studiare gli effetti di SMG sui linfociti. Mentre ci sono limitazioni a questo metodo di coltura cellulare, rimane un'opzione praticabile per la coltura di linfociti e potenzialmente altre colture cellulari in sospensione in microgravità simulata.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Questo lavoro è sostenuto dall'Agenzia spaziale canadese (CSA), borsa di ricerca (17ILSRA3, Immuno Profile). Gli autori desiderano riconoscere e ringraziare la dottoressa Roxanne Fournier (Università di Toronto), il dottor Randal Gregg (Lincoln Memorial University) e Preteesh Mylabathula (Università dell'Arizona) per il loro aiuto nella risoluzione dei problemi iniziali di questo protocollo.
Materiali
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
Riferimenti
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941 (2021).
- Choukèr, A., Ullrich, O. . The Immune System in Space: Are we Prepared. , (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437 (2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68 (2020).
- Murphy, K., Weaver, C. . Janeway's Immunobiology 9th Edition. , (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022)
- Counting cells using a hemocytometer. Abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6 (2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon