Method Article
Culture de lymphocytes en microgravité simulée à l’aide d’un système de culture cellulaire rotatif
Dans cet article
Résumé
Il s’agit d’un guide étape par étape pour l’utilisation d’un système de culture cellulaire rotative disponible dans le commerce pour cultiver des lymphocytes en microgravité simulée à l’aide de récipients de culture jetables spécialisés. Cette méthode de culture peut être appliquée à toute culture cellulaire de type suspension.
Résumé
Compte tenu des limites actuelles de la recherche biologique dans l’espace, il existe quelques options pour soumettre la culture cellulaire à la microgravité simulée (SMG) sur Terre. Ces options varient dans leurs méthodes, leurs principes et leur aptitude à être utilisées avec la culture cellulaire en suspension. Ici, une méthode de culture cellulaire est décrite pour soumettre les lymphocytes à une microgravité simulée à l’aide d’un système de culture cellulaire rotative disponible dans le commerce, également connu sous le nom de clinostat 2D ou de dispositif de récipient à paroi rotative (RWV). Cette méthode de culture cellulaire utilise le principe de l’annulation du vecteur de gravité moyenné dans le temps pour simuler la microgravité en faisant tourner les cellules sur un axe horizontal. Les cellules cultivées dans ce système peuvent être récoltées et utilisées dans de nombreux tests expérimentaux différents pour évaluer les effets de la microgravité simulée sur la fonction cellulaire et la physiologie. La technique de culture peut varier légèrement selon le type de cellule ou la lignée utilisée, mais la méthode décrite ici peut être appliquée à toute culture cellulaire de type suspension.
Introduction
Il a été démontré que les vols spatiaux ont un impact sur de nombreux aspects de la physiologie humaine, y compris le système immunitaire. De nombreuses études ont démontré des signes de dérégulation immunitaire à la suite de vols spatiaux in vivo et d’exposition à la microgravité simulée (SMG) in vitro 1,2,3,4. Un aspect majeur de l’environnement spatial qui a un impact sur la physiologie humaine est la microgravité. La microgravité fait référence à « l’apesanteur » ressentie en raison des faibles forces gravitationnelles dans l’environnement spatial5. Alors que l’humanité se prépare à des missions spatiales plus longues vers la Lune et Mars, davantage de recherches doivent être menées pour atténuer les risques graves pour la santé des astronautes.
Des conditions réelles de microgravité pour la recherche scientifique peuvent être obtenues dans l’espace à bord de la Station spatiale internationale (ISS) ou dans des nanosatellites lancés en orbite; Cependant, ces options peuvent être incroyablement coûteuses et complexes à orchestrer. Compte tenu des limites actuelles de la recherche biologique dans l’espace, plusieurs options existent pour induire une microgravité réelle et SMG sur Terre. Il existe des opérations à grande échelle qui peuvent produire de courtes périodes de microgravité réelle sur Terre, y compris des tours de largage, des vols paraboliques et des fusées-sondes. Cependant, ces méthodes ne sont pas trop adaptées à l’étude des effets de la microgravité sur les systèmes biologiques, en grande partie en raison de leurs courtes périodes de traitement en microgravité (c.-à-d. de quelques secondes à 20 minutes). Ces méthodes sont examinées plus en détail ailleurs 5,6. Les options adaptées à la culture cellulaire biologique comprennent des dispositifs à petite échelle tels que des clinostats 2D ou des dispositifs à cuve à paroi rotative (RWV) et des clinostats 3D ou des machines de positionnement aléatoire (RPM). Ces dispositifs peuvent être installés à l’intérieur d’incubateurs de culture cellulaire maintenus à 37 °C et 5% de CO2, et ils font tourner la culture cellulaire soit sur un axe horizontal (2D), soit sur deux axes perpendiculaires (3D)5. Cependant, il est important de souligner que ces méthodes de culture produisent du SMG par opposition à la microgravité réelle, qui est la plus réalisable dans l’espace pour les contextes de recherche biologique.
L’objectif du présent article est de décrire les étapes à suivre pour soumettre les lymphocytes à l’ASG à l’aide d’un dispositif RWV (Table of Materials) disponible dans le commerce, qui relève de la classification clinostat 2D. Bien qu’il existe un protocole général disponible auprès du fabricant pour l’utilisation de cet appareil, le présent article vise à couvrir les étapes de dépannage et d’optimisation plus en détail. Cet article couvre également la théorie derrière la façon dont ce dispositif fonctionne pour produire du SMG en culture cellulaire en suspension, en particulier avec des lymphocytes. Dans ce contexte, la culture cellulaire en suspension fait référence aux cellules qui se développent librement dans des milieux de culture supplémentés, sans adhérer à un échafaudage supplémentaire. De nombreux types de cellules sont cultivés en culture cellulaire en suspension, y compris les lymphocytes. Les lymphocytes sont des cellules du système immunitaire, y compris les cellules T, B et Natural Killer (NK), qui résident dans les organes lymphoïdes et la circulation sanguine7.
Le clinostat RWV 2D décrit ici fonctionne sur le principe de l’annulation du vecteur de gravité moyenné dans le temps 5,6,8,9, selon lequel le vecteur de gravité est randomisé par rotation de la culture cellulaire sur un axe horizontal. Ceci est réalisé en faisant correspondre la vitesse de rotation du récipient de culture à la vitesse de sédimentation des cellules. Tant que la vitesse de rotation du récipient de culture correspond bien à la vitesse de sédimentation des cellules, les cellules sont maintenues en chute libre et incapables de sédimenter, comme c’est le cas dans l’environnement spatial. Après une phase initiale d’accélération, le milieu dans le récipient de culture atteint finalement la « rotation du corps solide » au fil du temps. Cette rotation horizontale induit également un écoulement laminaire dans le récipient de culture cellulaire. Cela crée un environnement de « faible cisaillement », étant donné que la contrainte de cisaillement induite sur les cellules par l’écoulement laminaire est bien inférieure à celle de l’écoulement turbulent. Cependant, étant donné que le clinostat n’est pas un système parfait, de petits mouvements de fluide laminaire sont introduits, qui infligent une contrainte de cisaillement minimale aux cellules. En tant que telles, les cellules en suspension dans le milieu sont entraînées par ce flux pendant la rotation. Pendant la rotation horizontale, le vecteur de gravité agit sur les cellules et les amène dans une trajectoire oscillante, comme le montre la figure 1. Une autre petite source de contrainte de cisaillement est causée par les cellules qui « tombent » à travers le milieu, provoquant un flux laminaire autour des cellules. Lorsque le récipient de culture tourne sur un axe horizontal, le vecteur de gravité subi par les cellules tourne également. Au fil du temps, ce vecteur gravitationnel rotatif se rapproche de zéro; ce phénomène est appelé nullification du vecteur de gravité moyen dans le temps et induit un état de SMG 5,6,8,9. Ce dispositif a été utilisé pour étudier les effets du SMG sur de nombreux types de cellules, dont certaines sont couvertes dans les références10,11,12. Vous trouverez d’autres exemples sur le site Web du fabricant de l’appareil.
Cet appareil RWV utilise des « vaisseaux à rapport d’aspect élevé » (HARV) spécialisés disponibles auprès du fabricant de l’appareil. Ces HARV contiennent 10 mL de culture cellulaire chacun; cependant, des VHR de 50 mL sont également disponibles. Des HARV de 10 mL ou de 50 mL peuvent être utilisés selon le nombre de cellules nécessaires pour effectuer les essais expérimentaux en aval, ce qui est décrit plus en détail dans la section de discussion. Les HARV sont faits de polycarbonate et comprennent une membrane d’oxygénation en silicone pour permettre l’échange gazeux pendant la culture cellulaire. Cela maintient le pH du milieu cellulaire et permet une respiration cellulaire efficace. Il y a un orifice de remplissage principal et deux orifices de seringue bouchés sur la face du navire (figure 2A). Après le chargement de la culture cellulaire par l’orifice de remplissage principal, deux seringues sont chargées sur le récipient pour aider à l’élimination des bulles. Lors de l’utilisation des vaisseaux de 10 mL, deux seringues de 3 mL fonctionnent bien. Une seringue est fixée au dispositif vide, la seringue est complètement enfoncée et l’autre est fixée remplie de 3 mL de culture cellulaire (figure 2E). Ceux-ci sont utilisés en combinaison pour éliminer les bulles du récipient, ce qui est important pour maintenir le traitement SMG. En général, il est conseillé de mettre en place deux contrôles négatifs, que l’on peut appeler le contrôle « Flask » et le contrôle « 1G ». Le témoin « Flask » correspond aux cellules cultivées dans un ballon de culture cellulaire en suspension standard T25. Le contrôle 1G correspond aux cellules qui sont cultivées dans le récipient de culture spécialisé de 10 mL, qui est simplement placé dans l’incubateur (c’est-à-dire sans être soumis au traitement SMG). Veuillez consulter la section Discussion pour plus de détails sur les contrôles.
La méthode décrite ici convient à tout chercheur cherchant à étudier les effets du SMG sur les lymphocytes, en mettant l’accent sur les cellules NK en utilisant la lignée cellulaire NK9213. Les résultats de ces études pourraient nous aider à mieux comprendre et atténuer les effets néfastes des vols spatiaux sur le système immunitaire humain.
Protocole
REMARQUE : Les étapes suivantes doivent être effectuées à l’intérieur d’une enceinte de sécurité biologique stérile.
1. Préparation des récipients pour la culture cellulaire
- Sortez les récipients de culture de l’emballage en plastique. Étiquetez chaque récipient sur le bord en fonction du type de cellule ou de la lignée utilisée, qu’il s’agisse du témoin (1G) ou du traitement (SMG) et de toute autre information pertinente.
- Stabilisez le récipient et ouvrez l’orifice de remplissage avec précaution, sans toucher la cheville du bouchon de l’orifice de remplissage/joint torique. Placez le bouchon sur un tampon d’éthanol, avec la cheville / joint torique vers le haut, pendant que le récipient est en cours de remplissage. Ne retirez pas les capuchons des orifices de la seringue.
REMARQUE: Si la cheville / joint torique est accidentellement touché, vaporisez la cheville de bouchon avec de l’éthanol à 70% et laissez-la reposer (tournée vers le haut) pendant quelques instants pendant que vous remplissez le récipient. Lorsque vous êtes prêt à refermer l’orifice de remplissage, ramassez le bouchon avec une lingette en papier frais pour bien sécher le bouchon avant de le remettre sur le récipient. - Charger le récipient avec 10 ml du milieu complet approprié pour la culture cellulaire à l’aide d’une pipette sérologique stérile et remettre soigneusement le bouchon sur l’orifice de remplissage.
REMARQUE: Ici, la lignée cellulaire NK NK a été utilisée, qui a été cultivée dans un milieu GM1, comme précédemment validé dans un essai clinique utilisant des cellules NK92 comme thérapie cellulaire14. Le milieu de culture utilisé dépend de la lignée cellulaire ou du type de cellule cultivé. Veuillez consulter le site Web du fournisseur pour connaître la recette de média appropriée pour la lignée cellulaire ou le type de cellule utilisé. - Assurez-vous que les bouchons de l’orifice de la seringue et l’orifice de remplissage sont bien fermés et placez les récipients remplis dans un incubateur à 37 °C, 5 % de CO2 tout en effectuant les étapes suivantes pour amorcer les récipients pour la culture cellulaire.
REMARQUE: Cette étape d’amorçage permet de minimiser la formation de grosses bulles pour faciliter l’expulsion des bulles plus tard à l’étape 6.
2. Préparation de la culture cellulaire mère pour la configuration du traitement SMG
- Lorsqu’elles ne sont pas utilisées, entreposer les cellules d’intérêt à une température inférieure à -130 °C ou, idéalement, dans une phase vapeur d’azote liquide.
- Au moins 1 semaine avant la mise en place du traitement prévu, décongelez les cellules et cultivez-les en utilisant la recette appropriée du milieu de culture cellulaire trouvée sur le site Web du fournisseur. Planifiez le nombre de cellules nécessaires pour mettre en place le traitement (détails ci-dessous dans les étapes suivantes) et assurez-vous de commencer les cultures suffisamment tôt pour permettre une prolifération et une adaptation suffisantes à la culture.
- Conserver la culture cellulaire dans un incubateur à 37 °C, 5 % de CO2 . De plus amples détails sur la pratique standard de la culture cellulaire sont fournis ailleurs15.
- Le jour de la configuration prévue du traitement SMG, déterminer la concentration initiale et la viabilité de la culture cellulaire initiale.
- Utilisez la méthode préférée pour déterminer la concentration de la culture cellulaire initiale (p. ex., hémocytomètre, ViCell, cytométrie en flux, etc.). Prendre note de la concentration de cellules viables (cellules par mL) et de la viabilité (%) des cellules, en veillant à ce que la viabilité soit idéalement supérieure à 85 %. Un protocole d’utilisation d’un hémocytomètre peut être trouvé ailleurs16.
- Déterminer la densité/concentration d’ensemencement cellulaire appropriée de la culture cellulaire pour le traitement par SMG en tenant compte de la plage de concentration cellulaire optimale du type ou de la lignée cellulaire en question, de leur temps de doublement et de la durée du traitement par SMG. Veuillez vous référer à la section Discussion pour plus de détails.
REMARQUE: D’après l’expérience, la plage de concentration optimale pour les cellules NK92 est comprise entre 0,3 x 10 6 - 1,2 x 106 cellules / mL. Généralement, ces cellules ont un temps de doublement de 48-72 h et sont nourries tous les 2-3 jours en tant que telles. Étant donné que la durée du traitement était de 72 h, les cellules ont été ensemencées à l’extrémité inférieure de leur plage optimale à 0,4-0,5 x 106 cellules/mL. Le fournisseur recommande également cette densité d’ensemencement lors du démarrage de la culture cellulaire initiale à partir d’un flacon frais de cellules NK92. - Déterminer le volume de culture cellulaire mère nécessaire pour mettre en place le traitement et les témoins.
REMARQUE : 10 mL de culture cellulaire sont nécessaires par groupe expérimental. Si trois groupes expérimentaux sont mis en place (c.-à-d. un traitement : « SMG » et deux témoins négatifs : « Flask » et « 1G »), 10 mL supplémentaires de culture cellulaire sont suffisants pour être aliquotes dans un tube de 15 mL utilisé pour charger les seringues HARV. Il s’agit de 40 mL au total, qui peuvent fluctuer en fonction du plan expérimental spécifique. - Déterminez le nombre de cellules nécessaires à la mise en place du traitement.
- Calculer le nombre total de cellules nécessaires en multipliant la densité d’ensemencement choisie (cellules/mL) par le volume total nécessaire (mL).
REMARQUE : D’après l’expérience acquise avec NK92, 40 mL de culture cellulaire mère sont préparés comme indiqué ci-dessus à une concentration d’ensemencement de 0,4 à 0,5 x 106 cellules/mL. En tant que tel, 16-20 x 106 cellules NK92 sont nécessaires pour compléter la configuration de traitement typique. Pour la lignée cellulaire NK92, l’utilisation d’un peu plus de cellules est préférable à un peu moins de cellules pour maintenir une viabilité élevée tout au long du traitement.
- Calculer le nombre total de cellules nécessaires en multipliant la densité d’ensemencement choisie (cellules/mL) par le volume total nécessaire (mL).
- Déterminez le volume de culture cellulaire initiale à faire tourner.
- Étant donné que la concentration cellulaire est représentée en cellules/mL, diviser le nombre total de cellules (cellules) nécessaires à l’expérience par la concentration initiale mesurée de la culture cellulaire (cellules/mL).
REMARQUE : Par exemple, si 16 x 10 6 cellules sont nécessaires et que la concentration initiale de la culture est de 0,8 x 106 cellules/mL, 20 mL de la culture doivent être filés.
- Étant donné que la concentration cellulaire est représentée en cellules/mL, diviser le nombre total de cellules (cellules) nécessaires à l’expérience par la concentration initiale mesurée de la culture cellulaire (cellules/mL).
- Faire la culture cellulaire mère finale.
- Centrifuger le nombre approprié de cellules à 300 x g pendant 8 minutes dans un tube conique de 50 mL.
- Versez délicatement le surnageant dans un récipient à déchets et agitez doucement le tube pour remettre en suspension la pastille dans le petit volume restant.
- Resuspendre les cellules dans le volume approprié de milieu complet chauffé (37 °C) pour amener la culture à la densité de semis désirée. Ce volume a été calculé à l’étape 2.6.
- Boucher solidement le tube de 50 ml et le retourner doucement plusieurs fois pour bien mélanger la suspension cellulaire.
REMARQUE: Si plus de 50 mL sont nécessaires pour mettre en place l’expérience complète, il est préférable de centrifuger le nombre total de cellules nécessaires dans un tube conique de 50 mL et de le remettre en suspension dans la moitié du volume nécessaire. Ensuite, bien mélanger et faire une dilution 1:2 dans un tube conique séparé de 50 mL. Par exemple, si 100 mL sont nécessaires à 0,4 x 10 6 cellules/mL, faire tourner 40 x 106 cellules dans un tube de 50 mL, remettre en suspension dans 50 mL de média, transférer 25 mL dans un autre tube de 50 mL, puis compléter les deux avec 25 mL de média frais.
3. Récipients de chargement avec culture de cellules mères
- Récupérez les récipients amorcés dans les médias de l’incubateur.
- Si une fiole témoin est utilisée, charger une fiole de culture en suspension T25 avec 10 mL de culture cellulaire provenant de la souche préparée ci-dessus. De plus, ajoutez 10 mL de culture cellulaire mère dans un tube conique séparé de 15 mL, qui sera utilisé pour charger les seringues.
- Dévissez les bouchons d’orifice de la seringue pour les retirer du navire et vous assurer que les robinets d’arrêt sont en position ouverte (figure 2C).
- Stabilisez le récipient et ouvrez l’orifice de remplissage avec précaution, sans toucher la cheville du bouchon de l’orifice de remplissage/joint torique. Placez le bouchon sur un tampon d’éthanol, avec la cheville / joint torique vers le haut, pendant que le récipient est en cours de remplissage. Dévissez délicatement les bouchons des orifices de seringue.
- Assurez-vous que les robinets d’arrêt sont en position ouverte (figure 2C). Versez soigneusement le fluide du récipient dans un conteneur à déchets, retirez le média à l’aide d’une pipette sérologique ou aspirez-le à l’aide d’une pipette Pasteur en verre stérile fixée au système de vide, sans toucher la membrane d’oxygénation.
- Fermez hermétiquement le tube conique de 50 ml qui contient la culture cellulaire mère et retournez-le doucement plusieurs fois pour bien mélanger le contenu.
- Prélever 10 ml de stock de culture cellulaire à partir du tube de 50 ml à l’aide d’une pipette sérologique fraîchement stérile. Ramassez le récipient et inclinez-le de manière à ce que l’orifice de remplissage soit vers le haut, puis distribuez soigneusement le stock de culture cellulaire dans le récipient par l’orifice de remplissage.
REMARQUE: Soyez prudent et surveillez le volume afin que la culture ne se répande pas à travers les orifices de la seringue lors de l’inclinaison du récipient. - Viser à remplir le navire jusqu’au sommet de la lèvre de l’orifice de remplissage sans renverser; Inclinez le récipient vers le bas pendant qu’il est rempli pour éviter de se renverser. Attention à ne pas toucher la membrane d’oxygénation avec la pipette car elle est très fragile.
REMARQUE : Le processus de remplissage du récipient peut prendre un certain temps; Soyez patient et allez-y lentement. Si un film de bulles se forme à l’ouverture de l’orifice de remplissage, cela interférera avec le chargement du navire. Si cela se produit, frappez doucement le récipient pour briser le joint créé par le film de bulles. - Une fois le navire chargé, replacez soigneusement le bouchon de l’orifice de remplissage, en veillant à ne pas toucher la cheville / le joint torique.
- Placer sur les seringues.
REMARQUE : Il y a deux orifices de seringue sur la face avant du navire (figure 2A). L’un tiendra une seringue vide et l’autre une seringue pleine de culture cellulaire (Figure 2E).- Tout d’abord, fixez la seringue vide de 3 ml à l’un des orifices de la seringue, en vous assurant que la seringue est complètement enfoncée.
REMARQUE: Pompez les seringues plusieurs fois avant de les attacher au récipient car elles sont un peu serrées au début. Faites-le à l’intérieur de l’enceinte de sécurité biologique pour maintenir la stérilité. - Fermez hermétiquement le tube conique de 15 ml avec 10 ml de culture cellulaire aliquote et inversez-le doucement plusieurs fois pour bien mélanger le contenu.
- Ensuite, semi-immergez soigneusement la deuxième seringue de 3 ml dans la culture cellulaire et prélevez une culture. Pour minimiser la bulle d’air dans le haut de la seringue, redistribuez-la complètement dans le tube, puis aspirez 3 ml de la culture.
- Fixez la seringue remplie au port de seringue restant et désinfectez soigneusement les seringues et autour de l’orifice de remplissage avec un tampon d’éthanol. Ne pas mettre d’éthanol sur la membrane d’oxygénation. Maintenant, le navire est prêt à être débarrassé des bulles.
REMARQUE : La deuxième seringue remplie pour le deuxième récipient est plus difficile à charger étant donné la profondeur du tube de 15 mL. Il aide à incliner le tube tout en remplissant la seringue pour maintenir l’étanchéité entre la seringue en cours de remplissage et la culture cellulaire. - Répétez les étapes 3.3 à 3.10 pour les autres navires. S’il reste une quantité légèrement insuffisante de culture cellulaire dans le tube conique de 50 mL pour le dernier récipient (p. ex. 9,5 mL au lieu de 10 mL), prélever la quantité restante du tube conique de 15 mL utilisé pour charger les seringues.
REMARQUE : Les étapes suivantes n’ont pas besoin d’être effectuées dans une enceinte de sécurité biologique stérile, car le récipient est maintenant un système fermé et stérile.
- Tout d’abord, fixez la seringue vide de 3 ml à l’un des orifices de la seringue, en vous assurant que la seringue est complètement enfoncée.
4. Éliminer les bulles des vaisseaux
REMARQUE : Les bulles sont inévitables dans cette configuration et doivent être éliminées de manière cohérente tout au long du traitement (Figure 3). Veuillez vous référer à la section Discussion pour plus de détails à ce sujet.
- Assurez-vous que les robinets d’arrêt de l’orifice de la seringue sont en position fermée (figure 2D) afin de limiter la migration des cellules et des bulles des seringues dans les vaisseaux. Ceci est particulièrement important plus tard pendant le traitement (voir ci-dessous). Pour recueillir les bulles initiales, retournez le récipient et frappez le côté de celui-ci plusieurs fois.
- Retournez rapidement le récipient vers l’arrière, puis sur un léger angle tourné vers l’extérieur afin que les bulles flottent toutes vers le haut du navire (Figure 3B).
- Manœuvrez les bulles sous le port avec la seringue vide et regardez-les commencer à entrer dans le port. Ouvrez les deux robinets d’arrêt de l’orifice de la seringue (Figure 2C).
- Frappez doucement le récipient pour encourager les bulles à flotter dans la seringue vide. Aspirez lentement les grosses bulles avec la seringue vide, tout en appuyant soigneusement sur la seringue pleine, pour maintenir la pression dans le récipient afin que la membrane d’oxygénation n’éclate pas.
REMARQUE: Les grosses bulles devront être aspirées, tandis que les petites bulles et les microbulles peuvent être encouragées à flotter dans la seringue en les manœuvrant dans les orifices de la seringue et en frappant doucement le récipient. Après quelques heures de traitement, il est très important de minimiser la « contamination croisée » entre les cellules dans les seringues et les cellules dans le récipient de culture. En effet, les cellules des seringues ne reçoivent pas la même quantité d’oxygénation ou d’exposition au SMG que les cellules du vaisseau. - Répétez les étapes 4.2 à 4.4 plusieurs fois pour vous assurer que toutes les bulles sont supprimées. Enlevez toutes les bulles, y compris les microbulles, des vaisseaux.
NOTE: Les bulles peuvent être facilement vues à travers la membrane d’oxygénation (arrière du récipient) lorsque le récipient est dirigé vers une source de lumière (fenêtre, lumière, etc.). Lorsque vous effectuez les étapes 4.2 et 4.3, regardez les bulles qui se déplacent de l’arrière du vaisseau pour aider à visualiser les bulles les plus difficiles à voir. - Lorsque les bulles ont été efficacement éliminées, fermez les robinets d’arrêt de l’orifice de la seringue. Gardez les seringues pendant le traitement pour permettre l’élimination ultérieure des bulles, en veillant à ce que le volume dans les deux seringues soit approximativement égal.
5. Fixation du récipient à la base tournante
- Essuyez soigneusement la surface de la base rotative et du câble ruban avec de l’éthanol à 70%.
- Assurez-vous que le câble ruban fourni est connecté au bloc d’alimentation. Placez la base rotative dans l’incubateur et fixez le câble ruban à la base. Assurez-vous que l’alimentation électrique est maintenue à proximité mais à l’extérieur de l’incubateur. La figure 4 illustre la base rotative et l’alimentation électrique pour le contexte.
- Fixez le récipient de traitement SMG en alignant les filetages du récipient à la cheville rotative et en tournant doucement la cheville rotative sur la base dans le sens inverse des aiguilles d’une montre. Assurez-vous que le navire est bien attaché. Assurez-vous que l’incubateur maintient près de 100 % d’humidité en remplissant le bac à eau avec suffisamment d’eau autoclavée par osmose inverse (OI).
- Choisissez une vitesse de rotation appropriée (tr/min). Ajustez la vitesse de rotation pour qu’elle corresponde à la vitesse de sédimentation des cellules, de sorte que les cellules ne « tombent pas du tout à travers le milieu », mais finissent par tourner sur une petite trajectoire orbitale. Ce phénomène est visualisé sous forme de diagramme schématique à la figure 1.
REMARQUE: La société recommande de commencer la rotation à 8-10 rpm pour les lymphocytes. Dans ce cas, les cellules NK92 ont été tournées à 11 tr/min, comme démontré dans un article précédent17. Selon la taille de la cellule, le régime doit être augmenté pour les cellules plus grandes et diminué pour les cellules plus petites. Le même schéma s’applique si les cellules utilisées ont tendance à s’agglutiner pendant la culture. Veuillez consulter la section Discussion pour plus de détails à ce sujet.
6. Traitement
- Choisissez une durée de traitement appropriée pour la demande de recherche, qui peut dépendre des paramètres de la fonction cellulaire / physiologie à tester. Veuillez consulter la section Discussion pour plus de détails à ce sujet.
REMARQUE: Dans ce cas, les cellules NK92 ont été soumises à un traitement SMG de 72 h, sur la base des résultats d’études antérieures18,19. Des bulles se formeront inévitablement tout au long du traitement et devront être enlevées. La rotation peut être brièvement arrêtée et redémarrée pour faciliter cela. Voir l’étape 7.1 pour savoir comment retirer le récipient SMG en toute sécurité. - Le premier jour de la mise en place du traitement, vérifiez la formation de bulles toutes les quelques heures en répétant les étapes 4.2 à 4.6. Après le premier jour, vérifiez les vaisseaux si nécessaire (au moins une fois par jour), en répétant les étapes 4.2-4.6, jusqu’à la fin du traitement.
7. Prélèvement de cellules dans les vaisseaux
- Une fois la durée de traitement prévue écoulée, arrêtez la rotation et démontez l’appareil. Retirez la cuve de traitement SMG en maintenant doucement la cuve immobile tout en tournant la cheville rotative de l’appareil dans le sens des aiguilles d’une montre.
- Amener la fiole de commande, le récipient de contrôle 1G et le récipient SMG traité dans une enceinte de sécurité biologique stérile.
- Prenez chaque récipient (1G et SMG seulement; pas le flacon) et retournez-le pour qu’il soit orienté vers le bas et frappez-le doucement pour mettre toutes les cellules en suspension. Ensuite, tournez le récipient sur le côté avec l’orifice de remplissage vers le fond et frappez à nouveau le récipient pour encourager les cellules vers l’orifice de remplissage pour une aspiration efficace.
- Manipulez chaque navire individuellement. Dévissez les seringues des deux orifices et jetez-les dans les déchets présentant un risque biologique. Ouvrez les robinets d’arrêt des orifices de seringue.
- Retirez délicatement le bouchon de l’orifice de remplissage et prélevez le contenu à l’aide d’une pipette sérologique stérile de 10 mL, en inclinant le récipient pendant qu’il est vidé. Distribuer le contenu des groupes « Flask », « 1G » et « SMG » dans des tubes coniques de 15 mL étiquetés individuellement.
- Fermez chaque tube et retournez-les doucement plusieurs fois pour vous assurer qu’ils sont bien mélangés. Utiliser la méthode préférée pour déterminer la concentration et la viabilité de la culture cellulaire résultante afin de se préparer à l’utilisation dans les essais expérimentaux ultérieurs.
Résultats
Cette méthode de culture est considérée comme efficace si 1) la prolifération des cellules est approximativement constante dans tous les groupes témoins (et idéalement dans tous les groupes expérimentaux), 2) la prolifération est appropriée compte tenu de la densité d’ensemencement, de la durée du traitement et du temps de doublement du type ou de la lignée cellulaire, et 3) la viabilité des cellules récoltées est de 85 % ou plus (tableau 1). ). Idéalement, les cellules résultantes devraient être aussi saines qu’elles le seraient dans une culture cellulaire standard, en particulier pour une utilisation dans des expériences et des essais ultérieurs (c.-à-d. viabilité de 85% ou plus). Cette méthode de culture est considérée comme infructueuse si le contraire est vrai, c’est-à-dire que les cellules résultantes meurent, diffèrent considérablement dans la prolifération entre les groupes témoins ou ont une viabilité sous-optimale d’environ 70% ou moins (tableau 1). La prolifération dans le groupe de traitement SMG peut ou non différer par rapport aux témoins, selon la façon dont le traitement SMG affecte la physiologie cellulaire. Cependant, cela n’a pas été un problème à ce jour, et la prolifération cellulaire était à peu près égale dans les groupes témoin et de traitement (tableau 1). Comme mentionné précédemment, ces paramètres sont importants pour le succès des essais et des expériences en aval, et les cellules résultantes des deux groupes témoins devraient avoir des performances relativement similaires.
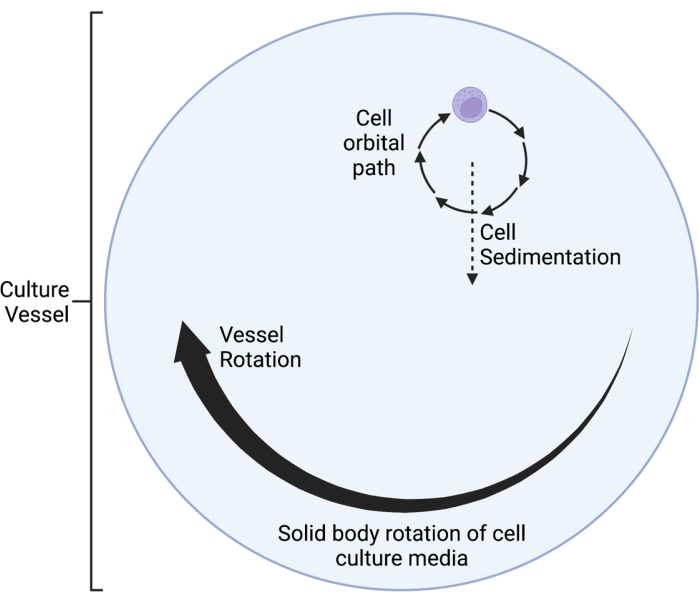
Figure 1 : Schéma de principe de la trajectoire orbitale localisée des cellules cultivées dans le vaisseau de microgravité simulée (SMG) pendant le fonctionnement. Le clinostat RWV 2D décrit ici fonctionne sur le principe de l’annulation du vecteur de gravité moyenné dans le temps 5,6,8,9, selon lequel le vecteur de gravité est randomisé par rotation de la culture cellulaire sur un axe horizontal. Ceci est réalisé en faisant correspondre la vitesse de rotation du récipient de culture à la vitesse de sédimentation des cellules. Après une phase initiale d’accélération, le milieu dans le récipient de culture atteint finalement la « rotation du corps solide » au fil du temps. Cette rotation horizontale induit également un écoulement laminaire dans le récipient de culture cellulaire. Cela crée un environnement de « faible cisaillement », étant donné que la contrainte de cisaillement induite sur les cellules par l’écoulement laminaire est bien inférieure à celle de l’écoulement turbulent. Cependant, étant donné que le clinostat n’est pas un système parfait, de petits mouvements de fluide laminaire sont introduits, qui infligent une contrainte de cisaillement minimale aux cellules. En tant que telles, les cellules en suspension dans le milieu sont entraînées par ce flux pendant la rotation. Lors de la rotation horizontale, le vecteur gravité agit sur les cellules et les amène dans une trajectoire oscillante, qui est visualisée ici. Lorsque le récipient de culture tourne sur un axe horizontal, le vecteur de gravité subi par les cellules tourne également. Au fil du temps, ce vecteur gravitationnel rotatif se rapproche de zéro; ce phénomène est appelé « annulation du vecteur de gravité moyenné dans le temps » et induit un état de SMG 5,6,8,9. Cette figure a été modifiée à partir de Castro et al., 201120. Créé avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Récipient à rapport d’aspect élevé (HARV) de 10 mL. (A) Vue aérienne du HARV, montrant l’orifice de remplissage principal et deux orifices de seringue. (B) Arrière du HARV montrant l’orifice vissé pour relier le HARV à la base rotative et à la membrane d’oxygénation. (C) Vue latérale du HARV montrant les orifices de seringue ouverts (bouchon). (D) Vue latérale du HARV montrant les orifices fermés de la seringue (bouchon). E) Vue latérale du HARV montrant les deux seringues de 3 mL attachées; La seringue gauche est remplie de culture cellulaire et la seringue droite est vide. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Bulles dans le HARV. (A) Vue à vol d’oiseau du HARV, montrant les bulles à éliminer de la culture cellulaire. (B) Vue latérale du HARV, montrant les mêmes bulles. Notez comment les bulles varient en taille; Les microbulles doivent également être enlevées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Base rotative et alimentation électrique du dispositif RWV. (A) Vue de face de la base tournante, montrant quatre chevilles rotatives pouvant accueillir jusqu’à quatre récipients de culture. (B) Vue arrière de la base rotative, montrant l’entrée du câble ruban (non illustré) qui relie la base et l’alimentation. (C) Vue de face de l’alimentation électrique maintenue au-dessus de l’incubateur. Notez l’interrupteur marche/arrêt à gauche et la molette de réglage du régime à droite. L’alimentation est branchée sur la prise la plus proche (généralement à l’arrière de l’incubateur) et comprend une entrée pour le câble ruban à connecter à la base rotative. L’alimentation reste à l’extérieur de l’incubateur. La base est placée à l’intérieur de l’incubateur (37 °C, 5% CO2) pendant le fonctionnement, et le câble ruban est alimenté par la porte de l’incubateur et connecté à l’alimentation. Le câble ruban n’interfère pas avec le joint de l’incubateur. Lorsque la base rotative n’est pas utilisée, elle doit être conservée à l’extérieur de l’incubateur, stockée en toute sécurité sur une paillasse ou une étagère de laboratoire. Consultez le tableau des matériaux pour obtenir des détails sur l’instrument commercial utilisé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| # | Viabilité initiale | Densité d’ensemencement cellules/ml | Viabilité finale (F) | Viabilité finale (1G) | Viabilité finale (SMG) | Cellules Conc terminales (F)/ml | Cellules Conc terminales (1G)/ml | Cellules Conc terminales (SMG)/ml | Notes | |||||
| Viabilité de départ et densité de semis sous-optimales (résultat négatif) | 1 | 79% | 0,2 x 106 | 67% | 60% | 60% | 0,10 x 106 | 0,075 x 106 | 0,071 x 106 | Une faible densité de semis et une viabilité de départ sous-optimale ont entraîné la mort cellulaire au cours de la période de traitement | ||||
| 2 | 73% | 0,2 x 106 | 43% | 63% | 70% | 0,071 x 106 | 0,081 x 106 | 0,085 x 106 | ||||||
| Viabilité de départ et densité de semis optimales (résultat positif) | 3 | 93% | 0,4 x 106 | 93% | 93% | 96% | 1,2 x 106 | 1,1 x 106 | 1,5 x 106 | Une densité de semis appropriée et une viabilité de départ optimale ont conduit à une croissance et à une viabilité cellulaires saines tout au long du traitement | ||||
| 4 | 92% | 0,4 x 106 | 92% | 92% | 94% | 0,81 x 106 | 0,80 x 106 | 0,70 x 106 | ||||||
Tableau 1 : Tableau comparatif montrant les traitements en microgravité simulée (SMG) infructueux et réussis. La viabilité initiale et les densités d’ensemencement de NK92 ont été comparées à la viabilité finale et aux concentrations finales résultantes après un traitement SMG de 72 h dans un incubateur de culture cellulaire à 37 °C supplémenté en CO2 à 5%. Deux cas de résultats négatifs et deux cas de résultats positifs ont été comparés. À titre de comparaison, notez que la plage de concentration optimale de la lignée cellulaire NK92 utilisée était comprise entre 0,3 x 10 6 cellules/mL et 1,2 x 106 cellules/mL, avec un temps de doublement d’environ 2-3 jours.
Discussion
Alors que l’humanité se prépare à des missions spatiales plus longues vers la Lune et Mars, davantage de recherches doivent être menées pour atténuer les risques graves pour la santé des astronautes. Un aspect majeur de l’environnement spatial qui a un impact sur la physiologie humaine est la microgravité. Ici, une méthode de culture cellulaire a été décrite pour soumettre les lymphocytes à l’ASG à l’aide d’un système de culture cellulaire rotative disponible dans le commerce.
Ce protocole contient quelques étapes critiques qui peuvent devoir être optimisées en fonction du type de cellule ou de la lignée utilisée. Il s’agit notamment 1) de choisir une densité de semis appropriée en fonction du temps de doublement des cellules et de la durée du traitement SMG, et 2) de déterminer une longueur de traitement optimale, une vitesse de rotation et des témoins appropriés. Le choix d’une densité de semis qui se situe dans la moyenne des concentrations cellulaires appropriées pour le type de cellule ou la lignée étudiée devrait suffire. Cependant, le choix d’une densité de semis trop faible peut entraîner une faible prolifération et viabilité cellulaire (tableau 1), et le choix d’une densité trop élevée peut entraîner un épuisement prématuré des nutriments et une faible viabilité cellulaire. La densité de semis choisie dépend également du temps de doublement des cellules étudiées; Les cellules avec un temps de doublement plus court peuvent être ensemencées à une densité plus faible, et celles avec un temps de doublement plus long peuvent avoir besoin d’être ensemencées à une densité plus élevée. La densité d’ensemencement et la durée du traitement dépendent également du nombre de cellules nécessaires pour compléter les essais expérimentaux ultérieurs. D’après l’expérience, l’ensemencement de cellules NK92 hautement viables (90 % +) à une concentration de 0,4 à 0,5 x 10 6 cellules/mL dans des vaisseaux de 10 mL (c.-à-d. 4 à 5 millions de cellules par groupe expérimental; intervalle optimal pour la lignée cellulaire = 0,3 x 10 6-1,2 x 106 cellules/mL, temps de doublement = 2-3 jours) et leur traitement pendant 72 heures ont donné environ 8 à 15 millions de cellules (tableau 1). Par conséquent, les vaisseaux de 10 mL étaient appropriés pour la récolte de cellules pour les essais fonctionnels (3 x 10 6 cellules) et les cellules de collecte pour la qPCR (1 x 10 6 cellules) et le transfert Western (2 x 10 6-6 x 10 6 cellules). Les surnageants peuvent également être collectés pour l’analyse des composants sécrétoires. Cependant, des récipients de 50 mL sont également disponibles et peuvent être utilisés lorsqu’un plus grand rendement cellulaire est requis. Lors de l’utilisation de vaisseaux de 50 mL, des seringues plus grandes doivent également être utilisées.
La détermination d’une durée de traitement appropriée dépendra également du type de cellule / lignée utilisée. S’il existe des études antérieures, il convient de s’y référer afin de choisir une durée de traitement appropriée pour commencer. Quelques études ont utilisé des dispositifs RWV pour cultiver des cellules NK et sont référencées ici17,18,19. À partir de là, les résultats du traitement ou la prolifération des cellules et leur viabilité, ainsi que leur performance dans les essais expérimentaux ultérieurs, doivent être examinés. Il peut être possible de prolonger la durée du traitement au-delà de 72 h en retirant la culture cellulaire des récipients dans un tube, en centrifugeant puis en remettant en suspension les cellules dans 10 ml de milieux de culture complets chauds et frais, en les remplaçant dans les vaisseaux et en recommençant la rotation. Cependant, cela peut introduire des confusions dues à l’exposition à l’hypergravité par centrifugation, et la division / dilution des cellules peut être nécessaire pour s’assurer que les cellules sont maintenues dans leur plage de concentration optimale. Si des molécules stimulantes (par exemple, LPS, cytokines, etc.) doivent être utilisées, il est recommandé de les ajouter à une concentration appropriée à la recette complète du milieu avant de mettre en place le traitement SMG.
Le réglage d’une vitesse de rotation appropriée (tr/min) est également essentiel pour maintenir le traitement en microgravité simulé. La société recommande de commencer avec une vitesse de rotation comprise entre 8 et 10 tr / min lors de la culture de lymphocytes. D’après l’expérience, une vitesse de 11 tr/min a bien fonctionné pour s’assurer que les cellules NK92 sont maintenues en suspension et a été utilisée dans une étude antérieure sur les cellules NK17. Selon les modèles de croissance du type ou de la lignée cellulaire utilisée, il peut être nécessaire d’augmenter la vitesse de rotation pour tenir compte de l’agglutination cellulaire. Cela conduirait à une sédimentation accrue des cellules en raison de l’augmentation de la masse. Pour un traitement SMG optimal, la vitesse de rotation du récipient de culture doit être ajustée pour correspondre à la vitesse de sédimentation des cellules 5,6,8,9. En d’autres termes, les cellules ou les amas cellulaires ne doivent pas être vus tomber à travers le milieu, et ils doivent rester relativement stationnaires.
Dans ce contexte, il est recommandé d’essayer deux témoins négatifs en comparant des cellules cultivées dans un flacon de culture T25 standard (« flacon ») et des cellules cultivées dans le HARV spécialisé mais non soumises à un SMG (c.-à-d. simplement placées dans l’incubateur; « 1G »). Idéalement, la performance cellulaire et les résultats dans les essais expérimentaux en aval entre les deux témoins négatifs devraient être comparables. Toute incohérence doit être notée. Pour la plupart des essais, la meilleure comparaison est probablement entre le contrôle « 1G » et le traitement SMG ; cependant, l’inclusion des commandes « Flask » et « 1G » peut être bénéfique pour une comparaison suffisante et une optimisation initiale.
Les principales limites de ce protocole comprennent 1) la formation de bulles pendant la culture cellulaire, 2) l’étendue du SMG et 3) la durée possible du traitement. Il est crucial de surveiller la formation de bulles tout au long du traitement SMG. Même de minuscules microbulles peuvent s’accumuler, croître et conduire à la formation de bulles plus grandes très perturbatrices. Ces bulles plus grosses interrompent la dynamique des fluides à faible cisaillement dans le récipient de culture, provoquant une turbulence accrue lorsque l’écoulement du fluide est dévié autour de la bulle21. En fin de compte, cela perturbe complètement la condition SMG. Ce phénomène est longuement discuté et visualisé par Phelan et al21. De plus, il est important de garder à l’esprit que cet appareil produit du SMG et non de la microgravité réelle comme on l’a expérimenté à bord de l’ISS6. Néanmoins, des études ont montré des effets similaires du SMG produit par ce dispositif par rapport aux effets de la microgravité réelle des études effectuées sur l’ISS 1,5,6.
Il existe d’autres méthodes pour soumettre la culture cellulaire au SMG. Il s’agit notamment de l’utilisation de clinostats 3D ou de machines de positionnement aléatoire (RPM) et de la lévitation diamagnétique. Les clinostats 3D font tourner la culture cellulaire sur deux axes perpendiculaires à la même vitesse, tandis que les RPM tournent sur deux axes perpendiculaires, la vitesse et la directionnalité de la rotation étant randomisées 5,6. Par conséquent, par rapport aux clinostats 2D ou aux appareils RWV, les RPM sont plus complexes, ce qui présente plusieurs avantages et inconvénients. Tout d’abord, le degré de microgravité qui peut être atteint dans un RPM peut être modulé pour simuler la gravité partielle, comme celle vécue sur la Lune (0,16 g) et Mars (0,33 g)6. Cependant, la complexité accrue des directions et des vitesses de rotation aléatoires peut introduire des mouvements saccadés et des forces d’accélération, en particulier vers les zones extérieures du récipient de culture, ce qui peut entraîner des confusions dans les données. La lévitation diamagnétique expose les échantillons à de forts champs magnétiques répulsifs pour contrer le poids de l’eau dans les échantillons biologiques, comme moyen de contrer la gravité. Cependant, le fort champ magnétique généré pour ce faire peut également avoir un impact négatif sur les cellules, introduisant ainsi des confusions dans les données 5,6. Ces méthodes sont examinées plus en détail ailleurs 5,6.
En conclusion, le système de culture cellulaire rotative disponible dans le commerce dont il est question ici est une plate-forme relativement facile à utiliser et accessible pour les scientifiques qui cherchent à étudier les effets du SMG sur les lymphocytes. Bien qu’il y ait des limites à cette méthode de culture cellulaire, elle reste une option viable pour la culture de lymphocytes et potentiellement d’autres cultures cellulaires en suspension en microgravité simulée.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Ces travaux sont financés par une subvention de recherche de l’Agence spatiale canadienne (ASC) (17ILSRA3, Immuno-Profile). Les auteurs aimeraient remercier la Dre Roxanne Fournier (Université de Toronto), le Dr Randal Gregg (Université Lincoln Memorial) et Preteesh Mylabathula (Université de l’Arizona) pour leur aide dans le dépannage initial de ce protocole.
matériels
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
Références
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941 (2021).
- Choukèr, A., Ullrich, O. . The Immune System in Space: Are we Prepared. , (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437 (2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68 (2020).
- Murphy, K., Weaver, C. . Janeway's Immunobiology 9th Edition. , (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022)
- Counting cells using a hemocytometer. Abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6 (2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.