Method Article
زراعة الخلايا الليمفاوية في محاكاة الجاذبية الصغرى باستخدام نظام زراعة الخلايا الدوارة
In This Article
Summary
هذا دليل خطوة بخطوة لاستخدام نظام زراعة الخلايا الدوارة المتاح تجاريا لزرع الخلايا الليمفاوية في محاكاة الجاذبية الصغرى باستخدام أوعية استزراع متخصصة يمكن التخلص منها. يمكن تطبيق طريقة الاستزراع هذه على أي مزرعة خلايا من نوع التعليق.
Abstract
بالنظر إلى القيود الحالية لإجراء البحوث البيولوجية في الفضاء ، توجد بعض الخيارات لإخضاع زراعة الخلايا لمحاكاة الجاذبية الصغرى (SMG) على الأرض. تختلف هذه الخيارات في أساليبها ومبادئها ومدى ملاءمتها للاستخدام مع مزرعة الخلايا المعلقة. هنا ، يتم وصف طريقة زراعة الخلايا لإخضاع الخلايا الليمفاوية لمحاكاة الجاذبية الصغرى باستخدام نظام زراعة الخلايا الدوارة المتاح تجاريا ، والمعروف أيضا باسم clinostat 2D أو جهاز وعاء الجدار الدوار (RWV). تستخدم طريقة زراعة الخلايا هذه مبدأ إبطال ناقل الجاذبية المتوسط زمنيا لمحاكاة الجاذبية الصغرى عن طريق تدوير الخلايا على محور أفقي. يمكن حصاد الخلايا المستزرعة في هذا النظام واستخدامها في العديد من المقايسات التجريبية المختلفة لتقييم آثار محاكاة الجاذبية الصغرى على الوظيفة الخلوية وعلم وظائف الأعضاء. قد تختلف تقنية الاستزراع قليلا اعتمادا على نوع الخلية أو الخط المستخدم ، ولكن يمكن تطبيق الطريقة الموضحة هنا على أي مزرعة خلية من نوع التعليق.
Introduction
لقد ثبت أن رحلات الفضاء تؤثر على العديد من جوانب علم وظائف الأعضاء البشرية ، بما في ذلك جهاز المناعة. أظهرت العديد من الدراسات أدلة على عدم التنظيم المناعي نتيجة لرحلات الفضاء في الجسم الحي والتعرض لمحاكاة الجاذبية الصغرى (SMG) في المختبر1،2،3،4. ومن الجوانب الرئيسية للبيئة الفضائية التي تؤثر على فسيولوجيا الإنسان الجاذبية الصغرى. تشير الجاذبية الصغرى إلى "انعدام الوزن" الذي يحدث بسبب قوى الجاذبية المنخفضة في بيئة الفضاء5. بينما تستعد البشرية لبعثات فضائية أطول إلى القمر والمريخ ، يجب إجراء المزيد من الأبحاث للتخفيف من المخاطر الصحية الخطيرة على رواد الفضاء.
ويمكن تحقيق ظروف الجاذبية الصغرى الحقيقية للبحث العلمي في الفضاء على متن محطة الفضاء الدولية (ISS) أو في السواتل النانوية التي تطلق في المدار؛ ومع ذلك ، يمكن أن تكون هذه الخيارات مكلفة للغاية ومعقدة للتنسيق. بالنظر إلى القيود الحالية لإجراء البحوث البيولوجية في الفضاء ، توجد عدة خيارات لإحداث جاذبية صغيرة حقيقية و SMG على الأرض. توجد عمليات واسعة النطاق يمكن أن تنتج فترات قصيرة من الجاذبية الصغرى الحقيقية على الأرض ، بما في ذلك أبراج الإسقاط ، والطيران المكافئ ، وصواريخ السبر. ومع ذلك ، فإن هذه الطرق ليست مناسبة بشكل مفرط لدراسة آثار الجاذبية الصغرى على النظم البيولوجية ، ويرجع ذلك إلى حد كبير إلى فترات قصيرة من معالجة الجاذبية الصغرى (أي ثوان إلى 20 دقيقة). تتم مناقشة هذه الأساليب بمزيد من التفصيل في مكان آخر 5,6. تشمل الخيارات المناسبة لزراعة الخلايا البيولوجية الأجهزة الصغيرة الحجم مثل 2D clinostats أو أجهزة وعاء الجدار الدوار (RWV) و clinostats 3D أو آلات تحديد المواقع العشوائية (RPM). يمكن إعداد هذه الأجهزة داخل حاضنات زراعة الخلايا التي يتم الحفاظ عليها عند 37 درجة مئوية و 5٪ CO2 ، وتقوم بتدوير ثقافة الخلية إما على محور أفقي (2D) أو على محورين عموديين (3D) 5. ومع ذلك ، من المهم التأكيد على أن طرق الاستزراع هذه تنتج رشاشات صغيرة بدلا من الجاذبية الصغرى الحقيقية ، والتي يتم تحقيقها بشكل عملي في الفضاء لسياقات البحث البيولوجي.
الهدف من الورقة الحالية هو تحديد خطوات إخضاع الخلايا الليمفاوية ل SMG باستخدام جهاز RWV المتاح تجاريا (جدول المواد) ، والذي يندرج تحت تصنيف clinostat 2D. على الرغم من وجود بروتوكول عام متاح من الشركة المصنعة لتشغيل هذا الجهاز ، تهدف المقالة الحالية إلى تغطية خطوات استكشاف الأخطاء وإصلاحها والتحسين بمزيد من التفصيل. تغطي هذه المقالة أيضا النظرية الكامنة وراء كيفية عمل هذا الجهاز لإنتاج SMG في ثقافة الخلايا المعلقة ، وتحديدا مع الخلايا الليمفاوية. في هذا السياق ، تشير زراعة الخلايا المعلقة إلى الخلايا التي تنمو بحرية في وسائط الاستزراع التكميلية ، دون الالتزام بأي سقالات إضافية. تزرع العديد من أنواع الخلايا في زراعة الخلايا المعلقة ، بما في ذلك الخلايا الليمفاوية. الخلايا الليمفاوية هي خلايا الجهاز المناعي ، بما في ذلك الخلايا التائية والبائية والقاتلة الطبيعية (NK) ، الموجودة في الأعضاء اللمفاوية ومجرى الدم7.
يعمل كلينستات RWV 2D الموصوف هنا على مبدأ إبطال متجه الجاذبية متوسط الوقت5،6،8،9 ، حيث يتم اختيار متجه الجاذبية بشكل عشوائي من خلال دوران ثقافة الخلية على محور أفقي. يتم تحقيق ذلك من خلال مطابقة سرعة دوران وعاء الاستزراع مع سرعة ترسيب الخلايا. وطالما أن سرعة دوران وعاء الاستزراع تتطابق بشكل جيد مع سرعة ترسيب الخلايا، فإن الخلايا تظل في حالة سقوط حر وغير قادرة على الترسب، كما حدث في بيئة الفضاء. بعد مرحلة التسريع الأولية ، تصل الوسائط في وعاء الاستزراع في النهاية إلى "دوران الجسم الصلب" بمرور الوقت. يحفز هذا الدوران الأفقي أيضا التدفق الصفحي في وعاء زراعة الخلايا. هذا يخلق بيئة "قص منخفضة" ، بالنظر إلى أن إجهاد القص الناجم عن الخلايا عن طريق التدفق الصفحي أقل بكثير من التدفق المضطرب. ومع ذلك ، بالنظر إلى أن clinostat ليس نظاما مثاليا ، فهناك بعض حركات السوائل الصفائحية الصغيرة التي يتم إدخالها ، والتي تسبب الحد الأدنى من إجهاد القص على الخلايا. على هذا النحو ، يتم سحب الخلايا المعلقة في الوسائط بواسطة هذا التدفق أثناء الدوران. أثناء الدوران الأفقي، يؤثر متجه الجاذبية على الخلايا ويضعها في مسار متذبذب، كما هو موضح في الشكل 1. مصدر صغير آخر لإجهاد القص ناتج عن "سقوط" الخلايا عبر الوسائط ، مما يتسبب في تدفق رقائقي حول الخلايا. عندما يدور وعاء الاستزراع على محور أفقي ، يدور ناقل الجاذبية الذي تتعرض له الخلايا أيضا. بمرور الوقت ، يقترب متوسط ناقل الجاذبية الدوار هذا من الصفر. تسمى هذه الظاهرة إبطال ناقل الجاذبية المتوسط الزمني وتؤدي إلى حالة SMG5،6،8،9. تم استخدام هذا الجهاز لدراسة آثار SMG على العديد من أنواع الخلايا ، والتي يتم تغطية بعضها في المراجع10،11،12. يمكن العثور على المزيد من الأمثلة على موقع الشركة المصنعة للجهاز.
يستخدم جهاز RWV هذا "أوعية ذات نسبة عرض إلى ارتفاع عالية" (HARVs) متخصصة متوفرة من خلال الشركة المصنعة للجهاز. تحتوي هذه HARVs على 10 مل من زراعة الخلايا لكل منها. ومع ذلك ، تتوفر أيضا 50 مل من HARVs. يمكن استخدام 10 مل أو 50 مل HARVs اعتمادا على عدد الخلايا اللازمة لإكمال أي فحوصات تجريبية نهائية ، والتي تم توضيحها بمزيد من التفصيل في قسم المناقشة. تصنع HARVs من البولي كربونات وتشمل غشاء أكسجة السيليكون للسماح بتبادل الغازات أثناء زراعة الخلايا. وهذا يحافظ على الأس الهيدروجيني للوسائط الخلوية ويسمح بالتنفس الخلوي بكفاءة. يوجد منفذ تعبئة رئيسي ومنفذي حقنة مغطاة على وجه الوعاء (الشكل 2 أ). بعد تحميل مزرعة الخلية من خلال منفذ التعبئة الرئيسي ، يتم تحميل حقنتين على الوعاء للمساعدة في إزالة الفقاعة. عند استخدام الأوعية سعة 10 مل ، تعمل حقنتان سعة 3 مل بشكل جيد. يتم توصيل حقنة واحدة بالجهاز فارغة ، مع الضغط التام على المحقنة ، والأخرى متصلة مملوءة ب 3 مل من زراعة الخلايا (الشكل 2E). يتم استخدامها معا لإزالة الفقاعات من الوعاء ، وهو أمر مهم للحفاظ على علاج SMG. بشكل عام ، ينصح بإعداد عنصري تحكم سلبيين ، يمكن الإشارة إليهما باسم عنصر التحكم "Flask" وعنصر التحكم "1G". يتوافق عنصر التحكم "القارورة" مع الخلايا التي تزرع في قارورة ثقافة الخلايا المعلقة T25 القياسية. يتوافق عنصر التحكم 1G مع الخلايا التي تزرع في وعاء الاستزراع المتخصص سعة 10 مل ، والذي يتم وضعه ببساطة في الحاضنة (أي دون التعرض لعلاج SMG). يرجى الاطلاع على قسم المناقشة للحصول على مزيد من التفاصيل حول عناصر التحكم.
الطريقة الموصوفة هنا مناسبة لأي باحث يتطلع إلى دراسة آثار SMG على الخلايا الليمفاوية ، مع التركيز بشكل خاص على الخلايا القاتلة الطبيعية باستخدام خط الخلية NK9213. قد تساعدنا نتائج هذه الدراسات على فهم أفضل وتخفيف الآثار الضارة لرحلات الفضاء على جهاز المناعة البشري.
Protocol
ملاحظة: يجب إكمال الخطوات التالية داخل خزانة أمان بيولوجي معقمة.
1. إعداد الأوعية لزراعة الخلايا
- أخرج أوعية الاستزراع من العبوة البلاستيكية. قم بتسمية كل وعاء على الحافة وفقا لنوع / خط الخلية المستخدم ، سواء كان التحكم (1G) أو العلاج (SMG) ، وأي معلومات أخرى ذات صلة.
- ثبت الوعاء وافتح منفذ التعبئة بعناية ، دون لمس ربط غطاء منفذ التعبئة / الحلقة O. ضع الغطاء على وسادة الإيثانول ، مع توجيه الوتد / الحلقة O لأعلى ، أثناء ملء الوعاء. لا تقم بإزالة الأغطية من منافذ الحقن.
ملاحظة: إذا تم لمس الوتد / الحلقة O عن طريق الخطأ ، فقم برش ربط الغطاء بنسبة 70٪ من الإيثانول واتركه (متجها لأعلى) لبضع لحظات أثناء ملء الوعاء. عندما تكون جاهزا لإغلاق منفذ التعبئة مرة أخرى ، التقط الغطاء بمنديل ورقي جديد لتجفيف الغطاء تماما قبل وضعه مرة أخرى على الوعاء. - قم بتحميل الوعاء ب 10 مل من الوسائط الكاملة المناسبة لزراعة الخلايا باستخدام ماصة مصلية معقمة ، ثم ضع الغطاء بعناية مرة أخرى على منفذ التعبئة.
ملاحظة: هنا ، تم استخدام خط الخلايا NK92 NK ، والذي تم زراعته في وسائط GM1 ، كما تم التحقق من صحته سابقا في تجربة سريرية باستخدام خلايا NK92 كعلاج خلوي14. تعتمد وسائط الاستزراع المستخدمة على خط الخلية أو نوع الخلية التي يتم استزراعها. يرجى التحقق من موقع المورد للحصول على وصفة الوسائط الصحيحة لخط الخلية أو نوع الخلية المستخدمة. - تأكد من إغلاق أغطية منفذ المحقنة ومنفذ التعبئة بإحكام ، ووضع الأوعية المملوءة في حاضنة 37 درجة مئوية ، 5٪ CO2 أثناء تنفيذ الخطوات اللاحقة لتجهيز الأوعية لزراعة الخلايا.
ملاحظة: تساعد خطوة التحضير هذه على تقليل تكوين الفقاعات الكبيرة لتسهيل طرد الفقاعات لاحقا في الخطوة 6.
2. إعداد ثقافة خلايا المخزون لإعداد علاج SMG
- عندما لا تكون قيد الاستخدام ، قم بتخزين الخلايا ذات الأهمية عند درجة حرارة أقل من -130 درجة مئوية أو ، من الناحية المثالية ، في مرحلة بخار النيتروجين السائل.
- ما لا يقل عن 1 أسبوع قبل إعداد العلاج المخطط له ، قم بإذابة الخلايا واستزراعتها باستخدام وصفة وسائط زراعة الخلايا المناسبة الموجودة على موقع المورد. خطط لعدد الخلايا اللازمة لإعداد العلاج (التفاصيل أدناه في الخطوات اللاحقة) وتأكد من بدء الثقافات في وقت مبكر بما يكفي للسماح بالانتشار الكافي والتكيف مع الثقافة.
- قم بتخزين ثقافة الخلايا في حاضنة 37 درجة مئوية ، 5٪ CO2 . يتم تغطية مزيد من التفاصيل حول ممارسة زراعة الخلايا القياسية في مكان آخر15.
- في يوم إعداد علاج SMG المخطط له ، حدد تركيز البدء وصلاحية ثقافة الخلية الأولية.
- استخدم الطريقة المفضلة لتحديد تركيز مزرعة الخلية الأولية (على سبيل المثال ، مقياس الدم ، ViCell ، قياس التدفق الخلوي ، إلخ). لاحظ تركيز الخلية القابل للحياة (الخلايا لكل مل) وقابلية البقاء (٪) للخلايا ، مما يضمن أن تكون الصلاحية أكبر من 85٪ بشكل مثالي. يمكن العثور على بروتوكول لاستخدام مقياس الدم في مكان آخر16.
- تحديد كثافة / تركيز بذر الخلية المناسب لثقافة الخلية لعلاج SMG من خلال النظر في نطاق تركيز الخلية الأمثل لنوع / خط خلية معين ، ووقت مضاعفتها ، وطول علاج SMG. يرجى الرجوع إلى قسم المناقشة لمزيد من التفصيل.
ملاحظة: من التجربة ، يتراوح نطاق التركيز الأمثل لخلايا NK92 بين 0.3 × 10 6- 1.2 × 106 خلايا / مل. بشكل عام ، هذه الخلايا لها وقت مضاعف من 48-72 ساعة ويتم تغذيتها كل 2-3 أيام على هذا النحو. بالنظر إلى أن طول العلاج كان 72 ساعة ، تم زرع الخلايا في الطرف الأدنى من نطاقها الأمثل عند 0.4-0.5 × 106 خلايا / مل. يوصي المورد أيضا بكثافة البذر هذه عند بدء زراعة الخلايا الأولية من قارورة جديدة من خلايا NK92. - تحديد حجم زراعة خلايا المخزون اللازمة لإعداد العلاج والضوابط.
ملاحظة: هناك حاجة إلى 10 مل من زراعة الخلايا لكل مجموعة تجريبية. إذا تم إعداد ثلاث مجموعات تجريبية (أي علاج واحد: "SMG" ، وضابطان سلبيان: "قارورة" و "1G") ، فإن 10 مل أخرى من زراعة الخلايا تكفي للقسمة في أنبوب 15 مل يستخدم لتحميل محاقن HARV. هذا هو 40 مل في المجموع ، والتي قد تتقلب اعتمادا على التصميم التجريبي المحدد. - تحديد عدد الخلايا اللازمة لإعداد العلاج.
- احسب العدد الإجمالي للخلايا المطلوبة بضرب كثافة البذر المختارة (الخلايا / مل) في الحجم الإجمالي المطلوب (مل).
ملاحظة: من التجربة مع NK92 ، يتم تحضير 40 مل من زراعة خلايا المخزون كما هو مفصل أعلاه بتركيز بذر 0.4-0.5 × 106 خلايا / مل. على هذا النحو ، هناك حاجة إلى 16-20 × 106 خلايا NK92 لإكمال إعداد العلاج النموذجي. بالنسبة لخط خلايا NK92 ، يعد استخدام خلايا أكثر قليلا أفضل من عدد أقل قليلا من الخلايا للحفاظ على قابلية عالية للبقاء طوال فترة العلاج.
- احسب العدد الإجمالي للخلايا المطلوبة بضرب كثافة البذر المختارة (الخلايا / مل) في الحجم الإجمالي المطلوب (مل).
- تحديد حجم زراعة الخلية الأولية للدوران.
- بالنظر إلى أن تركيز الخلية يتم تمثيله كخلايا / مل ، اقسم العدد الإجمالي للخلايا (الخلايا) اللازمة للتجربة على تركيز البدء المقاس لثقافة الخلية (الخلايا / مل).
ملاحظة: على سبيل المثال ، إذا كانت هناك حاجة إلى 16 × 10 6 خلايا وكان تركيز البدء للثقافة 0.8 × 106 خلايا / مل ، فيجب تدوير 20 مل من المستزرع.
- بالنظر إلى أن تركيز الخلية يتم تمثيله كخلايا / مل ، اقسم العدد الإجمالي للخلايا (الخلايا) اللازمة للتجربة على تركيز البدء المقاس لثقافة الخلية (الخلايا / مل).
- جعل ثقافة خلية الأسهم النهائية.
- أجهزة الطرد المركزي العدد المناسب من الخلايا عند 300 × جم لمدة 8 دقائق في أنبوب مخروطي سعة 50 مل.
- اسكب المادة الطافية بعناية في حاوية نفايات ، وحرك الأنبوب برفق لإعادة تعليق الحبيبات في الحجم الصغير المتبقي.
- أعد تعليق الخلايا في الحجم المناسب من الوسائط الكاملة الدافئة (37 درجة مئوية) لإحضار الثقافة إلى كثافة البذر المطلوبة. تم حساب هذا الحجم في الخطوة 2.6.
- قم بتغطية الأنبوب سعة 50 مل بإحكام ، وقم بقلبه برفق عدة مرات لخلط تعليق الخلية جيدا.
ملاحظة: إذا كانت هناك حاجة إلى أكثر من 50 مل لإعداد التجربة الكاملة ، فمن الأفضل طرد مركزي العدد الإجمالي للخلايا اللازمة في أنبوب مخروطي سعة 50 مل وإعادة تعليقه بنصف الحجم المطلوب. بعد ذلك ، امزج جيدا وقم بعمل تخفيف 1: 2 في أنبوب مخروطي منفصل سعة 50 مل. على سبيل المثال ، إذا كانت هناك حاجة إلى 100 مل عند 0.4 × 10 6 خلايا / مل ، فقم بتدوير 40 × 106 خلايا في أنبوب 50 مل ، وأعد التعليق في 50 مل من الوسائط ، وانقل 25 مل إلى أنبوب 50 مل آخر ، ثم قم بتعبئة كليهما ب 25 مل من الوسائط الجديدة.
3. تحميل السفن مع ثقافة خلية الأسهم
- استرجع الأوعية المهيأة للوسائط من الحاضنة.
- إذا تم استخدام عنصر تحكم "قارورة" ، فقم بتحميل قارورة ثقافة التعليق T25 ب 10 مل من زراعة الخلايا من المخزون المحضر أعلاه. أضف أيضا 10 مل من زراعة خلايا المخزون إلى أنبوب مخروطي منفصل سعة 15 مل ، والذي سيتم استخدامه لتحميل المحاقن.
- قم بفك أغطية منفذ المحقنة لإزالتها من السفينة وتأكد من أن محبس المحابس في وضع الفتح (الشكل 2C).
- ثبت الوعاء وافتح منفذ التعبئة بعناية ، دون لمس ربط غطاء منفذ التعبئة / الحلقة O. ضع الغطاء على وسادة الإيثانول ، مع توجيه الوتد / الحلقة O لأعلى ، أثناء ملء الوعاء. قم بفك الأغطية بعناية من منافذ الحقن.
- تأكد من أن المحبس في الوضع المفتوح (الشكل 2C). اسكب الوسائط بعناية من الوعاء في حاوية نفايات ، أو قم بإزالة الوسائط باستخدام ماصة مصلية ، أو قم باستنشاقها باستخدام ماصة باستور زجاجية معقمة متصلة بنظام التفريغ ، دون لمس غشاء الأكسجين.
- أغلق بإحكام الأنبوب المخروطي سعة 50 مل الذي يحتوي على مزرعة خلايا المخزون واقلبه برفق عدة مرات لخلط المحتويات جيدا.
- ارسم 10 مل من مخزون زراعة الخلايا من أنبوب 50 مل باستخدام ماصة مصلية معقمة جديدة. التقط الوعاء وقم بإمالته بحيث يكون منفذ التعبئة باتجاه الأعلى ثم قم بتوزيع مخزون زراعة الخلايا بعناية في الوعاء من خلال منفذ التعبئة.
ملاحظة: كن حذرا وراقب مستوى الصوت حتى لا تتسرب الثقافة عبر منافذ الحقن أثناء إمالة الوعاء. - تهدف إلى ملء السفينة مباشرة إلى أعلى شفة منفذ التعبئة دون انسكاب ؛ قم بإمالة الوعاء لأسفل أثناء ملئه لتجنب انسكابه. احرص على عدم لمس غشاء الأوكسجين بالماصة لأنه هش للغاية.
ملاحظة: قد تستغرق عملية ملء الوعاء بعض الممارسة ؛ التحلي بالصبر والذهاب ببطء. إذا تشكل فيلم فقاعة عند فتح منفذ التعبئة ، فسوف يتداخل ذلك مع تحميل الوعاء. إذا حدث هذا ، فاضغط برفق على الوعاء لكسر الختم الناتج عن فيلم الفقاعة. - بمجرد تحميل الوعاء ، ضع غطاء منفذ التعبئة بعناية مرة أخرى ، مع التأكد من عدم لمس الوتد / الحلقة O.
- ضع على المحاقن.
ملاحظة: يوجد منفذا حقنة على وجه السفينة (الشكل 2 أ). سيحمل أحدهما حقنة فارغة ، والآخر سيحمل حقنة مليئة بزراعة الخلايا (الشكل 2E).- أولا ، قم بتوصيل المحقنة الفارغة سعة 3 مل بأحد منافذ الحقن ، مع التأكد من أن المحقنة مكتئبة تماما.
ملاحظة: قم بضخ المحاقن عدة مرات قبل توصيلها بالوعاء لأنها ضيقة بعض الشيء في البداية. افعل ذلك داخل خزانة السلامة البيولوجية للحفاظ على العقم. - أغلق الأنبوب المخروطي سعة 15 مل بإحكام مع 10 مل من مزرعة الخلايا المقتبسة واقلبه برفق عدة مرات لخلط المحتويات جيدا.
- بعد ذلك ، قم بغمر المحقنة الثانية سعة 3 مل بعناية في ثقافة الخلايا ووضع بعض الثقافة. لتقليل فقاعة الهواء في الجزء العلوي من المحقنة ، قم بتوزيعها تماما في الأنبوب ، ثم ارسم 3 مل من الثقافة.
- قم بتوصيل المحقنة المملوءة بمنفذ الحقنة المتبقي ، وقم بتعقيم المحاقن بعناية وحول منفذ التعبئة باستخدام وسادة الإيثانول. لا تحصل على الإيثانول على غشاء الأكسجين. الآن السفينة جاهزة للتخلص من الفقاعات.
ملاحظة: يصعب تحميل المحقنة الثانية المملوءة للوعاء الثاني نظرا لعمق الأنبوب سعة 15 مل. يساعد على إمالة الأنبوب أثناء ملء المحقنة للحفاظ على الختم بين المحقنة التي يتم ملؤها وثقافة الخلية. - كرر الخطوات 3.3-3.10 للسفن المتبقية. إذا كان هناك كمية غير كافية قليلا من زراعة الخلايا المتبقية في الأنبوب المخروطي 50 مل للوعاء الأخير (على سبيل المثال ، 9.5 مل بدلا من 10 مل) ، استرجع الكمية المتبقية من الأنبوب المخروطي 15 مل المستخدم لتحميل المحاقن.
ملاحظة: لا يلزم أن تتم الخطوات التالية داخل خزانة أمان بيولوجي معقمة ، حيث أصبحت السفينة الآن نظاما مغلقا ومعقما.
- أولا ، قم بتوصيل المحقنة الفارغة سعة 3 مل بأحد منافذ الحقن ، مع التأكد من أن المحقنة مكتئبة تماما.
4. إزالة الفقاعات من الأوعية
ملاحظة: الفقاعات أمر لا مفر منه في هذا الإعداد ويجب إزالتها باستمرار طوال فترة العلاج (الشكل 3). يرجى الرجوع إلى قسم المناقشة لمزيد من التفاصيل حول هذا الموضوع.
- تأكد من أن محبس منفذ الحقن في الوضع المغلق (الشكل 2 د) للحد من هجرة الخلايا والفقاعات من المحاقن إلى الأوعية. هذا مهم بشكل خاص في وقت لاحق أثناء العلاج (تمت مناقشته أدناه). لجمع الفقاعات الأولية ، اقلب الوعاء رأسا على عقب واضغط على جانبه عدة مرات.
- اقلب الوعاء بسرعة للخلف ليواجه لأعلى ثم بزاوية طفيفة متجهة بعيدا بحيث تطفو جميع الفقاعات إلى الجانب العلوي من الوعاء (الشكل 3 ب).
- قم بمناورة الفقاعات الموجودة أسفل المنفذ باستخدام المحقنة الفارغة وشاهدها تبدأ في الدخول إلى المنفذ. افتح كلا من محبس منفذ المحقنة (الشكل 2C).
- اضرب الوعاء برفق لتشجيع الفقاعات على الطفو في المحقنة الفارغة. تمتص ببطء الفقاعات الكبيرة باستخدام المحقنة الفارغة ، مع الضغط بعناية على المحقنة الكاملة ، للحفاظ على الضغط في الوعاء حتى لا ينفجر غشاء الأكسجين.
ملاحظة: يجب امتصاص الفقاعات الكبيرة ، في حين يمكن تشجيع الفقاعات الصغيرة والفقاعات الدقيقة على الطفو في المحقنة عن طريق المناورة بها في منافذ الحقن وضرب الوعاء برفق. بعد بضع ساعات من العلاج ، من المهم للغاية تقليل "التلوث المتبادل" بين الخلايا الموجودة في المحاقن والخلايا الموجودة في وعاء الثقافة. وذلك لأن الخلايا الموجودة في المحاقن لا تتلقى نفس الكمية من الأوكسجين أو التعرض لرشاش الرذاذ كما تفعل الخلايا الموجودة في الوعاء. - كرر الخطوات 4.2-4.4 عدة مرات لضمان إزالة جميع الفقاعات. قم بإزالة جميع الفقاعات بما في ذلك الفقاعات الدقيقة من الأوعية.
ملاحظة: يمكن رؤية الفقاعات بسهولة من خلال غشاء الأوكسجين (الجزء الخلفي من الوعاء) عندما يستهدف الوعاء مصدر ضوء (نافذة ، ضوء ، إلخ). عند تنفيذ الخطوتين 4.2 و 4.3 ، انظر إلى الفقاعات التي تتحرك من الجزء الخلفي من الوعاء للمساعدة في تصور الفقاعات التي يصعب رؤيتها. - عندما تتم إزالة الفقاعات بشكل فعال ، أغلق محبس منفذ المحقنة. حافظ على تشغيل المحاقن أثناء العلاج للسماح بإزالة الفقاعات اللاحقة ، مما يضمن أن الحجم في كلتا الحقنتين متساو تقريبا.
5. ربط السفينة بالقاعدة الدوارة
- امسح بعناية سطح القاعدة الدوارة وكابل الشريط بنسبة 70٪ إيثانول.
- تأكد من توصيل كبل الشريط المرفق بموفر الطاقة. ضع القاعدة الدوارة في الحاضنة وقم بتوصيل كابل الشريط بالقاعدة. تأكد من إبقاء مصدر الطاقة بالقرب من الحاضنة ولكن خارجها. يصور الشكل 4 القاعدة الدوارة ومصدر الطاقة للسياق.
- قم بتوصيل وعاء معالجة SMG عن طريق اصطفاف خيوط الوعاء بالوتد الدوار وتدوير الوتد الدوار برفق على القاعدة في اتجاه عكس اتجاه عقارب الساعة. تأكد من توصيل السفينة بإحكام. تأكد من أن الحاضنة تحافظ على رطوبة قريبة من 100٪ عن طريق ملء صينية المياه بكمية كافية من مياه التناضح العكسي (RO).
- اختر سرعة دوران مناسبة (دورة في الدقيقة). اضبط سرعة الدوران لتتناسب مع سرعة ترسيب الخلايا ، بحيث لا "تسقط الخلايا عبر الوسائط" على الإطلاق ولكن ينتهي بها الأمر بالدوران في مسار مداري صغير. يتم تصور هذه الظاهرة كمخطط تخطيطي في الشكل 1.
ملاحظة: توصي الشركة ببدء الدوران عند 8-10 دورة في الدقيقة للخلايا الليمفاوية. في هذه الحالة ، تم تدوير خلايا NK92 عند 11 دورة في الدقيقة ، كما هو موضح في ورقة سابقة17. اعتمادا على حجم الخلية ، يجب زيادة عدد الدورات في الدقيقة للخلايا الأكبر وتقليل الخلايا الأصغر. ينطبق نفس النمط إذا كانت الخلايا المستخدمة تميل إلى التكتل أثناء الزراعة. يرجى الاطلاع على قسم المناقشة لمزيد من التفاصيل حول هذا الموضوع.
6. العلاج
- اختر مدة العلاج المناسبة لتطبيق البحث ، والتي قد تعتمد على معلمات وظيفة الخلية / علم وظائف الأعضاء التي يتم فحصها. يرجى الاطلاع على قسم المناقشة لمزيد من التفاصيل حول هذا الموضوع.
ملاحظة: في هذه الحالة ، تعرضت خلايا NK92 لعلاج رشاش 72 ساعة ، بناء على نتائج الدراسات السابقة18,19. سوف تتشكل الفقاعات حتما طوال فترة العلاج وستحتاج إلى إزالتها. يمكن إيقاف الدوران لفترة وجيزة وإعادة تشغيله لتسهيل ذلك. راجع الخطوة 7.1 لمعرفة كيفية إزالة سفينة SMG بأمان. - في اليوم الأول من إعداد العلاج ، تحقق من تكوين الفقاعات كل بضع ساعات عن طريق تكرار الخطوات 4.2-4.6. بعد اليوم الأول ، تحقق من الأوعية حسب الضرورة (مرة واحدة على الأقل يوميا) ، كرر الخطوات 4.2-4.6 ، حتى نهاية العلاج.
7. حصاد الخلايا من الأوعية
- بمجرد انقضاء طول العلاج المخطط له ، أوقف الدوران وفك الجهاز. قم بإزالة وعاء معالجة SMG عن طريق تثبيت الوعاء برفق أثناء تدوير الوتد الدوار للجهاز في اتجاه عقارب الساعة.
- أحضر قارورة التحكم ، والتحكم في وعاء 1G ، ووعاء SMG المعالج في خزانة أمان بيولوجي معقمة.
- خذ كل وعاء (1G و SMG فقط ؛ وليس القارورة) واقلبه رأسا على عقب بحيث يواجه لأسفل وضربه برفق لتعليق جميع الخلايا. بعد ذلك ، أدر الوعاء على جانبه مع منفذ التعبئة نحو الأسفل واضغط على الوعاء مرة أخرى لتشجيع الخلايا نحو منفذ التعبئة من أجل الشفط الفعال.
- تعامل مع كل سفينة على حدة. قم بفك المحاقن من المنفذين وتخلص منها في النفايات البيولوجية. افتح محبس على منافذ الحقن.
- قم بإزالة غطاء منفذ التعبئة بعناية وارسم المحتويات باستخدام ماصة مصلية معقمة سعة 10 مل ، مع إمالة الوعاء أثناء تفريغه. قم بتوزيع محتويات مجموعات "القارورة" و "1G" و "SMG" في أنابيب مخروطية سعة 15 مل تحمل علامات فردية.
- أغلق كل أنبوب واقلبه برفق عدة مرات للتأكد من خلطه بشكل صحيح. استخدم الطريقة المفضلة لتحديد تركيز وصلاحية ثقافة الخلية الناتجة للتحضير للاستخدام في المقايسات التجريبية اللاحقة.
النتائج
تعتبر طريقة الاستزراع هذه ناجحة إذا 1) كان تكاثر الخلايا متسقا تقريبا عبر المجموعات الضابطة (ومن الناحية المثالية جميع المجموعات التجريبية) ، 2) كان الانتشار مناسبا نظرا لكثافة البذر وطول المعالجة ووقت مضاعفة نوع / خط الخلية ، و 3) كانت صلاحية الخلايا المحصودة 85٪ أو أعلى (الجدول 1 ). من الناحية المثالية ، يجب أن تكون الخلايا الناتجة صحية كما هي في زراعة الخلايا القياسية ، خاصة للاستخدام في التجارب والمقايسات اللاحقة (أي قابلية البقاء بنسبة 85٪ أو أعلى). تعتبر طريقة الاستزراع هذه غير ناجحة إذا كان العكس صحيحا ، حيث تموت الخلايا الناتجة ، أو تختلف اختلافا كبيرا في الانتشار عبر المجموعات الضابطة ، أو تكون قابلة للحياة دون المستوى الأمثل حوالي 70٪ أو أقل (الجدول 1). قد يختلف الانتشار في مجموعة علاج SMG أو لا يختلف مقارنة بالضوابط ، اعتمادا على كيفية تأثير علاج SMG على فسيولوجيا الخلية. ومع ذلك ، لم تكن هذه مشكلة حتى الآن ، وكان تكاثر الخلايا متساويا تقريبا عبر مجموعات التحكم والعلاج (الجدول 1). كما ذكرنا سابقا ، تعد هذه المعلمات مهمة لنجاح المقايسات والتجارب النهائية ، ويجب أن تؤدي الخلايا الناتجة من مجموعتي التحكم أداء مشابها نسبيا.
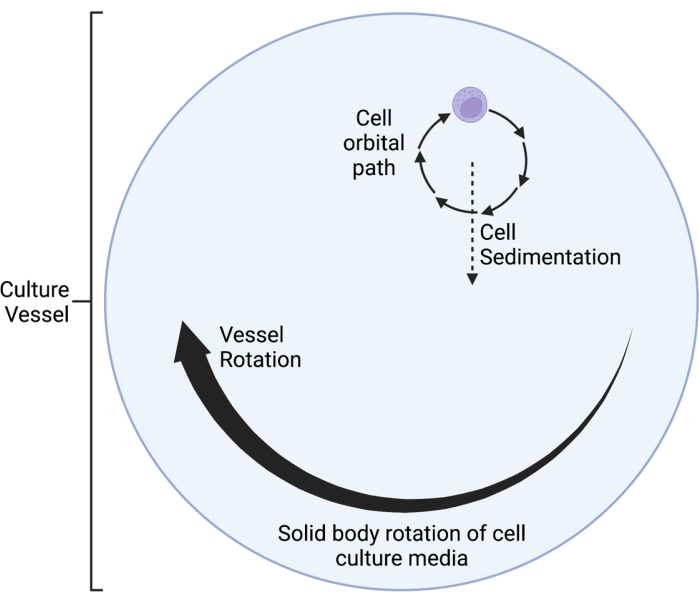
الشكل 1: رسم تخطيطي للمسار المداري الموضعي للخلايا المزروعة داخل وعاء محاكاة الجاذبية الصغرى (SMG) أثناء التشغيل. يعمل كلينستات RWV 2D الموصوف هنا على مبدأ إبطال متجه الجاذبية متوسط الوقت5،6،8،9 ، حيث يتم اختيار متجه الجاذبية بشكل عشوائي من خلال دوران ثقافة الخلية على محور أفقي. يتم تحقيق ذلك من خلال مطابقة سرعة دوران وعاء الاستزراع مع سرعة ترسيب الخلايا. بعد مرحلة التسريع الأولية ، تصل الوسائط في وعاء الاستزراع في النهاية إلى "دوران الجسم الصلب" بمرور الوقت. يحفز هذا الدوران الأفقي أيضا التدفق الصفحي في وعاء زراعة الخلايا. هذا يخلق بيئة "قص منخفضة" ، بالنظر إلى أن إجهاد القص الناجم عن الخلايا عن طريق التدفق الصفحي أقل بكثير من التدفق المضطرب. ومع ذلك ، بالنظر إلى أن clinostat ليس نظاما مثاليا ، فهناك بعض حركات السوائل الصفائحية الصغيرة التي يتم إدخالها ، والتي تسبب الحد الأدنى من إجهاد القص على الخلايا. على هذا النحو ، يتم سحب الخلايا المعلقة في الوسائط بواسطة هذا التدفق أثناء الدوران. أثناء الدوران الأفقي ، يعمل ناقل الجاذبية على الخلايا ويجلبها إلى مسار متذبذب ، والذي يتم تصوره هنا. عندما يدور وعاء الاستزراع على محور أفقي ، يدور ناقل الجاذبية الذي تتعرض له الخلايا أيضا. بمرور الوقت ، يقترب متوسط ناقل الجاذبية الدوار هذا من الصفر. تسمى هذه الظاهرة "إبطال ناقل الجاذبية المتوسط زمنيا" ، وتؤدي إلى حالة SMG5،6،8،9. تم تعديل هذا الرقم من كاسترو وآخرون ، 201120. تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: وعاء نسبة عرض إلى ارتفاع عالية 10 مل (HARV). (أ) منظر من أعلى ل HARV ، يوضح منفذ التعبئة الرئيسي ومنفذي حقنة. (B) يظهر الجزء الخلفي من HARV المنفذ اللولبي لتوصيل HARV بالقاعدة الدوارة وغشاء الأكسجين. (C) منظر جانبي ل HARV يظهر منافذ حقنة مفتوحة (مغطاة). (D) منظر جانبي ل HARV يظهر منافذ المحاقن المغلقة (مغطاة). (ه) منظر جانبي ل HARV يظهر المحقنتين سعة 3 مل المرفقتين ؛ تمتلئ المحقنة اليسرى بزراعة الخلايا والمحقنة اليمنى فارغة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الفقاعات في HARV. (أ) منظر عين الطائر ل HARV ، يوضح الفقاعات التي يجب التخلص منها من مزرعة الخلية. (B) منظر جانبي ل HARV ، يظهر نفس الفقاعات. لاحظ كيف تختلف الفقاعات في الحجم ؛ يجب إزالة الفقاعات الدقيقة أيضا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: القاعدة الدوارة ومصدر الطاقة لجهاز RWV . (أ) منظر أمامي للقاعدة الدوارة ، يظهر أربعة أوتاد دوارة يمكن أن تستوعب ما يصل إلى أربعة أوعية استزراع. ( B) منظر خلفي للقاعدة الدوارة، يوضح مدخل كبل الشريط (غير المصورة) الذي يربط القاعدة ومصدر الطاقة. (ج) منظر أمامي لمصدر الطاقة المزود بأعلى الحاضنة. لاحظ مفتاح التشغيل / الإيقاف على اليسار وقرص ضبط دورة في الدقيقة على اليمين. يتم توصيل مصدر الطاقة بأقرب منفذ (عادة في الجزء الخلفي من الحاضنة) ويتضمن مدخلا لكابل الشريط للاتصال بالقاعدة الدوارة. يبقى مصدر الطاقة خارج الحاضنة. يتم وضع القاعدة داخل الحاضنة (37 °C ، 5٪ CO2) أثناء التشغيل ، ويتم تغذية كابل الشريط من خلال باب الحاضنة وتوصيله بمصدر الطاقة. لا يتداخل كابل الشريط مع ختم الحاضنة. عندما لا تكون القاعدة الدوارة قيد الاستخدام ، يجب أن تبقى خارج الحاضنة ، وتخزينها بأمان على مقعد أو رف مختبر. ارجع إلى جدول المواد للحصول على تفاصيل الجهاز التجاري المستخدم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| # | بدء الجدوى | خلايا كثافة البذر / مل | الجدوى النهائية (F) | الجدوى النهائية (1G) | الجدوى النهائية (SMG) | نهاية Conc (F) الخلايا / مل | نهاية Conc (1G) خلايا / مل | خلايا نهاية Conc (SMG) / مل | تلاحظ | |||||
| قابلية البدء دون المستوى الأمثل وكثافة البذر (نتيجة سلبية) | 1 | 79% | 0.2 س 106 | 67% | 60% | 60% | 0.10 س 106 | 0.075 س 106 | 0.071 س 106 | أدت كثافة البذر المنخفضة وقابلية البدء دون المستوى الأمثل إلى موت الخلايا على مدار فترة العلاج | ||||
| 2 | 73% | 0.2 س 106 | 43% | 63% | 70% | 0.071 س 106 | 0.081 س 106 | 0.085 س 106 | ||||||
| الجدوى المثلى لبدء التشغيل وكثافة البذر (نتيجة إيجابية) | 3 | 93% | 0.4 س 106 | 93% | 93% | 96% | 1.2 س 106 | 1.1 س 106 | 1.5 س 106 | أدت كثافة البذر المناسبة وقابلية البدء المثلى إلى نمو الخلايا السليمة وصلاحيتها طوال فترة العلاج | ||||
| 4 | 92% | 0.4 س 106 | 92% | 92% | 94% | 0.81 س 106 | 0.80 س 106 | 0.70 س 106 | ||||||
الجدول 1: مخطط مقارنة يوضح علاجات محاكاة الجاذبية الصغرى (SMG) غير الناجحة والناجحة. تمت مقارنة قابلية بدء NK92 وكثافات البذر مع الجدوى النهائية الناتجة والتركيزات النهائية بعد معالجة SMG لمدة 72 ساعة في حاضنة زراعة الخلايا 37 درجة مئوية مكملة بنسبة 5٪ CO2. تمت مقارنة حالتين من النتائج السلبية وحالتين من النتائج الإيجابية. للمقارنة ، لاحظ أن نطاق التركيز الأمثل لخط خلية NK92 المستخدم كان بين 0.3 × 10 6 خلايا / مل و 1.2 × 106 خلايا / مل ، مع مضاعفة الوقت حوالي 2-3 أيام.
Discussion
بينما تستعد البشرية لبعثات فضائية أطول إلى القمر والمريخ ، يجب إجراء المزيد من الأبحاث للتخفيف من المخاطر الصحية الخطيرة على رواد الفضاء. ومن الجوانب الرئيسية للبيئة الفضائية التي تؤثر على فسيولوجيا الإنسان الجاذبية الصغرى. هنا ، تم وصف طريقة زراعة الخلايا لإخضاع الخلايا الليمفاوية لرشاش الدم باستخدام نظام زراعة الخلايا الدوارة المتاح تجاريا.
يحتوي هذا البروتوكول على بعض الخطوات الهامة التي قد تحتاج إلى تحسين اعتمادا على نوع الخلية أو الخط المستخدم. وتشمل هذه 1) اختيار كثافة البذر المناسبة اعتمادا على وقت مضاعفة الخلايا وطول علاج SMG ، و 2) تحديد طول العلاج الأمثل وسرعة الدوران والضوابط المناسبة. يجب أن يكون اختيار كثافة البذر في النطاق المتوسط لتركيزات الخلايا المناسبة لنوع الخلية أو الخط الذي تتم دراسته كافيا. ومع ذلك ، فإن اختيار كثافة البذر منخفضة جدا قد يؤدي إلى انخفاض تكاثر الخلايا وصلاحيتها (الجدول 1) ، واختيار كثافة عالية جدا قد يؤدي إلى استنفاد المغذيات قبل الأوان وانخفاض صلاحية الخلية. تعتمد كثافة البذر المختارة أيضا على وقت مضاعفة الخلايا التي تتم دراستها ؛ قد يتم زرع الخلايا ذات وقت المضاعفة الأقصر بكثافة أقل ، وتلك التي لها وقت مضاعفة أطول قد تحتاج إلى البذر بكثافة أعلى. تعتمد كثافة البذر وطول العلاج أيضا على عدد الخلايا اللازمة لإكمال المقايسات التجريبية اللاحقة. من التجربة ، فإن البذر عالي القابلية للحياة (90٪ +) خلايا NK92 عند 0.4-0.5 × 10 6 خلايا / مل في أوعية سعة 10 مل (أي 4-5 ملايين خلية لكل مجموعة تجريبية ؛ النطاق الأمثل لخط الخلية = 0.3 × 10 6-1.2 × 10 6 خلايا / مل ، مضاعفة الوقت = 2-3 أيام) ومعالجتها لمدة 72 ساعة قد أسفرت عن ما يقرب من 8-15 مليون خلية (الجدول 1). على هذا النحو ، كانت الأوعية سعة 10 مل مناسبة لحصاد الخلايا لكل من المقايسات الوظيفية (3 × 10 6 خلايا) وخلايا التجميع ل qPCR (1 × 10 6 خلايا) واللطخة الغربية (2 × 10 6-6 × 10 6 خلايا). يمكن أيضا جمع المواد الطافية لتحليل المكونات الإفرازية. ومع ذلك ، تتوفر أيضا أوعية سعة 50 مل ويمكن استخدامها عند الحاجة إلى زيادة إنتاجية الخلايا. عند استخدام أوعية سعة 50 مل ، يجب أيضا استخدام محاقن أكبر.
يعتمد تحديد مدة العلاج المناسبة أيضا على نوع / خط الخلية المستخدم. في حالة وجود دراسات سابقة ، يجب الرجوع إليها من أجل اختيار مدة العلاج المناسبة للبدء بها. استخدمت بعض الدراسات أجهزة RWV لزراعة الخلايا القاتلة الطبيعية ، ويشار إليها هنا17،18،19. من هناك ، يجب فحص نتائج العلاج أو مدى تكاثر الخلايا وصلاحيتها ، وأدائها في المقايسات التجريبية اللاحقة. قد يكون من الممكن تمديد طول العلاج إلى ما بعد 72 ساعة عن طريق إزالة مزرعة الخلايا من الأوعية إلى أنبوب ، والطرد المركزي ثم إعادة تعليق الخلايا في 10 مل من وسائط الاستزراع الكاملة الدافئة والطازجة ، واستبدالها في الأوعية ، وإعادة بدء الدوران. ومع ذلك ، قد يؤدي ذلك إلى حدوث ارتباك بسبب التعرض للجاذبية المفرطة من خلال الطرد المركزي ، وقد يكون من الضروري تقسيم / تمييع الخلايا لضمان بقاء الخلايا ضمن نطاق تركيزها الأمثل. في حالة استخدام أي جزيئات محفزة (مثل LPS ، السيتوكينات ، إلخ) ، يوصى بإضافتها بتركيز مناسب إلى وصفة الوسائط الكاملة قبل إعداد علاج SMG.
يعد تحديد سرعة الدوران المناسبة (rpm) أيضا أمرا أساسيا للحفاظ على معالجة الجاذبية الصغرى المحاكاة. توصي الشركة بالبدء بسرعة دوران تتراوح بين 8 و 10 دورات في الدقيقة عند زراعة الخلايا الليمفاوية. من التجربة ، عملت سرعة 11 دورة في الدقيقة بشكل جيد لضمان إبقاء خلايا NK92 معلقة وتم استخدامها في دراسة سابقة للخلايا القاتلةالطبيعية 17. اعتمادا على أنماط نمو نوع / خط الخلية المستخدم ، قد يلزم زيادة سرعة الدوران لحساب تكتل الخلية. هذا من شأنه أن يؤدي إلى زيادة ترسيب الخلايا بسبب زيادة الكتلة. للحصول على المعالجة المثلى ل SMG ، يجب تعديل سرعة دوران وعاء الاستزراع لتتناسب مع سرعة الترسيب للخلايا5،6،8،9. بمعنى آخر ، لا ينبغي رؤية الخلايا أو كتل الخلايا تسقط عبر الوسائط ، ويجب أن تظل ثابتة نسبيا.
في هذا السياق ، من الممارسات الجيدة تجربة اثنين من عناصر التحكم السلبية من خلال مقارنة الخلايا المزروعة في دورق ثقافة T25 القياسي ("قارورة") والخلايا المزروعة في HARV المتخصصة ولكنها لا تخضع ل SMG (أي وضعت للتو في الحاضنة. "1G"). من الناحية المثالية ، يجب أن يكون أداء الخلية والنتائج في المقايسات التجريبية النهائية بين الضابطين السلبيين قابلين للمقارنة. يجب ملاحظة أي تناقضات. بالنسبة لمعظم المقايسات ، من المحتمل أن تكون أفضل مقارنة بين التحكم "1G" وعلاج SMG. ومع ذلك ، قد يكون تضمين كل من عناصر التحكم "Flask" و "1G" مفيدا للمقارنة الكافية والتحسين الأولي.
تشمل القيود الرئيسية لهذا البروتوكول 1) تكوين الفقاعات أثناء زراعة الخلايا ، 2) مدى رشاش الدم ، و 3) المدة المحتملة للعلاج. من الأهمية بمكان مراقبة تكوين الفقاعات طوال فترة علاج الرشاش. حتى الفقاعات الدقيقة الصغيرة يمكن أن تتراكم وتنمو وتؤدي إلى تكوين فقاعات أكبر شديدة الاضطراب. هذه الفقاعات الكبيرة تقاطع ديناميكيات السوائل منخفضة القص داخل وعاء الاستزراع ، مما يتسبب في زيادة الاضطراب حيث ينحرف تدفق السائل حول الفقاعة21. في النهاية ، هذا يعطل تماما حالة SMG. تمت مناقشة هذه الظاهرة بإسهاب وتصورها بواسطة Phelan etal 21. بالإضافة إلى ذلك ، من المهم أن تضع في اعتبارك أن هذا الجهاز ينتج رشاشات صغيرة وليس جاذبية صغيرة حقيقية كما هو الحال على متن محطة الفضاء الدولية6. ومع ذلك ، فقد أظهرت الدراسات تأثيرات مماثلة ل SMG التي ينتجها هذا الجهاز مقارنة بتأثيرات الجاذبية الصغرى الحقيقية من الدراسات التي أجريت على محطة الفضاء الدولية1،5،6.
توجد طرق بديلة لإخضاع ثقافة الخلية ل SMG. وتشمل هذه استخدام clinostats 3D أو آلات تحديد المواقع العشوائية (RPM) والرفع المغناطيسي. تقوم clinostats 3D بتدوير ثقافة الخلية على محورين عموديين بنفس السرعة ، بينما تدور RPMs على محورين عموديين ، حيث يتم اختيار كل من سرعة واتجاه الدوران بشكل عشوائي 5,6. لذلك ، بالمقارنة مع أجهزة clinostats 2D أو RWV ، فإن RPMs أكثر تعقيدا ، مما يقدم العديد من المزايا والعيوب. أولا ، يمكن تعديل درجة الجاذبية الصغرى التي يمكن تحقيقها في دورة في الدقيقة لمحاكاة الجاذبية الجزئية ، مثل تلك التي حدثت على القمر (0.16 جم) والمريخ (0.33 جم)6. ومع ذلك ، فإن التعقيد الإضافي للاتجاهات والسرعات الدورانية العشوائية قد يؤدي إلى حركة رعشة وقوى تسارع ، خاصة نحو المناطق الخارجية لوعاء الاستزراع ، مما قد يؤدي إلى حدوث ارتباك في البيانات. يعرض الرفع المغنطيسي العينات لمجالات مغناطيسية تنافرية قوية لمواجهة وزن الماء في العينات البيولوجية ، كطريقة لمواجهة الجاذبية. ومع ذلك ، فإن المجال المغناطيسي القوي المتولد للقيام بذلك قد يؤثر سلبا أيضا على الخلايا ، وبالتالي يؤدي إلى إرباك البيانات 5,6. تتم مناقشة هذه الطرق بمزيد من التفصيل في مكان آخر 5,6.
في الختام ، فإن نظام زراعة الخلايا الدوارة المتاح تجاريا الذي تمت مناقشته هنا هو منصة سهلة الاستخدام نسبيا ويمكن الوصول إليها للعلماء الذين يتطلعون إلى دراسة آثار SMG على الخلايا الليمفاوية. في حين أن هناك قيودا على طريقة زراعة الخلايا هذه ، إلا أنها تظل خيارا قابلا للتطبيق لزراعة الخلايا الليمفاوية وربما مزارع الخلايا المعلقة الأخرى في محاكاة الجاذبية الصغرى.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
يتم دعم هذا العمل من قبل وكالة الفضاء الكندية (CSA) ، منحة بحثية (17ILSRA3 ، الملف المناعي). يود المؤلفون أن يشكروا وشكروا الدكتورة روكسان فورنييه (جامعة تورنتو) والدكتور راندال جريج (جامعة لينكولن التذكارية) وبريتيش ميلاباثولا (جامعة أريزونا) على مساعدتهم في استكشاف الأخطاء وإصلاحها الأولية لهذا البروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| Disposible High Aspect Ratio Vessel (HARV) (10 mL) | Synthecon | D-410 | Gamma sterilized culture vessels (4/box) |
| Luer-Lok tip syringes (3 mL) | BD | 309657 | For attaching to the 10 mL HARVs |
| NK92 Cell-line | ATCC | CRL-2407 | |
| Rotary Cell Culture System (RCCS) | Synthecon | RCCS-4D | Rotating wall vessel device; 2D clinostat |
| Sarsedt 15 mL conical tubes | Fisher Scientific | 50-809-220 | |
| Sarsedt 50 mL conical tubes | Fisher Scientific | 50-809-218 | |
| Sarsedt sterile serological pipettes | Fisher Scientific | 86.1254.001 | |
| T25 suspension culture flasks | Sarsedt | 83.3910.502 | For flask control |
References
- ElGindi, M., et al. May the force be with you (or not): the immune system under microgravity. Cells. 10 (8), 1941(2021).
- Choukèr, A., Ullrich, O. The Immune System in Space: Are we Prepared. , Springer International Publishing. Cham. (2016).
- Crucian, B. E., et al. Immune system dysregulation during spaceflight: potential countermeasures for deep space exploration missions. Frontiers in Immunology. 9, 1437(2018).
- Crucian, B. E., et al. Countermeasures-based improvements in stress, immune system dysregulation and latent herpesvirus reactivation onboard the International Space Station - relevance for deep space missions and terrestrial medicine. Neuroscience & Biobehavioral Reviews. 115, 68-76 (2020).
- Herranz, R., et al. Ground-based facilities for simulation of microgravity: organism-specific recommendations for their use, and recommended terminology. Astrobiology. 13 (1), 1-17 (2013).
- Ferranti, F., Del Bianco, M., Pacelli, C. Advantages and limitations of current microgravity platforms for space biology research. Applied Sciences. 11 (1), 68(2020).
- Murphy, K., Weaver, C. Janeway's Immunobiology 9th Edition. , Garland Science/Taylor & Francis Group LLC. New York, NY. (2016).
- Dedolph, R. R., Dipert, M. H. The physical basis of gravity stimulus nullification by clinostat rotation. Plant Physiology. 47 (6), 756-764 (1971).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), 12-25 (2001).
- Crabbé, A. Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen. Applied and Environmental Microbiology. 77 (4), 1221-1230 (2011).
- Ulbrich, C., et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. BioMed Research International. 2014, 1-15 (2014).
- Martinez, E. M., Yoshida, M. C., Candelario, T. L. T., Hughes-Fulford, M. Spaceflight and simulated microgravity cause a significant reduction of key gene expression in early T-cell activation. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 308 (6), 480-488 (2015).
- Jong, J., Maki, G., Klingemann, H. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Williams, B. A., et al. A phase I trial of NK-92 cells for refractory hematological malignancies relapsing after autologous hematopoietic cell. Oncotarget. 8 (51), 89256-89268 (2017).
- Cryopreservation of mammalian cell lines video protocol. Abcam. , Available from: https://www.abcam.com/protocols/cryopreservation-of-mammalian-cell-lines-video-protocol (2022).
- Counting cells using a hemocytometer. Abcam. , Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022).
- Mylabathula, P. L., et al. Simulated microgravity disarms human NK-cells and inhibits anti-tumor cytotoxicity in vitro. Acta Astronautica. 174, 32-40 (2020).
- Li, Q., et al. Effects of simulated microgravity on primary human NK cells. Astrobiology. 13 (8), 703-714 (2013).
- Shao, D., et al. Mechanisms of the effect of simulated microgravity on the cytotoxicity of NK cells following the DNA methylation of NKG2D and the expression of DAP10. Microgravity Science and Technology. 33 (1), 6(2021).
- Castro, S. L., Nelman-Gonzalez, M., Nickerson, C. A., Ott, C. M. Induction of attachment-independent biofilm formation and repression of hfq expression by low-fluid-shear culture of Staphylococcus aureus. Applied and Environmental Microbiology. 77 (18), 6368-6378 (2011).
- Phelan, M. A., Gianforcaro, A. L., Gerstenhaber, J. A., Lelkes, P. I. An air bubble-isolating rotating wall vessel bioreactor for improved spheroid/organoid formation. Tissue Engineering Part C: Methods. 25 (8), 479-488 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved