Method Article
Recuperação aprimorada do óleo usando uma combinação de biosurfactantes
Neste Artigo
Resumo
Ilustramos os métodos envolvidos na triagem e identificação dos micróbios produtores biosurfactantes. Também são apresentados métodos de caracterização cromatografia e identificação química dos biosurfactantes, determinando a aplicabilidade industrial do biosurfactante no aprimoramento da recuperação residual do óleo.
Resumo
Biosurfactantes são compostos ativos na superfície capazes de reduzir a tensão superficial entre duas fases de diferentes polaridades. Os biosurfactantes vêm surgindo como alternativas promissoras aos surfactantes químicos devido à menor toxicidade, alta biodegradabilidade, compatibilidade ambiental e tolerância a condições ambientais extremas. Aqui, ilustramos os métodos utilizados para a triagem de micróbios capazes de produzir biosurfactantes. Os micróbios produtores de biosurfactantes foram identificados usando o colapso da queda, a propagação do óleo e os ensaios do índice de emulsão. A produção biosufactante foi validada determinando a redução da tensão superficial da mídia devido ao crescimento dos membros microbianos. Descrevemos também os métodos envolvidos na caracterização e identificação de biosurfactantes. A cromatografia de camada fina do biosurfactante extraído seguido de coloração diferencial das placas foi realizada para determinar a natureza do biosurfactante. LCMS, 1H NMR e FT-IR foram utilizados para identificar quimicamente o biosurfactante. Ilustramos ainda os métodos para avaliar a aplicação da combinação de biosurfactantes produzidos para melhorar a recuperação residual do óleo em uma coluna simulada de embalagem de areia.
Introdução
Biosurfactantes são as moléculas anfípáticas de superfície ativa produzidas por microrganismos que têm a capacidade de reduzir a superfície e a tensão interfacial entre duas fases1. Um biosurfactante típico contém uma parte hidrofílica que é geralmente composta de uma moiety de açúcar ou uma cadeia de peptídeos ou aminoácidos hidrofílicos e uma parte hidrofóbica que é composta de uma cadeia de ácidos graxos saturados ou insaturados2. Devido à sua natureza anfípppica, os biosurfactantes se reúnem na interface entre as duas fases e reduzem a tensão interfacial no limite, o que facilita a dispersão de uma fase para a outra 1,3. Vários tipos de biosurfactantes que foram relatados até agora incluem glicolipídios nos quais os carboidratos estão ligados a ácidos alifáticos de cadeia longa ou hidroxia-alifáticos através de ligações éster (por exemplo, rhamnolipids, trehalolipids e sophorolipids), lipopeptides nos quais lipoides são ligados a cadeias de polipeptídeos (por exemplo, surfactina e lichenysina), e biosurfactantes poliméricas que são geralmente compostos de complexos de proteínas polissacarídeos (por exemplo, emulsano, liposano, alasan e lipomannan)4. Outros tipos de biosurfactantes produzidos pelos microrganismos incluem ácidos graxos, fosfolipídios, lipídios neutros e biosurfactantesde partículas 5. A classe mais estudada de biosurfactídeos é a glicoslipids e entre eles a maioria dos estudos foram relatados sobre rhamnolipids6. Os rhamnolipids contêm uma ou duas moléculas de rhamnose (que formam a parte hidrofílica) ligadas a uma ou duas moléculas de ácido graxo de cadeia longa (geralmente ácido hidroxi-decanoico). Rhamnolipids são glicolipídios primários relatados primeiro de Pseudomonas aeruginosa7.
Os biosurfactantes têm ganhado cada vez mais foco em comparação com suas contrapartes químicas devido a várias propriedades únicas e distintas que oferecem8. Estes incluem maior especificidade, menor toxicidade, maior diversidade, facilidade de preparação, maior biodegradabilidade, melhor espuma, compatibilidade ambiental e atividade em condições extremas9. A diversidade estrutural dos biosurfactantes (Figura S1) é outra vantagem que lhes dá uma vantagem sobre as contrapartes químicas10. Eles são geralmente mais eficazes e eficientes em concentrações mais baixas, pois sua concentração crítica de micelas (CMC) é geralmente várias vezes menor do que os surfactantes químicos11. Eles têm sido relatados como altamente termostáveis (até 100 °C) e podem tolerar maior pH (até 9) e altas concentrações de sal (até 50 g/L)12 , assim, oferecem várias vantagens em processos industriais, que requerem exposição a condições extremas13. A biodegradabilidade e a menor toxicidade as tornam adequadas para aplicações ambientais, como a bioremediação. Devido às vantagens que oferecem, eles têm recebido maior atenção em várias indústrias como alimentos, agrícolas, detergentes, cosméticos e indústria petrolífera11. Os biosurfactantes também ganharam muita atenção na remediação do óleo para a remoção de contaminantes de petróleo e poluentes tóxicos14.
Aqui relatamos a produção, caracterização e aplicação de biosurfactantes produzidos por Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108. As etapas envolvidas na triagem, caracterização e aplicação de uma combinação de biosurfactantes para maior recuperação do óleo estão descritas na Figura 1.
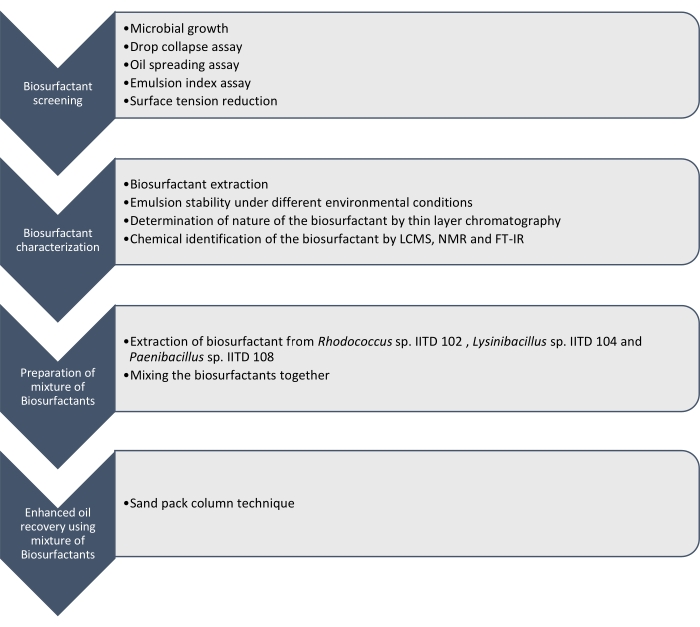
Figura 1: Um método para maior recuperação do óleo usando uma combinação de Biosurfactantes. O fluxo de trabalho stepwise é mostrado. O trabalho foi realizado em quatro etapas. Primeiro, as cepas microbianas foram cultivadas e rastreadas para a produção de biosurfactantes por vários ensaios, que incluíram ensaio de colapso de queda, ensaio de espalhamento de óleo, ensaio de índice de emulsão e medição de tensão superficial. Em seguida, os biosurfactantes foram extraídos do caldo livre de células e sua natureza foi identificada por meio de cromatografia de camada fina e foram ainda identificadas usando LCMS, NMR e FT-IR. Na etapa seguinte, os biosurfactantes extraídos foram misturados e o potencial da mistura resultante para maior recuperação do óleo foi determinado utilizando-se a técnica da coluna de blocos de areia. Clique aqui para ver uma versão maior desta figura.
A triagem dessas cepas microbianas para produzir biosurfactantes foi feita pelo colapso da queda, propagação do óleo, ensaio do índice de emulsão e determinação de redução da tensão superficial do meio livre de células devido ao crescimento dos micróbios. Os biosurfactantes foram extraídos, caracterizados e quimicamente identificados por LCMS, 1H NMR e FT-IR. Finalmente, foi preparada uma mistura de biosurfactantes produzidos por esses micróbios e utilizada para recuperar o óleo residual em uma coluna simulada de embalagem de areia.
O presente estudo ilustra apenas os métodos envolvidos na triagem, identificação, caracterização estrutural e aplicação da combinação biosurfactante no aprimoramento da recuperação residual do óleo. Não fornece uma caracterização funcional detalhada dos biosurfactantes produzidos pelas cepas microbianas15,16. Vários experimentos como determinação crítica de micela, análise termogravimétrica, capacidade de wettability superficial e biodegradabilidade são realizados para caracterização funcional detalhada de qualquer biosurfactante. Mas como este artigo é um artigo de métodos, o foco é a triagem, identificação, caracterização estrutural e aplicação da combinação biosurfactante no aprimoramento da recuperação residual do óleo; esses experimentos não foram incluídos neste estudo.
Protocolo
1. Crescimento de cepas microbianas
- Pese 2 g de pó de Caldo de Luria e adicione a 50 mL de água destilada em um frasco cônico de 250 mL. Misture o conteúdo até que o pó se dissolva completamente e coma o volume de 100 mL usando água destilada.
- Da mesma forma, prepare mais dois frascos de 100 mL de Caldo de Luria e coloque tampões de algodão no pescoço dos frascos.
- Cubra os plugues de algodão com papel alumínio e autoclave os frascos por 15 min a 121 °C e 15 psi para esterilizar a mídia.
- Depois de autoclaving, deixe a mídia esfriar até a temperatura ambiente.
- Para a preparação da cultura primária de uma cepa, escolha uma única colônia de uma placa de LA usando um laço de inoculação e inoculada em um tubo de ensaio contendo 5 mL de caldo Luria estéril.
- Incubar o tubo de ensaio durante a noite a 30 °C a 180 rpm.
- Inocular os frascos contendo 100 mL de Caldo de Luria autoclaved adicionando 1 mL de culturas de sementes cultivadas durante a noite aos frascos dentro do armário de fluxo de ar laminar.
- Incubar os frascos em uma incubadora rotativa a 30 °C e 180 rpm durante 7 dias.
- Após a conclusão do período de incubação, colhia os frascos e transfira o caldo de cultura para os tubos de centrífuga. Centrifugar a cultura a 4.500 x g por 20 min em uma centrífuga refrigerada a 4 °C.
- Suavemente, despeje a célula livre de supernasce em um béquer fresco e use-a em ensaios de triagem para produção biosurfactante.
2. Ensaios de triagem para produção biosurfactante
NOTA: Nas seções a seguir, o surfactante comercial (Saponin) foi usado como controle positivo, enquanto a água e a mídia não vacinada foram utilizadas como controle negativo.
- Ensaio de colapso de queda
- Pegue uma lâmina de vidro limpa e cubra a superfície do slide com 200 μL de óleo.
- Adicione 20 μL da supernasce livre de células ao centro do óleo e deixe-o intacto por 2-3 min.
NOTA: Se a queda entrar em colapso, marque o supernatante positivo para a presença de biosurfactante.
- Ensaio de espalhamento de óleo
- Pegue 20 mL de água dupla destilada em uma placa de Petri (75 mm de diâmetro) e adicione 200 μL de petróleo bruto à superfície da água.
- Adicione 20 μL de supernanato livre de células ao centro do óleo e deixe-o intacto por 1 min.
NOTA: Se uma zona de desobstrução for formada por causa do deslocamento do óleo, escore o positivo sobrenante para a presença do biosurfactante.
- Ensaio do índice de emulsão (ensaio E24 )
- Adicione 4 mL de gasolina (gasolina) e supernanato sem células cada um em um tubo de ensaio de vidro limpo.
- Vórtice a mistura vigorosamente por 3 min e deixá-la intacta pelas próximas 24 horas.
- Após 24 horas, determine o índice E24 como uma porcentagem da altura da camada emulsificada (cm) em relação à altura de toda a coluna líquida (cm).

NOTA: Se uma emulsão (óleo na água ou água no óleo) for observada após 24h, é provável que o supernatante contenha o biosurfactante.
- Medição da tensão superficial
NOTA: A tensão superficial foi medida utilizando o método do anel Du Noüy17. O instrumento utilizado neste experimento (ver Tabela de Materiais) é muito sensível, por isso garanta a limpeza adequada do vaso de vidro e da sonda.- Ligue o sistema e clique duas vezes no software associado para abri-lo.
- Limpe o recipiente de vidro com o líquido cuja tensão superficial deve ser determinada.
- Adicione o líquido (40 mL) no recipiente e monte o recipiente no suporte do vaso.
- Desbloqueie o suporte da sonda e monte a sonda nele. Agora bloqueie o suporte da sonda pressionando o botão Travar no controlador manual.
- Usando o controlador manual, ajuste a altura da plataforma de modo que a sonda esteja a cerca de 2-3 mm de distância da superfície do líquido.
- Agora use o software para medir a tensão superficial. Clique em Arquivo localizado no painel superior esquerdo da tela. Clique em Abrir espaço de trabalho. Uma janela pop-up aparecerá.
- Role para baixo e clique duas vezes no ícone K100: Surface and Interfacial Tension .
- Agora, clique no ícone Arquivo localizado no canto superior esquerdo da tela. Clique em Novo Banco de Dados. Digite o nome para salvar os dados e clique em OK.
- Novamente, clique em Arquivo > Nova medição > SFT > Ring. Digite o nome para a medição. Certifique-se de que o modelo de configuração mostra o anel SFT.
- Preencha os detalhes na janela Configuração de medição selecionando a sonda e a nave que está sendo usada para a medição. Além disso, preencha os detalhes do líquido e da fase gasosa.
NOTA: A fase líquida será de água, enquanto a fase gasosa será de ar. A densidade da fase líquida é a densidade do supernanato livre de células. Isso pode ser determinado tomando o peso de 50 mL do líquido e calculando a densidade como Kg/m3. - Agora clique na guia Procedimento e preencha os seguintes detalhes: Velocidade de detecção: 6 mm/min, Sensibilidade de detecção: 0,005 g, Velocidade de Pesquisa: 6 mm/min, Sensibilidade à pesquisa: 0,005 g, Velocidade de Medição: 3 mm/min, Sensibilidade de Medição: 0,001 g, Profundidade de Imersão: 3 mm, Distância de Retorno: 10%, correção: Harkins & Jordan, valores máximos: 5. Clique em OK.
- Na janela pop-up, selecione o banco de dados para armazenar dados e clique em OK.
NOTA: Pode-se criar um novo banco de dados aqui ou adicionar novas medidas aos dados existentes. - Agora clique no botão Reproduzir localizado no centro superior da tela. O sistema começará a executar o script. Depois que o sistema estabilizar, detectará a superfície. Mergulhe a sonda no líquido, mova a sonda para frente e para trás e detecte a tensão na lamella formada.
- Para obter os resultados, clique no ícone Medição no lado meio-esquerdo da tela. Clique em Data e note abaixo a tensão superficial determinada.
- Após a conclusão da medição, baixe a altura da plataforma e desbloqueie e desmonte a sonda e o vaso do instrumento.
NOTA: Para determinar a diminuição da tensão superficial devido à produção biosurfactante, a LB não vacinada deve ser usada como controle.
3. Extração biosurfactante
- Ajuste o pH do supernanato livre de células para 2 usando 2 N HCl. Armazene a mistura a 4 °C durante a noite.
- Adicione o volume igual de mistura clorofórmio-metanol (2:1) ao supernante e misture vigorosamente por 20 minutos.
- Deixe a mistura intacta para que a separação de fase ocorra.
- Remova a fase superior contendo água e metanol e deixe a fase inferior contendo o biosurfactante para evaporar em um capô de fumaça.
- Após a evaporação da fase orgânica, ressolar o biosurfactante bruto cor de mel em 3 mL de clorofórmio e usar esta mistura para maior identificação e caracterização do biosurfactante.
4. Estudos de estabilidade da emulsão
-
Estabilidade de emulsão em diferentes temperaturas
- Tome 5 mL de supernantes livres de células em diferentes tubos de ensaio.
- Adicione 5 mL de gasolina a cada tubo de ensaio e misture vigorosamente por vórtice por 3 minutos.
- Incubar os tubos de ensaio durante a noite em diferentes banhos de água em diferentes temperaturas (30 °C, 40 °C, 50 °C, 60 °C e 70 °C).
- Após 24h, estime os índices de emulsão mencionados anteriormente.
-
Estabilidade de emulsão em diferentes valores de pH
- Tome 5 mL da supernasce sem células em tubos de ensaio limpos.
- Ajuste o pH de supernacantes livres de células (2, 4, 6, 8 e 10) usando 1 N HCl e 1 N NaOH.
- Adicione uma quantidade igual de gasolina aos tubos de ensaio e misture vigorosamente por vórtice por 3 minutos.
- Deixe os tubos de ensaio imperturbáveis à temperatura ambiente por 24 horas.
- Estime o índice de emulsão como mencionado anteriormente.
-
Estabilidade de emulsão em diferentes concentrações de sal
- Tome 5 mL da supernasce sem células em tubos de ensaio limpos.
- Adicione diferentes quantidades de sal (NaCl) aos supernantes (0 g/L, 5 g/L, 10 g/L, 20 g/L, 60 g/L e 80 g/L).
- Dissolva os sais nas células livres de supernaentes por vórtice por 3 minutos.
- Adicione uma quantidade igual de gasolina aos tubos de ensaio e misture vigorosamente por vórtice por 3 minutos.
- Deixe os tubos de ensaio imperturbáveis à temperatura ambiente por 24 horas.
- Estime o índice de emulsão após 24 h.
5. Determinando a natureza do biosurfactante
-
TLC do biosurfactante extraído
- Local 20 μL dos biosurfactantes em placas TLC. Ponto 2 μL de uma só vez.
- Localmente, os biosurfactantes em três placas TLC diferentes.
- Prepare uma mistura de 100 mL do eluent contendo clorofórmio:metanol (2:1) e adicione o eluente à câmara TLC. Feche a tampa da câmara e deixe-a saturar por 20 minutos.
- Depois de secar as placas, coloque as placas TLC dentro da câmara saturadas com uma mistura de metanol clorofórmio e execute o TLC.
- Depois que o eluente atingir a parte superior da placa TLC (1 cm de distância da parte superior), retire as placas e deixe-a secar.
-
Coloração para detecção de lipídios
- Pegue uma câmara TLC limpa e adicione alguns (5-10) grânulos de iodo na câmara fresca e saturar a câmara por 5 a 10 minutos.
- Coloque a placa TLC dentro da câmara e observe para o desenvolvimento das manchas amarelas. Se as manchas aparecerem, escore o biosurfactante positivo para a presença do componente lipíduo.
-
Coloração para detecção de peptídeos ou aminoácidos
- Prepare uma solução de ninidrina dissolvendo 0,4 g de ninidrina em 20 mL de butanol. Adicione 0,6 mL de ácido acético glacial 100% à mistura.
- Pulverize a placa TLC com solução de ninidrina e deixe secar o ar por 2 minutos. Aqueça a placa a 110 °C e observe o desenvolvimento da cor.
NOTA: Se as manchas azuis aparecerem, escore o biosurfactante positivo para a presença de qualquer cadeia de peptídeo ou aminoácido.
-
Coloração para detecção de carboidratos
- Prepare uma solução de p-anisaldeído adicionando 2 mL de p-anisaldeído a 48 mL de ácido acético glacial contendo 1 mL de H2SO4. Adicione 0,6 mL de ácido acético à mistura.
- Pulverize a mistura uniformemente em uma placa TLC e deixe secar o ar por 2 minutos.
- Incubar a placa a 110 °C e monitorar o desenvolvimento das manchas.
NOTA: Se aparecerem as manchas verdes ou pardas, escore o biosurfactante positivo para a presença de quaisquer carboidratos.
6. Identificação química do biosurfactante
- LCMS do biosurfactante
- Dissolva 25 mg do biosurfactante extraído em 1 mL de clorofórmio.
- Execute LCMS (em uma configuração de spray de bloqueio com uma frequência de varredura de referência de 10 s) usando uma coluna C18.
- Use clorofórmio:metanol (1:1) como fase móvel e injete 2 μL da amostra na coluna a uma taxa de fluxo de 0,1 mL/min.
- Definir os parâmetros experimentais para: polaridade: ES positiva, tensão capilar: 3 kV, temperatura-fonte: 80 °C, temperatura de desolação: 300 °C, taxa de fluxo de gás dessolvação: 7.000 L/h, e fluxo de gás de captura: 0,40 mL/min.
- Escaneie os 100 a 1.200 Da durante um tempo de detecção de 20 minutos e pesquise os íons no modo ES positivo.
- Analise os valores m/z usando qualquer software de espectrometria de massa.
- Para análise, entre no software.
- Clique em Pesquisa em Lote e insira a lista das massas obtidas. Pesquise os resultados em um modo de carga positiva e use M + H e M + Na como os adutos. Mantenha a precisão de 10 PPM e marque na Estrutura de Exibição.
- Clique em Pesquisar e na lista de compostos, selecione aquele com o nível de PPM mais baixo.
- 1 H NMR do biosurfactante
NOTA: 1H NMR do biosurfactante foi realizado utilizando um espectrômetro NMR de 400 MHz (ver Tabela de Materiais).- Dissolva 5 mg do biosurfactante em 1 mL de clorofórmio deuterado (CdCl3).
- Transfira a mistura para um tubo NMR. Tampe o tubo corretamente e insira o tubo na chave inglesa. Ajuste a altura do tubo usando o tubo do ajustador.
- Coloque o tubo junto com a chave inglesa na máquina NMR e siga os passos mencionados abaixo para obter um espectro NMR.
- Para selecionar o tipo de tubo de amostra: sx N, onde N é a posição onde o tubo foi colocado (por exemplo, sx 13, se o tubo foi colocadona posição 13) em software associado.
- Digite edc e pressione Enter para criar uma nova pasta onde os dados podem ser armazenados.
- Um pop-up aparecerá. Selecione o solvente clicando no CdCl 3 na lista e digite o nome da amostra.
- Para iniciar o protocolo, digite "getprosol"; para travar o solvente, digite "lock cdcl3".
- Digite "topshim" para shim a amostra e, finalmente, digite "rga;zgefp" para adquirir os dados. Isso vai começar o protocolo.
- Após a obtenção do espectro, digite "apk;abs n" e pressione enter para correção de fase e linha de base.
- Para selecionar picos primários, digite "pp" e pressione Enter. Para selecionar apenas picos intensos, digite "mi" e digite a intensidade acima da qual os picos devem ser selecionados. O valor padrão será 0.2.
- Para integrar os picos, clique em Integrar e coloque o cursor no lado esquerdo do pico para ser integrado e enquanto segura o clique do cursor e arraste o cursor ao redor do pico.
- Salve os dados clicando em Arquivo no canto superior esquerdo e, em seguida, clique em Salvar.
- A amostra pode ser ejetada da máquina digitando "sx ej".
- Analise os picos e determine o ambiente dos átomos H.
- Fourier Transform Infrared Spectroscopy of the biosurfactant
NOTA: FT-IR do biosurfactante extraído foi realizado utilizando-se um espectrômetro comercialmente disponível no modo ATR (ver Tabela de Materiais).- Ligue o espectrômetro e verifique o expurgo, o dessecante e o detector.
- Para coletar um espectro, primeiro colete o espectro de fundo sem uma amostra no lugar.
- Pegue o biosurfactante extraído e seque-o completamente. Coloque o biosurfactante seco diretamente sobre o cristal de diamante, aplique pressão e pressione o ponto de toque ATR.
- No software, selecione o número das varreduras (digite 30) e escaneie o espectro de 400 cm-1 a 4.000 cm-1.
- Clique em OK para adicionar o espectro de amostra à janela espectral.
- Clique em Arquivos > Salve > Salve As e digite o nome do arquivo seguido de extensão .spa e clique em OK.
7. Aplicação biosurfactante (recuperação aprimorada do óleo)
NOTA: Neste experimento, a água dupla destilada foi utilizada como controle negativo e 10% SDS, 10% Tween 80 e 10% saponina comercial foram utilizadas como controles positivos.
- Pegue o vidro e sele a tomada inferior com lã de vidro e contas de vidro.
- Embalar a coluna com solo arenoso de tal forma que algum líquido possa ser adicionado na parte superior do solo e o fluxo através pode ser coletado na parte inferior. Monte a coluna no suporte e adicione algumas contas de vidro em cima do solo.
- Inunde a coluna com 50 mL de solução de salmoura e colete o fluxo através para determinar o volume dos poros.
volume de poros = volume de salmoura adicionado em cima - volume de fluxo através de coletado. - Remova a salmoura da coluna forçando o petróleo cru a passar por ela depois de adicionar a partir da parte superior da coluna. Colete o volume da salmoura e do óleo que sai da coluna para determinar o volume inicial de saturação do óleo. O volume da salmoura liberada da coluna será o volume inicial de saturação do óleo ou o óleo original no local.
- Deixe a coluna intacta por 24 h.
- Após 24h, alagule a coluna com 10 volumes de poros de salmoura e recolhe o óleo que sai da coluna para estimar a recuperação secundária do óleo. O óleo deixado na coluna após a recuperação secundária do óleo corresponde ao óleo residual.
- Prepare uma mistura de biosurfactantes adicionando volumes iguais do biosurfactante extraído (extraído após a etapa 3.5) ao béquer de vidro. Adicione os biosurfactantes ao topo da coluna e incubar a coluna por 24h.
- Após 24 horas, meça a quantidade de óleo e água para determinar a recuperação adicional ou aprimorada do óleo. O volume do óleo liberado da coluna corresponderá ao óleo residual recuperado.
- Estimar uma recuperação aprimorada do óleo com a seguinte equação:

Resultados
Três cepas bacterianas (Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108) foram rastreadas para a produção de biosurfactantes por vários ensaios, que incluíram ensaio de colapso de queda, ensaio de deslocamento de óleo, ensaio do índice de emulsão e redução da tensão superficial. Supernantes livres de células de todas as três cepas bacterianas e uma solução de surfactante químico resultaram em um colapso de queda e, portanto, foram pontuados positivos para a presença dos biosurfactantes (Figura 4a). Por outro lado, a gota d'água não entrou em colapso e, portanto, foi negativa para a presença do biosurfactante. Surfactante comercial e os supernacantes livres de células das três culturas bacterianas também foram bem sucedidos no deslocamento da camada de óleo no ensaio de espalhamento de óleo e, portanto, foram pontuados positivos para a presença de biosurfactante (Figura 4b). A água, por outro lado, não conseguiu deslocar nenhum óleo e, portanto, foi marcada negativamente. Nos ensaios do índice de emulsão, observou-se emulsão estável em tubos de ensaio contendo surfactante comercial e supernantes das três cepas microbianas. No entanto, não foi observada emulsão no tubo de ensaio contendo meio de cultura não vacinada (Figura 4c). Isso sugeriu novamente que Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104, e Paenibacillus sp. IITD108 produzem biosurfactantes. A confirmação da produção biosurfactante foi obtida medindo a tensão superficial do caldo livre de células e comparando-o com o controle não vacinado. Os biosurfactantes de Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108 foram encontrados para reduzir a tensão superficial do meio de 58,89 mN/m para 45,41 mN/m, 45,82 mN/m e 28,43 mN/m, respectivamente (Figura 5).
As medições IFT foram realizadas utilizando-se o método de puxar o anel. Os biosurfactantes de todas as três cepas foram capazes de reduzir significativamente as tensões interfaciais entre várias fases aquosas e orgânicas (Tabela S1). A tensão superficial e as medidas de tensão interfacial confirmam que todas as três cepas produzem biosurfactantes.
A extração de solventes de biosurfactantes das culturas livres de células de Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108 resultaram em concentrações biosurfactantes de 820 mg/L, 560 mg/L e 480 mg/L, respectivamente.
Como observado na Figura 4C, a emulsão formada pelo biosurfactante foi água na microemulsão do óleo. Os ensaios de estabilidade da emulsão mostraram que os biosurfactantes apresentaram boa estabilidade em diversas condições ambientais (Figura 6). As emulsões produzidas foram muito estáveis em diversas temperaturas (Figura 6a), valores de pH (Figura 6b) e concentrações de sal (Figura 6c) testadas.
A cromatografia de camada fina foi realizada para determinar a natureza dos biosurfactantes. A coloração das placas com vapor de iodo resultou no desenvolvimento de manchas amarelas em todos os biosurfactantes e no controle (Biosurfactante do Bacillus sp. IITD 106 (Figura 7a). Isso indicou que os biosurfactantes continham um moiety lipídicos. Não foram obtidos pontos de cor azul em nenhuma das placas TLC após a coloração com ninhydrina (Figura 7b). Isso mostrou que os biosurfactantes não continham nenhuma moiety peptídeo. Manchas azuis e verdes foram observadas em todas as placas TLC, quando manchadas com mancha de anisaldeído (Figura 7c). Isso mostrou que os biosurfactantes continham uma moiety carboidrato. A partir dos resultados da TLC, concluiu-se que todos os biosurfactantes eram glicolipídios.
A identificação química dos biosurfactantes utilizando LCMS revelou que o Ácido Hidroxydecanorico Di-rhamnopyranosic e o ácido hidroxiadecanômico Di-rhamnopyranosic com massa de 480,25 da. A estrutura do biosurfactante foi suportada por dados de 1H NMR e FT-IR (Figura 8).
No espectro de 1H NMR, as mudanças químicas obtidas em 7,2 representavam os prótons de grupos carboxílicos. Os deslocamentos químicos correspondentes aos prótons do grupo metil foram obtidos na faixa 1-2 ppm. Os turnos correspondentes aos prótons ligados aos grupos alquilos foram obtidos a 2,3 ppm. Os espectros FT-IR dos biosurfactantes extraídos de Rhodococcus sp. IITD102 e Lysinibacillus sp. IITD104 mostraram a presença de picos fortes na onda número 3.290 cm-1, o que confirma a presença do grupo funcional OH. Um pequeno pico na onda número 2.951 cm-1 corresponde ao alongamento do CH. Um forte pico de 1.620 cm-1 representou a presença do grupo carboxílico nos biosurfactantes. Outros picos obtidos em 1.530, 1.410, 1.200 e 1.060 confirmaram a presença de grupos funcionais alquila, CH3, C-O-C e C-CH3 , respectivamente. Tanto os dados de RMR quanto ft-IR apoiaram a estrutura do biosurfactante determinada a partir de estudos de LCMS. LCMS de biosurfactante bruto de Paenibacillus sp. IITD108 (Figura 9) mostrou que produz um rhamnolipid contendo três cadeias lipídicas formando o núcleo hidrofóbico a granel do biosurfactante. O biosurfactante foi identificado como 2decanoyl)-αL rhamnopyranosyl-3-hidroxydecanoic ácido com uma massa de 802 Da. Os resultados do LCMS foram suportados por dados de 1H NMR e FT-IR.
A configuração para maior recuperação do óleo é mostrada na Figura 2.

Figura 2: Configuração experimental para maior recuperação do óleo usando a técnica da coluna de bloco de areia. A coluna embalada com solo foi montada no suporte. A tomada inferior foi selada com lã de vidro e contas de vidro. Após a recuperação secundária, o óleo residual dentro da coluna foi submetido a uma maior recuperação do óleo por adição da mistura biosurfactante a ele. O tubo colocado na parte inferior da coluna foi usado para coletar a fração elucidada. Clique aqui para ver uma versão maior desta figura.
No experimento simulado de recuperação de óleo aprimorado, de 50 mL de salmoura adicionado ao topo da coluna, 12 mL foram coletados no fluxo e, portanto, o volume de poros foi estimado em 38 mL. Quando o óleo foi forçado através da coluna, 33 mL de salmoura foi liberado da coluna. Isso representou o volume inicial de saturação do óleo. A recuperação secundária utilizando 10 volumes de poros de salmoura resultou na eluição de 10 mL de óleo. O óleo residual deixado na coluna era de 23 mL. A água contendo a mistura de biosurfactantes foi capaz de recuperar 13 mL de óleo da coluna (Figura 3).
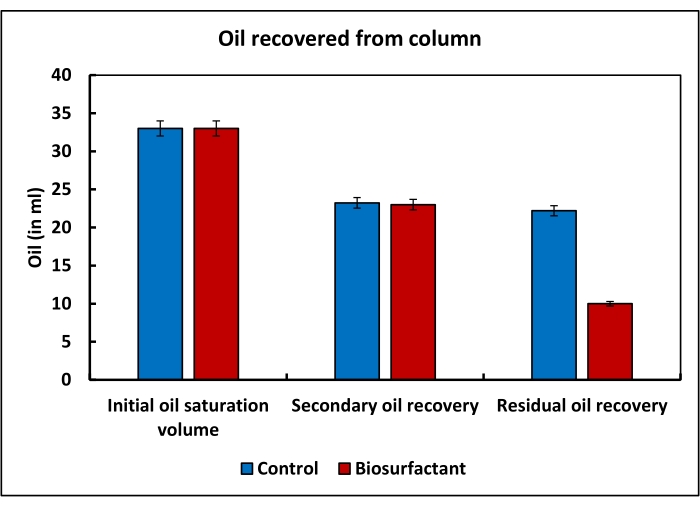
Figura 3: Recuperação aprimorada do óleo simulado usando uma coluna de embalagem de areia. O volume inicial de saturação de óleo tanto do controle quanto da coluna de teste foi de cerca de 33 mL. Durante a recuperação secundária do óleo, cerca de 10 mL do óleo foram recuperados tanto do controle quanto das colunas de teste. As diferenças nos perfis de recuperação do teste e das colunas de controle foram observadas apenas durante a recuperação do óleo residual deixado na coluna. A mistura biosurfactante resultou em uma recuperação adicional de 13 mL do óleo residual deixado da coluna de teste, enquanto na coluna de controle apenas 1,03 mL de óleo foi recuperado nesta etapa. Isso mostra que a mistura biosurfactante tem grande potencial para melhorar a recuperação do óleo residual dos reservatórios. Clique aqui para ver uma versão maior desta figura.
Isso representou uma maior recuperação do óleo. Assim, a água contendo a mistura de biosurfactantes foi capaz de recuperar 56,52% do óleo residual da coluna (Tabela 1). Por outro lado, soluções de 10% SDS, 10% Tween 80 e 10% saponina conseguiram recuperar 85%, 68% e 73% de óleo residual da coluna.
| Parâmetros | Controle de inundações | Inundações biosurfactantes combinadas | 10 % SDS | 10 % Interpol | 10 % saponina |
| PV (mL) | 37 | 38 | 38 | 35 | 37 |
| OOIP / IOSV (mL) | 33 | 33 | 33 | 29 | 33 |
| PDV (%) | 89.91 | 86.84 | 86.84 | 82.85 | 89.18 |
| SV (ml) | 330 | 330 | 330 | 330 | 330 |
| SOR (mL) | 9.77 | 10 | 11.5 | 9.2 | 10 |
| ROC (mL) | 23.23 | 23 | 21.5 | 18.8 | 23 |
| ROS (%) | 70.39 | 69.69 | 65.15 | 64.82 | 69.69 |
| Rv (ml) | 60 | 60 | 60 | 60 | 60 |
| ROR (mL) | 1.03 | 13 | 18.5 | 12.8 | 16.8 |
| AOR (%) | 4.43 | 56.5 | 85 | 68.08 | 73.04 |
onde PV = volume de poros determinado após a saturação da coluna inicial com salmoura, OOIP = óleo original no lugar, IOSV = volume inicial de saturação de óleo, POS = Saturação percentual de óleo, Sv = volume de salmoura adicionado para recuperação secundária, SOR = óleo secundário recuperado após inundação de salmoura, ROC = óleo residual em coluna após recuperação secundária, ROS = saturação residual de óleo, ROR = Óleo residual recuperado após inundação de biosurfactante, AOR = óleo adicional recuperado
Tabela 1: Simulbal recuperação aprimorada do óleo em uma coluna de embalagem de areia.

Figura 4: Ensaios de triagem para produção biosurfactante (a) Ensaio de colapso de gota: A gota d'água não entrou em colapso após ser adicionada à superfície revestida de óleo enquanto o surfactante químico e supernantes livres de células das três cepas bacterianas resultaram no colapso da queda. (b) Ensaio de deslocamento do óleo: A gota d'água não resultou no deslocamento do óleo enquanto os supernacantes químicos surfactantes e livres de células das três cepas bacterianas deslocaram as camadas de óleo (c) ensaio do índice de emulsão: Os supernantes livres de células e a solução comercial surfactante resultaram na formação de um índice de emulsão estável. Clique aqui para ver uma versão maior desta figura.
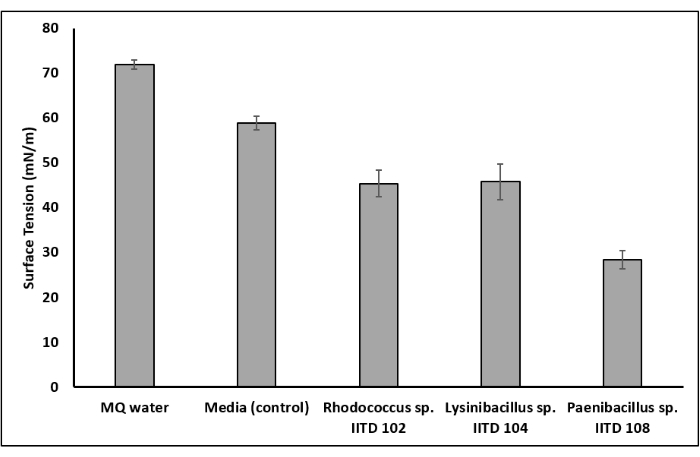
Figura 5: Redução da tensão superficial devido à produção biosurfactante. Determinação de redução da tensão superficial do meio devido ao crescimento microbiano confirmou a produção biosurfactante pelos membros microbianos. Devido ao crescimento do Rhodococcus sp. IITD 102 e Lysinibacillus sp. IITD 104, a tensão superficial do meio reduziu de 59 mN/m para 45 mN/m. Devido ao crescimento do Paenibacillus sp. IITD 108, a tensão superficial do meio reduziu de 59 mN/m para 28 mN/m. Clique aqui para ver uma versão maior desta figura.
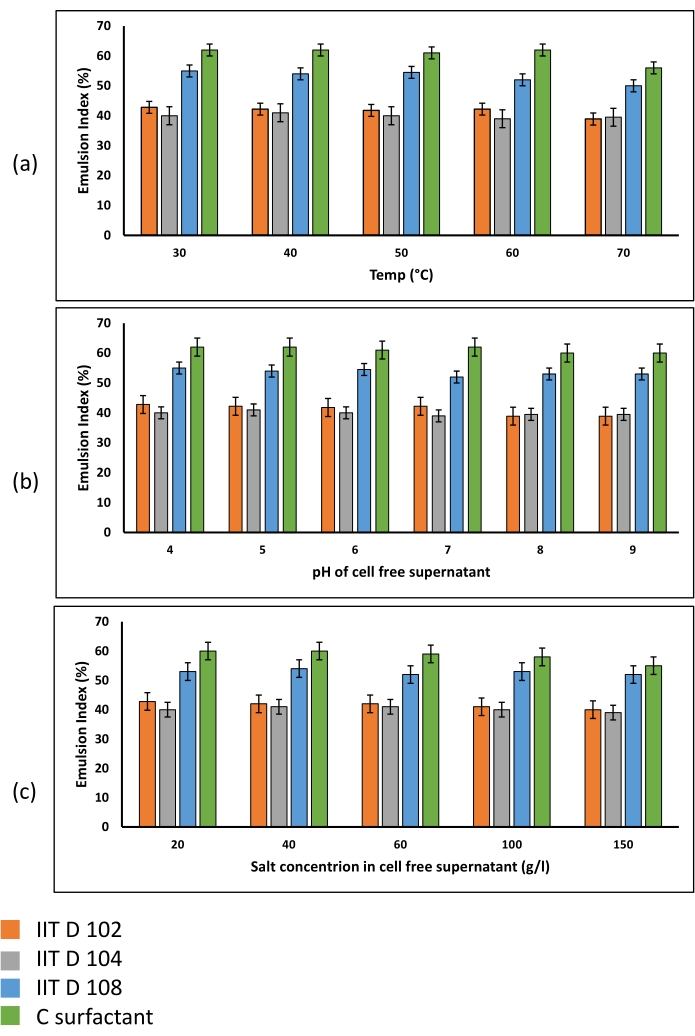
Figura 6: Estabilidade da emulsão em várias (a) temperaturas, (b) valores de pH e (c) concentrações de sal. Todas as emulsões geradas utilizando os supernantes das três cepas microbianas e a mistura de surfactante comercial apresentam grande estabilidade em diferentes condições ambientais. Dentro das faixas de temperatura, pH e concentração de sal testadas, os índices de emulsão determinados foram semelhantes e nenhuma redução maior do IE foi observada em valores mais elevados dos diferentes fatores que implicam que o biosurfactante pode ser usado em condições ambientais extremas. Clique aqui para ver uma versão maior desta figura.
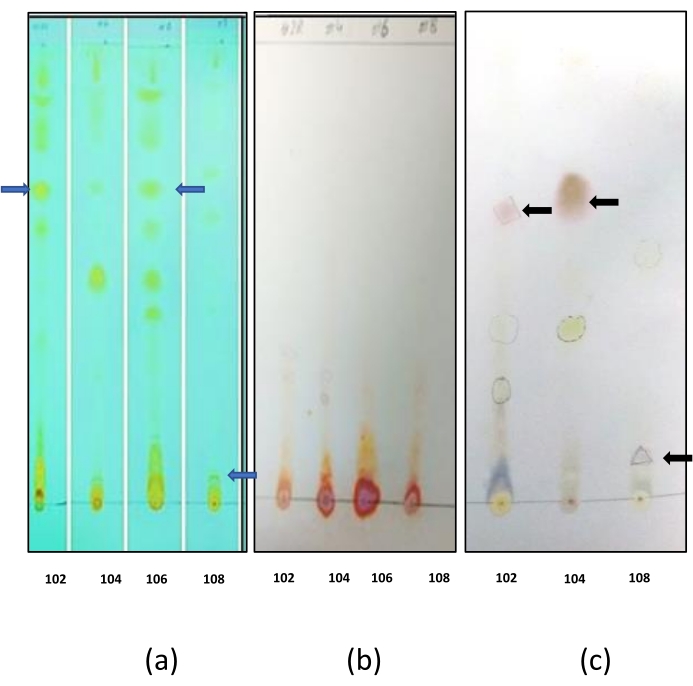
Figura 7: Caracterização TLC de biosurfactantes (a) Placas manchadas com vapor de iodo: Várias manchas desenvolvidas na placa TLC mostram que os biosurfactantes extraídos são uma mistura de vários compostos contendo um grupo lipídedo. As manchas marcadas com seta azul representam os biosurfactantes, que mancharam positivo para a presença de moiety lipídica. Os outros pontos representam o resto dos compostos presentes na mistura do biosurfactante bruto. (b) Placas manchadas com ninhydrin: Não apareceram manchas roxas quando as placas estavam manchadas com ninhydrin. Isso representou ausência de quaisquer aminoácidos na mistura biosurfactante e (c) Placas manchadas com anisaldeído: Manchas verdes e amarelas claras apareceram na placa TLC e estes representam os compostos que contêm açúcares. As manchas marcadas com setas negras representam os biosurfactantes que mancharam positivo para a presença da moiety carboidrato. As manchas que mancharam tanto com iodo quanto anisaldeído representam compostos contendo moieties lipídicos e carboidratos e podem ser um biosurfactante glicolipid. Clique aqui para ver uma versão maior desta figura.
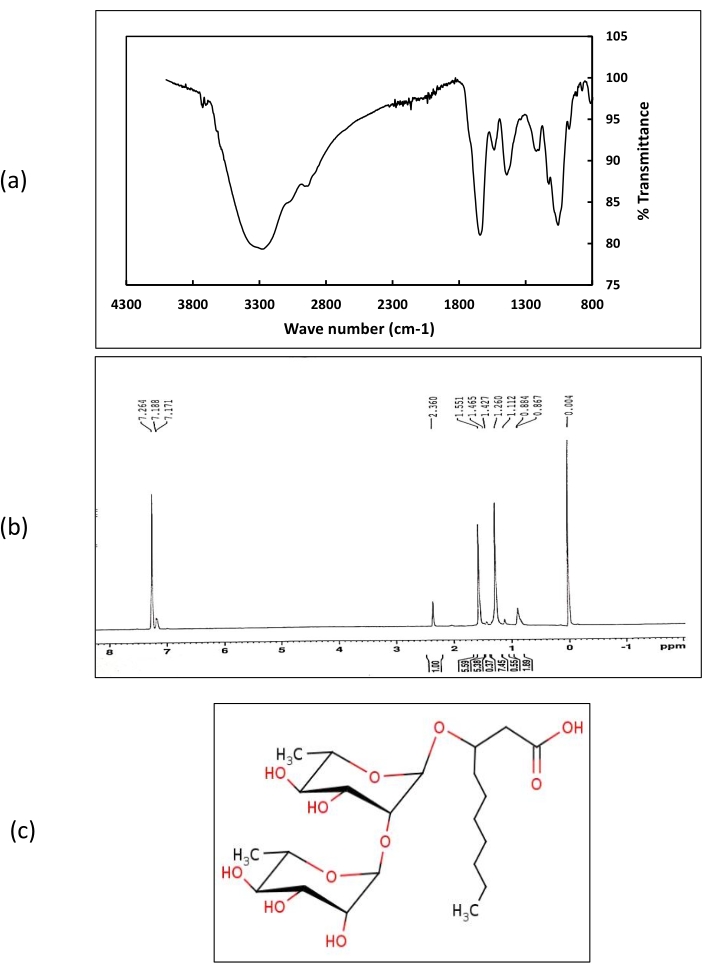
Figura 8: Caracterização química do biosurfactante extraído de Rhodococcus sp. IITD 102 e Lysinibacillus sp. IITD 104. a Representa o espectro FT-IR dos biosurfactantes extraídos de Rhodococcus sp. IITD 102 e Lysinibacillus sp. IITD 104, b Representa os espectros H1 NMR dos biosurfactantes extraídos de Rhodococcus sp. IITD 102 e Lysinibacillus sp. IITD 104, e (c) mostra a estrutura dos biosurfactantes brutos extraídos de Rhodococcus sp. IITD 102 e Lysinibacillus sp. IITD 104. Clique aqui para ver uma versão maior desta figura.
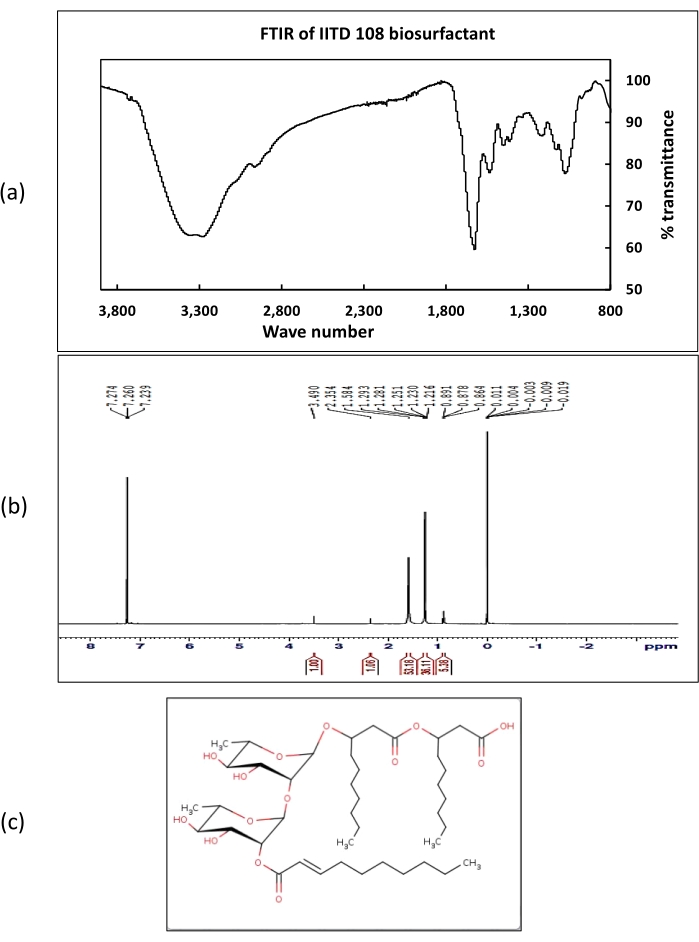
Figura 9: Caracterização química do biosurfactante extraído de Paenibacillus sp. IITD 108. a Representa o espectro FT-IR dos biosurfactantes extraídos de Paenibacillus sp. IITD 108, (b) representa o espectro de 1H NMR dos biosurfactantes extraídos de Paenibacillus sp. IITD 108, e (c) mostra a estrutura dos biosurfactantes brutos extraídos de Paenibacillus sp. IITD 108. Clique aqui para ver uma versão maior desta figura.
Figura S1: Estrutura de diferentes tipos de biosurfactantes. Clique aqui para baixar este Arquivo.
Tabela S1: Efeito dos biosurfactantes na tensão interfacial (IFT) entre água e hidrocarbonetos. Clique aqui para baixar esta Tabela.
Discussão
Os biosurfactantes são um dos mais versáteis grupos de componentes biologicamente ativos que estão se tornando alternativas atraentes para surfactantes químicos. Eles têm uma ampla gama de aplicações em inúmeras indústrias, como detergentes, tintas, cosméticos, alimentos, produtos farmacêuticos, agricultura, petróleo e tratamento de água devido à sua melhor capacidade de lintibilidade, menor CMC, estrutura diversificada e simpatia ambiental18. Isso levou a um maior interesse em descobrir mais cepas microbianas capazes de produzir biosurfactantes. Aqui, ilustramos os métodos de triagem, identificação e aplicação de uma mistura de biosurfactantes produzidos por Rhodococcus sp. IITD 102, Lysinibacillus sp. IITD 104, e Paenibacillus sp. IITD 108, para maior recuperação do óleo. A produção biosurfactante foi acompanhada pelo colapso da queda, espalhamento de óleo, ensaio do índice de emulsão e confirmada pela medição da redução da tensão superficial do meio devido ao crescimento microbiano. Vários relatórios sobre a produção de biosurfactantes glicoslipídeos (rhamnolipids e trehalolipids) de Rhodococcus estão disponíveis na literatura 19,20,21,22,23,24. Najafi et al. relataram produção e otimização de um biosurfactante lipopeptide de Paenibacillus sp. alvei ARN6325. Bezza et al. relataram biodegradação do pireno por um biosurfactante lipopeptide produzido por Paenibacillus dendritiformis CN526. A produção biosurfactante (Lipopeptides e glicoslipídios) também foi relatada por outras cepas de Paenibacillus 27,28,29,30,31. Várias espécies de Lysinibacillus foram relatadas para produzir biosurfactantes 32,33,34. Foi relatado que Lysinibacillus sphaericus produz rhamnolipid capaz de solubilização de pesticidas hidrofóbicos35.
Uma das vantagens que os biosurfactantes oferecem sobre seus homólogos químicos é sua estabilidade em condições ambientais extremas. Os biosurfactantes produzidos por Rhodococcus sp. IITD 102, Lysinibacillus sp. IITD 104 e Paenibacillus sp. IITD 108 foram avaliados para sua estabilidade em diferentes faixas de temperatura, pH e concentrações de sal e foram encontrados estáveis sob valores extremos desses parâmetros. Anteriormente, Habib et al. relataram um lipopeptídeo produzido por hidrocarbonetos degradantes Rhodococcus sp. que mostrou estabilidade em diferentes faixas de temperaturas, valores de pH e concentraçõesde sal 36. O aumento da concentração de sais inorgânicos foi relatado para aumentar a estabilidade da emulsão37. A tendência dos coloides de aglomerar ou separar é uma função das forças atraentes (Van der Walls) e forças repulsivas (forças eletrostáticas) que estão envolvidas durante a interação de partículas38. Os cristais de sal que se dissolvem na água estabelecem suas próprias cargas elétricas e os íons liberaram adsorb nas gotículas de emulsão. Ao aumentar a concentração de sal, a expansão e repulsa da segunda camada reduz. Além disso, quanto maior a densidade de carga de um íon, menor é o comprimento da camada elétrica. Assim, cations divalentes como o Na2+ resultam na formação de emulsões mais estáveis em comparação com as casções monovalentes39.
Outra vantagem que os biosurfactantes têm sobre os surfactantes químicos é que eles são biodegradáveis40. Zeng et al. compararam as capacidades de degradação do surfactante sintético Tritão X 100, sulfonatos lineares alquilbenzene (LAS) e rhamnolipid e descobriram que o biosurfactante rhamnolipid estava completamente degradado, enquanto LAS e Triton X 100 foram apenas parcialmente degradados41. Liu et al. também relatam que, em contraste com os surfactantes sintéticos CTAB, Triton X 100 e SDS, o rhamnolipid não apresenta toxicidade e poderia ser degradado facilmente por B. subtilis e outros microrganismosde composto 42.
Os biosurfactantes produzidos pelas três cepas microbianas foram encontrados como glicolipídios. Rhodococcus foi relatado anteriormente para produzir glicolipídio por vários grupos de pesquisa 20,21,23. Relatórios semelhantes sobre a produção de biosurfactante glicolipóides por Lysinibacillus e Paenibacillus também estão disponíveis na literatura 31,32,35,43,44. A identificação química dos biosurfactantes revelou-os como rhamnolipids. Rhamnolipids são a classe de biosurfactantes glicoslipídeos que contêm uma ou duas unidades de rhamnose conectadas a uma cadeia lipídica45. Eles são o tipo mais estudado de biosurfactantes. Várias cepas microbianas foram relatadas para produzir rhamnolipids 7,46,47,48,49. Os rhamnolipids apresentaram alto potencial para aumentar a recuperação do óleo residualem 50,51,52,53. Em nosso estudo, descobrimos que a mistura de biosurfactantes produzidos pela Rhodococcus sp. IITD 102, Lysinibacillus sp. IITD 104, e Paenibacillus sp. IITD 108 recuperou com sucesso cerca de 56,52% do óleo residual em um teste simulado de coluna de bloco de areia. Isso mostrou que a mistura de biosurfactantes pode ser utilizada para a recuperação de óleo residual dos reservatórios terrestres. Em um teste semelhante de embalagem de areia, Sun et al. relataram que o biosurfactante foi bem sucedido na recuperação de 50% do óleo residual54. Biosurfactantes contendo caldo livre de células de incillus subtilis também foram relatados como eficazes na recuperação de 33% do óleo residual55. A recuperação residual do petróleo de 27% e 26%-36% também foram relatadas por Darvishi et al. e Wahabi et al.56,57.
A avaliação econômica dos biosurfactantes para recuperação de óleo residual dos reservatórios mostra que a utilização de biosurfactantes no EOR é economicamente uma opção viável. Moutinho et al. relataram que o custo típico de um biosurfactante comercial (rhamnolipids) é de cerca de 59,6 USD por kg58. Em outro estudo, também foi relatado que a concentração biosurfactante de 28 mg/L de biosurfactante aumentou a recuperação residual do óleo e levou à produção de 52,5 m3 de óleo adicional59. Os estudos mostraram que a concentração biosurfactante de 10 mg/L foi suficiente para mobilizar a recuperação do óleo. De acordo com os dados relatados, a quantidade de biosurfactante necessária para produzir 52,5 m3 de óleo adicional é de cerca de 0,525 kg. O custo total de produção de 52,5 m3 de petróleo é de cerca de US$ 2.1463, dos quais apenas US$ 30 é o custo de produção do biosurfactante. Os dados mostram que o custo percentual do biosurfactante na produção de petróleo por barril é de apenas 0,0000139%.
Nossos resultados sugerem que a combinação dos biosurfactantes pode ser usada eficientemente para recuperar óleo residual dos reservatórios. Pelo que sabemos, este é o primeiro relatório sobre o aprimoramento da recuperação do óleo residual do reservatório utilizando uma mistura de biosurfactantes produzidos por diferentes cepas microbianas. Embora nosso estudo descreva claramente os métodos envolvidos na triagem, caracterização estrutural e aplicação de biosurfactantes na recuperação aprimorada do óleo, o estudo não fornece uma caracterização funcional detalhada dos biosurfactantes, que afetam sua eficiência em diversas aplicações. A concentração crítica de micelas, que é a medida da eficiência de qualquer surfactante na formação das micelas e especifica a concentração limitante do surfactante para seu uso significativo, não foi determinada no presente estudo60. Da mesma forma, a estabilidade térmica do biosurfactante, que determina sua aplicabilidade em condições de reservatório para EOR, também não foi descrita61. Biosurfactantes em algumas aplicações também são usados como agentes antibiofilm. Sua capacidade superficial desempenha um papel importante na determinação de sua natureza antibiofilm. Estudos de wettability superficial também não foram realizados no presente trabalho62. Outras características funcionais importantes em diversas aplicações de biosurfactantes, que incluem sua biodegradabilidade e a natureza antimicrobiana também não foram determinadas neste estudo63,64. Assim, focamos na caracterização estrutural dos biosurfactantes. Dependendo da aplicação alvo, pode ser realizada caracterização funcional como estabilidade, biodegradabilidade e atividade antimicrobiana.
No ensaio de colapso da queda e ensaio de espalhamento de óleo, para aumentar a visibilidade, é melhor usar um óleo que tenha alguma cor. No ensaio de espalhamento do óleo, a emulsão deve ser observada após 24 horas. Espumas leves, se formadas, se desintegram em 24 horas. Os tensores são instrumentos muito sensíveis, portanto, durante as medições de tensão superficial, o vaso e a sonda devem ser limpos corretamente antes de cada medição para evitar quaisquer erros devido ao transporte das últimas medições. A extração de biosurfactante envolve a adição de mistura de metanol de clorofórmio ao supernatante livre de células. A etapa deve ser realizada em um capô de fumaça, ou o frasco deve ser coberto com papel alumínio imediatamente após a transferência da mistura de extração. Durante a recuperação secundária em um experimento de EOR, a solução de salmoura deve ser adicionada em excesso até que nenhum óleo mais saia da coluna.
O método discute o escopo da mistura de biosurfactantes na recuperação do óleo residual das colunas. O processo depende de muitos fatores. O estágio de crescimento dos micróbios em que as culturas iniciais são colhidas. Alguns biosurfactantes foram relatados para serem produzidos na fase de registro, enquanto outros foram relatados para serem produzidos na fase estacionária. As culturas devem ser colhidas de acordo na fase específica em que a produção biosurfactante atingiu seu máximo. Os ensaios de triagem biosurfactante são menos sensíveis, portanto todos os ensaios devem ser realizados antes de chegar a uma conclusão sobre a capacidade de produção biosurfactante de uma determinada cepa. A purificação do biosurfactante deve ser realizada antes da caracterização química do biosurfactante se a concentração de biosurfactante for baixa no biosurfactante bruto. Experimentos aprimorados de recuperação de óleo são altamente dependentes do tipo de solo usado para embalar a coluna. O solo deve estar completamente seco e deve ser peneirado para remover grânulos maiores e outros contaminantes sólidos. Uma mistura de solo arenoso e solo seco de jardim (em proporção igual) deve ser preferida para embalar a coluna. A saída da coluna deve ser selada adequadamente com lã de vidro e contas de vidro para evitar o vazamento de solo da coluna durante o experimento.
O método descrito é útil para determinar a significância dos biosurfactantes produzidos e suas misturas na recuperação de óleo adicional em um experimento simulado de coluna de blocos de areia. Diferentes biosurfactantes têm especificidades diferentes porque contêm diferentes grupos funcionais65. Uma combinação de biosurfactantes permitirá a solubilização de diversos hidrocarbonetos e, portanto, aumentará a recuperação residual de óleo dos reservatórios. O método descrito ajudará a determinar o potencial de misturas biosurfactantes em aplicações de campo, como a maior recuperação de óleo de poços de petróleo.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Os autores gostariam de agradecer ao Departamento de Biotecnologia, Governo da Índia, pelo apoio financeiro.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Referências
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070(2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706(2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, Pt B 127201(2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371(2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138(2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- Trefalt, G., Borkovec, M. Overview of DLVO theory. , Available from: https://archive-ouverte.unige.ch/unige:148595 (2014).
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093(2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401(2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados