Method Article
Verbesserte Ölgewinnung mit einer Kombination von Biotensiden
In diesem Artikel
Zusammenfassung
Wir veranschaulichen die Methoden des Screenings und der Identifizierung der biotensidproduzierenden Mikroben. Methoden zur chromatographischen Charakterisierung und chemischen Identifizierung der Biotenside, zur Bestimmung der industriellen Anwendbarkeit des Biotensids zur Verbesserung der Restölgewinnung werden ebenfalls vorgestellt.
Zusammenfassung
Biotenside sind oberflächenaktive Verbindungen, die in der Lage sind, die Oberflächenspannung zwischen zwei Phasen unterschiedlicher Polaritäten zu reduzieren. Biotenside haben sich aufgrund der geringeren Toxizität, der hohen biologischen Abbaubarkeit, der Umweltverträglichkeit und der Toleranz gegenüber extremen Umweltbedingungen zu vielversprechenden Alternativen zu chemischen Tensiden entwickelt. Hier veranschaulichen wir die Methoden zum Screening von Mikroben, die Biotenside produzieren können. Die biotensidproduzierenden Mikroben wurden mittels Tropfenkollaps, Ölausbreitung und Emulsionsindex-Assays identifiziert. Die Produktion von Biotensiden wurde validiert, indem die Verringerung der Oberflächenspannung der Medien aufgrund des Wachstums der mikrobiellen Mitglieder bestimmt wurde. Wir beschreiben auch die Methoden zur Charakterisierung und Identifizierung von Biotensiden. Eine Dünnschichtchromatographie des extrahierten Biotensids mit anschließender differentieller Färbung der Platten wurde durchgeführt, um die Art des Biotensids zu bestimmen. LCMS, 1H NMR und FT-IR wurden verwendet, um das Biotensid chemisch zu identifizieren. Wir veranschaulichen ferner die Methoden zur Bewertung der Anwendung der Kombination von produzierten Biotensiden zur Verbesserung der Restölgewinnung in einer simulierten Sandpackungssäule.
Einleitung
Biotenside sind die amphipathischen oberflächenaktiven Moleküle, die von Mikroorganismen produziert werden und die Fähigkeit haben, die Oberfläche und die Grenzflächenspannung zwischen zwei Phasen1 zu reduzieren. Ein typisches Biotensid enthält einen hydrophilen Teil, der normalerweise aus einem Zuckeranteil oder einer Peptidkette oder einer hydrophilen Aminosäure besteht, und einen hydrophoben Teil, der aus einer gesättigten oder ungesättigten Fettsäurekettebesteht 2. Aufgrund ihrer amphipathischen Natur sammeln sich Biotenside an der Grenzfläche zwischen den beiden Phasen und reduzieren die Grenzflächenspannung an der Grenze, was die Dispersion einer Phase in die andere erleichtert 1,3. Verschiedene Arten von Biotensiden, die bisher berichtet wurden, umfassen Glykolipide, in denen Kohlenhydrate über Esterbindungen (z. B. Rhamnolipide, Trehalolipide und Sophorolipide) an langkettige aliphatische oder hydroxy-aliphatische Säuren gebunden sind, Lipopeptide, bei denen Lipide an Polypeptidketten gebunden sind (z. B. Surfactin und Lichenysin), und polymere Biotenside, die normalerweise aus Polysaccharid-Proteinkomplexen bestehen (z. Emulsan, Liposan, Alasan und Lipomannan)4. Andere Arten von Biotensiden, die von den Mikroorganismen produziert werden, umfassen Fettsäuren, Phospholipide, neutrale Lipide und partikuläre Biotenside5. Die am meisten untersuchte Klasse von Biotensiden sind Glykolipide und unter ihnen wurden die meisten Studien über Rhamnolipideberichtet 6. Rhamnolipide enthalten ein oder zwei Moleküle Rhamnose (die den hydrophilen Teil bilden), die mit einem oder zwei Molekülen langkettiger Fettsäure (normalerweise Hydroxy-Decansäure) verbunden sind. Rhamnolipide sind primäre Glykolipide, die zuerst aus Pseudomonas aeruginosa7 berichtet wurden.
Biotenside haben im Vergleich zu ihren chemischen Gegenstücken aufgrund verschiedener einzigartiger und unverwechselbarer Eigenschaften, die sie bieten, zunehmend an Bedeutung gewonnen8. Dazu gehören eine höhere Spezifität, geringere Toxizität, größere Vielfalt, einfache Zubereitung, höhere biologische Abbaubarkeit, bessere Schaumbildung, Umweltverträglichkeit und Aktivität unter extremen Bedingungen9. Die strukturelle Vielfalt der Biotenside (Abbildung S1) ist ein weiterer Vorteil, der ihnen einen Vorteil gegenüber den chemischen Gegenstückenverschafft 10. Sie sind im Allgemeinen wirksamer und effizienter bei niedrigeren Konzentrationen, da ihre kritische Mizellenkonzentration (CMC) in der Regel um ein Vielfaches niedriger ist als bei chemischen Tensiden11. Es wurde berichtet, dass sie sehr thermostabil (bis zu 100 °C) sind und einen höheren pH-Wert (bis zu 9) und hohe Salzkonzentrationen (bis zu 50 g/l)12 tolerieren können, was mehrere Vorteile in industriellen Prozessen bietet, die eine Exposition gegenüber extremen Bedingungen erfordern13. Biologische Abbaubarkeit und geringere Toxizität machen sie für Umweltanwendungen wie die Bioremediation geeignet. Aufgrund der Vorteile, die sie bieten, haben sie in verschiedenen Branchen wie der Lebensmittel-, Landwirtschafts-, Waschmittel-, Kosmetik- und Erdölindustrie mehr Aufmerksamkeit erhalten11. Biotenside haben auch in der Ölsanierung viel Aufmerksamkeit erregt, um Erdölverunreinigungen und toxische Schadstoffe zu entfernen14.
Hier berichten wir über die Herstellung, Charakterisierung und Anwendung von Biotensiden, die von Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 und Paenibacillus sp. IITD108 hergestellt werden. Die Schritte beim Screening, der Charakterisierung und der Anwendung einer Kombination von Biotensiden für eine verbesserte Ölgewinnung sind in Abbildung 1 dargestellt.
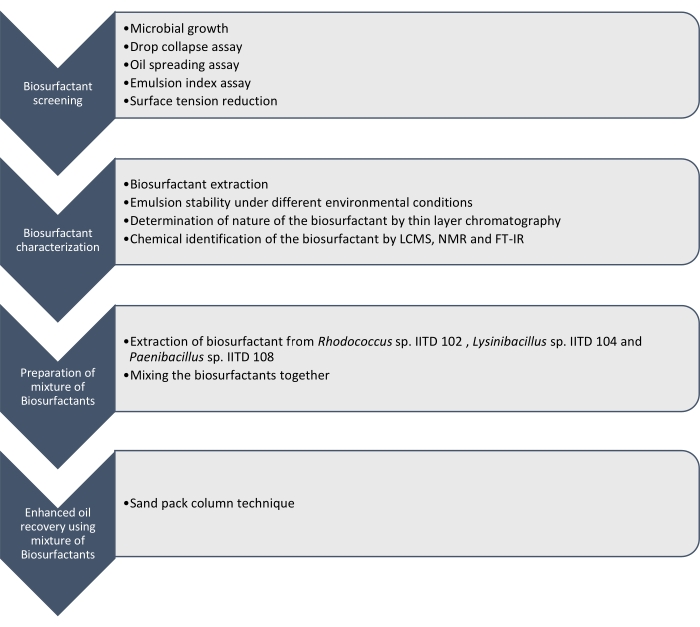
Abbildung 1: Eine Methode zur verbesserten Ölgewinnung unter Verwendung einer Kombination von Biotensiden. Der schrittweise Arbeitsablauf wird angezeigt. Die Arbeiten wurden in vier Schritten durchgeführt. Zuerst wurden die mikrobiellen Stämme kultiviert und für die Produktion von Biotensid durch verschiedene Assays untersucht, darunter Tropfenkollaps-Assay, Ölausbreitungsassay, Emulsionsindex-Assay und Oberflächenspannungsmessung. Dann wurden die Biotenside aus der zellfreien Brühe extrahiert und ihre Natur mittels Dünnschichtchromatographie identifiziert und sie wurden weiter mit LCMS, NMR und FT-IR identifiziert. Im nächsten Schritt wurden die extrahierten Biotenside miteinander vermischt und das Potenzial der resultierenden Mischung für eine verbesserte Ölgewinnung mittels der Sandpacksäulentechnik bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Das Screening dieser mikrobiellen Stämme zur Herstellung von Biotensiden erfolgte durch Tropfenkollaps, Ölausbreitung, Emulsionsindexmessung und Bestimmung der Verringerung der Oberflächenspannung des zellfreien Mediums aufgrund des Wachstums der Mikroben. Die Biotenside wurden durch LCMS, 1H NMR und FT-IR extrahiert, charakterisiert und chemisch identifiziert. Schließlich wurde eine Mischung aus Biotensiden hergestellt, die von diesen Mikroben produziert wurde und zur Rückgewinnung des Restöls in einer simulierten Sandpackungssäule verwendet wurde.
Die vorliegende Studie veranschaulicht nur die Methoden, die mit dem Screening, der Identifizierung, der strukturellen Charakterisierung und der Anwendung der Biotensidkombination zur Verbesserung der Restölgewinnung verbunden sind. Es bietet keine detaillierte funktionelle Charakterisierung der Biotenside, die von den mikrobiellen Stämmen15,16 produziert werden. Verschiedene Experimente wie die Bestimmung kritischer Mizellen, die thermogravimetrische Analyse, die Oberflächenbenetzbarkeit und die biologische Abbaubarkeit werden zur detaillierten funktionellen Charakterisierung jedes Biotensids durchgeführt. Da es sich bei diesem Papier jedoch um ein Methodenpapier handelt, liegt der Schwerpunkt auf dem Screening, der Identifizierung, der strukturellen Charakterisierung und der Anwendung der Biotensidkombination zur Verbesserung der Restölgewinnung. Diese Experimente wurden nicht in diese Studie einbezogen.
Protokoll
1. Wachstum mikrobieller Stämme
- Wiegen Sie 2 g Luria Brühe Pulver und fügen Sie zu 50 ml destilliertes Wasser in einem 250 ml konischen Kolben hinzu. Mischen Sie den Inhalt, bis sich das Pulver vollständig auflöst und machen Sie das Volumen mit destilliertem Wasser auf 100 ml.
- Bereiten Sie in ähnlicher Weise zwei weitere Flaschen mit 100 ml Luria-Brühe vor und legen Sie Wattestopfen auf den Hals der Kolben.
- Decken Sie die Baumwollstopfen mit Aluminiumfolie ab und autoklavieren Sie die Kolben für 15 min bei 121 °C und 15 psi, um die Medien zu sterilisieren.
- Nach dem Autoklavieren lassen Sie das Medium auf Raumtemperatur abkühlen.
- Für die Herstellung der Primärkultur eines Stammes wählen Sie eine einzelne Kolonie aus einer LA-Platte mit einer Impfschleife und impfen Sie in einem Reagenzglas mit 5 ml steriler Luria-Brühe.
- Inkubieren Sie das Reagenzglas über Nacht bei 30 °C bei 180 U/min.
- Beimpfen Sie die Kolben mit 100 ml autoklavierter Luria-Brühe, indem Sie 1 ml über Nacht gewachsene Samenkulturen in die Kolben im laminaren Luftstromschrank geben.
- Inkubieren Sie die Kolben in einem Drehinkubator bei 30 °C und 180 U/min für 7 Tage.
- Nach Abschluss der Inkubationszeit die Kolben ernten und die Kulturbrühe in die Zentrifugenröhrchen geben. Zentrifugieren Sie die Kultur bei 4.500 x g für 20 min in einer gekühlten Zentrifuge bei 4 °C.
- Gießen Sie den zellfreien Überstand vorsichtig in ein frisches Becherglas und verwenden Sie ihn in Screening-Assays für die Biotensidproduktion.
2. Screening-Assays für die Biotensidproduktion
HINWEIS: In den folgenden Abschnitten wurde kommerzielles Tensid (Saponin) als Positivkontrolle verwendet, während Wasser und ungeimpfte Medien als Negativkontrolle verwendet wurden.
- Tropfen-Collapse-Assay
- Nehmen Sie einen sauberen Glasträger und beschichten Sie die Oberfläche des Objektträgers mit 200 μL Öl.
- 20 μL des zellfreien Überstands in die Mitte des Öls geben und 2-3 min ungestört lassen.
HINWEIS: Wenn der Tropfen kollabiert, bewerten Sie den Überstand positiv auf das Vorhandensein von Biotensid.
- Ölausbreitungstest
- Nehmen Sie 20 ml doppelt destilliertes Wasser in eine Petriplatte (75 mm Durchmesser) und fügen Sie 200 μL Rohöl zur Wasseroberfläche hinzu.
- Geben Sie 20 μL zellfreien Überstand in die Mitte des Öls und lassen Sie es 1 min lang ungestört.
HINWEIS: Wenn eine Clearingzone aufgrund von Ölverdrängung gebildet wird, bewerten Sie den Überstand positiv für das Vorhandensein des Biotensids.
- Emulsionsindex-Assay (E-24-Assay )
- Fügen Sie jeweils 4 ml Benzin (Benzin) und zellfreien Überstand in ein sauberes Glasreagenzglas hinzu.
- Wirbeln Sie die Mischung 3 min lang kräftig auf und lassen Sie sie für die nächsten 24 h ungestört.
- Bestimmen Sie nach 24 h den E24-Index als Prozentsatz der Höhe der emulgierten Schicht (cm) im Verhältnis zur Höhe der gesamten Flüssigkeitssäule (cm).

HINWEIS: Wenn eine Emulsion (Öl in Wasser oder Wasser in Öl) nach 24 h beobachtet wird, enthält der Überstand wahrscheinlich das Biotensid.
- Messung der Oberflächenspannung
HINWEIS: Die Oberflächenspannung wurde mit der Du Noüy-Ringmethode17 gemessen. Das in diesem Experiment verwendete Instrument (siehe Materialtabelle) ist sehr empfindlich, also stellen Sie sicher, dass das Glasgefäß und die Sonde ordnungsgemäß gereinigt werden.- Schalten Sie das System ein und doppelklicken Sie auf die zugehörige Software, um es zu öffnen.
- Reinigen Sie das Glasgefäß mit der Flüssigkeit, deren Oberflächenspannung bestimmt werden soll.
- Geben Sie die Flüssigkeit (40 ml) in das Gefäß und montieren Sie das Gefäß auf dem Gefäßhalter.
- Entsperren Sie den Sondenhalter und montieren Sie die Sonde darauf. Verriegeln Sie nun den Sondenhalter durch Drücken der Lock-Taste am manuellen Controller.
- Stellen Sie mit dem manuellen Controller die Höhe der Plattform so ein, dass die Sonde etwa 2-3 mm von der Oberfläche der Flüssigkeit entfernt ist.
- Verwenden Sie nun die Software, um die Oberflächenspannung zu messen. Klicken Sie auf Datei im oberen linken Bereich des Bildschirms. Klicken Sie auf Arbeitsbereich öffnen. Ein Popup-Fenster wird angezeigt.
- Scrollen Sie nach unten und doppelklicken Sie auf das Symbol K100: Oberflächen- und Grenzflächenspannung.
- Klicken Sie nun auf das Dateisymbol in der oberen linken Ecke des Bildschirms. Klicken Sie auf Neue Datenbank. Geben Sie den Namen für das Speichern der Daten ein und klicken Sie auf OK.
- Klicken Sie erneut auf Datei > Neue Messung > SFT > Ring. Geben Sie den Namen für die Messung ein. Stellen Sie sicher, dass die Konfigurationsvorlage den SFT-Ring anzeigt.
- Füllen Sie die Details im Fenster Messkonfiguration aus, indem Sie die Sonde und das Gefäß auswählen, das für die Messung verwendet wird. Füllen Sie auch die Details der Flüssigkeits- und der Gasphase aus.
HINWEIS: Die flüssige Phase wird Wasser sein, während die Gasphase Luft sein wird. Die Dichte der flüssigen Phase ist die Dichte des zellfreien Überstandes. Dies kann bestimmt werden, indem das Gewicht von 50 ml der Flüssigkeit genommen und die Dichte als Kg/m3 berechnet wird. - Klicken Sie nun auf die Registerkarte Prozedur und geben Sie die folgenden Details ein: Erfassungsgeschwindigkeit: 6 mm/min, Detektionsempfindlichkeit: 0,005 g, Suchgeschwindigkeit: 6 mm/min, Suchempfindlichkeit: 0,005 g, Messgeschwindigkeit: 3 mm/min, Messempfindlichkeit: 0,001 g, Eintauchtiefe: 3 mm, Rücklaufdistanz: 10%, Korrektur: Harkins & Jordan, Max. Werte: 5. Klicken Sie auf OK.
- Wählen Sie im Popup-Fenster die Datenbank aus, in der Daten gespeichert werden sollen, und klicken Sie auf OK.
HINWEIS: Man kann hier eine neue Datenbank anlegen oder neue Messungen zu den vorhandenen Daten hinzufügen. - Klicken Sie nun auf die Schaltfläche Wiedergabe oben in der Mitte des Bildschirms. Das System beginnt mit der Ausführung des Skripts. Nachdem sich das System stabilisiert hat, erkennt es die Oberfläche. Tauchen Sie die Sonde in die Flüssigkeit ein, bewegen Sie die Sonde hin und her und erkennen Sie die Spannung in der gebildeten Lamelle.
- Um die Ergebnisse zu erhalten, klicken Sie auf das Messsymbol in der Mitte links auf dem Bildschirm. Klicken Sie auf Daten und notieren Sie sich die ermittelte Oberflächenspannung.
- Senken Sie nach Abschluss der Messung die Höhe der Plattform ab und entriegeln und demontieren Sie die Sonde und das Gefäß vom Instrument.
HINWEIS: Um die Abnahme der Oberflächenspannung aufgrund der Biotensidproduktion zu bestimmen, sollte uninokkuliertes LB als Kontrolle verwendet werden.
3. Extraktion von Biotensiden
- Stellen Sie den pH-Wert des zellfreien Überstands mit 2 N HCl auf 2 ein. Lagern Sie die Mischung über Nacht bei 4 °C.
- Das gleiche Volumen des Chloroform-Methanol-Gemisches (2:1) in den Überstand geben und 20 min lang kräftig mischen.
- Lassen Sie das Gemisch ungestört, damit eine Phasentrennung stattfinden kann.
- Entfernen Sie die obere Phase, die Wasser und Methanol enthält, und lassen Sie die untere Phase, die das Biotensid enthält, in einem Abzug verdampfen.
- Nach der Verdampfung der organischen Phase das honigfarbene rohe Biotensid in 3 ml Chloroform wieder auflösen und dieses Gemisch zur weiteren Identifizierung und Charakterisierung des Biotensids verwenden.
4. Studien zur Emulsionsstabilität
-
Emulsionsstabilität bei unterschiedlichen Temperaturen
- Nehmen Sie 5 ml zellfreie Überstände in verschiedenen Reagenzgläsern.
- Fügen Sie jedem Reagenzglas 5 ml Benzin hinzu und mischen Sie kräftig, indem Sie es 3 Minuten lang wirbeln.
- Inkubieren Sie die Reagenzgläser über Nacht in verschiedenen Wasserbädern bei unterschiedlichen Temperaturen (30 °C, 40 °C, 50 °C, 60 °C und 70 °C).
- Nach 24 h schätzen Sie die Emulsionsindizes wie bereits erwähnt.
-
Emulsionsstabilität bei unterschiedlichen pH-Werten
- Nehmen Sie 5 ml des zellfreien Überstands in saubere Reagenzgläser.
- Stellen Sie den pH-Wert von zellfreien Überständen (2, 4, 6, 8 und 10) mit 1 N HCl und 1 N NaOH ein.
- Geben Sie eine gleiche Menge Benzin in die Reagenzgläser und mischen Sie kräftig durch Vortexing für 3 min.
- Lassen Sie die Reagenzgläser bei Raumtemperatur 24 h ungestört.
- Schätzen Sie den Emulsionsindex wie bereits erwähnt.
-
Emulsionsstabilität bei unterschiedlichen Salzkonzentrationen
- Nehmen Sie 5 ml des zellfreien Überstands in saubere Reagenzgläser.
- Fügen Sie den Überständen unterschiedliche Mengen Salz (NaCl) hinzu (0 g/L, 5 g/L, 10 g/L, 20 g/L, 60 g/L und 80 g/L).
- Lösen Sie die Salze in den zellfreien Überständen auf, indem Sie 3 min lang wirbeln.
- Geben Sie eine gleiche Menge Benzin in die Reagenzgläser und mischen Sie kräftig durch Vortexing für 3 min.
- Lassen Sie die Reagenzgläser bei Raumtemperatur 24 h ungestört.
- Schätzen Sie den Emulsionsindex nach 24 h.
5. Bestimmung der Art des Biotensids
-
TLC des extrahierten Biotensids
- Spot 20 μL der Biotenside auf TLC-Platten. Spot 2 μL auf einmal.
- Erkennen Sie die Biotenside auf drei verschiedenen TLC-Platten.
- Es wird ein 100-ml-Gemisch des Elutionsmittels hergestellt, das Chloroform:Methanol (2:1) enthält, und das Elutionsmittel in die TLC-Kammer gegeben. Schließen Sie den Deckel der Kammer und lassen Sie ihn 20 Minuten lang sättigen.
- Nachdem Sie die Platten getrocknet haben, legen Sie die TLC-Platten in die mit einem Chloroform-Methanolgemisch gesättigte Kammer und lassen Sie die TLC laufen.
- Nachdem das Elutionsmittel die Oberseite der TLC-Platte (1 cm von der Oberseite entfernt) erreicht hat, nehmen Sie die Platten heraus und lassen Sie sie an der Luft trocknen.
-
Färbeung zur Lipiddetektion
- Nehmen Sie eine saubere TLC-Kammer und fügen Sie einige (5-10) Jodgranulate in die frische Kammer hinzu und sättigen Sie die Kammer für 5 bis 10 Minuten.
- Platzieren Sie die TLC-Platte in der Kammer und beobachten Sie die Entwicklung der gelben Flecken. Wenn die Flecken auftreten, bewerten Sie das Biotensid positiv auf das Vorhandensein der Lipidkomponente.
-
Färbeung zum Nachweis von Peptiden oder Aminosäuren
- Bereiten Sie eine Ninhydrinlösung vor, indem Sie 0,4 g Ninhydrin in 20 ml Butanol auflösen. Fügen Sie der Mischung 0,6 ml 100% Eisessigsäure hinzu.
- Besprühen Sie die TLC-Platte mit Ninhydrinlösung und lassen Sie sie 2 min an der Luft trocknen. Erhitzen Sie die Platte bei 110 °C und beobachten Sie die Entwicklung der Farbe.
HINWEIS: Wenn die blauen Flecken erscheinen, bewerten Sie das Biotensid positiv auf das Vorhandensein einer Peptidkette oder Aminosäure.
-
Färbeung zur Kohlenhydratdetektion
- Bereiten Sie eine Lösung von p-Anisaldehyd vor, indem Sie 2 ml p-Anisaldehyd zu 48 ml Eisessigsäure hinzufügen, die 1 mlH2SO4 enthält. Zugabe von 0,6 ml Essigsäure zu der Mischung.
- Sprühen Sie die Mischung gleichmäßig auf eine TLC-Platte und lassen Sie sie 2 min an der Luft trocknen.
- Inkubieren Sie die Platte bei 110 °C und überwachen Sie die Entwicklung von Spots.
HINWEIS: Wenn die grünen oder braunen Flecken erscheinen, bewerten Sie das Biotensid positiv auf das Vorhandensein von Kohlenhydraten.
6. Chemische Identifizierung des Biotensids
- LCMS des Biotensids
- 25 mg des extrahierten Biotensids in 1 ml Chloroform auflösen.
- Führen Sie LCMS (in einer Lock-Spray-Konfiguration mit einer Referenzscanfrequenz von 10 s) mit einer C18-Spalte durch.
- Verwenden Sie Chloroform:Methanol (1:1) als mobile Phase und injizieren Sie 2 μL der Probe mit einer Durchflussrate von 0,1 ml/min in die Säule.
- Stellen Sie die experimentellen Parameter wie folgt ein: Polarität: ES-positiv, Kapillarspannung: 3 kV, Quelltemperatur: 80 °C, Desolvationstemperatur: 300 °C, Desolvationsgasdurchfluss: 7.000 L/h und Abscheidergasdurchfluss: 0,40 ml/min.
- Scannen Sie die Bereiche von 100 bis 1.200 Da während einer Detektionszeit von 20 Minuten und untersuchen Sie die Ionen im positiven ES-Modus.
- Analysieren Sie die m / z-Werte mit einer beliebigen Massenspektrometrie-Software quantitativ.
- Zur Analyse melden Sie sich bei der Software an.
- Klicken Sie auf Stapelsuche und geben Sie die Liste der erhaltenen Massen ein. Untersuchen Sie die Ergebnisse in einem positiven Lademodus und verwenden Sie M + H und M + Na als Addukte. Halten Sie die Genauigkeit auf 10 PPM und aktivieren Sie die Display-Struktur.
- Klicken Sie auf Suchen und wählen Sie aus der Liste der Verbindungen diejenige mit dem niedrigsten PPM-Level aus.
- 1 H NMR des Biotensids
HINWEIS: 1H NMR des Biotensids wurde mit einem 400 MHz NMR-Spektrometer durchgeführt (siehe Materialtabelle).- 5 mg des Biotensids in 1 ml deuteriertem Chloroform (CdCl3) auflösen.
- Übertragen Sie die Mischung in ein NMR-Röhrchen. Verschließen Sie das Rohr ordnungsgemäß und führen Sie das Rohr in den Schraubenschlüssel ein. Stellen Sie die Höhe des Rohrs mit dem Einstellrohr ein.
- Legen Sie die Röhre zusammen mit dem Schraubenschlüssel in die NMR-Maschine und folgen Sie den unten genannten Schritten, um ein NMR-Spektrum zu erhalten.
- So wählen Sie den Probenröhrchentyp aus: sx N, wobei N die Position ist, an der das Röhrchen platziert wurde (z. B. sx 13, wenn das Röhrchen an der 13. Position platziert wurde) in der zugehörigenSoftware.
- Geben Sie edc ein und drücken Sie die Eingabetaste , um einen neuen Ordner zu erstellen, in dem Daten gespeichert werden können.
- Ein Popup-Fenster wird angezeigt. Wählen Sie das Lösungsmittel aus, indem Sie in der Liste auf CdCl 3 klicken und den Namen der Probe eingeben.
- Um das Protokoll zu starten, geben Sie "getprosol" ein. Um das Lösungsmittel zu verriegeln, geben Sie "Lock CDCL3" ein.
- Geben Sie "topshim" ein, um das Sample zu shimen, und geben Sie schließlich "rga;zgefp" ein, um die Daten zu erfassen. Dadurch wird das Protokoll gestartet.
- Nachdem die Spektren erhalten wurden, geben Sie "apk;abs n" ein und drücken Sie die Eingabetaste für die Phasen- und Baseline-Korrektur.
- Um primäre Spitzen auszuwählen, geben Sie "pp" ein und drücken Sie die Eingabetaste. Um nur intensive Spitzen auszuwählen, geben Sie "mi" ein und geben Sie die Intensität ein, ab der die Spitzen ausgewählt werden sollen. Der Standardwert ist 0,2.
- Um die Peaks zu integrieren, klicken Sie auf Integrieren und platzieren Sie den Cursor auf der linken Seite des zu integrierenden Peaks und während Sie den Cursor gedrückt halten, klicken und ziehen Sie den Cursor um den Peak.
- Speichern Sie die Daten, indem Sie in der oberen linken Ecke auf Datei und dann auf Speichern klicken.
- Die Probe kann durch Eingabe von "sx ej" aus der Maschine ausgeworfen werden.
- Analysieren Sie die Peaks und bestimmen Sie die Umgebung der H-Atome.
- Fourier-Transformations-Infrarotspektroskopie des Biotensids
HINWEIS: FT-IR des extrahierten Biotensids wurde mit einem kommerziell erhältlichen Spektralphotometer im ATR-Modus durchgeführt (siehe Materialtabelle).- Schalten Sie das Spektralphotometer ein und überprüfen Sie die Spülung, das Trockenmittel und den Detektor.
- Um ein Spektrum zu erfassen, erfassen Sie zunächst das Hintergrundspektrum, ohne dass eine Stichprobe vorhanden ist.
- Nehmen Sie das extrahierte Biotensid und trocknen Sie es vollständig ab. Legen Sie das getrocknete Biotensid direkt über den Diamantkristall, üben Sie Druck aus und drücken Sie den ATR-Berührungspunkt.
- Wählen Sie in der Software die Anzahl der Scans (geben Sie 30 ein) und scannen Sie das Spektrum von 400 cm-1 bis 4.000 cm-1.
- Klicken Sie auf OK, um das Probenspektrum zum Spektralfenster hinzuzufügen.
- Klicken Sie auf Dateien > Speichern > Speichern unter und geben Sie den Dateinamen gefolgt von der Erweiterung .spa ein und klicken Sie auf OK.
7. Anwendung von Biotensiden (verbesserte Ölgewinnung)
HINWEIS: In diesem Experiment wurde doppelt destilliertes Wasser als Negativkontrolle und 10% SDS, 10% Tween 80 und 10% kommerzielles Saponin als Positivkontrollen verwendet.
- Nehmen Sie das Glas und versiegeln Sie den unteren Auslass mit Glaswolle und Glasperlen.
- Packen Sie die Säule mit sandigem Boden so, dass oben auf dem Boden etwas Flüssigkeit hinzugefügt werden kann und der Durchfluss unten gesammelt werden kann. Montieren Sie die Säule auf dem Halter und fügen Sie einige Glasperlen auf dem Boden hinzu.
- Überfluten Sie die Säule mit 50 ml Solelösung und sammeln Sie den Durchfluss, um das Porenvolumen zu bestimmen.
Porenvolumen = Volumen der oben hinzugefügten Sole - Volumen des gesammelten Durchflusses. - Entfernen Sie die Sole von der Säule, indem Sie Rohöl zwingen, es zu passieren, nachdem Sie es von der Oberseite der Säule hinzugefügt haben. Sammeln Sie das Volumen der Sole und des Öls, das aus der Säule kommt, um das anfängliche Ölsättigungsvolumen zu bestimmen. Das Volumen der aus der Säule freigesetzten Sole ist das anfängliche Ölsättigungsvolumen oder das ursprüngliche Öl.
- Lassen Sie die Säule 24 Stunden lang ungestört.
- Nach 24 Stunden die Säule mit 10 Porenvolumina Sole überfluten und das aus der Säule austretende Öl sammeln, um die sekundäre Ölgewinnung abzuschätzen. Das Öl, das nach der Sekundärölgewinnung in der Säule verbleibt, entspricht dem Restöl.
- Bereiten Sie eine Mischung von Biotensiden vor, indem Sie gleiche Volumina des extrahierten Biotensids (extrahiert nach Schritt 3.5) in das Glasbecherglas geben. Fügen Sie die Biotenside an der Oberseite der Säule hinzu und inkubieren Sie die Säule für 24 h.
- Messen Sie nach 24 Stunden die Menge an Öl und Wasser, um eine zusätzliche oder verbesserte Ölgewinnung zu bestimmen. Das Volumen des aus der Kolonne freigesetzten Öls entspricht dem zurückgewonnenen Restöl.
- Schätzen Sie die verbesserte Ölgewinnung mit der folgenden Gleichung:

Ergebnisse
Drei Bakterienstämme (Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 und Paenibacillus sp. IITD108) wurden für die Produktion von Biotensiden durch verschiedene Assays untersucht, darunter Tropfenkollaps-Assay, Ölverdrängungsassay, Emulsionsindex-Assay und Oberflächenspannungsreduktion. Zellfreie Überstände aller drei Bakterienstämme und eine Lösung aus chemischem Tensid führten zu einem Tropfenkollaps und wurden daher positiv auf das Vorhandensein der Biotenside bewertet (Abbildung 4a). Auf der anderen Seite kollabierte der Wassertropfen nicht und wurde daher für das Vorhandensein des Biotensids negativ bewertet. Kommerzielles Tensid und die zellfreien Überstände der drei Bakterienkulturen waren auch erfolgreich bei der Verdrängung der Ölschicht im Ölausbreitungsassay und wurden daher positiv auf das Vorhandensein von Biotensid bewertet (Abbildung 4b). Wasser hingegen konnte kein Öl verdrängen und wurde daher negativ bewertet. Bei Emulsionsindex-Assays wurde eine stabile Emulsion in Reagenzgläsern beobachtet, die kommerzielles Tensid und die Überstände der drei mikrobiellen Stämme enthielten. Im Reagenzglas, das nicht geimpftes Kulturmedium enthielt, wurde jedoch keine Emulsion beobachtet (Abbildung 4c). Dies wiederum deutete darauf hin, dass Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 und Paenibacillus sp. IITD108 Biotenside produzieren. Die Bestätigung der Biotensidproduktion wurde erhalten, indem die Oberflächenspannung der zellfreien Brühe gemessen und mit der ungeimpften Kontrolle verglichen wurde. Die Biotenside von Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 und Paenibacillus sp. IITD108 reduzieren die Oberflächenspannung des Mediums von 58,89 mN/m auf 45,41 mN/m, 45,82 mN/m bzw. 28,43 mN/m (Abbildung 5).
IFT-Messungen wurden mit der Ringzugmethode durchgeführt. Die Biotenside aller drei Stämme waren in der Lage, die Grenzflächenspannungen zwischen verschiedenen wässrigen und organischen Phasen signifikant zu reduzieren (Tabelle S1). Die Oberflächenspannungs- und Grenzflächenspannungsmessungen bestätigen, dass alle drei Stämme Biotenside produzieren.
Die Lösungsmittelextraktion von Biotensiden aus den zellfreien Kulturen von Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 und Paenibacillus sp. IITD108 führte zu Biotensidkonzentrationen von 820 mg/L, 560 mg/L bzw. 480 mg/L.
Wie in Abbildung 4C beobachtet, handelte es sich bei der durch das Biotensid gebildeten Emulsion um Wasser in Ölmikroemulsion. Emulsionsstabilitätstests zeigten, dass die Biotenside unter verschiedenen Umweltbedingungen eine gute Stabilität aufwiesen (Abbildung 6). Die erzeugten Emulsionen waren sehr stabil über verschiedene getestete Temperaturen (Abbildung 6a), pH-Werte (Abbildung 6b) und Salzkonzentrationen (Abbildung 6c).
Die Dünnschichtchromatographie wurde durchgeführt, um die Art der Biotenside zu bestimmen. Die Färbung der Platten mit Joddampf führte zur Entwicklung gelber Flecken in allen Biotensiden und zur Kontrolle (Biotensid von Bacillus sp. IITD 106 (Abbildung 7a). Dies deutete darauf hin, dass die Biotenside einen Lipidanteil enthielten. Bei der Färbung mit Ninhydrin wurden in keiner der TLC-Platten blau gefärbte Flecken erhalten (Abbildung 7b). Dabei zeigte sich, dass die Biotenside keinen Peptidanteil enthielten. Blaue und grüne Flecken wurden in allen TLC-Platten beobachtet, wenn sie mit Anisaldehydflecken gefärbt waren (Abbildung 7c). Dabei zeigte sich, dass die Biotenside einen Kohlenhydratanteil enthielten. Aus den Ergebnissen von TLC wurde der Schluss gezogen, dass alle Biotenside Glykolipide waren.
Die chemische Identifizierung der Biotenside mittels LCMS ergab, dass die Rhodococcus sp. IITD102 und Lysinibacillus sp. IITD104 die gleiche Art von Biotensid produzieren, die als Di-rhamnopyranosische Hydroxydecansäure mit einer Masse von 480,25 Da identifiziert wurde. Die Struktur des Biotensids wurde durch 1H NMR- und FT-IR-Daten unterstützt (Abbildung 8).
Im 1-H-NMR-Spektrumrepräsentierten die bei 7,2 erhaltenen chemischen Verschiebungen die Protonen von Carbonsäuregruppen. Chemische Verschiebungen, die Protonen der Methylgruppe entsprechen, wurden im Bereich von 1-2 ppm erhalten. Verschiebungen, die Protonen entsprechen, die an Alkylgruppen gebunden sind, wurden bei 2,3 ppm erhalten. FT-IR-Spektren der aus Rhodococcus sp. IITD102 und Lysinibacillus sp. IITD104 extrahierten Biotenside zeigten das Vorhandensein starker Spitzen bei Welle 3.290 cm-1, was das Vorhandensein der OH-funktionellen Gruppe bestätigt. Ein kleiner Peak bei Welle Nummer 2.951 cm-1 entspricht der CH-Dehnung. Ein starker Peak bei 1.620 cm-1 repräsentierte das Vorhandensein von Carbonsäuregruppe in den Biotensiden. Andere Peaks, die bei 1.530, 1.410, 1.200 und 1.060 erhalten wurden, bestätigten das Vorhandensein von funktionellen Gruppen Alkyl, CH3, C-O-C bzw.C-CH3. Sowohl NMR- als auch FT-IR-Daten unterstützten die Struktur des Biotensids, die aus LCMS-Studien ermittelt wurde. LCMS von rohem Biotensid aus Paenibacillus sp. IITD108 (Abbildung 9) zeigte, dass es ein Rhamnolipid produziert, das drei Lipidketten enthält, die den hydrophoben Massenkern des Biotensids bilden. Das Biotensid wurde als 2decanoyl)-αL rhamnopyranosyl-3-hydroxydecanosäure mit einer Masse von 802 Da identifiziert. Die Ergebnisse von LCMS wurden durch 1H NMR- und FT-IR-Daten gestützt.
Die Einrichtung für eine verbesserte Ölgewinnung ist in Abbildung 2 dargestellt.

Abbildung 2: Versuchsaufbau zur verbesserten Ölgewinnung unter Verwendung der Sandpacksäulentechnik. Die mit Erde gefüllte Säule wurde auf dem Halter montiert. Der untere Auslass wurde mit Glaswolle und Glasperlen versiegelt. Nach der Sekundärgewinnung wurde das Restöl in der Säule einer verstärkten Ölrückgewinnung durch Zugabe des Biotensidgemisches unterzogen. Das am Boden der Säule platzierte Rohr wurde verwendet, um die eluierte Fraktion zu sammeln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
In dem simulierten Experiment zur verbesserten Ölgewinnung wurden von 50 ml Sole, die der Oberseite der Säule zugesetzt wurden, 12 ml im Durchfluss gesammelt, und daher wurde das Porenvolumen auf 38 ml geschätzt. Als Öl durch die Säule gedrückt wurde, wurden 33 ml Sole aus der Säule freigesetzt. Dies stellte das anfängliche Ölsättigungsvolumen dar. Die sekundäre Rückgewinnung unter Verwendung von 10 Porenvolumina Sole führte zur Elution von 10 ml Öl. Das in der Kolonne verbliebene Restöl betrug 23 ml. Wasser, das die Mischung von Biotensiden enthielt, konnte 13 ml Öl aus der Säule zurückgewinnen (Abbildung 3).
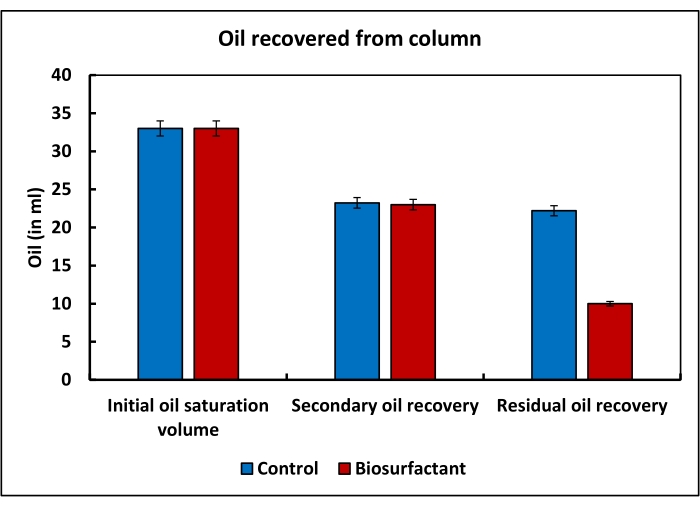
Abbildung 3: Simulierte verbesserte Ölgewinnung unter Verwendung einer Sandpacksäule. Das anfängliche Ölsättigungsvolumen sowohl der Kontroll- als auch der Testkolonne betrug etwa 33 ml. Während der Sekundärölgewinnung wurden rund 10 ml des Öls sowohl aus der Kontroll- als auch aus der Testkolonne gewonnen. Die Unterschiede in den Rückgewinnungsprofilen des Tests und der Kontrollsäulen wurden nur bei der Rückgewinnung des in der Kolonne verbliebenen Restöls beobachtet. Das Biotensidgemisch führte zu einer weiteren Rückgewinnung von 13 ml des Restöls aus der Testsäule, während in der Kontrollsäule in diesem Schritt nur 1,03 ml Öl zurückgewonnen wurden. Dies zeigt, dass das Biotensidgemisch ein großes Potenzial hat, die Rückgewinnung von Restöl aus den Lagerstätten zu verbessern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Dies stellte eine verbesserte Ölgewinnung dar. Daher war Wasser, das die Mischung von Biotensiden enthielt, in der Lage, 56,52% des Restöls aus der Säule zurückzugewinnen (Tabelle 1). Auf der anderen Seite konnten Lösungen von 10% SDS, 10% Tween 80 und 10% Saponin 85%, 68% und 73% Restöl aus der Säule gewinnen.
| Parameter | Hochwasser kontrollieren | Kombinierte Biotensidflutung | 10 % SDB | 10 % Tween | 10 % Saponin |
| PV (mL) | 37 | 38 | 38 | 35 | 37 |
| OOIP / IOSV (ml) | 33 | 33 | 33 | 29 | 33 |
| POS (%) | 89.91 | 86.84 | 86.84 | 82.85 | 89.18 |
| SV (ml) | 330 | 330 | 330 | 330 | 330 |
| SOR (ml) | 9.77 | 10 | 11.5 | 9.2 | 10 |
| ROC (ml) | 23.23 | 23 | 21.5 | 18.8 | 23 |
| ROS (%) | 70.39 | 69.69 | 65.15 | 64.82 | 69.69 |
| Rv (ml) | 60 | 60 | 60 | 60 | 60 |
| ROR (ml) | 1.03 | 13 | 18.5 | 12.8 | 16.8 |
| AOR (%) | 4.43 | 56.5 | 85 | 68.08 | 73.04 |
wobei PV = Porenvolumen, bestimmt nach anfänglicher Säulensättigung mit Sole, OOIP = ursprüngliches Öl an Ort und Stelle, IOSV = anfängliches Ölsättigungsvolumen, POS = Prozentuale Ölsättigung, Sv = Volumen der zur Sekundärgewinnung hinzugefügten Sole, SOR = Sekundäröl, das nach Soleüberschwemmungen gewonnen wird, ROC = Restöl in der Kolonne nach sekundärer Gewinnung, ROS = Restölsättigung, ROR = Restöl, das nach einer Biotensidflutung gewonnen wurde, AOR = zusätzliches gewonnenes Öl
Tabelle 1: Simulierte verbesserte Ölgewinnung in einer Sandpackungssäule.

Abbildung 4: Screening-Assays für die Biotensidproduktion (a) Tropfenkollaps-Assay: Der Wassertropfen kollabierte nicht, nachdem er auf die ölbeschichtete Oberfläche gegeben wurde, während das chemische Tensid und die zellfreien Überstände der drei Bakterienstämme zum Tropfenkollaps führten. (b) Ölverdrängungsassay: Der Wassertropfen führte nicht zu einer Verdrängung des Öls, während das chemische Tensid und die zellfreien Überstände der drei Bakterienstämme die Ölschichten verdrängten (c) Emulsionsindex-Assay: Die zellfreien Überstände und die kommerzielle Tensidlösung führten alle zur Bildung eines stabilen Emulsionsindex. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
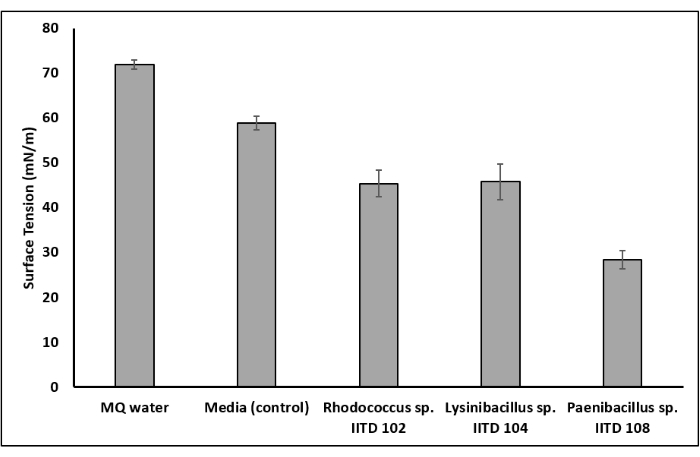
Abbildung 5: Reduzierung der Oberflächenspannung durch Biotensidproduktion. Die Bestimmung der Verringerung der Oberflächenspannung des Mediums aufgrund des mikrobiellen Wachstums bestätigte die Biotensidproduktion durch die mikrobiellen Mitglieder. Durch das Wachstum von Rhodococcus sp. IITD 102 und Lysinibacillus sp. IITD 104 reduzierte sich die Oberflächenspannung des Mediums von 59 mN/m auf 45 mN/m. Durch das Wachstum von Paenibacillus sp. IITD 108 reduzierte sich die Oberflächenspannung des Mediums von 59 mN/m auf 28 mN/m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
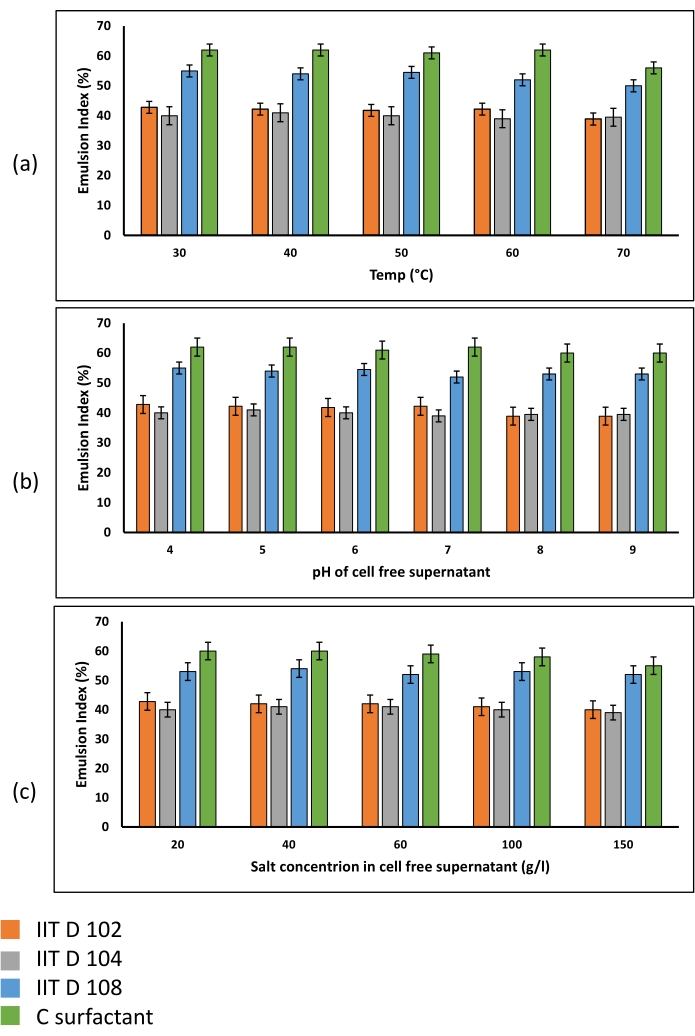
Abbildung 6: Emulsionsstabilität bei verschiedenen (a) Temperaturen, (b) pH-Werten und (c) Salzkonzentrationen. Alle Emulsionen, die unter Verwendung der Überstände der drei mikrobiellen Stämme und der Mischung aus kommerziellem Tensid erzeugt werden, zeigen eine große Stabilität unter verschiedenen Umgebungsbedingungen. Innerhalb der getesteten Bereiche Temperatur, pH-Wert und Salzkonzentration waren die ermittelten Emulsionsindizes ähnlich und es wurde keine signifikante Verringerung der EI bei höheren Werten der unterschiedlichen Faktoren beobachtet, was darauf hindeutet, dass Biotensid unter extremen Umweltbedingungen eingesetzt werden kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
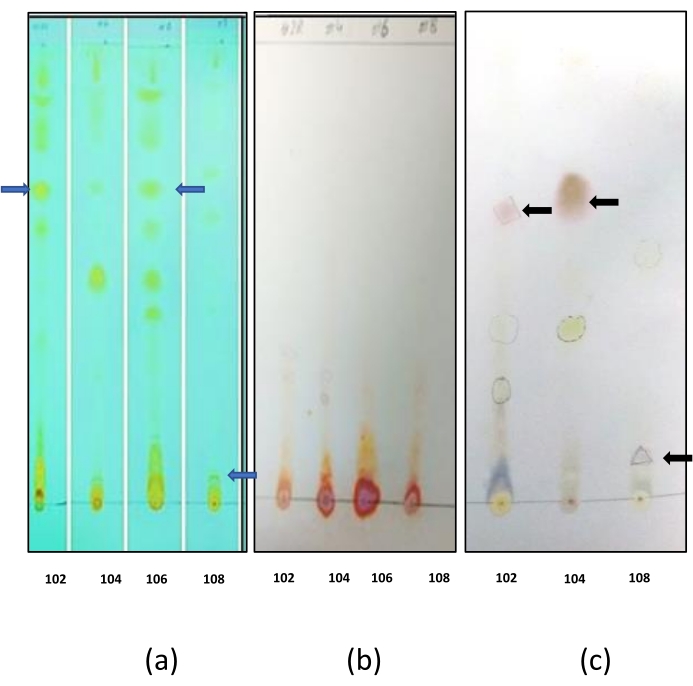
Abbildung 7: TLC-Charakterisierung von Biotensiden (a) Mit Joddampf angefärbte Platten: Verschiedene auf der TLC-Platte entwickelte Stellen zeigen, dass die extrahierten Biotenside eine Mischung aus verschiedenen Verbindungen sind, die eine Lipidgruppe enthalten. Die mit dem blauen Pfeil markierten Flecken stellen die Biotenside dar, die positiv auf das Vorhandensein von Lipidanteilen gefärbt sind. Die anderen Flecken stellen den Rest der Verbindungen dar, die in der Mischung des rohen Biotensids vorhanden sind. b) Mit Ninhydrin gefärbte Platten: Es traten keine violetten Flecken auf, wenn die Platten mit Ninhydrin gefärbt waren. Dies stellte das Fehlen von Aminosäuren in der Biotensidmischung und (c) mit Anisaldehyd angefärbten Platten dar: Hellgrüne und gelbe Flecken erschienen auf der TLC-Platte und diese stellen die zuckerhaltigen Verbindungen dar. Die mit schwarzen Pfeilen markierten Flecken stellen die Biotenside dar, die sich positiv auf das Vorhandensein des Kohlenhydratanteils ausgefärbt haben. Die Flecken, die sowohl mit Jod als auch mit Anisaldehyd gefärbt sind, stellen Verbindungen dar, die sowohl Lipid- als auch Kohlenhydratanteile enthalten, und könnten möglicherweise ein Glykolipid-Biotensid sein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
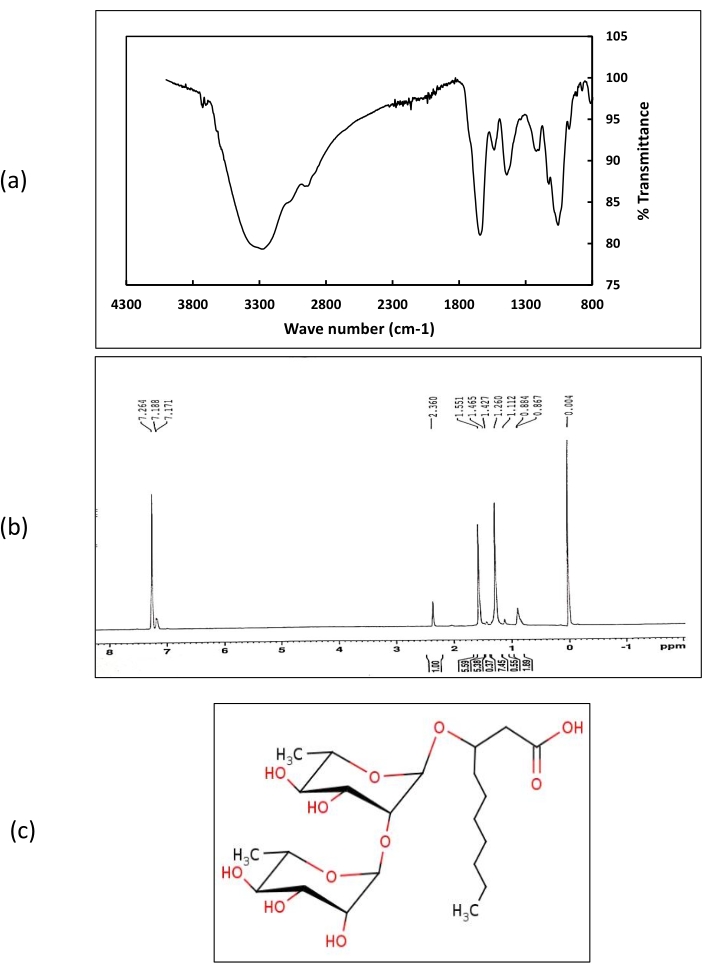
Abbildung 8: Chemische Charakterisierung des aus Rhodococcus sp. IITD 102 und Lysinibacillus sp. IITD 104 extrahierten Biotensids. (a) die FT-IR-Spektren der aus Rhodococcus sp. IITD 102 und Lysinibacillus sp. IITD 104 extrahierten Biotenside darstellt, (b) die H1 NMR-Spektren der aus Rhodococcus sp. IITD 102 und Lysinibacillus sp. IITD 104 extrahierten Biotenside darstellt, und (c) zeigt die Struktur der rohen Biotenside, die aus Rhodococcus sp. IITD 102 und Lysinibacillus sp. IITD 104 extrahiert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
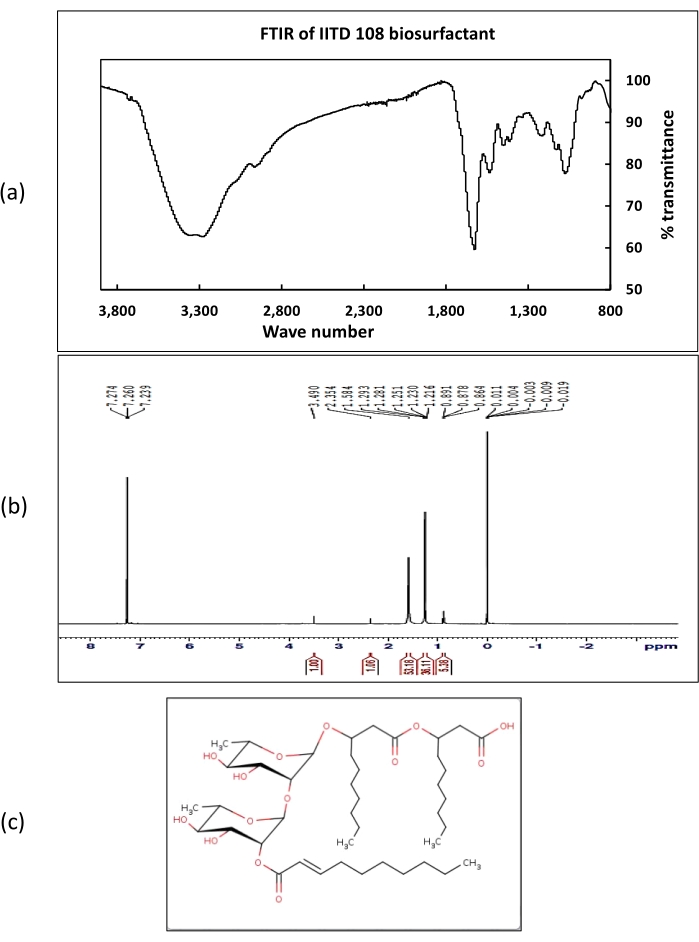
Abbildung 9: Chemische Charakterisierung des aus Paenibacillus sp. IITD 108 extrahierten Biotensids. (a) die FT-IR-Spektren der aus Paenibacillus sp. IITD 108 extrahierten Biotenside darstellt, (b) die 1H NMR-Spektren der aus Paenibacillus sp. IITD 108 extrahierten Biotenside darstellt und (c) die Struktur der aus Paenibacillus sp. IITD 108 extrahierten rohen Biotenside zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung S1: Struktur verschiedener Arten von Biotensiden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Tabelle S1: Wirkung von Biotensiden auf die Grenzflächenspannung (IFT) zwischen Wasser und Kohlenwasserstoffen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Biotenside sind eine der vielseitigsten Gruppen biologisch aktiver Komponenten, die zu attraktiven Alternativen zu chemischen Tensiden werden. Sie haben eine breite Palette von Anwendungen in zahlreichen Branchen wie Waschmittel, Farben, Kosmetika, Lebensmittel, Pharmazeutika, Landwirtschaft, Erdöl und Wasseraufbereitung aufgrund ihrer besseren Benetzbarkeit, niedrigeren CMC, diversifizierte Struktur und Umweltfreundlichkeit18. Dies hat zu einem erhöhten Interesse an der Entdeckung von mehr mikrobiellen Stämmen geführt, die in der Lage sind, Biotensid zu produzieren. Hier veranschaulichen wir die Methoden zum Screening, zur Identifizierung und Anwendung einer Mischung von Biotensiden, die von Rhodococcus sp. IITD 102, Lysinibacillus sp. IITD 104 und Paenibacillus sp. IITD 108 für eine verbesserte Ölgewinnung hergestellt werden. Die Biotensidproduktion wurde durch Tropfenkollaps, Ölausbreitung, Emulsionsindextest gescreent und durch Messung der Verringerung der Oberflächenspannung des Mediums aufgrund des mikrobiellen Wachstums bestätigt. Verschiedene Berichte über die Produktion von Glykolipid-Biotensiden (Rhamnolipide und Trehalolipide) aus Rhodococcus sind in der Literatur 19,20,21,22,23,24 verfügbar. Najafi et al. haben über die Produktion und Optimierung eines Lipopeptid-Biotensids aus Paenibacillus sp. alvei ARN6325 berichtet. Bezza et al. haben über den biologischen Abbau von Pyren durch ein Lipopeptid-Biotensid berichtet, das von Paenibacillus dendritiformis CN526 produziert wird. Die Produktion von Biotensiden (Lipopeptide und Glykolipide) wurde auch von anderen Stämmen von Paenibacillus 27,28,29,30,31 berichtet. Es wurde berichtet, dass verschiedene Arten von Lysinibacillus Biotenside produzieren32,33,34. Es wurde berichtet, dass Lysinibacillus sphaericus Rhamnolipid produziert, das zur Solubilisierung hydrophober Pestizidefähig ist 35.
Einer der Vorteile, die Biotenside gegenüber ihren chemischen Gegenstücken bieten, ist ihre Stabilität unter extremen Umweltbedingungen. Die von Rhodococcus sp. IITD 102, Lysinibacillus sp. IITD 104 und Paenibacillus sp. IITD 108 produzierten Biotenside wurden auf ihre Stabilität in verschiedenen Bereichen von Temperatur, pH-Wert und Salzkonzentrationen untersucht und erwiesen sich unter extremen Werten dieser Parameter als stabil. Zuvor berichteten Habib et al. über ein Lipopeptid, das durch Kohlenwasserstoffabbau von Rhodococcus sp. produziert wurde und Stabilität über verschiedene Temperaturbereiche, pH-Werte und Salzkonzentrationen zeigte36. Es wurde berichtet, dass ein Anstieg der Konzentration anorganischer Salze die Stabilität der Emulsionerhöht 37. Die Tendenz der Kolloide, sich zu agglomerieren oder zu trennen, ist eine Funktion der anziehenden (Van-der-Walls-Kräfte) und abstoßenden Kräfte (elektrostatische Kräfte), die während der Teilchenwechselwirkung beteiligt sind38. Die Salzkristalle beim Auflösen in Wasser bauen ihre eigenen elektrischen Ladungen auf und die freigesetzten Ionen adsorbieren an den Emulsionströpfchen. Bei Erhöhung der Salzkonzentration nimmt die Ausdehnung und Abstoßung der zweiten Schicht ab. Je höher die Ladungsdichte eines Ions ist, desto niedriger ist auch die Länge der elektrischen Schicht. So führen zweiwertige Kationen wie Na2+ zur Bildung stabilerer Emulsionen im Vergleich zu einwertigen Kationen39.
Ein weiterer Vorteil, den Biotenside gegenüber chemischen Tensiden haben, ist, dass sie biologisch abbaubarsind 40. Zeng et al. haben die Abbaukapazitäten von synthetischem Tensid Triton X 100, linearen Alkylbenzolsulfonaten (LAS) und Rhamnolipid verglichen und festgestellt, dass das Rhamnolipid-Biotensid vollständig abgebaut wurde, während LAS und Triton X 100 nur teilweise abgebautwurden 41. Liu et al. berichten auch, dass Rhannolipid im Gegensatz zu den synthetischen Tensiden CTAB, Triton X 100 und SDS keine Toxizität aufweisen und leicht durch B. subtilis und andere Kompostmikroorganismenabgebaut werden könnten 42.
Bei den von allen drei mikrobiellen Stämmen produzierten Biotensiden handelte es sich um Glykolipide. Rhodococcus wurde zuvor von verschiedenen Forschungsgruppen 20,21,23 berichtet, dass Rhodococcus Glykolipide produziert. Ähnliche Berichte über die Produktion von Glykolipid-Biotensiden durch Lysinibacillus und Paenibacillus sind auch in der Literatur 31,32,35,43,44 verfügbar. Die chemische Identifizierung der Biotenside ergab, dass es sich um Rhamnolipide handelt. Rhamnolipide sind die Klasse von Glykolipid-Biotensiden, die eine oder zwei Rhamnose-Einheiten enthalten, die mit einer Lipidketteverbunden sind 45. Sie sind die am meisten untersuchte Art von Biotensiden. Es wurde berichtet, dass verschiedene mikrobielle Stämme Rhamnolipide 7,46,47,48,49 produzieren. Es wurde berichtet, dass Rhamnolipide ein hohes Potenzial zur Verbesserung der Rückgewinnung von Restölaufweisen 50,51,52,53. In unserer Studie fanden wir heraus, dass die Mischung von Biotensiden, die von Rhodococcus sp. IITD 102, Lysinibacillus sp. IITD 104 und Paenibacillus sp. IITD 108 produziert wurde, in einem simulierten Sandpacksäulentest erfolgreich rund 56,52% des Restöls zurückgewonnen hat. Dabei zeigte sich, dass das Gemisch der Biotenside zur Rückgewinnung von Restöl aus den Bodenlagerstätten genutzt werden kann. In einem ähnlichen Sandpackungstest haben Sun et al. berichtet, dass Biotensid 50% des Restöls zurückgewinnenkonnte 54. Es wurde auch berichtet, dass Biotenside, die zellfreie Brühe von Bacillus subtilis enthalten, wirksam bei der Rückgewinnung von 33% des Restölssind 55. Die Restölgewinnung von 27% und 26%-36% wurde auch von Darvishi et al. und Wahabi et al.56,57 gemeldet.
Die ökonomische Bewertung von Biotensiden zur Rückgewinnung von Restöl aus Lagerstätten zeigt, dass der Einsatz von Biotensiden in EOR wirtschaftlich sinnvoll ist. Moutinho et al. berichteten, dass die typischen Kosten für ein kommerzielles Biotensid (Rhamnolipide) bei etwa 59,6 USD pro kg58 liegen. In einer anderen Studie wurde auch berichtet, dass die Biotensidkonzentration von 28 mg/L Biotensid die Restölgewinnung verbesserte und zur Produktion von52,5 m3 zusätzlichem Öl führte59. Die Studien zeigten, dass die Biotensidkonzentration von 10 mg/L ausreichte, um die Ölgewinnung zu mobilisieren. Nach den gemeldeten Daten beträgt die Menge an Biotensid, die zur Herstellung von 52,5 m3 zusätzlichem Öl benötigt wird, etwa 0,525 kg. Die Gesamtkosten der Produktion von 52,5 Mio.3 Öl betragen etwa 21463 US-Dollar, von denen nur 30 US-Dollar die Produktionskosten des Biotensids sind. Die Daten zeigen, dass die prozentualen Kosten des Biotensids in der Ölproduktion pro Barrel nur 0,0000139% betragen.
Unsere Ergebnisse deuten darauf hin, dass die Kombination der Biotenside effizient zur Rückgewinnung von Restöl aus den Lagerstätten eingesetzt werden kann. Unseres Wissens ist dies der erste Bericht über die Verbesserung der Rückgewinnung des Restöls aus dem Reservoir unter Verwendung einer Mischung von Biotensiden, die von verschiedenen mikrobiellen Stämmen produziert werden. Obwohl unsere Studie die Methoden des Screenings, der strukturellen Charakterisierung und der Anwendung von Biotensiden bei der verbesserten Ölgewinnung klar beschreibt, liefert die Studie keine detaillierte funktionelle Charakterisierung der Biotenside, die ihre Effizienz in verschiedenen Anwendungen beeinflussen. Die kritische Mizellenkonzentration, die das Maß für die Effizienz eines Tensids bei der Bildung der Mizellen ist und die Grenzkonzentration des Tensids für seine sinnvolle Verwendung angibt, wurde in der vorliegenden Studienicht bestimmt 60. In ähnlicher Weise wurde die thermische Stabilität des Biotensids, die seine Anwendbarkeit unter Reservoirbedingungen für EOR bestimmt, ebenfalls nicht beschrieben61. Biotenside werden in einigen Anwendungen auch als Antibiofilmmittel eingesetzt. Ihre Oberflächenbenetzbarkeit spielt eine wichtige Rolle bei der Bestimmung ihrer Antibiofilm-Natur. Studien zur Benetzbarkeit von Oberflächen wurden in der vorliegenden Arbeit ebenfalls nicht durchgeführt62. Andere funktionelle Eigenschaften, die für verschiedene Anwendungen von Biotensiden wichtig sind, einschließlich ihrer biologischen Abbaubarkeit und der antimikrobiellen Natur, wurden in dieser Studie ebenfalls nicht bestimmt63,64. Daher haben wir uns auf die strukturelle Charakterisierung von Biotensiden konzentriert. Abhängig von der Zielanwendung können funktionelle Charakterisierungen wie Stabilität, biologische Abbaubarkeit und antimikrobielle Aktivität durchgeführt werden.
Um die Sichtbarkeit zu erhöhen, ist es besser, ein Öl zu verwenden, das etwas Farbe hat, um die Sichtbarkeit zu erhöhen. Im Ölausbringungsassay sollte die Emulsion nach 24 h beobachtet werden. Leichte Schäume, wenn sie gebildet werden, zerfallen in 24 h. Tensiometer sind sehr empfindliche Instrumente, daher sollten bei Oberflächenspannungsmessungen der Behälter und die Sonde vor jeder Messung ordnungsgemäß gereinigt werden, um Fehler aufgrund von Übersetzungen der letzten Messungen zu vermeiden. Bei der Extraktion von Biotensid wird dem zellfreien Überstand ein Chloroform-Methanolgemisch zugesetzt. Der Schritt sollte entweder in einem Abzug durchgeführt werden, oder der Kolben sollte unmittelbar nach dem Transfer der Extraktionsmischung mit Aluminiumfolie bedeckt werden. Während der Sekundärgewinnung in einem EOR-Experiment sollte Solelösung im Übermaß zugegeben werden, bis kein weiteres Öl aus der Säule kommt.
Die Methode diskutiert den Umfang der Mischung von Biotensiden bei der Rückgewinnung von Restöl aus den Säulen. Der Prozess ist von vielen Faktoren abhängig. Das Wachstumsstadium der Mikroben, in dem die Ausgangskulturen geerntet werden. Es wurde berichtet, dass einige Biotenside in der Log-Phase produziert werden, während andere in der stationären Phase produziert werden. Die Kulturen sollten entsprechend in der jeweiligen Phase geerntet werden, in der die Biotensidproduktion ihr Maximum erreicht hat. Biotensid-Screening-Assays sind weniger empfindlich, daher sollten alle Assays durchgeführt werden, bevor eine Schlussfolgerung über die Biotensid-Produktionsfähigkeit eines bestimmten Stammes gezogen wird. Die Reinigung des Biotensids sollte vor der chemischen Charakterisierung des Biotensids durchgeführt werden, wenn die Konzentration des Biotensids im rohen Biotensid niedrig ist. Verbesserte Ölgewinnungsexperimente hängen stark von der Art des Bodens ab, der für die Verpackung der Säule verwendet wird. Der Boden muss vollständig trocken sein und sollte gesiebt werden, um größere Granulate und andere feste Verunreinigungen zu entfernen. Eine Mischung aus sandigem Boden und trockenem Gartenboden (im gleichen Verhältnis) sollte für die Verpackung der Säule bevorzugt werden. Der Säulenauslass muss ordnungsgemäß mit Glaswolle und Glasperlen abgedichtet werden, um ein Austreten von Erde aus der Säule während des Experiments zu vermeiden.
Das beschriebene Verfahren ist nützlich, um die Bedeutung der hergestellten Biotenside und ihrer Mischungen bei der Rückgewinnung von zusätzlichem Öl in einem simulierten Sandpacksäulenexperiment zu bestimmen. Verschiedene Biotenside haben unterschiedliche Spezifitäten, da sie unterschiedliche funktionelle Gruppenenthalten 65. Eine Kombination von Biotensiden wird die Solubilisierung verschiedener Kohlenwasserstoffe ermöglichen und somit die Restölgewinnung aus den Lagerstätten erhöhen. Die beschriebene Methode wird bei der Bestimmung des Potenzials von Biotensidmischungen in Feldanwendungen wie der verbesserten Ölgewinnung aus Ölquellen helfen.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Die Autoren danken dem Department of Biotechnology, Government of India, für die finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Referenzen
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070(2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706(2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, Pt B 127201(2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371(2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138(2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- Trefalt, G., Borkovec, M. Overview of DLVO theory. , Available from: https://archive-ouverte.unige.ch/unige:148595 (2014).
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093(2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401(2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten