Method Article
Preparação de grades de amostras de alta temperatura para crio-EM
Neste Artigo
Resumo
Este artigo fornece um protocolo detalhado para a preparação de grades de amostras a temperaturas tão altas quanto 70 °C, antes do congelamento por imersão para experimentos de crio-EM.
Resumo
As grades de amostras para experimentos de microscopia crioeletrônica (crio-EM) são geralmente preparadas a uma temperatura ideal para o armazenamento de amostras biológicas, principalmente a 4 °C e, ocasionalmente, à temperatura ambiente. Recentemente, descobrimos que a estrutura proteica resolvida a baixa temperatura pode não ser funcionalmente relevante, particularmente para proteínas de archaea termofílicas. Um procedimento foi desenvolvido para preparar amostras de proteína em temperaturas mais altas (até 70 °C) para análise crio-EM. Mostramos que as estruturas de amostras preparadas em temperaturas mais altas são funcionalmente relevantes e dependentes da temperatura. Aqui descrevemos um protocolo detalhado para a preparação de grades de amostras em alta temperatura, usando 55 °C como exemplo. O experimento utilizou um aparelho de vitrificação modificado com um tubo de centrífuga adicional, e as amostras foram incubadas a 55 °C. Os procedimentos detalhados foram ajustados para minimizar a condensação de vapor e obter uma fina camada de gelo na grade. Exemplos de experimentos bem-sucedidos e malsucedidos são fornecidos.
Introdução
A tecnologia crio-EM para a resolução das estruturas de complexos proteicos tem continuado a melhorar, particularmente no sentido da obtenção de estruturas de alta resolução 1,2. Nesse ínterim, o cenário de sua aplicação também foi ampliado pela variação das condições da amostra, como pH ou ligantes, antes do processo de vitrificação3, que envolve a preparação de grades de amostra seguidas de congelamento por imersão 4,5. Outra condição importante é a temperatura. Embora os experimentos de crio-EM, como a cristalografia de raios-X, sejam realizados a baixas temperaturas, a estrutura resolvida pela crio-EM reflete a estrutura no estado da solução antes da vitrificação. Até recentemente, a maioria dos estudos de crio-EM de análise de partícula única (SPA) usa amostras que são mantidas no gelo (ou seja, a 4 °C) antes da vitrificação6, embora vários estudos usem amostras em torno da temperatura ambiente 7,8,9,10 ou tão alto quanto 42 °C 11. Em um relatório recente, realizamos estudos dependentes da temperatura da enzima reducionoisorase cetola-ácida (KARI) do arqueão termofílico Sulfolobus solfataricus (Sso) em seis temperaturas diferentes de 4 °C a 70 °C12. Nossos estudos sugerem que é importante preparar grades de amostras a temperaturas funcionalmente relevantes e que o crio-EM é o único método estrutural praticamente viável para resolver a estrutura do mesmo complexo proteico em múltiplas temperaturas.
A maior dificuldade para a vitrificação em altas temperaturas é minimizar a condensação de vapor e alcançar gelo fino. Aqui relatamos o protocolo detalhado usado para preparar grades de amostras em altas temperaturas em nosso estudo anterior do Sso-KARI 12. Assumimos que os leitores ou espectadores já são experientes nos procedimentos gerais de preparação de amostras e processamento de dados para experimentos de crio-EM e enfatizamos os aspectos relevantes para a alta temperatura.
Protocolo
NOTA: Este protocolo tem como objetivo utilizar um aparelho de vitrificação comercial modificado para preparar as amostras de microscopia crio-eletrônica (crio-EM) em temperaturas específicas, especialmente superiores a 37 °C. A configuração experimental geral é mostrada na Figura 1. O protocolo usa 55 °C como exemplo. Para as condições específicas a outras temperaturas, consultar o quadro suplementar 2 na referência12.
1. Preparação do aparelho de vitrificação
- Faça um furo de 1 cm em um tubo de centrífuga de 50 mL em sua extremidade fechada.
- Colocar o tubo na câmara do aparelho de vitrificação na saída de água ultra-sônica, como mostra a Figura 2.
NOTA: O objetivo é minimizar a condensação de água, guiando o vapor de água para o trocador de calor através do tubo antes de atingir toda a câmara. - Ajustar a temperatura do aparelho de vitrificação à temperatura especificada (por exemplo, 55 °C, como indicado na figura 3) e permitir que a câmara do aparelho de vitrificação atinja 55 °C e 100% de humidade relativa. Deixe repousar por pelo menos meia hora para estabilizar as condições antes de iniciar o experimento.
2. Aquecendo a amostra e as ferramentas
- Coloque o banho de água numa placa de aquecimento e ajuste a placa de aquecimento para a temperatura desejada (aqui 55 °C). Verifique com um termômetro para garantir que a água atinja 55 °C.
- Incubar a amostra em banho-maria e pré-aquecer a ponta da pipeta na borda da placa de aquecimento por 2 minutos ou mais antes do experimento de blotting.
NOTA: A temperatura mais elevada para a câmara do aparelho de vitrificação é de 60 °C. Para preparar grelhas de temperatura mais elevadas para a experiência cyro-EM (por exemplo, 70 °C), a amostra é incubada em banho-maria a 80 °C, e a média entre a temperatura da amostra e a temperatura do aparelho de vitrificação é estimada como sendo a temperatura real da amostra na grelha (70 °C neste caso). Consulte a seção Discussão para obter mais detalhes e limitações sobre essa estimativa.
3. Preparação para o experimento de blotting
- Descarga de brilho de uma grade suportada por carbono holey a 25 mA por 30 s, ou alternativa aos valores, dependendo do dispositivo usado.
- Incubar a pinça com a grelha no aparelho de vitrificação durante 2 min ou mais.
- Encha o recipiente de etano com etano de acordo com os procedimentos padrão. Não deixe o etano transbordar.
NOTA: Esta etapa leva cerca de 10 minutos e deve ser seguida imediatamente com o experimento de blotting para evitar o congelamento. - Coloque o papel de filtro de vitrificação na câmara do aparelho de vitrificação não antes de 5 minutos antes da experiência de blotting.
NOTA: Colocar o papel de filtro na câmara muito cedo fará com que ele fique muito molhado.
4. Experiência de blotting
NOTA: Ao segurar a grade, verifique se a grade está estável e se há uma área de contato mínima com a pinça (Figura 4). Isso é feito para manter a melhor eficiência de resfriamento do etano e evitar o gelo não vítreo.
- Use uma ponta de pipeta para aplicar 7-9 μL da amostra à grade. Em seguida, aguarde 1-2 s, limpe por 1-1,5 s e mergulhe rapidamente a amostra em etano líquido.
- Transfira a grade do etano líquido para a caixa criogênica, que é armazenada em nitrogênio líquido.
NOTA: Esta etapa deve ser executada com muito cuidado, porque a pinça ainda está quente, então todo o tanque de resfriamento está cheio de vapor neste momento.
5. Verificação de qualidade para as grades
- Recorte as grades e carregue-as para um instrumento crio-EM.
- Use a tela de exibição do instrumento crio-EM e a função de baixa dose do software para rastrear a condição de gelo na grade e a distribuição da amostra na grade.
NOTA: Muitas vezes, as grades são muito secas, ou a camada de gelo é muito espessa. A taxa de sucesso das grelhas preparadas a altas temperaturas é substancialmente inferior à temperatura ambiente ou a 4 °C. Resultados representativos de grades boas e grades insatisfatórias são mostrados na próxima seção. - Se a qualidade da grade resultante não for boa, repita o processo de preparação da grade com condições variadas (como tempo de espera, tempo de blotting, etc.). Se a qualidade da grade resultante for boa, repita as mesmas etapas para criar grades a uma temperatura diferente.
6. Coleta de dados
- Transfira as grades de boa qualidade para um instrumento crio-EM de alta resolução.
- Realizar coleta e análise de dados de acordo com os procedimentos estabelecidos.
NOTA: Como mostrado em nossa publicação anterior, a resolução da estrutura não é afetada pela alta temperatura12.
Resultados
A visão geral de baixa ampliação é mostrada na Figura 5A,B. O Painel A é um exemplo de uma grade bem-sucedida. Há um gradiente de gelo do canto superior esquerdo (mais espesso) para o canto inferior direito (mais fino ou vazio). Essa grade facilita a localização de uma espessura apropriada da camada de gelo na área do meio adequada para a coleta de dados, como as caixas azul e verde. A grade B está muito seca. Os quadrados na grade têm contraste brilhante, o que significa que a camada de gelo é muito fina ou não há camada de gelo. Apenas os dois quadrados indicados pelas setas vermelhas são adequados para a coleta de dados.
Além disso, exemplos de imagens de baixa dose de diferentes grades são mostrados na Figura 5C,D. A imagem no painel C mostra que a maior parte do gelo está na forma cristalina, não adequada para a coleta de dados. Por outro lado, a imagem no painel D mostra que a camada de gelo está principalmente em um estado amorfo, adequado para a coleta de dados.
Por favor, note que este é um pequeno artigo com foco na preparação da grade em altas temperaturas. A grade contém apenas o exemplo para coleta de dados. Uma boa grade tem uma boa chance, embora não uma chance definitiva, de gerar bons dados para resolver uma estrutura de alta resolução. Os dados reais da crio-EM e as estruturas finais para os exemplos descritos neste artigo já estão descritos no artigo publicado12. Em suma, obtivemos grades boas o suficiente para a coleta de dados, resolvemos as estruturas de dois complexos Sso-KARI a seis temperaturas diferentes cada e comparamos as estruturas de diferentes temperaturas para cada complexo, bem como as estruturas entre os dois complexos a partir da mesma temperatura. Os resultados indicam que a estrutura de cada complexo é dependente da temperatura e que as mudanças dependentes da temperatura são diferentes entre os dois complexos. É importante ressaltar que as sucessivas mudanças estruturais se correlacionam bem com as sucessivas mudanças de temperatura, o que é uma forte indicação para o sucesso da preparação da grade de amostras dependente da temperatura.

Figura 1: A configuração experimental geral para a preparação de amostras crio-EM de alta temperatura. Os itens mostrados incluem aparelho de vitrificação, incubadora, temporizador, colocação da ponta da pipeta, tanque de resfriamento e pinça. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Modificação da câmara do aparelho de vitrificação. Um tubo de 50 mL é instalado na saída de pulverização ultra-sônica, conforme indicado pela seta vermelha12. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Aparência do aparelho de vitrificação durante o experimento. A tela mostra a temperatura a 55 °C e a umidade a 100%. Por favor, clique aqui para ver uma versão maior desta figura.
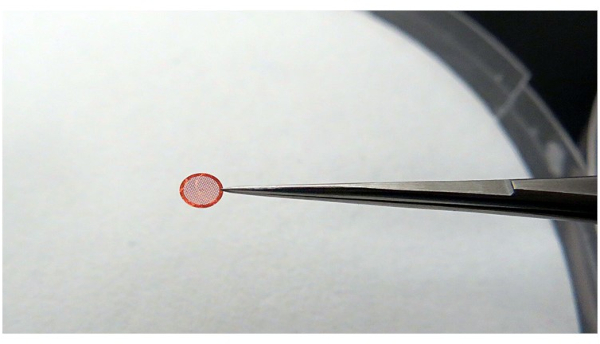
Figura 4: Usando pinças para agarrar a grade. Recomenda-se que as pinças segurem a grade com o mínimo de contato possível, mas devem ser capazes de segurar a grade de forma estável durante o processo da operação. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5: Resultados representativos: Verificação de grade pelo Cryo-EM. (A,B) mostram o estado geral da grade. (C,D) mostram exemplos de imagens de baixa dose de diferentes grades. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Na etapa 1 do protocolo, certifique-se de que o tubo de centrífuga foi bem instalado e não cai quando o experimento está em andamento. Devido ao acúmulo de um grande número de gotículas de água na câmara, o que poderia alterar a capacidade de adsorção do papel de filtro, recomenda-se que o tempo total do experimento não exceda 30 min após a câmara do aparelho de vitrificação atingir a temperatura de equilíbrio. Se o tempo de operação exceder 30 min, o operador precisa substituir o papel de filtro e esperar que a cabine equilibre a temperatura e a umidade novamente. Na etapa 8 do protocolo, o volume de amostra sugerido de 7-9 μL é maior do que o habitual, pois, caso contrário, a amostra evapora rapidamente a alta temperatura, levando a quadrados vazios na grade. Por outro lado, é altamente recomendável que a amostra aplicada não exceda 9 μL. Caso contrário, é muito provável que a amostra escorra durante o processo de mover a pinça antes de borrar. No geral, uma chave para o sucesso dessa técnica é a aderência estável e rápida das grades e a execução correta e estável de cada ação limitada no tempo. Além disso, recomenda-se que cada rodada de experimentos lide com apenas uma alta temperatura específica. Antes de prosseguir para a realização do experimento em outra temperatura, todos os sistemas devem ser totalmente recuperados e reiniciados.
Devido à alta temperatura e alta umidade da câmara, a janela é frequentemente coberta com neblina, levando a dificuldades no lançamento do experimento. Recomenda-se o uso de um pouco de espuma de sabão para limpar a janela. Se as grades não forem boas, as possíveis razões são que as etapas descritas acima não são seguidas com precisão e / ou que as etapas levam muito tempo. Tente repetir a preparação das grades de amostra com precisão e rapidez. Se as grades ainda não estiverem boas após as repetições, tente ajustar as condições. O problema mais frequente observado neste experimento é a ausência de gelo na grade em alta temperatura. Se assim for, tente reduzir ainda mais o tempo de blotting. Por outro lado, se o gelo for muito espesso, tente aumentar o tempo de blotting.
Uma limitação da crio-EM de alta temperatura é que a temperatura máxima de aquecimento no aparelho de vitrificação é de 60 °C. Para atingir a temperatura mais elevada, a amostra foi aquecida acima de 60 °C (por exemplo, 80 °C), e a média entre a temperatura da amostra e a temperatura de vitrificação foi estimada como sendo a temperatura real da amostra na grade (70 °C, neste caso). Pode haver alguma imprecisão com base nessa estimativa. Uma possível solução futura é construir um termopar para medir a temperatura da rede com precisão antes do congelamento por mergulho. Outra limitação potencial é a estabilidade da proteína em altas temperaturas. Um experimento separado usando dicroísmo circular deve ser realizado para garantir que a proteína seja estável à temperatura para o experimento de crio-EM planejado.
Outra limitação é que apenas dois tipos de aparelhos de vitrificação comercialmente disponíveis podem ser aquecidos acima de 37 °C e até 60 °C, conforme mencionado acima (por exemplo, Thermo Fischer Vitrobot e Leica EM-GP). Os aparelhos de vitrificação de outros fornecedores são limitados à temperatura ambiente ou ajustáveis apenas entre 4 °C e 37 °C. No entanto, é possível que os grupos de pesquisa construam seus próprios dispositivos de mergulho com faixas de temperatura estendidas no futuro.
Nosso protocolo é modificado em relação aos protocolos existentes 4,5,6, com o objetivo de preparar as grades a temperaturas superiores à temperatura ambiente. Sem fazer as modificações descritas aqui, a chance de sucesso para fazer boas grades de amostra de alta temperatura adequadas para a coleta de imagens crio-EM é muito pequena.
Dois artigos em 2019 demonstraram que as estruturas proteicas são dependentes da temperatura, em correlação com a dependência da temperatura das funções proteicas, na faixa de 4 °C a 42 °C para o canal TRP TRPV311 e 4 °C a 70 °C para Sso-KARI 12. Esses relatórios provavelmente encorajarão uma mudança na pesquisa crio-EM, na medida em que mais estudos futuros serão realizados em temperaturas funcionalmente relevantes, geralmente a 37 °C. A estabilidade da proteína purificada a esta temperatura pode ser uma preocupação. No entanto, é necessário incubar a amostra de proteína a esta temperatura por apenas 2 minutos de acordo com o nosso protocolo. Alternativamente, as condições fisiológicas podem ser alcançadas por meio de proteínas de imagem em células usando tomografia e média subtomo. Além disso, a crio-EM pode ser usada para estudar o mecanismo e os intermediários do desdobramento de proteínas em altas temperaturas, provavelmente na faixa de 40 °C a 80 °C. Todos esses estudos se beneficiarão do protocolo descrito aqui.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Os autores agradecem ao Dr. Hervé Remigy da Thermo Fisher Scientific por conselhos úteis. Os experimentos de crio-EM foram realizados na Academia Sinica Cryo-EM Facility (ASCEM). A ASCEM é apoiada pela Academia Sinica (Grant No. AS-CFII-108-110) e Taiwan Protein Project (Grant No. AS-KPQ-109-TPP2). Os autores também agradecem à Sra. Hui-Ju Huang pela assistência na preparação da amostra.
Materiais
| Name | Company | Catalog Number | Comments |
| Falcon tube | Falcon | 352070 | size: 50 mL |
| Filter paper | Ted Pella | 47000-100 | Ø55/20mm, Grade 595 |
| HI1210 | Leica | water bath | |
| K100X | Electron Microscopy Sciences | glow discharge | |
| Quantifoil, 1.2/1.3 200Mesh Cu grid | Ted Pella | 658-200-CU-100 | |
| Titan Krios G3 | Thermo Fisher Scientific | 1063996 | low dose imaging |
| Vitrobot Mark IV | Thermo Fisher Scientific | 1086439 | |
| Vitrobot Tweezer | Ted Pella | 47000-500 |
Referências
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587, 157-161 (2020).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Chen, C. Y., et al. Use of Cryo-EM to uncover structural bases of pH effect and cofactor bi-specificity of ketol-acid reductoisomerase. Journal of the American Chemical Society. 141, 6136-6140 (2019).
- Cabra, V., Samsó, M. Do's and don'ts of cryo-electron microscopy: A primer on sample preparation and high quality data collection for macromolecular 3D reconstruction. Journal of Visualized Experiments. (95), e52311(2015).
- Klebl, D. P., et al. Need for speed: Examining protein behavior during CryoEM grid preparation at different timescales. Structure. 28 (11), 1238-1248 (2020).
- Passmore, L. A., Russo, C. Specimen preparation for high resolution cryo-EM. J. Methods in Enzymology. 579, 51-86 (2016).
- Laughlin, T. G., Bayne, A. N., Trempe, J. -F., Savage, D. F., Davies, K. M. Structure of the complex I-like molecule NDH of oxygenic photosynthesis. Nature. 566, 411-414 (2019).
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363, (2019).
- Zhao, Y., Chen, S., Swensen, A. C., Qian, W. -J., Gouaux, E. Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM. Science. 364, 355-362 (2019).
- Chen, B., et al. Structural dynamics of ribosome subunit association studied by mixing-spraying time-resolved cryogenic electron microscopy. Structure. 23, 1097-1105 (2015).
- Singh, A. K., et al. Structural basis of temperature sensation by the TRP channel TRPV3. Nature Structure and Molecular Biology. 26, 994-998 (2019).
- Chen, C. Y., Chang, Y. C., Lin, B. L., Huang, C. H., Tsai, M. D. Temperature-resolved cryo-EM uncovers structural bases of temperature-dependent enzyme functions. Journal of the American Chemical Society. 141, 19983-19987 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados