Method Article
クライオ電子顕微鏡用高温サンプルグリッドの作製
要約
この論文は、クライオEM実験のために急落凍結する前に、70°Cという高い温度でサンプルグリッドを準備するための詳細なプロトコルを提供します。
要約
クライオ電子顕微鏡(クライオEM)実験用のサンプルグリッドは、通常、生物学的サンプルの保存に最適な温度、主に4°C、場合によっては室温で調製されます。最近、低温で解かれたタンパク質構造は、特に好熱性古細菌のタンパク質にとって、機能的に関連性がない可能性があることを発見しました。クライオEM分析のために、より高い温度(最大70°C)でタンパク質サンプルを調製するための手順が開発されました。我々は、より高い温度で調製されたサンプルの構造が機能的に関連性があり、温度に依存することを示した。ここでは、55°Cを例に、高温でサンプルグリッドを調製するための詳細なプロトコルについて説明します。実験では、追加の遠沈管を使用して修正したガラス化保存装置を利用し、サンプルを55°Cでインキュベートしました。 詳細な手順は、蒸気の凝縮を最小限に抑え、グリッド上に薄い氷の層を得るために微調整されました。成功した実験と失敗した実験の例が提供されています。
概要
タンパク質複合体の構造を解明するためのクライオEM技術は、特に高分解能の構造を得る方向に改善を続けています1,2。その間、そのアプリケーションの展望は、サンプルグリッドの準備とそれに続くプランジ凍結を含むガラス化プロセス3の前にpHやリガンドなどのサンプル条件を変えることによっても拡大されました4,5。もう一つの重要な条件は温度です。クライオ電子顕微鏡実験は、X線結晶構造解析と同様に低温で行われますが、クライオ電子顕微鏡で解かれた構造は、ガラス化前の溶液状態での構造を反映しています。最近まで、単粒子分析(SPA)クライオEM研究の大部分は、ガラス化の前に氷上(すなわち4°C)に保たれたサンプルを使用していますが6、多くの研究では、室温付近の7、8、9、10または42°Cまでのサンプルを使用しています11。最近の報告では、好熱性古細菌スルフォロブスソルファタリクス(Sso)由来の酵素ケトール酸レダクトイソメラーゼ(KARI)の温度依存的研究を4°Cから70°Cまでの6つの異なる温度で実施しました12。私たちの研究は、機能的に関連する温度でサンプルグリッドを準備することが重要であり、クライオEMが複数の温度で同じタンパク質複合体の構造を解くために実用的に実行可能な唯一の構造方法であることを示唆しています。
高温でのガラス化の主な困難は、蒸気の凝縮を最小限に抑え、薄い氷を実現することです。ここでは、 Sso-KARI 12の以前の研究で高温でサンプルグリッドを準備するために使用された詳細なプロトコルを報告します。読者または視聴者は、クライオEM実験のための全体的なサンプル調製およびデータ処理手順をすでに経験していることを前提とし、高温に関連する側面を強調します。
プロトコル
注:このプロトコルは、特定の温度、特に37°Cを超える温度でクライオ電子顕微鏡(クライオEM)サンプルを調製するために、変更された市販のガラス化装置を使用することを目的としています。 全体的な実験セットアップを 図1に示します。プロトコルは例として55°Cを使用します。その他の温度での具体的な条件については、参考文献12の補足表2を参照してください。
1. ガラス化保存装置の準備
- 閉じた端にある50 mLの遠心分離管に1cmの穴を開けます。
- 図2に示すように、超音波水出口のガラス化保存装置チャンバーにチューブを置きます。
注意: 目的は、チャンバー全体に到達する前に、水蒸気をチューブを介して熱交換器に導くことにより、水の凝縮を最小限に抑えることです。 - ガラス化保存装置の温度を規定温度( 図3に示すように55°Cなど)に設定し、ガラス化槽を55°C、相対湿度100%にします。実験を開始する前に、条件を安定させるために少なくとも30分間放置します。
2.サンプルとツールのウォームアップ
- ウォーターバスをホットプレートに置き、ホットプレートを希望の温度(ここでは55°C)に設定します。温度計で水が55°Cに達することを確認します。
- サンプルをウォーターバスでインキュベートし、ブロッティング実験の前にホットプレートの端にあるピペットチップを2分以上予熱します。
注:ガラス化装置チャンバーの最高温度は60°Cです。 サイロEM実験用のより高い温度(例えば70°C)のグリッドを作製するには、サンプルを80°Cの水浴中でインキュベートし、サンプル温度とガラス化保存装置温度の平均がグリッド上のサンプルの実際の温度(ここでは70°C)であると推定される。この見積もりの詳細と制限については、「 ディスカッション 」セクションを参照してください。
3. ブロッティング実験の準備
- グロー放電は、穴のあるカーボン支持グリッドを25mAで30秒間、または使用するデバイスに応じて値の代わりに放電します。
- ピンセットをガラス化装置のグリッドで2分以上インキュベートします。
- 標準的な手順に従って、エタン容器にエタンを入れます。エタンをオーバーフローさせないでください。
注:このステップには約10分かかり、凍結を避けるためにすぐにブロッティング実験を行う必要があります。 - ブロッティング実験の5分前までにガラス化ろ紙をガラス化装置チャンバーに入れます。
注意: ろ紙をチャンバーに入れるのが早すぎると、ろ紙が濡れすぎます。
4. ブロッティング実験
メモ: グリッドを保持するときは、グリッドが安定していて、ピンセットとの接触面積が最小限であることを確認してください(図4)。これは、エタンの最高の冷却効率を維持し、非ガラス質の氷を避けるために行われます。
- ピペットチップを使用して、7〜9 μLのサンプルをグリッドに塗布します。次に、1〜2秒待ち、1〜1.5秒間ブロットし、サンプルを液体エタンにすばやく浸します。
- グリッドを液体エタンから液体窒素に貯蔵されているクライオボックスに移します。
注意: ピンセットはまだ高温であるため、この手順は非常に慎重に実行する必要があり、この時点で冷却タンク全体が蒸気でいっぱいになります。
5.グリッドの品質チェック
- グリッドをクリップし、クライオEM装置にアップロードします。
- クライオEM装置の表示画面とソフトウェアの低線量機能を使用して、グリッド上の氷の状態とグリッド上のサンプルの分布をスクリーニングします。
注意: 多くの場合、グリッドは非常に乾燥しているか、氷の層が厚すぎます。高温で調製されたグリッドの成功率は、室温または4°Cでのそれよりも大幅に低い。 良好なグリッドと不満足なグリッドの代表的な結果を次のセクションに示します。 - 結果のグリッドの品質が良くない場合は、さまざまな条件(待機時間、ブロッティング時間など)でグリッド準備のプロセスを繰り返します。結果のグリッドの品質が良好な場合は、同じ手順を繰り返して、異なる温度でグリッドを作成します。
6. データ収集
- 高品質のグリッドを高解像度のクライオEM装置に移します。
- 確立された手順に従ってデータ収集とデータ分析を実行します。
注:以前の出版物に示されているように、構造の解像度は高温の影響を受けません12。
結果
低倍率の概要を 図5A、Bに示します。パネル A は、成功したグリッドの例です。左上(厚い)から右下(薄いまたは空)への氷のグラデーションがあります。このようなグリッドにより、青や緑のボックスなど、データ収集に適した中央領域の氷層の適切な厚さを簡単に見つけることができます。グリッドBが乾燥しすぎています。グリッド内の正方形のコントラストは明るいため、氷の層が薄すぎるか、氷の層がまったくありません。赤い矢印で示されている2つの正方形のみがデータ収集に適しています。
さらに、異なるグリッドからの低線量画像の例を 図5C、Dに示す。パネルCの画像は、ほとんどの氷が結晶形であり、データ収集には適していないことを示しています。一方、パネルDの画像は、氷層がほとんどアモルファス状態にあり、データ収集に適していることを示しています。
これは、高温でのグリッド準備に焦点を当てた短い論文であることに注意してください。グリッドには、データ収集用のサンプルのみが含まれています。良いグリッドは、明確なチャンスではありませんが、高解像度の構造を解くための良いデータを生成する良いチャンスがあります。この論文に記載されている実施例の実際のクライオ電子顕微鏡データおよび最終的な構造は、公開された論文12にすでに記載されている。要するに、データ収集に十分なグリッドを取得し、2つのSso-KARI複合体の構造をそれぞれ6つの異なる温度で解き、各複合体の異なる温度の構造と、同じ温度の2つの複合体間の構造を比較しました。結果は、各複合体の構造が温度依存的であり、温度依存性の変化が2つの複合体間で異なることを示しています。重要なことに、連続する構造変化は連続する温度変化とよく相関しており、これは温度依存のサンプルグリッド調製の成功を強く示しています。

図1:高温クライオEMサンプル調製の全体的な実験セットアップ。 示されている項目には、ガラス化保存装置、インキュベーター、タイマー、ピペットチップ配置、冷却タンク、ピンセットが含まれます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ガラス化保存装置室の改造。 赤い矢印12で示されているように、超音波スプレー出口に50mLチューブが設置されています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:実験中のガラス化保存装置の外観。 画面には、55°Cの温度と100%の湿度が表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
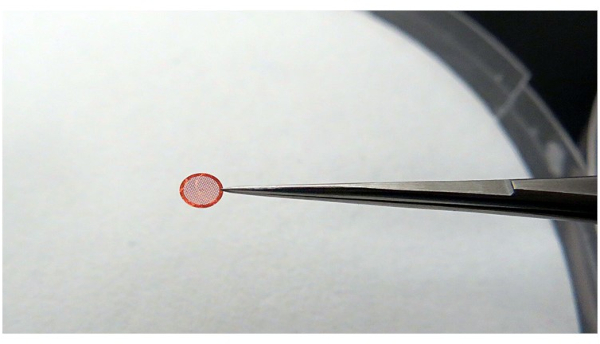
図4:ピンセットを使用してグリッドをつかむ。 ピンセットはできるだけ接触せずにグリッドをつかむことをお勧めしますが、操作の過程でグリッドを安定して保持できる必要があります。 この図の拡大版を表示するには、ここをクリックしてください。

図5:代表的な結果:クライオ電子顕微鏡によるグリッドチェック。 (A,B) は、グリッドの全体的な状態を示します。(C,D)は、異なるグリッドからの低線量画像の例を示す。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
プロトコルのステップ1では、遠心管がしっかりと取り付けられており、実験の進行中に落下しないことを確認してください。チャンバー内に多数の水滴が蓄積し、ろ紙の吸着能力が変化する可能性があるため、ガラス化装置チャンバーが平衡温度に達した後、実験の全体的な時間が30分を超えないようにすることをお勧めします。操作時間が30分を超える場合、オペレーターはろ紙を交換し、キャビンが温度と湿度のバランスを取り戻すのを待つ必要があります。プロトコルのステップ8では、7〜9 μLの推奨サンプル量は、それ以外の場合、サンプルが高温で急速に蒸発し、グリッド上に空の正方形につながるため、通常よりも大きくなります。一方、適用されるサンプルは9μLを超えないことを強くお勧めします。 そうしないと、吸い取り前にピンセットを動かす過程でサンプルが滴り落ちる可能性が非常に高くなります。全体として、この手法の成功の鍵は、グリッドの安定した迅速な把持と、時間制限のある各アクションの正確で安定した実行です。さらに、実験の各ラウンドは、1つの特定の高温のみを扱うことをお勧めします。別の温度で実験を実行する前に、すべてのシステムを完全に回復してリセットする必要があります。
チャンバーの高温多湿のため、窓は霧で覆われることが多く、実験の開始が困難になります。窓を片付けるには、少量の石鹸を使用することをお勧めします。グリッドが適切でない場合、考えられる理由は、上記の手順が正確に実行されていないか、手順に時間がかかりすぎることです。サンプルグリッドの準備を正確かつ迅速に繰り返すようにしてください。繰り返してもグリッドが良くない場合は、条件を調整してみてください。この実験で観察されるより頻繁な問題は、高温でグリッド上に氷がないことです。その場合は、ブロッティング時間をさらに短縮してみてください。一方、氷が厚すぎる場合は、ブロッティング時間を長くしてみてください。
高温クライオEMの制限は、ガラス化保存装置の最高加熱温度が60°Cであることである。 より高い温度に到達するために、サンプルを60°C(例えば、80°C)以上に加熱し、サンプル温度とガラス化温度との間の平均は、グリッド上のサンプルの実際の温度(この場合は70°C)であると推定された。この推定に基づいて、いくつかの不正確さが存在する可能性があります。将来の解決策として考えられるのは、急降下凍結の直前にグリッド温度を正確に測定する熱電対を構築することです。別の潜在的な制限は、高温でのタンパク質の安定性です。計画されたクライオEM実験の温度でタンパク質が安定していることを確認するために、円二色性を使用した別の実験を実行する必要があります。
別の制限は、上記のように37°C以上および60°Cまで加熱できる市販のガラス化保存装置の2種類(例えば、サーモフィッシャーVitrobotおよびライカEM-GP)のみであることである。他のベンダーのガラス化装置は、室温に制限されているか、4°C〜37°Cの間でのみ調整可能です。 しかし、将来的には、研究グループが独自の温度範囲のプランジデバイスを構築することは可能です。
我々のプロトコルは、室温よりも高い温度でグリッドを準備する目的で、既存のプロトコル4,5,6から変更されています。ここで説明した変更を加えないと、クライオEM画像収集に適した優れた高温サンプルグリッドの作成に成功する可能性は非常に低くなります。
2019年の2つの論文は、TRPチャネルTRPV311 では4°Cから42°C、 Sso-KARI 12では4°Cから70°Cの範囲で、タンパク質構造はタンパク質機能の温度依存性と相関して温度依存性があることを実証しています。これらの報告は、機能的に関連する温度(通常は37°C)でより多くの将来の研究が行われるという点で、クライオEM研究の変化を促進する可能性があります。 この温度での精製タンパク質の安定性が懸念される可能性があります。ただし、当社のプロトコルに従って、この温度でタンパク質サンプルをわずか2分間インキュベートする必要があります。あるいは、生理学的条件は、断層撮影およびサブトモ平均を用いて細胞内のタンパク質をイメージングすることによって達成することができる。さらに、クライオEMは、おそらく40°Cから80°Cの範囲の高温でのタンパク質のアンフォールディングのメカニズムと中間体を研究するために使用できます。 これらの研究はすべて、ここで説明するプロトコルの恩恵を受けます。
開示事項
著者は、競合する金銭的利益を宣言していません。
謝辞
著者らは、有用なアドバイスを提供してくれたサーモフィッシャーサイエンティフィックのHervé Remigy博士に感謝します。クライオEM実験は中央研究院クライオEM施設(ASCEM)で実施しました。ASCEMは中央研究院の支援を受けています(助成金番号。AS-CFII-108-110)および台湾タンパク質プロジェクト(助成金番号。AS-KPQ-109-TPP2)。著者らはまた、サンプル調製の支援をしてくれたHui-Ju Huang氏にも感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Falcon tube | Falcon | 352070 | size: 50 mL |
| Filter paper | Ted Pella | 47000-100 | Ø55/20mm, Grade 595 |
| HI1210 | Leica | water bath | |
| K100X | Electron Microscopy Sciences | glow discharge | |
| Quantifoil, 1.2/1.3 200Mesh Cu grid | Ted Pella | 658-200-CU-100 | |
| Titan Krios G3 | Thermo Fisher Scientific | 1063996 | low dose imaging |
| Vitrobot Mark IV | Thermo Fisher Scientific | 1086439 | |
| Vitrobot Tweezer | Ted Pella | 47000-500 |
参考文献
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587, 157-161 (2020).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Chen, C. Y., et al. Use of Cryo-EM to uncover structural bases of pH effect and cofactor bi-specificity of ketol-acid reductoisomerase. Journal of the American Chemical Society. 141, 6136-6140 (2019).
- Cabra, V., Samsó, M. Do's and don'ts of cryo-electron microscopy: A primer on sample preparation and high quality data collection for macromolecular 3D reconstruction. Journal of Visualized Experiments. (95), e52311(2015).
- Klebl, D. P., et al. Need for speed: Examining protein behavior during CryoEM grid preparation at different timescales. Structure. 28 (11), 1238-1248 (2020).
- Passmore, L. A., Russo, C. Specimen preparation for high resolution cryo-EM. J. Methods in Enzymology. 579, 51-86 (2016).
- Laughlin, T. G., Bayne, A. N., Trempe, J. -F., Savage, D. F., Davies, K. M. Structure of the complex I-like molecule NDH of oxygenic photosynthesis. Nature. 566, 411-414 (2019).
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363, (2019).
- Zhao, Y., Chen, S., Swensen, A. C., Qian, W. -J., Gouaux, E. Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM. Science. 364, 355-362 (2019).
- Chen, B., et al. Structural dynamics of ribosome subunit association studied by mixing-spraying time-resolved cryogenic electron microscopy. Structure. 23, 1097-1105 (2015).
- Singh, A. K., et al. Structural basis of temperature sensation by the TRP channel TRPV3. Nature Structure and Molecular Biology. 26, 994-998 (2019).
- Chen, C. Y., Chang, Y. C., Lin, B. L., Huang, C. H., Tsai, M. D. Temperature-resolved cryo-EM uncovers structural bases of temperature-dependent enzyme functions. Journal of the American Chemical Society. 141, 19983-19987 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2037
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。
