Method Article
Preparazione di griglie di campionamento ad alta temperatura per crio-EM
In questo articolo
Riepilogo
Questo documento fornisce un protocollo dettagliato per la preparazione di griglie di campioni a temperature fino a 70 °C, prima del congelamento a immersione per esperimenti crio-EM.
Abstract
Le griglie di campioni per esperimenti di crio-microscopia elettronica (crio-EM) sono solitamente preparate ad una temperatura ottimale per la conservazione di campioni biologici, per lo più a 4 °C e occasionalmente a temperatura ambiente. Recentemente, abbiamo scoperto che la struttura proteica risolta a bassa temperatura potrebbe non essere funzionalmente rilevante, in particolare per le proteine degli archei termofili. È stata sviluppata una procedura per preparare campioni proteici a temperature più elevate (fino a 70 °C) per l'analisi crio-EM. Abbiamo dimostrato che le strutture provenienti da campioni preparati a temperature più elevate sono funzionalmente rilevanti e dipendenti dalla temperatura. Qui descriviamo un protocollo dettagliato per la preparazione di griglie di campioni ad alta temperatura, usando 55 °C come esempio. L'esperimento si è avvalso di un apparecchio di vetrificazione modificato mediante una provetta da centrifuga supplementare e i campioni sono stati incubati a 55 °C. Le procedure dettagliate sono state messe a punto per ridurre al minimo la condensa del vapore e ottenere un sottile strato di ghiaccio sulla griglia. Vengono forniti esempi di esperimenti riusciti e falliti.
Introduzione
La tecnologia crio-EM per risolvere le strutture dei complessi proteici ha continuato a migliorare, in particolare nella direzione di ottenere strutture ad alta risoluzione 1,2. Nel frattempo, anche il panorama della sua applicazione è stato ampliato variando le condizioni del campione come pH o leganti prima del processo di vetrificazione3, che prevede la preparazione di griglie di campionamento seguite dal congelamento a tuffo 4,5. Un'altra condizione importante è la temperatura. Sebbene gli esperimenti crio-EM, come la cristallografia a raggi X, vengano eseguiti a basse temperature, la struttura risolta dalla crio-EM riflette la struttura allo stato di soluzione prima della vetrificazione. Fino a poco tempo fa, la maggior parte degli studi crio-EM di analisi di singole particelle (SPA) utilizza campioni che vengono conservati sul ghiaccio (cioè a 4 °C) prima della vetrificazione6, sebbene un certo numero di studi utilizzi campioni a temperatura ambiente di circa 7,8,9,10 o fino a 42 °C 11. In un recente rapporto, abbiamo eseguito studi dipendenti dalla temperatura dell'enzima cheto-acido riduttoisomerasi (KARI) dall'archeone termofilo Sulfolobus solfataricus (Sso) a sei diverse temperature da 4 ° C a 70 ° C12. I nostri studi suggeriscono che è importante preparare griglie di campioni a temperature funzionalmente rilevanti e che la crio-EM è l'unico metodo strutturale praticamente fattibile per risolvere la struttura dello stesso complesso proteico a più temperature.
La principale difficoltà per la vetrificazione ad alte temperature è ridurre al minimo la condensa del vapore e ottenere ghiaccio sottile. Qui riportiamo il protocollo dettagliato utilizzato per la preparazione di griglie campione ad alte temperature nel nostro precedente studio di Sso-KARI 12. Partiamo dal presupposto che i lettori o gli spettatori abbiano già esperienza nella preparazione complessiva del campione e nelle procedure di elaborazione dei dati per gli esperimenti crio-EM e sottolineiamo gli aspetti rilevanti per l'alta temperatura.
Protocollo
NOTA: Questo protocollo mira ad utilizzare un apparato di vetrificazione commerciale modificato per preparare i campioni di microscopia crioelettronica (crio-EM) a temperature specifiche, in particolare superiori a 37 °C. La configurazione sperimentale complessiva è mostrata nella Figura 1. Il protocollo utilizza 55 °C come esempio. Per le condizioni specifiche ad altre temperature, fare riferimento alla tabella supplementare 2 nel riferimento12.
1. Preparazione dell'apparecchio di vetrificazione
- Fare un foro di 1 cm in un tubo di centrifuga da 50 ml sulla sua estremità chiusa.
- Posizionare il tubo nella camera dell'apparato di vetrificazione all'uscita dell'acqua ad ultrasuoni, come mostrato nella Figura 2.
NOTA: Lo scopo è ridurre al minimo la condensa dell'acqua guidando il vapore acqueo verso lo scambiatore di calore attraverso il tubo prima di raggiungere l'intera camera. - Impostare la temperatura dell'apparecchio di vetrificazione alla temperatura specificata (ad esempio, 55 °C, come mostrato nella Figura 3) e consentire alla camera dell'apparecchio di vetrificazione di raggiungere 55 °C e il 100% di umidità relativa. Lasciare riposare per almeno mezz'ora per stabilizzare le condizioni prima di iniziare l'esperimento.
2. Riscaldamento del campione e degli strumenti
- Posizionare il bagnomaria su una piastra riscaldante e impostare la piastra alla temperatura desiderata (qui 55 °C). Controllare con un termometro che l'acqua raggiunga i 55 °C.
- Incubare il campione a bagnomaria e preriscaldare la punta della pipetta sul bordo della piastra riscaldante per 2 minuti o più prima dell'esperimento di sterilizzazione a secco.
NOTA: L'impostazione della temperatura massima per la camera dell'apparecchio di vetrificazione è 60 °C. Per preparare griglie a temperatura più elevata per esperimenti cyro-EM (ad esempio, 70 °C), il campione viene incubato nel bagno d'acqua a 80 °C e la media tra la temperatura del campione e la temperatura dell'apparato di vetrificazione è stimata essere la temperatura effettiva del campione sulla griglia (70 °C in questo caso). Vedere la sezione Discussione per ulteriori dettagli e limitazioni su questa stima.
3. Preparazione per l'esperimento di blotting
- Glow scarica una griglia supportata da carbonio holey a 25 mA per 30 s, o in alternativa ai valori a seconda del dispositivo utilizzato.
- Incubare le pinzette con la griglia nell'apparecchio di vetrificazione per 2 minuti o più.
- Riempire il contenitore di etano con etano secondo le procedure standard. Non lasciare che l'etano trabocchi.
NOTA: questo passaggio richiede circa 10 minuti e deve essere seguito immediatamente con l'esperimento di blotting per evitare il congelamento. - Posizionare la carta da filtro per vetrificazione nella camera dell'apparecchio di vetrificazione non prima di 5 minuti prima dell'esperimento di blotting.
NOTA: Posizionare la carta da filtro nella camera troppo presto causerà un consumo eccessivo.
4. Esperimento di blotting
NOTA: Quando si tiene la griglia, assicurarsi che la griglia sia stabile e che vi sia un'area di contatto minima con le pinzette (Figura 4). Questo viene fatto per mantenere la migliore efficienza di raffreddamento dell'etano e per evitare il ghiaccio non vetroso.
- Utilizzare una punta per pipetta per applicare 7-9 μL del campione alla griglia. Quindi attendere 1-2 s, asciugare per 1-1,5 s e immergere rapidamente il campione in etano liquido.
- Trasferire la griglia dall'etano liquido alla scatola criogenica, che viene immagazzinata in azoto liquido.
NOTA: Questo passaggio deve essere eseguito con molta attenzione perché la pinzetta è ancora calda, quindi l'intero serbatoio di raffreddamento è pieno di vapore in questo momento.
5. Controllo qualità delle griglie
- Ritaglia le griglie e caricale su uno strumento crio-EM.
- Utilizzare lo schermo di visualizzazione dello strumento crio-EM e la funzione a basso dosaggio del software per schermare le condizioni del ghiaccio sulla griglia e la distribuzione del campione sulla griglia.
NOTA: Spesso, le griglie sono molto secche o lo strato di ghiaccio è troppo spesso. Il tasso di successo delle griglie preparate ad alte temperature è sostanzialmente inferiore a quello a temperatura ambiente o 4 °C. I risultati rappresentativi di buone griglie e griglie non soddisfacenti sono mostrati nella sezione successiva. - Se la qualità della griglia risultante non è buona, ripetere il processo di preparazione della griglia con varie condizioni (come tempo di attesa, tempo di asciugatura, ecc.). Se la qualità della griglia risultante è buona, ripetere gli stessi passaggi per creare griglie a una temperatura diversa.
6. Raccolta dei dati
- Trasferire le griglie di buona qualità su uno strumento crio-EM ad alta risoluzione.
- Eseguire la raccolta e l'analisi dei dati secondo procedure stabilite.
NOTA: Come mostrato nella nostra precedente pubblicazione, la risoluzione della struttura non è influenzata dall'alta temperatura12.
Risultati
La panoramica del basso ingrandimento è mostrata nella Figura 5A,B. Il pannello A è un esempio di griglia di successo. C'è un gradiente di ghiaccio dall'alto a sinistra (più spesso) al basso a destra (più sottile o vuoto). Tale griglia rende più facile trovare uno spessore appropriato dello strato di ghiaccio nell'area centrale adatto alla raccolta dei dati, come le caselle blu e verdi. La griglia B è troppo asciutta. I quadrati nella griglia hanno un contrasto luminoso, il che significa che lo strato di ghiaccio è troppo sottile o non c'è affatto uno strato di ghiaccio. Solo i due quadrati indicati dalle frecce rosse sono adatti per la raccolta dei dati.
Inoltre, esempi di immagini a basso dosaggio provenienti da griglie diverse sono mostrati nella Figura 5C,D. L'immagine nel pannello C mostra che la maggior parte del ghiaccio è in forma cristallina, non adatta per la raccolta dei dati. D'altra parte, l'immagine nel pannello D mostra che lo strato di ghiaccio è per lo più in uno stato amorfo, adatto per la raccolta dei dati.
Si prega di notare che questo è un breve documento incentrato sulla preparazione della griglia ad alte temperature. La griglia contiene solo l'esempio per la raccolta dei dati. Una buona griglia ha una buona possibilità, anche se non una possibilità certa, di generare buoni dati per risolvere una struttura ad alta risoluzione. I dati reali della crio-EM e le strutture finali per gli esempi descritti in questo articolo sono già descritti nell'articolo pubblicato12. In breve, abbiamo ottenuto griglie abbastanza buone per la raccolta dei dati, risolto le strutture di due complessi Sso-KARI a sei diverse temperature ciascuno e confrontato le strutture di temperature diverse per ciascun complesso, così come le strutture tra i due complessi dalla stessa temperatura. I risultati indicano che la struttura di ciascun complesso dipende dalla temperatura e che i cambiamenti dipendenti dalla temperatura sono diversi tra i due complessi. È importante sottolineare che i successivi cambiamenti strutturali si correlano bene con i successivi cambiamenti di temperatura, il che è una forte indicazione del successo della preparazione della griglia del campione dipendente dalla temperatura.

Figura 1: La configurazione sperimentale complessiva per la preparazione di campioni crio-EM ad alta temperatura. Gli articoli mostrati includono apparecchi di vetrificazione, incubatore, timer, posizionamento della punta della pipetta, serbatoio di raffreddamento e pinzette. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Modifica della camera dell'apparato di vetrificazione. Un tubo da 50 mL è installato all'uscita dello spray ad ultrasuoni come indicato dalla freccia rossa12. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Aspetto dell'apparato di vetrificazione durante l'esperimento. Lo schermo mostra la temperatura a 55 °C e l'umidità al 100%. Fare clic qui per visualizzare una versione ingrandita di questa figura.
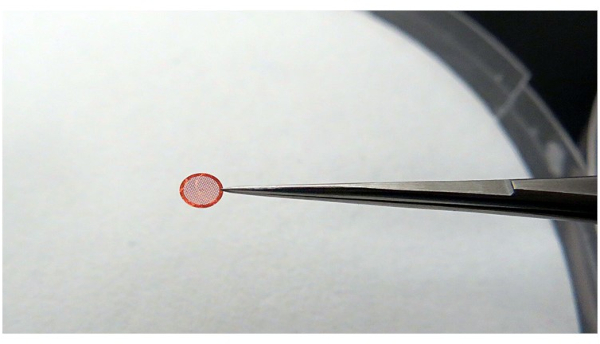
Figura 4: Utilizzo di una pinzetta per afferrare la griglia. Si raccomanda che le pinzette afferrino la griglia con il minor contatto possibile, ma deve essere in grado di tenere la griglia stabilmente durante il processo dell'operazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Risultati rappresentativi: Controllo della griglia da parte di Cryo-EM. (A,B) mostrano lo stato generale della rete. (C,D) mostrano esempi di immagini a basso dosaggio provenienti da griglie diverse. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Nella fase 1 del protocollo, assicurarsi che il tubo della centrifuga sia stato installato bene e non cada quando l'esperimento è in corso. A causa dell'accumulo di un gran numero di goccioline d'acqua nella camera, che potrebbero modificare la capacità di adsorbimento della carta da filtro, si raccomanda che il tempo complessivo dell'esperimento non superi i 30 minuti dopo che la camera dell'apparato di vetrificazione ha raggiunto la temperatura di equilibrio. Se il tempo di funzionamento supera i 30 minuti, l'operatore deve sostituire la carta da filtro e attendere che la cabina bilanci nuovamente la temperatura e l'umidità. Al punto 8 del protocollo, il volume di campione suggerito di 7-9 μL è più grande del solito poiché altrimenti il campione evapora rapidamente ad alta temperatura, portando a quadrati vuoti sulla griglia. D'altra parte, si raccomanda vivamente che il campione applicato non superi i 9 μL. Altrimenti, è molto probabile che il campione goccioli durante il processo di spostamento della pinzetta prima di asciugare. Nel complesso, una chiave per il successo di questa tecnica è la presa stabile e veloce delle griglie e l'esecuzione corretta e stabile di ogni azione limitata nel tempo. Inoltre, si raccomanda che ogni ciclo di esperimenti si occupi di una sola temperatura elevata specifica. Prima di procedere all'esecuzione dell'esperimento ad un'altra temperatura, tutti i sistemi devono essere completamente ripristinati e ripristinati.
A causa dell'alta temperatura e dell'elevata umidità della camera, la finestra è spesso coperta di nebbia che porta a difficoltà nel lancio dell'esperimento. Si consiglia l'uso di un po 'di sapone per cancellare la finestra. Se le griglie non sono buone, le possibili ragioni sono che i passaggi sopra descritti non sono seguiti con precisione e / o che i passaggi richiedono troppo tempo. Prova a ripetere la preparazione delle griglie di campioni con precisione e rapidità. Se le griglie non sono ancora buone dopo le ripetizioni, prova a regolare le condizioni. Il problema più frequente osservato in questo esperimento è l'assenza di ghiaccio sulla griglia ad alta temperatura. In tal caso, prova a ridurre ulteriormente il tempo di pulizia. D'altra parte, se il ghiaccio è troppo spesso, cerca di aumentare il tempo di asciugatura.
Una limitazione della crio-EM ad alta temperatura è che la temperatura massima di riscaldamento sull'apparecchio di vetrificazione è di 60 °C. Per raggiungere la temperatura più elevata, il campione è stato riscaldato al di sopra di 60 °C (ad esempio, 80 °C) e la media tra la temperatura del campione e la temperatura di vetrificazione è stata stimata come la temperatura reale del campione sulla griglia (70 °C, in questo caso). Potrebbe esserci qualche imprecisione sulla base di questa stima. Una possibile soluzione futura è quella di costruire una termocoppia per misurare con precisione la temperatura della griglia prima del congelamento. Un'altra potenziale limitazione è la stabilità della proteina alle alte temperature. Un esperimento separato che utilizza il dicroismo circolare dovrebbe essere eseguito per garantire che la proteina sia stabile alla temperatura per l'esperimento crio-EM pianificato.
Un'altra limitazione è che solo due tipi di apparecchi di vetrificazione disponibili in commercio possono essere riscaldati a oltre 37 °C e fino a 60 °C come menzionato sopra (ad esempio, Thermo Fischer Vitrobot e Leica EM-GP). Gli apparecchi di vetrificazione di altri fornitori sono limitati alla temperatura ambiente o regolabili solo tra 4 °C e 37 °C. Tuttavia, è possibile per i gruppi di ricerca costruire i propri dispositivi di immersione con intervalli di temperatura estesi in futuro.
Il nostro protocollo è modificato dai protocolli esistenti 4,5,6, con lo scopo di preparare le griglie a temperature superiori alla temperatura ambiente. Senza apportare le modifiche qui descritte, la possibilità di successo per realizzare buone griglie di campionamento ad alta temperatura adatte alla raccolta di immagini crio-EM è molto piccola.
Due articoli nel 2019 hanno dimostrato che le strutture proteiche dipendono dalla temperatura, in correlazione con la dipendenza dalla temperatura delle funzioni proteiche, nell'intervallo da 4 °C a 42 °C per il canale TRP TRPV311 e da 4 °C a 70 °C per Sso-KARI 12. È probabile che questi rapporti incoraggino un cambiamento nella ricerca crio-EM in quanto ulteriori studi futuri saranno eseguiti a temperature funzionalmente rilevanti, di solito a 37 ° C. La stabilità della proteina purificata a questa temperatura potrebbe essere un problema. Tuttavia, è necessario incubare il campione proteico a questa temperatura per soli 2 minuti secondo il nostro protocollo. In alternativa, le condizioni fisiologiche possono essere raggiunte mediante l'imaging delle proteine nelle cellule utilizzando la tomografia e la media sub-tomo. Inoltre, la crio-EM può essere utilizzata per studiare il meccanismo e gli intermedi del dispiegamento delle proteine ad alte temperature, probabilmente nell'intervallo da 40 °C a 80 °C. Questi studi trarranno tutti beneficio dal protocollo qui descritto.
Divulgazioni
Gli autori non dichiarano interessi finanziari concorrenti.
Riconoscimenti
Gli autori ringraziano il Dr. Hervé Remigy di Thermo Fisher Scientific per gli utili consigli. Gli esperimenti crio-EM sono stati eseguiti presso l'Academia Sinica Cryo-EM Facility (ASCEM). ASCEM è sostenuto da Academia Sinica (Grant No. AS-CFII-108-110) e Taiwan Protein Project (sovvenzione n. AS-KPQ-109-TPP2). Gli autori ringraziano anche la signora Hui-Ju Huang per l'assistenza nella preparazione del campione.
Materiali
| Name | Company | Catalog Number | Comments |
| Falcon tube | Falcon | 352070 | size: 50 mL |
| Filter paper | Ted Pella | 47000-100 | Ø55/20mm, Grade 595 |
| HI1210 | Leica | water bath | |
| K100X | Electron Microscopy Sciences | glow discharge | |
| Quantifoil, 1.2/1.3 200Mesh Cu grid | Ted Pella | 658-200-CU-100 | |
| Titan Krios G3 | Thermo Fisher Scientific | 1063996 | low dose imaging |
| Vitrobot Mark IV | Thermo Fisher Scientific | 1086439 | |
| Vitrobot Tweezer | Ted Pella | 47000-500 |
Riferimenti
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587, 157-161 (2020).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Chen, C. Y., et al. Use of Cryo-EM to uncover structural bases of pH effect and cofactor bi-specificity of ketol-acid reductoisomerase. Journal of the American Chemical Society. 141, 6136-6140 (2019).
- Cabra, V., Samsó, M. Do's and don'ts of cryo-electron microscopy: A primer on sample preparation and high quality data collection for macromolecular 3D reconstruction. Journal of Visualized Experiments. (95), e52311(2015).
- Klebl, D. P., et al. Need for speed: Examining protein behavior during CryoEM grid preparation at different timescales. Structure. 28 (11), 1238-1248 (2020).
- Passmore, L. A., Russo, C. Specimen preparation for high resolution cryo-EM. J. Methods in Enzymology. 579, 51-86 (2016).
- Laughlin, T. G., Bayne, A. N., Trempe, J. -F., Savage, D. F., Davies, K. M. Structure of the complex I-like molecule NDH of oxygenic photosynthesis. Nature. 566, 411-414 (2019).
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363, (2019).
- Zhao, Y., Chen, S., Swensen, A. C., Qian, W. -J., Gouaux, E. Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM. Science. 364, 355-362 (2019).
- Chen, B., et al. Structural dynamics of ribosome subunit association studied by mixing-spraying time-resolved cryogenic electron microscopy. Structure. 23, 1097-1105 (2015).
- Singh, A. K., et al. Structural basis of temperature sensation by the TRP channel TRPV3. Nature Structure and Molecular Biology. 26, 994-998 (2019).
- Chen, C. Y., Chang, Y. C., Lin, B. L., Huang, C. H., Tsai, M. D. Temperature-resolved cryo-EM uncovers structural bases of temperature-dependent enzyme functions. Journal of the American Chemical Society. 141, 19983-19987 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon