Method Article
Preparación de rejillas de muestra de alta temperatura para crio-EM
En este artículo
Resumen
Este documento proporciona un protocolo detallado para preparar rejillas de muestra a temperaturas de hasta 70 ° C, antes de la congelación por inmersión para experimentos crio-EM.
Resumen
Las rejillas de muestreo para experimentos de criomicroscopía electrónica (crio-EM) se preparan generalmente a una temperatura óptima para el almacenamiento de muestras biológicas, principalmente a 4 °C y ocasionalmente a temperatura ambiente. Recientemente, descubrimos que la estructura de proteínas resuelta a baja temperatura puede no ser funcionalmente relevante, particularmente para proteínas de arqueas termófilas. Se desarrolló un procedimiento para preparar muestras de proteínas a temperaturas más altas (hasta 70 °C) para el análisis crio-EM. Demostramos que las estructuras de muestras preparadas a temperaturas más altas son funcionalmente relevantes y dependientes de la temperatura. Aquí describimos un protocolo detallado para preparar rejillas de muestra a alta temperatura, utilizando 55 ° C como ejemplo. El experimento utilizó un aparato de vitrificación modificado con un tubo centrífugo adicional, y las muestras se incubaron a 55 °C. Los procedimientos detallados se ajustaron para minimizar la condensación de vapor y obtener una fina capa de hielo en la rejilla. Se proporcionan ejemplos de experimentos exitosos y no exitosos.
Introducción
La tecnología crio-EM para resolver las estructuras de complejos proteicos ha continuado mejorando, particularmente en la dirección de la obtención de estructuras de alta resolución 1,2. Mientras tanto, el panorama de su aplicación también se ha ampliado variando las condiciones de la muestra, como el pH o los ligandos, antes del proceso de vitrificación3, que implica la preparación de rejillas de muestra seguidas de congelación por inmersión 4,5. Otra condición importante es la temperatura. Aunque los experimentos crio-EM, como la cristalografía de rayos X, se realizan a bajas temperaturas, la estructura resuelta por cryo-EM refleja la estructura en el estado de solución antes de la vitrificación. Hasta hace poco, la mayoría de los estudios crio-EM de análisis de partículas individuales (SPA) utilizan muestras que se mantienen en hielo (es decir, a 4 °C) antes de la vitrificación6, aunque varios estudios utilizan muestras a una temperatura ambiente de alrededor de 7,8,9,10 o tan alta como 42 °C 11. En un informe reciente, realizamos estudios dependientes de la temperatura de la enzima cetol-ácido reductoisomerasa (KARI) de la arquea termófila Sulfolobus solfataricus (Sso) a seis temperaturas diferentes de 4 ° C a 70 ° C12. Nuestros estudios sugieren que es importante preparar rejillas de muestra a temperaturas funcionalmente relevantes y que la crio-EM es el único método estructural que es prácticamente factible para resolver la estructura del mismo complejo proteico a múltiples temperaturas.
La principal dificultad para la vitrificación a altas temperaturas es minimizar la condensación de vapor y lograr hielo delgado. Aquí informamos el protocolo detallado utilizado para preparar rejillas de muestra a altas temperaturas en nuestro estudio previo del Sso-KARI 12. Asumimos que los lectores o espectadores ya tienen experiencia en la preparación general de muestras y los procedimientos de procesamiento de datos para experimentos crio-EM y enfatizamos los aspectos relevantes para la alta temperatura.
Protocolo
NOTA: Este protocolo tiene como objetivo utilizar un aparato de vitrificación comercial modificado para preparar las muestras de criomicroscopía electrónica (crio-EM) a temperaturas específicas, especialmente superiores a 37 °C. La configuración experimental general se muestra en la Figura 1. El protocolo utiliza 55 °C como ejemplo. Para las condiciones específicas a otras temperaturas, véase el cuadro complementario 2 en la referencia12.
1. Preparación del aparato de vitrificación
- Haga un orificio de 1 cm en un tubo de centrífuga de 50 ml en su extremo cerrado.
- Coloque el tubo en la cámara del aparato de vitrificación en la salida de agua ultrasónica, como se muestra en la Figura 2.
NOTA: El propósito es minimizar la condensación de agua guiando el vapor de agua al intercambiador de calor a través del tubo antes de llegar a toda la cámara. - Ajuste la temperatura del aparato de vitrificación a la temperatura especificada (por ejemplo, 55 °C, como se muestra en la Figura 3) y permita que la cámara del aparato de vitrificación alcance los 55 °C y el 100% de humedad relativa. Déjelo reposar durante al menos media hora para estabilizar las condiciones antes de comenzar el experimento.
2. Calentamiento de la muestra y las herramientas
- Coloque el baño de agua en una placa calefactora y ajuste la placa a la temperatura deseada (aquí 55 ° C). Verifique con un termómetro para asegurarse de que el agua alcance los 55 ° C.
- Incubar la muestra en el baño maría y precalentar la punta de la pipeta en el borde de la placa calefactora durante 2 minutos o más antes del experimento de secado.
NOTA: El ajuste de temperatura más alto para la cámara del aparato de vitrificación es de 60 °C. Para preparar rejillas de temperatura más altas para el experimento cyro-EM (por ejemplo, 70 °C), la muestra se incuba en el baño maría a 80 °C, y el promedio entre la temperatura de la muestra y la temperatura del aparato de vitrificación se estima como la temperatura real de la muestra en la rejilla (70 °C en este caso). Consulte la sección Discusión para obtener más detalles y limitaciones sobre esta estimación.
3. Preparación para el experimento de transferencia
- Descarga incandescente una rejilla agujereada soportada por carbono a 25 mA durante 30 s, o alternativa a los valores dependiendo del dispositivo utilizado.
- Incubar las pinzas con la rejilla en el aparato de vitrificación durante 2 min o más.
- Llene el recipiente de etano con etano de acuerdo con los procedimientos estándar. No dejes que el etano se desborde.
NOTA: Este paso dura unos 10 minutos y debe seguirse inmediatamente con el experimento de secado para evitar la congelación. - Coloque el papel de filtro de vitrificación en la cámara del aparato de vitrificación no antes de 5 minutos antes del experimento de secado.
NOTA: Colocar el papel de filtro en la cámara demasiado pronto hará que se humedezca demasiado.
4. Experimento de transferencia
NOTA: Cuando sostenga la rejilla, asegúrese de que la rejilla sea estable y que haya un área de contacto mínima con las pinzas (Figura 4). Esto se hace para mantener la mejor eficiencia de enfriamiento del etano y para evitar el hielo no vítreo.
- Utilice una punta de pipeta para aplicar 7-9 μL de la muestra a la rejilla. Luego espere 1-2 s, seque durante 1-1.5 s y sumerja rápidamente la muestra en etano líquido.
- Transfiera la rejilla del etano líquido a la caja criogénica, que se almacena en nitrógeno líquido.
NOTA: Este paso debe realizarse con mucho cuidado porque las pinzas todavía están calientes, por lo que todo el tanque de enfriamiento está lleno de vapor en este momento.
5. Control de calidad de las redes
- Recorte las cuadrículas y cárguelas en un instrumento crio-EM.
- Utilice la pantalla de visualización del instrumento crio-EM y la función de dosis baja del software para detectar la condición del hielo en la rejilla y la distribución de la muestra en la rejilla.
NOTA: A menudo, las rejillas están muy secas o la capa de hielo es demasiado gruesa. La tasa de éxito de las rejillas preparadas a altas temperaturas es sustancialmente inferior a la de las rejillas a temperatura ambiente o a 4 °C. Los resultados representativos de las cuadrículas buenas y las cuadrículas no satisfactorias se muestran en la siguiente sección. - Si la calidad de la rejilla resultante no es buena, repita el proceso de preparación de la rejilla con condiciones variadas (como tiempo de espera, tiempo de borrado, etc.). Si la calidad de la rejilla resultante es buena, repita los mismos pasos para hacer rejillas a una temperatura diferente.
6. Recopilación de datos
- Transfiera las rejillas de buena calidad a un instrumento crio-EM de alta resolución.
- Realizar la recopilación y el análisis de datos de acuerdo con los procedimientos establecidos.
NOTA: Como se muestra en nuestra publicación anterior, la resolución de la estructura no se ve afectada por la alta temperatura12.
Resultados
La descripción general de bajo aumento se muestra en la Figura 5A,B. El panel A es un ejemplo de una cuadrícula exitosa. Hay un gradiente de hielo desde la parte superior izquierda (más gruesa) hasta la parte inferior derecha (más delgada o vacía). Dicha cuadrícula hace que sea más fácil encontrar un espesor apropiado de la capa de hielo en el área media adecuada para la recopilación de datos, como las cajas azul y verde. La rejilla B está demasiado seca. Los cuadrados en la cuadrícula tienen un contraste brillante, lo que significa que la capa de hielo es demasiado delgada o no hay ninguna capa de hielo. Solo los dos cuadrados indicados por las flechas rojas son adecuados para la recopilación de datos.
Además, en la Figura 5C,D se muestran ejemplos de imágenes de baja dosis de diferentes cuadrículas. La imagen en el panel C muestra que la mayor parte del hielo está en forma cristalina, no adecuado para la recopilación de datos. Por otro lado, la imagen en el panel D muestra que la capa de hielo se encuentra principalmente en un estado amorfo, adecuado para la recopilación de datos.
Tenga en cuenta que este es un breve documento que se centra en la preparación de la red a altas temperaturas. La cuadrícula solo contiene la muestra para la recopilación de datos. Una buena cuadrícula tiene una buena oportunidad, aunque no una oportunidad definitiva, de generar buenos datos para resolver una estructura de alta resolución. Los datos reales de crio-EM y las estructuras finales para los ejemplos descritos en este artículo ya se describen en el artículo publicado12. En resumen, hemos obtenido cuadrículas lo suficientemente buenas para la recopilación de datos, resuelto las estructuras de dos complejos Sso-KARI a seis temperaturas diferentes cada uno, y comparado las estructuras de diferentes temperaturas para cada complejo, así como las estructuras entre los dos complejos de la misma temperatura. Los resultados indican que la estructura de cada complejo depende de la temperatura y que los cambios dependientes de la temperatura son diferentes entre los dos complejos. Es importante destacar que los sucesivos cambios estructurales se correlacionan bien con los sucesivos cambios de temperatura, lo que es una fuerte indicación del éxito de la preparación de la rejilla de muestra dependiente de la temperatura.

Figura 1: Configuración experimental general para la preparación de muestras crioelectromagnéticas a alta temperatura. Los elementos mostrados incluyen aparatos de vitrificación, incubadora, temporizador, colocación de punta de pipeta, tanque de enfriamiento y pinzas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Modificación de la cámara del aparato de vitrificación. Se instala un tubo de 50 ml en la salida de pulverización ultrasónica como lo indica la flecha roja12. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Aspecto del aparato de vitrificación durante el experimento. La pantalla muestra la temperatura a 55 °C y la humedad al 100%. Haga clic aquí para ver una versión más grande de esta figura.
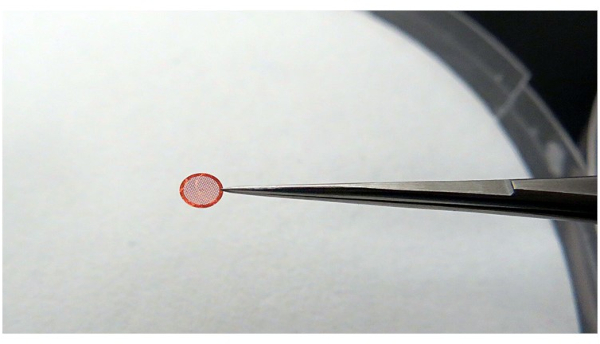
Figura 4: Uso de pinzas para agarrar la cuadrícula. Se recomienda que las pinzas agarren la rejilla con el menor contacto posible, pero debe ser capaz de sostener la rejilla de manera estable durante el proceso de la operación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Resultados representativos: Verificación de cuadrícula por Cryo-EM. (A,B) muestra el estado general de la cuadrícula. (C, D) muestran ejemplos de imágenes de baja dosis de diferentes cuadrículas. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En el paso 1 del protocolo, asegúrese de que el tubo de centrífuga se haya instalado bien y no se caiga cuando el experimento esté en curso. Debido a la acumulación de una gran cantidad de gotas de agua en la cámara, lo que podría cambiar la capacidad de adsorción del papel de filtro, se recomienda que el tiempo total del experimento no exceda los 30 minutos después de que la cámara del aparato de vitrificación haya alcanzado la temperatura de equilibrio. Si el tiempo de operación excede los 30 minutos, el operador debe reemplazar el papel de filtro y esperar a que la cabina equilibre la temperatura y la humedad nuevamente. En el paso 8 del protocolo, el volumen de muestra sugerido de 7-9 μL es mayor de lo habitual, ya que de lo contrario, la muestra se evapora rápidamente a alta temperatura, lo que lleva a cuadrados vacíos en la cuadrícula. Por otro lado, es muy recomendable que la muestra aplicada no supere los 9 μL. De lo contrario, es muy probable que la muestra gotee durante el proceso de mover la pinza antes de secar. En general, una clave para el éxito de esta técnica es el agarre estable y rápido de las cuadrículas y la ejecución correcta y estable de cada acción limitada en el tiempo. Además, se recomienda que cada ronda de experimentos se ocupe de una sola temperatura alta específica. Antes de proceder a realizar el experimento a otra temperatura, todos los sistemas deben recuperarse y reiniciarse por completo.
Debido a la alta temperatura y la alta humedad de la cámara, la ventana a menudo está cubierta de niebla, lo que dificulta el lanzamiento del experimento. Se recomienda el uso de un poco de jabón para despejar la ventana. Si las cuadrículas no son buenas, las posibles razones son que los pasos descritos anteriormente no se siguen con precisión y / o que los pasos toman demasiado tiempo. Intente repetir la preparación de las rejillas de muestra con precisión y rapidez. Si las rejillas aún no son buenas después de las repeticiones, intente ajustar las condiciones. El problema más frecuente observado en este experimento es que no hay hielo en la red a alta temperatura. Si es así, trate de reducir aún más el tiempo de secado. Por otro lado, si el hielo es demasiado espeso, trate de aumentar el tiempo de secado.
Una limitación de la crio-EM de alta temperatura es que la temperatura máxima de calentamiento en el aparato de vitrificación es de 60 °C. Para alcanzar la temperatura más alta, la muestra se calentó por encima de 60 °C (por ejemplo, 80 °C), y el promedio entre la temperatura de la muestra y la temperatura de vitrificación se estimó en la temperatura real de la muestra en la cuadrícula (70 °C, en este caso). Podría haber alguna inexactitud basada en esta estimación. Una posible solución futura es construir un termopar para medir la temperatura de la red con precisión justo antes de la congelación. Otra limitación potencial es la estabilidad de la proteína a altas temperaturas. Se debe realizar un experimento separado utilizando dicroísmo circular para garantizar que la proteína sea estable a la temperatura para el experimento crio-EM planificado.
Otra limitación es que solo dos tipos de aparatos de vitrificación disponibles comercialmente pueden calentarse a más de 37 °C y hasta 60 °C como se mencionó anteriormente (por ejemplo, Thermo Fischer Vitrobot y Leica EM-GP). Los aparatos de vitrificación de otros proveedores están limitados a temperatura ambiente o ajustables solo entre 4 °C y 37 °C. Sin embargo, es posible que los grupos de investigación construyan sus propios dispositivos de inmersión con rangos de temperatura extendidos en el futuro.
Nuestro protocolo se modifica a partir de los protocolos existentes 4,5,6, con el propósito de preparar las rejillas a temperaturas superiores a la temperatura ambiente. Sin hacer las modificaciones descritas aquí, la posibilidad de éxito para hacer buenas rejillas de muestra de alta temperatura adecuadas para la recolección de imágenes crio-EM es muy pequeña.
Dos artículos en 2019 han demostrado que las estructuras de proteínas dependen de la temperatura, en correlación con la dependencia de la temperatura de las funciones de las proteínas, en el rango de 4 ° C a 42 ° C para el canal TRPV311 y de 4 ° C a 70 ° C para Sso-KARI 12. Es probable que estos informes fomenten un cambio en la investigación crio-EM en el sentido de que se realizarán más estudios futuros a temperaturas funcionalmente relevantes, generalmente a 37 ° C. La estabilidad de la proteína purificada a esta temperatura podría ser una preocupación. Sin embargo, se requiere incubar la muestra de proteína a esta temperatura durante solo 2 minutos de acuerdo con nuestro protocolo. Alternativamente, las condiciones fisiológicas se pueden lograr mediante imágenes de proteínas en las células mediante tomografía y promedio de sub-tomos. Además, la crio-EM se puede utilizar para estudiar el mecanismo y los intermediarios de la proteína que se despliega a altas temperaturas, probablemente en el rango de 40 ° C a 80 ° C. Todos estos estudios se beneficiarán del protocolo descrito aquí.
Divulgaciones
Los autores declaran que no hay intereses financieros contrapuestos.
Agradecimientos
Los autores agradecen al Dr. Hervé Remigy de Thermo Fisher Scientific sus útiles consejos. Los experimentos crio-EM se realizaron en la Academia Sinica Cryo-EM Facility (ASCEM). ASCEM cuenta con el apoyo de la Academia Sínica (Subvención No. AS-CFII-108-110) y Taiwan Protein Project (subvención No. AS-KPQ-109-TPP2). Los autores también agradecen a la Sra. Hui-Ju Huang por la ayuda con la preparación de la muestra.
Materiales
| Name | Company | Catalog Number | Comments |
| Falcon tube | Falcon | 352070 | size: 50 mL |
| Filter paper | Ted Pella | 47000-100 | Ø55/20mm, Grade 595 |
| HI1210 | Leica | water bath | |
| K100X | Electron Microscopy Sciences | glow discharge | |
| Quantifoil, 1.2/1.3 200Mesh Cu grid | Ted Pella | 658-200-CU-100 | |
| Titan Krios G3 | Thermo Fisher Scientific | 1063996 | low dose imaging |
| Vitrobot Mark IV | Thermo Fisher Scientific | 1086439 | |
| Vitrobot Tweezer | Ted Pella | 47000-500 |
Referencias
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587, 157-161 (2020).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Chen, C. Y., et al. Use of Cryo-EM to uncover structural bases of pH effect and cofactor bi-specificity of ketol-acid reductoisomerase. Journal of the American Chemical Society. 141, 6136-6140 (2019).
- Cabra, V., Samsó, M. Do's and don'ts of cryo-electron microscopy: A primer on sample preparation and high quality data collection for macromolecular 3D reconstruction. Journal of Visualized Experiments. (95), e52311(2015).
- Klebl, D. P., et al. Need for speed: Examining protein behavior during CryoEM grid preparation at different timescales. Structure. 28 (11), 1238-1248 (2020).
- Passmore, L. A., Russo, C. Specimen preparation for high resolution cryo-EM. J. Methods in Enzymology. 579, 51-86 (2016).
- Laughlin, T. G., Bayne, A. N., Trempe, J. -F., Savage, D. F., Davies, K. M. Structure of the complex I-like molecule NDH of oxygenic photosynthesis. Nature. 566, 411-414 (2019).
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363, (2019).
- Zhao, Y., Chen, S., Swensen, A. C., Qian, W. -J., Gouaux, E. Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM. Science. 364, 355-362 (2019).
- Chen, B., et al. Structural dynamics of ribosome subunit association studied by mixing-spraying time-resolved cryogenic electron microscopy. Structure. 23, 1097-1105 (2015).
- Singh, A. K., et al. Structural basis of temperature sensation by the TRP channel TRPV3. Nature Structure and Molecular Biology. 26, 994-998 (2019).
- Chen, C. Y., Chang, Y. C., Lin, B. L., Huang, C. H., Tsai, M. D. Temperature-resolved cryo-EM uncovers structural bases of temperature-dependent enzyme functions. Journal of the American Chemical Society. 141, 19983-19987 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados