Method Article
Vorbereitung von Hochtemperatur-Probengittern für Kryo-EM
In diesem Artikel
Zusammenfassung
Dieses Papier enthält ein detailliertes Protokoll für die Vorbereitung von Probengittern bei Temperaturen von bis zu 70 °C vor dem Einfrieren von Proben für Kryo-EM-Experimente.
Zusammenfassung
Die Probengitter für Kryo-Elektronenmikroskopie-Experimente (Kryo-EM) werden üblicherweise bei einer für die Lagerung biologischer Proben optimalen Temperatur präpariert, meist bei 4 °C und gelegentlich bei Raumtemperatur. Kürzlich haben wir entdeckt, dass die Proteinstruktur, die bei niedrigen Temperaturen gelöst wird, möglicherweise nicht funktionell relevant ist, insbesondere für Proteine aus thermophilen Archaeen. Es wurde ein Verfahren entwickelt, um Proteinproben bei höheren Temperaturen (bis zu 70 °C) für die Kryo-EM-Analyse vorzubereiten. Wir haben gezeigt, dass die Strukturen von Proben, die bei höheren Temperaturen präpariert wurden, funktionell relevant und temperaturabhängig sind. Hier beschreiben wir ein detailliertes Protokoll zur Vorbereitung von Probengittern bei hohen Temperaturen am Beispiel von 55 °C. Das Experiment verwendete eine Vitrifikationsapparatur, die mit einem zusätzlichen Zentrifugenröhrchen modifiziert wurde, und die Proben wurden bei 55 °C inkubiert. Die detaillierten Verfahren wurden fein abgestimmt, um Dampfkondensation zu minimieren und eine dünne Eisschicht auf dem Gitter zu erhalten. Beispiele für erfolgreiche und erfolglose Experimente werden gegeben.
Einleitung
Die Kryo-EM-Technologie zur Lösung der Strukturen von Proteinkomplexen hat sich weiter verbessert, insbesondere in Richtung der Gewinnung hochauflösender Strukturen 1,2. In der Zwischenzeit wurde die Anwendungslandschaft auch durch Variation der Probenbedingungen wie pH-Wert oder Liganden vor dem Vitrifikationsprozess3 erweitert, der die Vorbereitung von Probengittern mit anschließendem Tauchgefrieren beinhaltet 4,5. Eine weitere wichtige Bedingung ist die Temperatur. Obwohl Kryo-EM-Experimente, wie die Röntgenkristallographie, bei niedrigen Temperaturen durchgeführt werden, spiegelt die durch Kryo-EM gelöste Struktur die Struktur im Lösungszustand vor der Vitrifikation wider. Bis vor kurzem verwendete die Mehrheit der Einzelpartikelanalyse (SPA) Kryo-EM-Studien Proben, die vor der Vitrifikation auf Eis gehalten wurden(dh bei 4 ° C), obwohl eine Reihe von Studien Proben bei etwaRaumtemperatur 7,8,9,10 oder so hoch wie 42 ° C 11 verwendet. In einem aktuellen Bericht haben wir temperaturabhängige Untersuchungen des Enzyms Ketolsäure-Reduktoisomerase (KARI) aus dem thermophilen Archaeon Sulfolobus solfataricus (Sso) bei sechs verschiedenen Temperaturen von 4 °C bis 70 °C durchgeführt12. Unsere Studien legen nahe, dass es wichtig ist, Probengitter bei funktionell relevanten Temperaturen vorzubereiten und dass Kryo-EM die einzige Strukturmethode ist, die praktisch möglich ist, um die Struktur desselben Proteinkomplexes bei mehreren Temperaturen zu lösen.
Die Hauptschwierigkeit bei der Verglasung bei hohen Temperaturen besteht darin, die Dampfkondensation zu minimieren und dünnes Eis zu erreichen. Hier berichten wir über das detaillierte Protokoll, das für die Vorbereitung von Probengittern bei hohen Temperaturen in unserer früheren Studie des Sso-KARI 12 verwendet wurde. Wir gehen davon aus, dass die Leser oder Betrachter bereits Erfahrung mit den gesamten Probenvorbereitungs- und Datenverarbeitungsverfahren für Kryo-EM-Experimente haben und betonen die für hohe Temperaturen relevanten Aspekte.
Protokoll
HINWEIS: Dieses Protokoll zielt darauf ab, eine modifizierte kommerzielle Vitrifikationsvorrichtung zu verwenden, um die Kryo-Elektronenmikroskopie-Proben (Kryo-EM) bei bestimmten Temperaturen, insbesondere über 37 °C, vorzubereiten. Der gesamte Versuchsaufbau ist in Abbildung 1 dargestellt. Das Protokoll verwendet 55 °C als Beispiel. Für die spezifischen Bedingungen bei anderen Temperaturen siehe Zusatztabelle 2 in Referenz12.
1. Vorbereitung des Vitrifikationsapparates
- Machen Sie ein 1 cm großes Loch in ein 50-ml-Zentrifugenröhrchen an seinem geschlossenen Ende.
- Setzen Sie das Röhrchen in die Kammer des Vitrifikationsgeräts am Ultraschallwasserauslass ein, wie in Abbildung 2 dargestellt.
HINWEIS: Der Zweck besteht darin, die Wasserkondensation zu minimieren, indem Wasserdampf durch das Rohr zum Wärmetauscher geleitet wird, bevor die gesamte Kammer erreicht wird. - Stellen Sie die Temperatur des Verglasungsapparats auf die angegebene Temperatur ein (z. B. 55 °C, wie in Abbildung 3 dargestellt), und lassen Sie die Kammer des Verglasungsgeräts 55 °C und 100 % relative Luftfeuchtigkeit erreichen. Lassen Sie es mindestens eine halbe Stunde stehen, um die Bedingungen zu stabilisieren, bevor Sie mit dem Experiment beginnen.
2. Aufwärmen der Probe und der Werkzeuge
- Stellen Sie das Wasserbad auf eine Kochplatte und stellen Sie die Kochplatte auf die gewünschte Temperatur (hier 55 °C). Überprüfen Sie mit einem Thermometer, ob das Wasser 55 ° C erreicht.
- Inkubieren Sie die Probe im Wasserbad und heizen Sie die Pipettenspitze am Rand der Heizplatte für 2 min oder länger vor dem Blotting-Experiment vor.
HINWEIS: Die höchste Temperatureinstellung für die Verglasungsgerätekammer beträgt 60 °C. Um höhere Temperaturgitter für Cyro-EM-Experimente (z. B. 70 °C) vorzubereiten, wird die Probe im Wasserbad bei 80 °C inkubiert, und der Mittelwert zwischen der Probentemperatur und der Temperatur des Vitrifikationsapparats wird auf die tatsächliche Temperatur der Probe auf dem Gitter geschätzt (in diesem Fall 70 °C). Weitere Details und Einschränkungen dieser Schätzung finden Sie im Abschnitt Diskussion .
3. Vorbereitung des Blotting-Experiments
- Glimmenentladung eines löchrigen, kohlenstoffgestützten Gitters bei 25 mA für 30 s oder alternativ zu den Werten je nach verwendetem Gerät.
- Inkubieren Sie die Pinzette mit dem Gitter im Vitrifikationsapparat für 2 min oder länger.
- Füllen Sie den Ethanbehälter nach Standardverfahren mit Ethan. Lassen Sie das Ethan nicht überlaufen.
HINWEIS: Dieser Schritt dauert ca. 10 Minuten und sollte sofort mit dem Blotting-Experiment gefolgt werden, um ein Einfrieren zu vermeiden. - Legen Sie das Vitrifikationsfilterpapier frühestens 5 min vor dem Blotting-Versuch in die Kammer des Vitrifikationsapparates.
HINWEIS: Wenn Sie das Filterpapier zu früh in die Kammer legen, wird es zu nass.
4. Blotting-Experiment
HINWEIS: Stellen Sie beim Halten des Gitters sicher, dass das Gitter stabil ist und eine minimale Kontaktfläche mit der Pinzette vorhanden ist (Abbildung 4). Dies geschieht, um die beste Kühleffizienz von Ethan zu erhalten und nicht glasiges Eis zu vermeiden.
- Verwenden Sie eine Pipettenspitze, um 7-9 μL der Probe auf das Gitter aufzutragen. Dann warten Sie 1-2 s, tupfen Sie für 1-1,5 s und tauchen Sie die Probe schnell in flüssiges Ethan.
- Übertragen Sie das Gitter von flüssigem Ethan in die Kryobox, die in flüssigem Stickstoff gespeichert ist.
HINWEIS: Dieser Schritt muss sehr sorgfältig durchgeführt werden, da die Pinzette noch heiß ist, so dass der gesamte Kühltank zu diesem Zeitpunkt mit Dampf gefüllt ist.
5. Qualitätsprüfung der Netze
- Schneiden Sie die Gitter ab und laden Sie sie auf ein Kryo-EM-Instrument hoch.
- Verwenden Sie den Bildschirm des Kryo-EM-Instruments und die Niedrigdosisfunktion der Software, um den Eiszustand auf dem Gitter und die Verteilung der Probe auf dem Gitter zu überprüfen.
HINWEIS: Oft sind die Gitter sehr trocken oder die Eisschicht ist zu dick. Die Erfolgsquote der bei hohen Temperaturen vorbereiteten Netze ist wesentlich geringer als bei Raumtemperatur oder 4 °C. Repräsentative Ergebnisse von guten und nicht zufriedenstellenden Gittern werden im nächsten Abschnitt gezeigt. - Wenn die Qualität des resultierenden Gitters nicht gut ist, wiederholen Sie den Prozess der Netzvorbereitung unter verschiedenen Bedingungen (z. B. Wartezeit, Löschzeit usw.). Wenn die Qualität des resultierenden Gitters gut ist, wiederholen Sie die gleichen Schritte, um Gitter mit einer anderen Temperatur zu erstellen.
6. Datenerhebung
- Übertragen Sie die qualitativ hochwertigen Gitter auf ein hochauflösendes Kryo-EM-Instrument.
- Führen Sie Datenerhebung und Datenanalysen nach festgelegten Verfahren durch.
HINWEIS: Wie in unserer vorherigen Veröffentlichung gezeigt, wird die Auflösung der Struktur durch die hohe Temperatur12 nicht beeinflusst.
Ergebnisse
Die Übersicht über die geringe Vergrößerung ist in Abbildung 5A,B dargestellt. Panel A ist ein Beispiel für ein erfolgreiches Raster. Es gibt einen Eisgradienten von links oben (dicker) nach rechts unten (dünner oder leer). Ein solches Raster erleichtert es, eine geeignete Dicke der Eisschicht im mittleren Bereich zu finden, die für die Datenerhebung geeignet ist, wie z. B. die blauen und grünen Boxen. Das Gitter B ist zu trocken. Die Quadrate im Raster haben einen hellen Kontrast, was bedeutet, dass die Eisschicht zu dünn ist oder überhaupt keine Eisschicht vorhanden ist. Nur die beiden Quadrate, die durch die roten Pfeile gekennzeichnet sind, sind für die Datenerfassung geeignet.
Darüber hinaus sind Beispiele für die niedrig dosierten Bilder aus verschiedenen Gittern in Abbildung 5C,D dargestellt. Das Bild in Panel C zeigt, dass der größte Teil des Eises in kristalliner Form vorliegt und nicht für die Datenerfassung geeignet ist. Auf der anderen Seite zeigt das Bild in Panel D, dass sich die Eisschicht größtenteils in einem amorphen Zustand befindet, der für die Datenerhebung geeignet ist.
Bitte beachten Sie, dass dies ein kurzes Papier ist, das sich auf die Netzvorbereitung bei hohen Temperaturen konzentriert. Das Raster enthält nur das Beispiel für die Datenerfassung. Ein gutes Gitter hat eine gute Chance, wenn auch keine definitive Chance, gute Daten für die Lösung einer hochauflösenden Struktur zu generieren. Die realen Kryo-EM-Daten und endgültigen Strukturen für die in diesem Artikel beschriebenen Beispiele sind bereits in der veröffentlichten Arbeit12 beschrieben. Kurz gesagt, wir haben Gitter erhalten, die gut genug für die Datenerfassung sind, die Strukturen von zwei Sso-KARI-Komplexen bei jeweils sechs verschiedenen Temperaturen gelöst und die Strukturen von verschiedenen Temperaturen für jeden Komplex sowie die Strukturen zwischen den beiden Komplexen von der gleichen Temperatur verglichen. Die Ergebnisse deuten darauf hin, dass die Struktur jedes Komplexes temperaturabhängig ist und dass die temperaturabhängigen Änderungen zwischen den beiden Komplexen unterschiedlich sind. Wichtig ist, dass die aufeinanderfolgenden Strukturänderungen gut mit den aufeinanderfolgenden Temperaturänderungen korrelieren, was ein starker Indikator für den Erfolg der temperaturabhängigen Probengittervorbereitung ist.

Abbildung 1: Der gesamte Versuchsaufbau für die Hochtemperatur-Kryo-EM-Probenvorbereitung. Zu den gezeigten Gegenständen gehören Vitrifikationsgerät, Inkubator, Timer, Platzierung der Pipettenspitze, Kühltank und Pinzette. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Modifikation der Vitrifikationsapparatekammer. Ein 50-ml-Röhrchen ist am Ultraschall-Sprühauslass installiert, wie durch den roten Pfeil12 angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Aussehen des Vitrifikationsapparates während des Experiments. Der Bildschirm zeigt die Temperatur bei 55 °C und die Luftfeuchtigkeit bei 100%. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
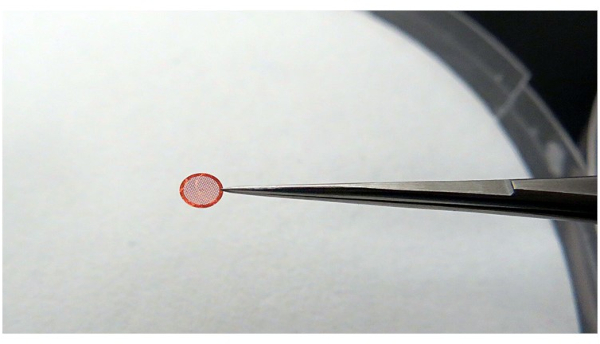
Abbildung 4: Verwenden einer Pinzette zum Greifen des Gitters. Es wird empfohlen, dass die Pinzette das Gitter so berührungslos wie möglich greift, aber es muss in der Lage sein, das Gitter während des Vorgangs stabil zu halten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Repräsentative Ergebnisse: Netzprüfung durch Kryo-EM. (A,B) zeigen den Gesamtzustand des Gitters an. (C,D) zeigen Beispiele für die niedrig dosierten Bilder aus verschiedenen Gittern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Stellen Sie in Schritt 1 des Protokolls sicher, dass das Zentrifugenröhrchen gut installiert wurde und nicht herunterfällt, wenn das Experiment läuft. Aufgrund der Ansammlung einer großen Anzahl von Wassertröpfchen in der Kammer, die die Adsorptionskapazität des Filterpapiers verändern könnten, wird empfohlen, dass die Gesamtzeit des Experiments 30 min nicht überschreiten sollte, nachdem die Vitrifikationsapparatekammer die Gleichgewichtstemperatur erreicht hat. Wenn die Betriebszeit 30 Minuten überschreitet, muss der Bediener das Filterpapier austauschen und warten, bis die Kabine Temperatur und Luftfeuchtigkeit wieder ausgeglichen hat. In Schritt 8 des Protokolls ist das vorgeschlagene Probenvolumen von 7-9 μL größer als üblich, da die Probe sonst bei hoher Temperatur schnell verdampft, was zu leeren Quadraten auf dem Gitter führt. Auf der anderen Seite wird dringend empfohlen, dass die aufgetragene Probe 9 μL nicht überschreitet. Andernfalls ist es sehr wahrscheinlich, dass die Probe während des Bewegens der Pinzette vor dem Ablöschen heruntertropft. Insgesamt ist ein Schlüssel zum Erfolg dieser Technik das stabile und schnelle Greifen von Gittern und die korrekte und stabile Ausführung jeder zeitlich begrenzten Aktion. Darüber hinaus wird empfohlen, dass sich jede Versuchsrunde nur mit einer bestimmten hohen Temperatur befasst. Bevor das Experiment bei einer anderen Temperatur durchgeführt wird, müssen alle Systeme vollständig wiederhergestellt und zurückgesetzt werden.
Aufgrund der hohen Temperatur und der hohen Luftfeuchtigkeit der Kammer ist das Fenster oft mit Nebel bedeckt, was zu Schwierigkeiten beim Starten des Experiments führt. Es wird empfohlen, ein wenig Seifenlauge zu verwenden, um das Fenster zu räumen. Wenn Raster nicht gut sind, können Gründe sein, dass die oben beschriebenen Schritte nicht genau befolgt werden und/oder dass die Schritte zu lange dauern. Versuchen Sie, die Vorbereitung der Probengitter mit Präzision und Schnelligkeit zu wiederholen. Wenn die Gitter nach Wiederholungen immer noch nicht gut sind, versuchen Sie, die Bedingungen anzupassen. Das häufigere Problem, das in diesem Experiment beobachtet wurde, ist kein Eis auf dem Gitter bei der hohen Temperatur. Wenn ja, versuchen Sie, die Löschzeit weiter zu reduzieren. Auf der anderen Seite, wenn das Eis zu dick ist, versuchen Sie, die Löschzeit zu erhöhen.
Eine Einschränkung der Hochtemperatur-Kryo-EM besteht darin, dass die maximale Heiztemperatur an der Vitrifikationsapparatur 60 °C beträgt. Um die höhere Temperatur zu erreichen, wurde die Probe über 60 °C (z. B. 80 °C) erhitzt, und der Durchschnitt zwischen der Probentemperatur und der Vitrifikationstemperatur wurde als die tatsächliche Temperatur der Probe auf dem Raster geschätzt (in diesem Fall 70 °C). Es könnte einige Ungenauigkeiten geben, die auf dieser Schätzung basieren. Eine mögliche zukünftige Lösung ist der Bau eines Thermoelements, um die Netztemperatur kurz vor dem Einfrieren genau zu messen. Eine weitere mögliche Einschränkung ist die Stabilität des Proteins bei hohen Temperaturen. Ein separates Experiment mit Zirkulardichroismus sollte durchgeführt werden, um sicherzustellen, dass das Protein bei der Temperatur für das geplante Kryo-EM-Experiment stabil ist.
Eine weitere Einschränkung besteht darin, dass nur zwei Arten von handelsüblichen Vitrifikationsgeräten auf über 37 °C und bis zu 60 °C wie oben erwähnt erhitzt werden können (z. B. Thermo Fischer Vitrobot und Leica EM-GP). Die Verglasungsapparate anderer Hersteller sind entweder auf Raumtemperatur beschränkt oder nur zwischen 4 °C und 37 °C einstellbar. Es ist jedoch möglich, dass Forschungsgruppen in Zukunft eigene Tauchgeräte mit erweiterten Temperaturbereichen bauen.
Unser Protokoll wurde von den bestehenden Protokollen 4,5,6 modifiziert, um die Netze bei Temperaturen über Raumtemperatur vorzubereiten. Ohne die hier beschriebenen Modifikationen ist die Erfolgschance für die Herstellung guter Hochtemperatur-Probengitter, die für die Kryo-EM-Bildsammlung geeignet sind, sehr gering.
Zwei Arbeiten aus dem Jahr 2019 haben gezeigt, dass Proteinstrukturen temperaturabhängig sind, in Korrelation mit der Temperaturabhängigkeit von Proteinfunktionen, im Bereich von 4 °C bis 42 °C für den TRP-Kanal TRPV311 und 4 °C bis 70 °C für Sso-KARI 12. Diese Berichte werden wahrscheinlich eine Veränderung in der Kryo-EM-Forschung fördern, da mehr zukünftige Studien bei funktionell relevanten Temperaturen, normalerweise bei 37 ° C, durchgeführt werden. Die Stabilität des gereinigten Proteins bei dieser Temperatur könnte ein Problem darstellen. Es ist jedoch erforderlich, die Proteinprobe bei dieser Temperatur für nur 2 Minuten gemäß unserem Protokoll zu inkubieren. Alternativ können physiologische Bedingungen durch die Abbildung von Proteinen in Zellen mittels Tomographie und Sub-Tomo-Mittelung erreicht werden. Darüber hinaus kann Kryo-EM verwendet werden, um den Mechanismus und die Zwischenprodukte der Proteinentfaltung bei hohen Temperaturen zu untersuchen, wahrscheinlich im Bereich von 40 ° C bis 80 ° C. Diese Studien werden alle von dem hier beschriebenen Protokoll profitieren.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Die Autoren danken Dr. Hervé Remigy von Thermo Fisher Scientific für nützliche Ratschläge. Die Kryo-EM-Experimente wurden an der Academia Sinica Cryo-EM Facility (ASCEM) durchgeführt. ASCEM wird unterstützt von der Academia Sinica (Grant No. AS-CFII-108-110) und Taiwan Protein Project (Grant No. AS-KPQ-109-TPP2). Die Autoren danken auch Frau Hui-Ju Huang für die Unterstützung bei der Probenvorbereitung.
Materialien
| Name | Company | Catalog Number | Comments |
| Falcon tube | Falcon | 352070 | size: 50 mL |
| Filter paper | Ted Pella | 47000-100 | Ø55/20mm, Grade 595 |
| HI1210 | Leica | water bath | |
| K100X | Electron Microscopy Sciences | glow discharge | |
| Quantifoil, 1.2/1.3 200Mesh Cu grid | Ted Pella | 658-200-CU-100 | |
| Titan Krios G3 | Thermo Fisher Scientific | 1063996 | low dose imaging |
| Vitrobot Mark IV | Thermo Fisher Scientific | 1086439 | |
| Vitrobot Tweezer | Ted Pella | 47000-500 |
Referenzen
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587, 157-161 (2020).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587, 152-156 (2020).
- Chen, C. Y., et al. Use of Cryo-EM to uncover structural bases of pH effect and cofactor bi-specificity of ketol-acid reductoisomerase. Journal of the American Chemical Society. 141, 6136-6140 (2019).
- Cabra, V., Samsó, M. Do's and don'ts of cryo-electron microscopy: A primer on sample preparation and high quality data collection for macromolecular 3D reconstruction. Journal of Visualized Experiments. (95), e52311 (2015).
- Klebl, D. P., et al. Need for speed: Examining protein behavior during CryoEM grid preparation at different timescales. Structure. 28 (11), 1238-1248 (2020).
- Passmore, L. A., Russo, C. Specimen preparation for high resolution cryo-EM. J. Methods in Enzymology. 579, 51-86 (2016).
- Laughlin, T. G., Bayne, A. N., Trempe, J. -. F., Savage, D. F., Davies, K. M. Structure of the complex I-like molecule NDH of oxygenic photosynthesis. Nature. 566, 411-414 (2019).
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363, (2019).
- Zhao, Y., Chen, S., Swensen, A. C., Qian, W. -. J., Gouaux, E. Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM. Science. 364, 355-362 (2019).
- Chen, B., et al. Structural dynamics of ribosome subunit association studied by mixing-spraying time-resolved cryogenic electron microscopy. Structure. 23, 1097-1105 (2015).
- Singh, A. K., et al. Structural basis of temperature sensation by the TRP channel TRPV3. Nature Structure and Molecular Biology. 26, 994-998 (2019).
- Chen, C. Y., Chang, Y. C., Lin, B. L., Huang, C. H., Tsai, M. D. Temperature-resolved cryo-EM uncovers structural bases of temperature-dependent enzyme functions. Journal of the American Chemical Society. 141, 19983-19987 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten