Method Article
Geração de Organoides cerebrais humanos para modelagem de doenças mitocondriais
Neste Artigo
Resumo
Descrevemos um protocolo detalhado para a geração de organoides cerebrais pluripotentes induzidos por células-tronco induzidos pelo homem e seu uso na modelagem de doenças mitocondriais.
Resumo
As doenças mitocondriais representam a maior classe de erros inatos do metabolismo e são atualmente incuráveis. Essas doenças causam defeitos neurodesenvolvimentistas cujos mecanismos subjacentes permanecem a ser elucidados. Um grande obstáculo é a falta de modelos eficazes recapitulando o comprometimento neuronal de início precoce visto nos pacientes. Os avanços na tecnologia de células-tronco pluripotentes induzidas (iPSCs) permitem a geração de organoides cerebrais tridimensionais (3D) que podem ser usados para investigar o impacto das doenças no desenvolvimento e organização do sistema nervoso. Pesquisadores, incluindo esses autores, introduziram recentemente organoides cerebrais humanos para modelar distúrbios mitocondriais. Este artigo relata um protocolo detalhado para a geração robusta de organoides cerebrais derivados do iPSC humanos e seu uso em perfis bioenergénicos mitocondrial e análises de imagens. Esses experimentos permitirão o uso de organoides cerebrais para investigar disfunções metabólicas e de desenvolvimento e podem fornecer informações cruciais para dissecar a patologia neuronal de doenças mitocondriais.
Introdução
As doenças mitocondriais representam a maior classe de erros inatos do metabolismo1. São causadas por mutações genéticas que interrompem diferentes processos mitocondriais, incluindo fosforilação oxidativa (OXPHOS)2, montagem da cadeia respiratória, dinâmica mitocondrial e transcrição ou replicação do DNA mitocondrial3. Tecidos com necessidades energéticas são particularmente afetados pela disfunção mitocondrial4. Assim, pacientes com doenças mitocondriais normalmente desenvolvem manifestações neurológicas precoces.
Atualmente, não há tratamentos disponíveis para crianças afetadas com doenças mitocondriais5. Um grande obstáculo para o desenvolvimento de medicamentos de doenças mitocondriais é a falta de modelos eficazes recapitulando o curso da doença humana6. Vários dos modelos animais atualmente estudados não apresentam os defeitos neurológicos presentes nos pacientes7. Assim, os mecanismos subjacentes à patologia neuronal das doenças mitocondriais ainda não são totalmente compreendidos.
Estudos recentes geraram iPSCs de pacientes afetados por doenças mitocondriais e usaram essas células para obter células neuronais específicas do paciente. Por exemplo, defeitos genéticos associados à doença mitocondrial, síndrome de Leigh, foram encontrados para causar aberrações em bioenergética celular8,9, síntese proteica10 e homeostase de cálcio9,11. Esses relatórios forneceram importantes pistas mecanicistas sobre o comprometimento neuronal que ocorre em doenças mitocondriais, abrindo caminho para a descoberta de medicamentos para essas doenças incuráveis12.
Culturas bidimensionais (2D), no entanto, não permitem a investigação da complexidade arquitetônica e da organização regional dos órgãos 3D13. Para isso, o uso de organoides cerebrais 3D derivados de iPSCs 14 específicos do paciente pode permitir que os pesquisadores obtenham informações importantes adicionais e, assim, ajudem a dissecar como as doenças mitocondriais impactam o desenvolvimento e a função do sistema nervoso15. Estudos que empregam organoides cerebrais derivados do IPSC para investigar doenças mitocondriais estão começando a descobrir os componentes neurodesenvolvimentista das doenças mitocondriais.
Organoides medulares portadores de mutações associadas à doença mitocondrial, encefalopatia mitocondrial, acidose láctica e síndrome de episódios semelhantes a acidente vascular cerebral (MELAS), apresentaram neurogênese defeituosa e diferenciação retardada do neurônio motor16. Organoides corticais derivados de pacientes com a doença mitocondrial, síndrome de Leigh, apresentaram tamanho reduzido, defeitos na geração de brotos epiteliais neurais e perda de arquitetura cortical17. Organoides cerebrais de pacientes com síndrome de Leigh mostraram que os defeitos da doença iniciam-se ao nível das células progenitoras neurais, que não podem se comprometer com o metabolismo mitocondrial, causando ramificação neuronal aberrante e morfogênese18. Assim, os progenitores neurais podem representar um alvo terapêutico celular para doenças mitocondriais, e estratégias que promovam sua função mitocondrial podem apoiar o desenvolvimento funcional do sistema nervoso.
O uso de organoides cerebrais pode ajudar a descobrir os componentes neurodesenvolvimentos de doenças mitocondriais. As doenças mitocondriais são consideradas principalmente como neurodegeneração de início precoce5. No entanto, defeitos neurodesenvolvimentais também estão presentes em pacientes afetados por doenças mitocondriais, incluindo atraso no desenvolvimento e comprometimento cognitivo19. Organoides cerebrais específicos do paciente podem ajudar a abordar esses aspectos e elucidar como doenças mitocondriais podem afetar o desenvolvimento cerebral humano. A disfunção mitocondrial também poderia desempenhar um papel patogênico em outras doenças neurológicas mais comuns, como a doença de Alzheimer, a doença de Parkinson e a doença de Huntington4. Assim, elucidar o impacto dos defeitos mitocondriais no neurodesenvolvimento usando organoides cerebrais também pode ser fundamental para o estudo dessas doenças. Este artigo descreve um protocolo detalhado para a geração de organoides cerebrais reprodutíveis que podem ser usados para a condução da modelagem de doenças mitocondriais.
Protocolo
NOTA: O uso de iPSCs humanos pode exigir uma aprovação ética. Os iPSCs utilizados neste estudo foram derivados de indivíduos de controle saudável após aprovação ética local (#2019-681). Todos os procedimentos de cultura celular devem ser realizados sob uma capa de cultura celular estéril, desinfetando cuidadosamente todos os reagentes e consumíveis antes de serem transferidos sob o capô. Os iPSCs humanos usados para diferenciação devem ter um número de passagem abaixo de 50 para evitar possíveis aberrações genômicas que podem ocorrer após uma cultura extensiva. O estado pluripotente das células deve ser validado antes da geração organoide, por exemplo, monitorando a expressão de marcadores associados à pluripotência, como NANOG ou OCT4. Os testes de mycoplasma devem ser realizados semanalmente para garantir culturas livres de mycoplasma.
1. Geração de organoides cerebrais
- Cultura dos iPSCs humanos
- Cultura iPSCs humanos em condições livres de alimentadores em meio iPSC (ver a Tabela de Materiais) em placas revestidas de 6 poços e mantê-los em uma incubadora de cultura de tecido umidificado a 37 °C e 5% de CO2.
NOTA: O transporte de células alimentador pode dificultar a diferenciação organoide. Passagem as células pelo menos uma vez em condições livres de alimentadores. - Passar os iPSCs a 80% de confluência utilizando meio de desprendimento sem enzimas em proporções que variam de 1:4 a 1:12. Para aumentar a sobrevida celular, adicione 10 μM inibidor de proteínas associadas a Rho (ROCK) (Y27632) após cada divisão.
- Cultura iPSCs humanos em condições livres de alimentadores em meio iPSC (ver a Tabela de Materiais) em placas revestidas de 6 poços e mantê-los em uma incubadora de cultura de tecido umidificado a 37 °C e 5% de CO2.
- Dissociar os iPSCs (80% de confluência)-Dia 0.
- Prepare o Meio de Diferenciação Cortical I (CDMI) (Tabela 1). Meio de IMC pré-guerra à temperatura ambiente (22-25 °C) antes de adicioná-lo às células.
- Lave os poços que contêm os iPSCs com soro fisiológico tamponado de fosfato (PBS) para remover células mortas e detritos.
- Adicione 500 μL de Reagente Pré-caçado A (Tabela de Materiais) a cada poço e incubar por 5 min a 37 °C. Verifique sob o microscópio para garantir o desprendimento celular.
- Adicione 1 mL de meio iPSC para diluir o reagente A para neutralizar sua atividade.
- Use uma pipeta de 1000 μL para dissociar as células, pipetando para cima e para baixo e transfira a suspensão celular para um tubo de centrífuga de 15 mL.
- Centrifufique suavemente os iPSCs a 125 x g por 5 min a temperatura ambiente (22-25 °C).
- Aspire cuidadosamente o supernatante para evitar perturbar a pelota celular.
- Resuspende a pelota com 1 mL de CDMI para obter uma suspensão unicelular e conte o número do celular.
- Prepare o meio de semeadura com 9.000 iPSCs por 100 μL em CDMI suplementado com 20 μM inibidor de ROCHA, inibidor de 3 μM WNT-catenin (IWR1) e 5 μM SB431542.
- Adicione 100 μL de meio de semeadura por poço a uma placa de fundo v de 96 poços.
- Mantenha a placa em uma incubadora de cultura de tecido umidificado a 37 °C e 5% de CO2.
- Geração da neurosfera
- No primeiro dia, observe que agregados de células redondas (neuroferas) com bordas lisas definidas estão se formando. Note as células mortas ao redor dos agregados. Continue a cultura na incubadora a 37 °C e 5% de CO2.
- No dia 3, agitar a placa tocando nas laterais três vezes para desacopar células mortas.
- Adicione 100 μL de CDMI suplementado com inibidor de ROCK de 20 μM, 3 μM IWR1 e 5 μM SB431542 para cada poço.
- Devolva a placa à incubadora a 37 °C e 5% de CO2.
- No dia 6, remova cuidadosamente 80 μL do meio sobrenante de cada poço. Evite tocar na parte inferior do poço.
- Adicione 100 μL de CDMI suplementado com 3 μM IWR1 e 5 μM SB431542 a cada poço. Devolva a placa à incubadora a 37 °C e 5% de CO2.
- Repita os passos 5 e 6 a cada 3 dias até o dia 18.
- Transferência de neurosferas
- No dia 18, prepare o Cortical Diferenciação Médio II (CDMII) (Tabela 1) e adicione 10 mL a uma placa de cultura celular de apego ultra-baixa de 100 mm.
- Use uma pipeta de 200 μL com a ponta cortada para transferir as neurosferas redondas da placa de 96 poços para a placa de cultura celular de 100 mm ultra-baixa.
NOTA: Seja gentil para evitar danificar as neurosferas, certificando-se de que a abertura da ponta é ampla o suficiente e que os agregados não são aspirados muito rapidamente. - Remova 5 mL de meio da placa contendo as neurosferas e adicione 5 mL de CDMII fresco.
NOTA: Este procedimento ajuda a reduzir a quantidade de meio CDMI que pode ter sido transportada a partir da transferência de neuroesferas. - Coloque a placa em um agitador orbital a 70 rpm dentro de uma incubadora de cultura de tecido umidificado a 37 °C e 5% de CO2.
NOTA: Inspecione visualmente as neurosferas no dia seguinte. Aumente a velocidade do agitador orbital se as neurosferas forem agrupadas ou anexadas à parte inferior da placa. - A cada 3 dias, aspire cuidadosamente o meio supernante e substitua-o por CDMII fresco. Deixe uma pequena quantidade do meio para evitar que as neurosferas sequem.
- No dia 35, prepare o Meio de Diferenciação Cortical III (CDMIII) (Tabela 1).
NOTA: O componente da matriz deve ser dissolvido em CDMIII frio. - Aspire o meio da placa e adicione 10 mL de CDMIII frio.
NOTA: É mais eficaz usar meio frio para que o componente matricial possa revestir os organoides sem formar aglomerados. - Depois de mudar o meio, coloque a placa de volta em um agitador orbital a 70 rpm dentro de uma incubadora de cultura de tecido umidificado a 37 °C e 5% de CO2.
- Alterar o meio a cada 3-5 dias dependendo da taxa de crescimento, conforme indicado pela cor do meio.
- No dia 70, prepare o Meio de Diferenciação Cortical IV (CDMIV) (Tabela 1). Use o meio CDMIV até que a idade desejada dos organoides seja atingida. Durante este período, mantenha a placa em um agitador orbital a 70 rpm dentro de uma incubadora de cultura de tecido umidificado (37 °C e 5% de CO2).
- Mude o meio a cada 3-5 dias, dependendo da taxa de crescimento.
2. Imunostaining de organoides cerebrais
- Preparação tecidual
- Prepare 4% de solução paraformaldeída (PFA) e coloque-a sob um capô de segurança.
NOTA: Use equipamentos de segurança pessoal ao manusear PFA. - Colete organoides cerebrais e transfira-os suavemente com uma pipeta pasteur de plástico pasteur de 3 mL para uma placa de 6 poços cheia de PFA.
NOTA: Use organoides com mais de 40 dias para permitir a visualização de estruturas com maior complexidade celular. - Mantenha os organoides na solução PFA por 1h à temperatura ambiente.
- Remova cuidadosamente o PFA com uma pipeta Pasteur de plástico de 3 mL e lave os organoides fixos três vezes usando PBS.
- Armazene os organoides fixos a 4 °C em PBS até que use mais.
- Prepare 4% de solução paraformaldeída (PFA) e coloque-a sob um capô de segurança.
- Preparação de fatias organoides cerebrais
- Prepare uma solução de ágar de 3% e aqueça lentamente até liquefeito.
- Coloque o molde (a extremidade cortada de uma seringa de 10 mL) em um pedaço de papel filtro absorvente (lado liso para cima). Coloque uma gota de ágar sobre ele.
- Retire rapidamente um único organoide da placa de 6 poços com uma espátula e remova o PBS excessivo com papel filtro.
NOTA: Tenha cuidado para não tocar diretamente no organoide com papel filtro. - Coloque o organoide na gota de ágar.
- Repita este procedimento com até três organoides.
NOTA: Trabalhe rápido para evitar a solidificação do ágar durante esta etapa. - Reabastecer o molde com ágar até que todos os organoides estejam totalmente cobertos.
- Aguarde até que o ágar comece a solidificar e, em seguida, transfira suavemente todo o molde contendo os organoides, incluindo o papel do filtro absorvente, em um elemento de resfriamento.
NOTA: Se um elemento de resfriamento não estiver disponível, armazene os organoides por alguns minutos em uma geladeira a 4 °C. - Enquanto isso, prepare-se para o procedimento de corte: coloque uma lâmina de barbear (limpa com acetona e lavada com água dupla destilada) no suporte do vibratome, monte no banho e encha-a com PBS.
- Remova o molde do ágar (solidificado) e use um bisturi para aparar para formar um cubo.
- Conecte o cubo de ágar contendo os organoides na placa portadora do vibratome com gel adesivo (veja a Tabela de Materiais), e coloque-o no banho contendo PBS.
- Ajuste o vibratome (ver a Tabela de Materiais) para cortar fatias a uma espessura de 150 μm.
NOTA: As configurações de vibratome (ângulo adequado, amplitude, frequência e velocidade da lâmina) podem ser semelhantes às usadas para cortar tecido cerebral fixo derivado de animais pós-natais precoces. No entanto, as configurações ideais dependem fortemente do tipo do vibratome e devem ser determinadas em um primeiro passo para evitar distorções ou até mesmo rasgar o tecido durante o corte. - Inicie o procedimento de corte. Use uma pipeta de vidro ou uma espátula para transferir suavemente cada fatia recém-cortada em uma placa de 24 poços cheia de PBS.
- Armazene a placa contendo fatias a 4 °C (por até alguns dias) até que seja mais processamento.
- Transfira as fatias para fora da placa com uma pipeta de vidro ou uma espátula em slides de microscópio. Use um mínimo de 2 fatias por slide.
- Remova cuidadosamente o ágar e o excesso de PBS com uma seringa.
- Deixe as fatias secarem até que aderam aos slides.
NOTA: Enquanto os slides do microscópio podem ser armazenados em câmaras plásticas cheias de PBS a 4 °C, elas devem ser manchadas o mais rápido possível após o procedimento de corte.
- Coloração imunohistoquímica
- Prepare a solução de bloqueio (Tabela 1).
- Use uma caneta PAP para desenhar uma borda hidrofóbica ao redor das fatias no slide para ajudar a manter todas as soluções nos slides.
- Adicione cuidadosamente a solução de bloqueio no slide e incubar por 1h à temperatura ambiente (22-25 °C). Para evitar destruir o tecido, não adicione a solução diretamente em cima das fatias.
- Aspire a solução de bloqueio e aplique o anticorpo primário desejado diluído na solução de bloqueio.
- Incubar o slide durante a noite em uma câmara umidificada a 4 °C.
- Enxágüe o slide três vezes com 1x PBS por 10 minutos cada.
- Incubar as fatias com o anticorpo secundário específico diluído na solução de bloqueio e realizar a coloração hoechst (1:2.500) por 1 h à temperatura ambiente no escuro.
NOTA: Lembre-se de realizar controles negativos para confirmar que não há vinculação não específica ou auto-fluorescência. - Enxágüe três vezes com 1x PBS por 10 min cada no escuro.
- Adicione uma gota de meio de montagem à fatia, coloque uma mancha de cobertura na borda da gota e coloque lentamente a tampa em direção à fatia para evitar bolhas de ar.
- Deixe o slide descansar durante a noite em temperatura ambiente. Aplique esmalte na borda do deslizamento para selar ainda mais o slide. Para armazenamento a longo prazo, armazene a 4 °C.
- Documentação de coloração
- Para digitalizar imagens grandes para costura, utilize um microscópio motorizado de campo largo ereto equipado com (ver a Tabela de Materiais para obter detalhes) um objetivo de alta qualidade; Conjunto de filtro DAPI (por exemplo, excitação (EX): 340-380 nm, espelho dicroico (DM): 400 nm, filtro de barreira (BA): 435-485 nm); conjunto de filtro isothiocyanato fluoresceína (por exemplo, EX: 465-495 nm, DM: 505 nm, BA: 515-555 nm); Conjunto de filtros Alexa594 (por exemplo, ET 575/40; T 600 LPXR; HC 623/24); câmera digital; software de aquisição de alto desempenho que permite costuras automatizadas e operações de pilha.
- Para o manuseio de imagens, use um programa de processamento de imagem capaz de gerar arquivos de tif de 8 bits, pontos de corte, ajustar contraste e brilho, mesclar os canais (por exemplo, azul, verde e vermelho) e adicionar barras de escala.
- Para digitalizar detalhes, use um microscópio de varredura a laser confocal motorizado equipado com um objetivo de alta qualidade, um laser UV (EX: 408 nm), um laser argon (EX: 488 nm), um laser Hélio-Neon (EX: 543), software de imagem para um microscópio confocal.
- Para o manuseio de imagens de detalhes, use um programa de processamento de imagens capaz de gerar projeções de intensidade máxima de pilhas z confocal (por exemplo, seções ópticas de 0,6 μm cada), gerando arquivos de tif de 8 bits, ajustando contraste e brilho, mesclando os canais (por exemplo, azul, verde e vermelho), adicionando barras de escala.
- Use um editor gráfico para organizar as figuras.
3. Perfil bioenergético de organoides cerebrais
- Preparação de organoides para perfil bioenergetic
- Prepare a solução papain e DNase seguindo o protocolo do fabricante.
- Transfira 3-5 organoides em uma placa de 6 poços. Lave-os duas vezes com PBS pré-armado.
- Adicione 2 mL de solução de papain ativado pré-armado contendo DNase. Usando uma lâmina, corte os organoides em pequenos pedaços.
- Coloque a placa em um agitador orbital a 27 rpm dentro de uma incubadora de cultura celular (a 37 °C, 5% de CO2) e incubar por 15-20 min.
NOTA: O tempo de incubação depende do estágio organoide. Organoides em estágio inicial podem ser usados como são. Para organoides com mais de 3 meses, recomenda-se cortar os organoides em 2-3 peças antes da dissociação e incubar as peças a uma velocidade de balanço a 27 rpm por 15-20 min a 37 °C. Este procedimento pode ajudar a remover tecido necrosado que pode estar presente nos organoides em estágio posterior. - Colete os tecidos digeridos em um tubo de 15 mL e adicione 5 mL de cultura organoide meio CDMIV (Tabela 1).
- Triturar o tecido com uma pipeta de plástico de 10 mL por pipetar para cima e para baixo 10-15 vezes. Deixe o tecido não dissociado se acalmar até o fundo do tubo.
- Transfira cuidadosamente a suspensão celular para um tubo de 15 mL, evitando quaisquer pedaços de tecido não dissociado. Filtre a solução através de um coador de células de 40 μm (por exemplo, tubos de fundo redondo de poliestireno com tampas de coador de células).
- Pelota as células por centrifugação a 300 x g por 5 min a temperatura ambiente.
- Avalie o número do celular e a qualidade usando o azul trypan.
- Emplaque o número desejado (~20.000/bem) das células em microplacos revestidos de 96 poços. Altere o médio 6-8 h após o revestimento para o meio neuronal (Tabela 1).
- Incubar a microplaca revestida de 96 poços em uma incubadora de CO2 (37 °C, 5% de CO2) durante 4 dias.
- Perfil bioenergésico
- No dia 3, após a replação das células dissociadas, adicione 200 μL de solução de calibração em cada poço da parte inferior da micropla placa de 96 poços, e coloque o cartucho de sensor verde superior sobre a microplacão hidratada.
NOTA: Coloque o cartucho do sensor em cima da microplacão na orientação correta e certifique-se de que a solução calibrante cubra todos os sensores. - Incubar a microplaca hidratada de 96 poços em uma incubadora não-CO2 a 37 °C durante a noite.
- Ligue o analisador para permitir que o instrumento se estabilize a 37 °C durante a noite.
- No dia 4, após a replação, inspecione a cultura organoide desassociada na microplacão de 96 poços sob o microscópio para garantir que as células apareçam como uma monocamada confluente.
- Prepare o médium de ensaio (Tabela 1).
- Remova o meio neuronal de todos os poços com uma pipeta sem tocar na parte inferior do poço para evitar danos celulares. Alternativamente, inverta cuidadosamente toda a placa e depois seque-a em papel limpo. Trabalhe rápido para evitar a morte celular.
- Lave as células duas vezes com 200 μL pré-armados de Assay Medium. Adicione o Assay Medium a um volume final de 180 μL por poço. Incubar a microplaca de 96 poços em uma incubadora não-CO2 a 37 °C por 1 h.
- Prepare 10 soluções μM de inibidores mitocondriais no meio Assay. Note que a concentração final após a injeção é de 1 μM.
- Carregue o cartucho do sensor colocado na microplacão hidratada com soluções 10x dos inibidores mitocondriais.
- Adicione 18 μL de inibidor mitocondrial 1 na porta A.
- Adicione 19,8 μL de inibidor mitocondrial 2 na porta B.
- Adicione 21,6 μL de inibidor mitocondrial 2 na porta C.
- Adicione 23,4 μL de inibidor mitocondrial 3 na porta D.
- Coloque o cartucho carregado na microplaca hidratada em uma incubadora não-CO2 a 37 °C até o início do ensaio.
- Configure um protocolo de execução no software do instrumento (Tabela 2).
- Pressione start. Pegue o cartucho carregado da incubadora não-CO2 e coloque-o no analisador para calibração.
NOTA: Certifique-se de que a placa está inserida na orientação correta e sem a tampa. - Quando a etapa de calibração terminar, remova a placa de calibração. Pegue a microplaca de 96 poços da incubadora não-CO2 e coloque-a no analisador. Clique em CONTINUAR para iniciar as medições.
- Quando a corrida estiver concluída, remova a microplacão de cultura celular de 96 poços do analisador e colete o meio de todos os poços sem perturbar as células.
NOTA: O meio pode ser armazenado a -20 °C e usado posteriormente para medir a quantidade de lactato liberado pelas células no meio usando um kit de ensaio de lactato apropriado. - Lave as células com 200 μL de 1x PBS em cada poço.
- Depois de remover o PBS, congele a placa a -20 °C.
NOTA: A placa congelada pode ser usada para quantificar células, proteínas ou DNA em cada poço da microplacão. Essa quantificação será necessária para normalizar as taxas bioenergéticas obtidas. Siga as instruções do fabricante para ensaios de quantificação celular, proteína ou DNA.
- No dia 3, após a replação das células dissociadas, adicione 200 μL de solução de calibração em cada poço da parte inferior da micropla placa de 96 poços, e coloque o cartucho de sensor verde superior sobre a microplacão hidratada.
Resultados
O protocolo aqui descrito facilita a geração robusta de organoides redondos (Figura 1A). Os organoides gerados contêm neurônios maduros que podem ser visualizados usando marcadores proteicos específicos para axônios (SMI312) e dendritos (proteína associada a microtúbulos 2 (MAP2)) (Figura 1B). Os organoides maduros contêm não apenas células neuronais (MAP2 positivos), mas também células gliais (por exemplo, positivas para o marcador de astrócito S100 proteína de ligação de cálcio B (S100ß)) (Figura 1B).
Analisando organoides cerebrais fatiados usando microscopia confocal, é possível identificar e monitorar a distribuição detalhada e organização de diferentes tipos celulares e estruturas celulares. Isso poderia fornecer uma nova visão de como as doenças mitocondriais podem afetar o desenvolvimento do sistema nervoso. Por exemplo, é possível monitorar axônios neuronais (SMI312-positivo) e dendritos (MAP2-positivo) (Figura 2A) ou a ocorrência mútua de células neuronais (MAP2-positivo) e células gliais (S100ß-positivo) (Figura 2A). As imagens confocal também podem ajudar a investigar com mais detalhes a distribuição e organização de progenitores neurais ((região determinante de sexo Y) box-2 (SOX2)-positive) em relação aos neurônios (beta-III tubulin (TUJ1)-positivo) (Figura 2B). Finalmente, os organoides cerebrais podem ser manchados para marcadores específicos de mitocôndrias (como a proteína da membrana mitocondrial externa, translocase da subunidade de membrana externa 20 kDa (TOM20)) (Figura 2C).
O protocolo descrito permite que os pesquisadores realizem o perfil bioenergésico de organoides cerebrais. Utilizando este procedimento, é possível medir tanto o metabolismo mitocondrial usando a taxa de consumo de oxigênio (OCR) (Figura 2D) quanto o metabolismo glicóltico usando a taxa de acidificação extracelular (ECAR) (Figura 2E). O perfil bioenergésico permite monitorar como as células podem modificar seus perfis de OCR e ECAR em resposta a uma administração sequencial de inibidores mitocondriais.
Primeiro, o inibidor de synthase ATP, oligomicina, pode ser aplicado. A oligomicina causa uma queda no perfil OCR (Figura 2D) e, portanto, identifica o OCR necessário para a produção de ATP. Após o tratamento da oligomiecina, também pode haver um aumento compensatório no ECAR (Figura 2E), sugerindo que as células podem aumentar a glicólise para evitar o estresse metabólico causado pela redução do metabolismo mitocondrial. A subsequente dupla aplicação do ionóforo de próton, cianeto carbonil-p-trifluorometotoxyphenylhydrazon (FCCP), causa a perda do potencial da membrana mitocondrial. Como as moléculas de oxigênio estão agora livres para se mover, isso causa um rápido aumento no OCR (Figura 2D).
Essas alterações no perfil OCR identificam a capacidade máxima de respiração das células. A administração final de rotenona mais antimicina A causa um bloco do transporte de elétrons e, portanto, uma diminuição acentuada do OCR (Figura 2D). O ECAR pode apresentar flutuação após o tratamento com FCCP e rotenona mais antimicina A (Figura 2E),dependendo da capacidade glicolírica residual das células. Os perfis de OCR e ECAR podem ser drasticamente alterados em organoides cerebrais derivados de pacientes mitocondriais.
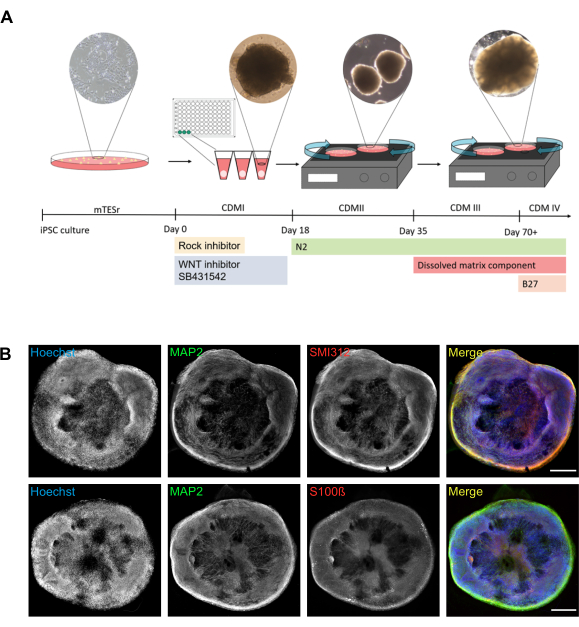
Figura 1: Geração de organoides cerebrais a partir de iPSCs humanos. (A) Representação esquemática do protocolo usado para produzir organoides cerebrais com imagens de transmissão correspondentes. O dia 0 corresponde à dissociação de iPSCs e semeadura em uma placa de 96 poços com fundo V usando CDMI suplementado com um inibidor de ROCHA, um inibidor WNT e SB431542. No dia 18, as neurosferas são transferidas das placas de 96 poços para pratos de cultura celular de 100 mm com CDMII complementado com N2. A partir deste ponto, as culturas estão posicionadas em um agitador orbital. No dia 35, o meio é trocado de CDMII para CDMIII, que também contém um componente de matriz dissolvido (Tabela 1). A partir do dia 70, o CDMIII é trocado para CDMIV complementado com B27. Uma imagem representativa da neurosfera foi tirada no dia 12 usando uma câmera de microscópio com ampliação de 10x. Uma imagem organoide inicial foi tirada no dia 22 usando uma câmera de microscópio na ampliação de 4x. Uma imagem organoide madura foi tirada no dia 40 usando uma câmera de microscópio com ampliação 4x. (B) A estrutura geral e a organização celular dos organoides cerebrais podem ser visualizadas por meio de microscopia de campo largo. Imagens de campo largo costuradas representativas são mostradas para visualizar as relações entre dendritos (MAP2 positivo) e axônios (SMI312-positivo), e entre células neuronais (MAP2-positivo) e astrócitos presumidos (S10ß-positivo). As células foram contra-manchadas com Hoechst para revelar os núcleos. Todas as imagens foram tiradas usando organoides cerebrais de 78 dias. A coluna direita mostra a sobreposição de três canais (mesclagem). Barras de escala = 500 μm. Abreviaturas: iPSC = célula-tronco pluripotente induzida; MDL = Meio de Diferenciação Cortical; ROCK = Rho quinase; MAP2 = proteína associada a microtúbulos 2; S100ß= S100 proteína de ligação de cálcio B. Clique aqui para ver uma versão maior desta figura.

Figura 2: Visualização e perfil bioenergésico de organoides cerebrais para modelagem de doenças mitocondriais. A organização detalhada e arquitetura dos organoides podem ser analisadas por meio de microscopia confocal. Todas as imagens foram tiradas usando organoides cerebrais de 78 dias de idade e contra-manchadas com Hoechst para revelar os núcleos. A coluna direita mostra a sobreposição de três canais (mesclagem). Barras de escala = 50 μm. (A) Projeções representativas de foco estendido (44-48 planos ópticos, 0,6 μm cada) abordando a interação entre dendritos (MAP2 positivos, pontas de flecha) e axônios (SMI312-positivo, setas) e entre células neuronais (MAP2-positivo, pontas de flecha) e astrócitos presumidos (S100ß-positivo, setas). (B) Projeções representativas de foco estendido (14-31 planos ópticos, 0,6 μm cada) mostrando a distribuição de neurônios (TUJ1-positivo, pontas de flecha) em relação aos progenitores neurais (SOX2-positivos, flechas). (C) Projeções representativas de foco estendido (20 planos ópticos, 0,6 μm cada) mostrando a distribuição dentro de neurônios (TUJ1-positivo, pontas de flecha) de mitocôndrias (visualizadas usando anticorpos contra a proteína da membrana mitocondrial externa TOM20, setas). (D) A respiração mitocondrial de organoides cerebrais pode ser monitorada com base no perfil do OCR após a administração sequencial de diferentes inibidores mitocondriais (ver texto para detalhes). (E) A atividade glicolylítica dos organoides cerebrais pode ser monitorada com base no ECAR sobre a administração sequencial de inibidores mitocondriais (ver texto para detalhes). Para o perfil bioenergésico, aproximadamente 10-15 organoides cerebrais foram dissociados para obter células suficientes para replacar na microplacão de 96 poços. As barras indicam as SEMs com base nos resultados obtidos em dois experimentos independentes. Abreviaturas: MAP2 = proteína associada a microtúbulos 2; S100ß = S100 proteína de ligação de cálcio B; TUJ1 = tubulina beta-III; SOX2 = (região determinante do sexo Y) caixa-2; TOM20 = translocase da subunidade de membrana externa 20 kDa; OCR = taxa de consumo de oxigênio; ECAR = taxa de acidificação extracelular; Oligom. = oligomicina; FCCP = cianeto carbonil-p-trifluorometotoxifenilhydrazon; R = rotenona; AntA = Antimicina A; SEMs = erro padrão de meios. Clique aqui para ver uma versão maior desta figura.
| Composição de mídia | |||
| CDMI (Dia 0-18) | Conc final. | ||
| Glasgow-MEM | Gibco | 11710-035 | [1:1] |
| Substituição de soro de nocaute (KSR) | Gibco | 10828010 | 20% |
| MEM-NEAA (solução de aminoácido não essencial mem) | Gibco | 11140-050 | 0,1 mM |
| Piruvato de Sódio | Gibco | 11360070 | 1 mM |
| 2-mercaptetanol | Gibco | 31350-010 | 0,1 mM |
| Penicilina e estreptomicina | Gibco | 15140-122 | 100 U/mL e 100 μg/mL |
| CDMII (Dia 18-35) | Conc final. | ||
| DMEM/F12 | Gibco | 31330038 | [1:1] |
| Glutamax | Gibco | 35050-061 | 2 mM |
| Suplemento N-2 (100x) | Gibco | 17502-048 | 1% |
| Concentrado lipídedo quimicamente definido | Gibco | 11905031 | 1% |
| Penicilina e estreptomicina | Gibco | 15140-122 | 100 U/mL e 100 μg/mL |
| CDMIII (Dia 35-70) | Conc final. | ||
| DMEM/F12 | Gibco | 31330038 | [1:1] |
| Glutamax | Gibco | 35050-061 | 2 mM |
| Suplemento N-2 (100x) | Gibco | 17502-048 | 1% |
| Concentrado lipídedo quimicamente definido | Gibco | 11905031 | 1% |
| Penicilina e estreptomicina | Gibco | 15140-122 | 100 U/mL e 100 μg/mL |
| Soro Bovino Fetal (FBS) | Gibco | 10270-106 | 10% |
| Heparina | Merck | H3149-25KU | 5 μg/mL |
| Matrigel | Corning | 356231 | 1% |
| CDMIV (Dia 70+) | Conc final. | ||
| DMEM/F12 | Gibco | 31330038 | [1:1] |
| Glutamax | Gibco | 35050-061 | 2 mM |
| Suplemento N-2 (100x) | Gibco | 17502-048 | 1% |
| Concentrado lipídedo quimicamente definido | Gibco | 11905031 | 1% |
| Penicilina e estreptomicina | Gibco | 15140-122 | 100 U/mL e 100 μg/mL |
| Soro Bovino Fetal (FBS) | Gibco | 10270-106 | 10% |
| Heparina | Merck | H3149-25KU | 5 μg/mL |
| Matrigel | Corning | 356231 | 2% |
| Suplemento B-27 com Vitamina A 50x | Gibco | 17504044 | 2% |
| Meio Neuronal | Conc final. | ||
| DMEM/F12 | Gibco | 31330038 | [1:1] |
| Suplemento N-2 | Gibco | 17502048 | [1x] |
| Suplemento B-27 com vitamina A 50x | Gibco | 17504044 | [1x] |
| Ácido L-Ascórbico | Sigma Aldrich | A92902 | [200 μM] |
| db-cAMP (monofosfato de adenosina cíclica dibutílico) | Sigma Aldrich | D0627 | 500 μM |
| BDNF (fator neutrófico derivado do cérebro) | MACS Miltenyi | 130-093-811 | [10 ng/mL] |
| GDNF (fator neurotrófico derivado da linha celular glial) | MACS Miltenyi | 130-096-290 | [10 ng/mL] |
| TGF-β3 humano (transformando fator de crescimento-beta3) | MACS Miltenyi | 130-094-007 | [1 ng/mL] |
| Meio de ensaio | Conc final. | ||
| Cavalo marinho XF DMEM meio | Biociência de cavalos marinhos | 103680-100 | 500 mL |
| Piruvato de Sódio | Gibco | 11360070 | 1 mM |
| L-Glutamina | Rio Lonza | BEBP17-605E | 2 mM |
| Glicose | Sigma Aldrich | 50-99-7 | 10 mM |
| Solução de bloqueio | Conc final. | ||
| PBS-Tween | [1:1] 0,1% Tween | ||
| Soro de Burro | Sigma Aldrich | D9663 | 10% |
| Tritão-X | Merck | X100-5ML | 1% |
Tabela 1: Detalhes das mídias e soluções utilizadas para a geração organoide.
| Inicialização | Linha de base (X3) | Injeção de oligomicina (X3) | Injeção de FCCP (X3) | Injeção de FCCP (X3) | Anti A + Rot Injection (X3) |
| Calibrar | Misturar | Misturar | Misturar | Misturar | Misturar |
| (04:00) | (04:00) | (04:00) | (04:00) | (04:00) | |
| Equilíbrio (12:00) | Esperar | Esperar | Esperar | Esperar | Esperar |
| (02:00) | (02:00) | (02:00) | (02:00) | (02:00) | |
| Medida (03:00) | Medida (03:00) | Medida (03:00) | Medir | Medida (03:00) | |
| (03:00) |
Tabela 2: Configuração do protocolo para perfil bioenergésico. Descrição das etapas e seu comprimento em minutos usando o software Seahorse Wave Desktop. Abreviaturas: FCCP = cianeto carbonil-p-trifluorometotoxifenilhidrazon; Rotenona = rotenona; Anti A = Antimicina A.
Discussão
Este artigo descreve a geração reprodutível de organoides cerebrais derivados do iPSC humanos e seu uso para modelagem de doenças mitocondriais. O protocolo descrito aqui é modificado com base em um trabalho publicado anteriormente20. Uma grande vantagem do presente protocolo é que ele não requer a incorporação manual de cada organoide em uma matriz de andaimes. Na verdade, a solução matricial é simplesmente dissolvida no meio da cultura celular. Além disso, não há necessidade de empregar bioreatores caros, pois os organoides podem ser cultivados na cultura de tecido padrão de 6 poços posicionados em um agitador orbital dentro da incubadora. Este procedimento também permite o cultivo paralelo de várias placas contendo diferentes organoides derivados de várias linhas individuais, aumentando assim o throughput dos experimentos e permitindo o monitoramento de potenciais diferenças emergindo nos perfis de crescimento de diferentes organoides. Testamos este protocolo utilizando diferentes iPSCs derivados de controles saudáveis e indivíduos afetados por doenças mitocondriais, com resultados consistentes.
Para a modelagem da doença mitocondrial, é essencial usar diferentes marcadores para visualizar a morfologia e organização da rede mitocondrial. Este procedimento permite a investigação de se o número mitocondrial, a morfologia ou a distribuição podem ser alterados em organoides cerebrais derivados de pacientes com doenças mitocondriais. A presença e organização de progenitores neurais dentro dos organoides cerebrais pode ser de importância crucial para modelar distúrbios mitocondriais. Descobrimos recentemente que mutações que causam a doença mitocondrial, síndrome de Leigh, interrompem a arquitetura celular e a distribuição de células progenitoras neurais dentro de organoides cerebrais derivados do paciente18.
Para a realização de perfis bioenergésicos, adaptamos um método que foi descrito anteriormente para avaliar o bioenergético de células-tronco pluripotentes21. Um protocolo recente descreveu como realizar o perfil bioenergésico de organoides derivados de intestino delgado de camundongos, cólon humano e tumores colorretais22. No entanto, esses organoides são bastante pequenos comparados aos organoides cerebrais, e, portanto, um protocolo diferente, como o relatado aqui, é necessário para organoides cerebrais. Recentemente, utilizamos este protocolo para avaliar o perfil bioenergénico de organoides cerebrais humanos portadores de mutações no gene surfeit locus protein 1 (SURF1) que causa a grave doença mitocondrial, síndrome de Leigh18. Descobrimos que o perfil OCR é particularmente afetado nos organoides da síndrome de Leigh, como mostrado por uma diminuição significativa no nível basal de OCR, na taxa de produção do ATP e na taxa máxima de respiração18.
Em conclusão, apresentamos aqui um protocolo detalhado para a geração robusta de organoides cerebrais humanos e descrevemos como realizar experimentos que seriam importantes para a investigação dos mecanismos de doenças subjacentes às doenças mitocondriais. Os organoides cerebrais humanos também podem ser de importância crítica para elucidar a diversidade mitocondrial no cérebro humano e seu papel na saúde humana e doenças23. É importante esclarecer que os organoides cerebrais gerados com protocolos atualmente disponíveis, incluindo o descrito aqui, ainda possuem limitações. Entre elas, por exemplo, a falta de vascularização e a ausência de população de microglia24. Esses aspectos precisam ser levados em consideração para interpretar corretamente os resultados.
Por exemplo, a falta de vasculatura e microglia poderia limitar mecanismos compensatórios que podem estar em vigor in vivo. Os organoides cerebrais derivados do paciente podem, assim, apresentar defeitos mais fortes do que os observados em pacientes17,18. Além disso, apesar da reprodutibilidade geral deste protocolo20, pode-se observar heterogeneidade linha-a-linha. Para isso, ao realizar estudos de modelagem de doenças, é sempre importante quantificar sistematicamente a uniformidade do controle e dos organoides do paciente, avaliando os padrões de morfologia (tamanho, camada) e a distribuição de marcadores moleculares em diferentes organoides.
Finalmente, não é possível gerar organoides cerebrais a partir de um único iPSC, limitando a viabilidade do rastreamento genético em larga escala com CRISPR/Cas9. Dado o ritmo da pesquisa, é provável que algumas das limitações atuais do protocolo aqui descrito sejam superadas em breve. Protocolos otimizados serão disponibilizados. Esses modelos 3D de doenças mitocondriais permitirão, esperançosamente, a eventual descoberta de terapias implementáveis para doenças mitocondriais, prejudiciais, e para doenças incuráveis com necessidades médicas altamente não atendidas.
Divulgações
Os autores não declaram interesses financeiros ou não financeiros concorrentes.
Agradecimentos
Agradecemos a Miriam Bünning pelo apoio técnico. Reconhecemos o apoio da Deutsche Forschungsgemeinschaft (DFG) (PR1527/5-1 a A.P.), Spark e Berlin Institute of Health (BIH) (BIH Validation Funds to A.P.), the United Mitochondrial Disease Foundation (UMDF) (Leigh Syndrome International Consortium Grant to A.P.), University Hospital Duesseldorf (Forschungskommission UKD to A.P.), e o Ministério Federal alemão de Educação e Pesquisa (BMBF) (e: Bio jovem investigador conceder AZ 031L0211 a A.P.). O trabalho no laboratório da C.R.R. foi apoiado pelo DFG (FOR 2795 "Sinapses sob estresse", Ro 2327/13-1).
Materiais
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| Affinity Designer | Serif (Europe) Ltd | Layout software; Vector graphics editor | |
| Alexa Fluor 488 donkey anti-guinea pig | Sigma Aldrich | SAB4600033-250UL | 1:300 |
| Alexa Fluor 488 donkey anti-mouse | Thermo Fisher Scientific | A-31571 | 1:300 |
| Antimycin A | Sigma Aldrich | 1397-94-0 | |
| Anti-β-Tubulin III (TUJ-1) | Sigma Aldrich | T8578 | 1:2000 |
| Argon Laser | Melles Griot | Any other Laser, e.g., diode lasers emitting 488 is fine, too | |
| Ascorbic acid | Sigma | A92902 | |
| B-27 with Vitamin A | Gibco | 17504044 | |
| Bacto Agar | Becton Dickinson | 3% in PBS, store solution at -20 °C | |
| BDNF | Miltenyi Biotec | 130-093-0811 | |
| cAMP | Sigma | D0627 | |
| Cell Star cell culture 6 well plate | Greiner-Bio-One | 657160 | |
| Chemically Defined Lipid Concentrate | Gibco | 11905031 | |
| Confocal laser scanning microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement membrane matrix, Phenol Red-free, LDEV-free | Corning | 356231 | Matrix component |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher | C7026 | |
| DMEM/F12 | ThermoFisher | 31330038 | |
| DMSO | Sigma | D2660-100ML | |
| Donkey anti-goat Cy3 | Merck Millipore | AP180C | 1:300 |
| Donkey anti-mouse Cy3 | Merck Millipore | AP192C | 1:300 |
| Donkey anti-rabbit Cy3 | Merck Millipore | AP182C | 1:300 |
| DPBS | Gibco | 14190250 | |
| DS-Q1Mc camera | Nikon Microscope Solutions | ||
| Eclipse 90i upright widefield microscope | Nikon Microscope Solutions | ||
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse Ts2 Inverted Microscope | Nikon Microsope Solutions | ||
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| FCCP | Sigma Aldrich | 370-86-5 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| GDNF | Miltenyi Biotec | 130-096-291 | |
| Glasgow MEM | Gibco | 11710-035 | |
| Glass Pasteur pipette | Brand | 747715 | Inverted |
| Glutamax | Gibco | 35050-061 | |
| Helium-Neon Laser | Melles Griot | Every other Laser, e.g., diode lasers emitting 594 is fine, too | |
| Heparin | Merck | H3149-25KU | |
| HERACell 240i CO2 Incubator | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Invitrogen | H3570 | 1:2500 |
| Image J 1.53c | Wayne Rasband National Institute of Health | Image processing Software | |
| Injekt Solo 10 mL/ Luer | Braun | 4606108V | |
| Knockout Serum Replacement | Gibco | 10828010 | |
| Laser (407 nm) | Coherent | Any other Laser, e.g., diode lasers emitting 407 is fine, too | |
| Map2 | Synaptic Systems | No. 188004 | 1:1000 |
| Maxisafe 2030i | |||
| MEM NEAA | Gibco | 11140-050 | |
| mTeSR Plus | Stemcell Technology | 85850 | iPSC medium |
| Multifuge X3R Centrifuge | Thermo Scientific | 10325804 | |
| MycoAlert Mycoplasma Detection Kit | Lonza | # LT07-218 | |
| N2 Supplement | Gibco | 17502-048 | |
| Needle for single usage (23G x 1” TW) | Neoject | 10016 | |
| NIS-Elements Aadvanced Research 3.2 | Nikon | Imaging software | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Orbital Shaker Heidolph Unimax 1010 | Heidolph | 543-12310-00 | |
| PAP Pen | Sigma | Z377821-1EA | To draw hydrophobic barrier on slides. |
| Papain Dissociation System kit | Worthington | LK003150 | |
| Paraformaldehyde | Merck | 818715 | 4% in PBS, store solution at -20 °C |
| Pasteur pipette 7mL | VWR | 612-1681 | Graduated up to 3 mL |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Plan Apo VC 20x / 0.75 air DIC N2 ∞/0.17 WD 1.0 | Nikon Microscope Solutions | Dry Microscope Objective | |
| Plan Apo VC 60x / 1.40 oil DIC N2 ∞/0.17 WD 0.13 | Nikon Microscope Solutions | Oil Immersion Microscope Objective | |
| Polystyrene Petri dish (100 mm) | Greiner Bio-One | 664161 | |
| Polystyrene round-bottom tube with cell-strainer cap (5 mL) | Falcon | 352235 | |
| Potassium chloride | Roth | 6781.1 | |
| ProLong Glass Antifade Moutant | Invitrogen | P36980 | |
| Qualitative filter paper | VWR | 516-0813 | |
| Rock Inhibitior | Merck | SCM075 | |
| Rotenone | Sigma | 83-794 | |
| S100β | Abcam | Ab11178 | 1:600 |
| SB-431542 | Cayman Chemical Company | 13031 | |
| Scalpel blades | Heinz Herenz Hamburq | 1110918 | |
| SMI312 | Biolegend | 837904 | 1:500 |
| Sodium bicarbonate | Merck/Sigma | 31437-1kg-M | |
| Sodium chloride | Roth | 3957 | |
| Sodium dihydrogen phosphate | Applichem | 131965 | |
| Sodium Pyruvate | Gibco | 11360070 | |
| SOX2 | Santa Cruz Biotechnology | Sc-17320 | 1:100 |
| StemPro Accutase Cell Dissociation Reagent | Gibco/StemPro | A1110501 | Reagent A |
| Super Glue Gel | UHU | 63261 | adhesive gel |
| SuperFrost Plus | VWR | 631-0108 | |
| Syringe for single usage (1 mL) | BD Plastipak | 300015 | |
| TB2 Thermoblock | Biometra | ||
| TC Plate 24 Well | Sarstedt | 83.3922 | |
| TC Plate 6 Well | Sarstedt | 83.392 | |
| TGFbeta3 | Miltenyi Biotec | 130-094-007 | |
| Tissue Culture Hood | ThermoFisher | 51032711 | |
| TOM20 | Santa Cruz Biotechnology | SC-11415 | 1:200 |
| Triton-X | Merck | X100-5ML | |
| UltraPure 0.5M EDTA | Invitrogen | 15575020 | |
| Vibratome Microm HM 650 V | Thermo Scientific | Production terminated, any other adjustable microtome is fine, too. | |
| Vibratome Wilkinson Classic Razor Blade | Wilkinson Sword | 70517470 | |
| Whatman Benchkote | Merck/Sigma | 28418852 | |
| Wnt Antagonist I | EMD Millipore Corp | 3378738 | |
| XF 96 extracellular flux analyser | Seahorse Bioscience | 100737-101 | |
| XF Assay DMEM Medium | Seahorse Bioscience | 103680-100 | |
| XF Calibrant Solution | Seahorse Bioscience | 100840-000 | |
| XFe96 FluxPak (96-well microplate) | Seahorse Bioscience | 102416-100 |
Referências
- Koopman, W. J., Willems, P. H., Smeitink, J. A. Monogenic mitochondrial disorders. New England Journal of Medicine. 366 (12), 1132-1141 (2012).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Review Disease Primers. 2, 16080 (2016).
- Vafai, S. B., Mootha, V. K. Mitochondrial disorders as windows into an ancient organelle. Nature. 491 (7424), 374-383 (2012).
- Carelli, V., Chan, D. C. Mitochondrial DNA: impacting central and peripheral nervous systems. Neuron. 84 (6), 1126-1142 (2014).
- Russell, O. M., Gorman, G. S., Lightowlers, R. N., Turnbull, D. M. Mitochondrial diseases: hope for the future. Cell. 181 (1), 168-188 (2020).
- Weissig, V. Drug development for the therapy of mitochondrial diseases. Trends in Molecular Medicine. 26 (1), 40-57 (2020).
- Tyynismaa, H., Suomalainen, A. Mouse models of mitochondrial DNA defects and their relevance for human disease. EMBO Reports. 10 (2), 137-143 (2009).
- Ma, H., et al. Metabolic rescue in pluripotent cells from patients with mtDNA disease. Nature. 524 (7564), 234-238 (2015).
- Galera-Monge, T., et al. Mitochondrial dysfunction and calcium dysregulation in Leigh syndrome induced pluripotent stem cell derived neurons. International Journal of Molecular Science. 21 (9), 3191 (2020).
- Zheng, X., et al. Alleviation of neuronal energy deficiency by mTOR inhibition as a treatment for mitochondria-related neurodegeneration. Elife. 5, 13378 (2016).
- Lorenz, C., et al. Human iPSC-derived neural progenitors are an effective drug discovery model for neurological mtDNA disorders. Cell Stem Cell. 20 (5), 659-674 (2017).
- Inak, G., et al. Concise review: induced pluripotent stem cell-based drug discovery for mitochondrial disease. Stem Cells. 35 (7), 1655-1662 (2017).
- Chiaradia, I., Lancaster, M. A. Brain organoids for the study of human neurobiology at the interface of in vitro and in vivo. Nature Neuroscience. 23 (12), 1496-1508 (2020).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocol. 9 (10), 2329-2340 (2014).
- Liput, M., et al. Tools and approaches for analyzing the role of mitochondria in health, development and disease using human cerebral organoids. Developmental Neurobiology. , (2021).
- Winanto, K. Z. J., Soh, B. S., Fan, Y., Ng, S. Y. Organoid cultures of MELAS neural cells reveal hyperactive Notch signaling that impacts neurodevelopment. Cell Death and Disease. 11 (3), 182 (2020).
- Romero-Morales, A. I., et al. Human iPSC-derived cerebral organoids model features of Leigh Syndrome and reveal abnormal corticogenesis. bioRxiv. , (2020).
- Inak, G., et al. Defective metabolic programming impairs early neuronal morphogenesis in neural cultures and an organoid model of Leigh syndrome. Nature Communications. 12 (1), 1929 (2021).
- Falk, M. J. Neurodevelopmental manifestations of mitochondrial disease. Journal of Developmental & Behavioral Pediatrics. 31 (7), 610-621 (2010).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Pfiffer, V., Prigione, A. Assessing the bioenergetic profile of human pluripotent stem cells. Methods in Molecular Biology. 1264, 279-288 (2015).
- Ludikhuize, M. C., Meerlo, M., Burgering, B. M. T., Colman, R. M. J. Protocol to profile the bioenergetics of organoids using Seahorse. STAR Protocols. 2 (1), 100386 (2021).
- Menacho, C., Prigione, A. Tackling mitochondrial diversity in brain function: from animal models to human brain organoids. International Journal of Biochemestry & Cell Biology. 123, 105760 (2020).
- Del Dosso, A., Urenda, J. P., Nguyen, T., Quadrato, G. Upgrading the physiological relevance of human brain organoids. Neuron. 107 (6), 1014-1028 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados