Method Article
جيل من الأعضاء الدماغ البشري لنمذجة مرض الميتوكوندريا
In This Article
Summary
نحن نصف بروتوكول مفصل لتوليد الخلايا الجذعية المتعددة القدرات المستحثة البشرية المستمدة من أعضاء الدماغ واستخدامها في نمذجة أمراض الميتوكوندريا.
Abstract
أمراض الميتوكوندريا تمثل أكبر فئة من الأخطاء الجنينية في التمثيل الغذائي وغير قابلة للشفاء حاليا. هذه الأمراض تسبب عيوب نمائية عصبية لا تزال آلياتها الأساسية في حالة توضيح. حاجز رئيسي هو عدم وجود نماذج فعالة تلخيص ضعف الخلايا العصبية في وقت مبكر ينظر في المرضى. يتيح التقدم في تكنولوجيا الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) توليد أعضاء دماغية ثلاثية الأبعاد (ثلاثية الأبعاد) يمكن استخدامها للتحقيق في تأثير الأمراض على تطور الجهاز العصبي وتنظيمه. وقد أدخل الباحثون، بما في ذلك هؤلاء المؤلفين، مؤخرا organoids الدماغ البشري لنموذج اضطرابات الميتوكوندريا. هذه الورقة تقارير بروتوكول مفصل للجيل قوية من الأعضاء الدماغ المستمدة من iPSC الإنسان واستخدامها في التنميط الحيوي الميتوكوندريا وتحليلات التصوير. هذه التجارب سوف تسمح باستخدام organoids الدماغ للتحقيق في الاختلالات الأيضية والتنموية، ويمكن أن توفر معلومات حاسمة لتشريح الأمراض العصبية من أمراض الميتوكوندريا.
Introduction
أمراض الميتوكوندريا تمثل أكبر فئة من الأخطاء الجنينية من التمثيل الغذائي1. وهي ناجمة عن الطفرات الوراثية التي تعطل عمليات الميتوكوندريا المختلفة، بما في ذلك الفوسفور التأكسدي (OXPHOS)2، وتجميع سلسلة الجهاز التنفسي، وديناميات الميتوكوندريا، ونسخ الحمض النووي الميتوكوندريا أو النسخ المتماثل3. تتأثر الأنسجة ذات متطلبات الطاقة بشكل خاص بخلل الميتوكوندريا4. وبناء على ذلك، فإن المرضى الذين يعانون من أمراض الميتوكوندريا عادة ما يطورون مظاهر عصبية مبكرة.
لا توجد حاليا علاجات متاحة للأطفال المصابين بأمراض الميتوكوندريا5. عائق رئيسي لتطوير المخدرات من أمراض الميتوكوندريا هو عدم وجود نماذج فعالة تلخيص مسار المرض البشري6. العديد من النماذج الحيوانية التي تمت دراستها حاليا لا تظهر العيوب العصبية الموجودة في المرضى7. وبالتالي ، فإن الآليات الكامنة وراء أمراض الخلايا العصبية لأمراض الميتوكوندريا لا تزال غير مفهومة تماما.
الدراسات الحديثة ولدت iPSCs من المرضى المتضررين من أمراض الميتوكوندريا واستخدمت هذه الخلايا للحصول على خلايا عصبية خاصة بالمرضى. على سبيل المثال، تم العثور على العيوب الوراثية المرتبطة بمرض الميتوكوندريا، متلازمة لي، تسبب انحرافات في الجيوجيات الحيوية الخلوية8،9، تخليق البروتين10، والكالسيوم homeostasis9،11. قدمت هذه التقارير أدلة ميكانيكية مهمة على ضعف الخلايا العصبية التي تحدث في أمراض الميتوكوندريا ، مما يمهد الطريق لاكتشاف الأدوية لهذه الأمراض المستعصية12.
الثقافات ثنائية الأبعاد (ثنائية الأبعاد) ، ومع ذلك ، لا تمكن من التحقيق في التعقيد المعماري والتنظيم الإقليمي للأجهزة ثلاثية الأبعاد13. وتحقيقا لهذه الغاية، فإن استخدام الأعضاء العضوية ثلاثية الأبعاد في الدماغ المستمدة من iPSCs14 الخاصة بالمرضى قد يسمح للباحثين بالحصول على معلومات إضافية مهمة وبالتالي المساعدة في تشريح كيفية تأثير أمراض الميتوكوندريا على تطور الجهاز العصبي ووظيفته15. بدأت الدراسات التي تستخدم الأعضاء المشتقة من الدماغ iPSC للتحقيق في أمراض الميتوكوندريا في الكشف عن المكونات العصبية النمائية لأمراض الميتوكوندريا.
أظهرت الأجهزة العضوية في الحبل الشوكي التي تحمل طفرات مرتبطة بمرض الميتوكوندريا واعتلال الدماغ الميتوكوندريا وحمض اللاكتيك ومتلازمة الحلقات الشبيهة بالسكتة الدماغية (MELAS) وجود خلل في تكوين الأعصاب وتمايز الخلايا العصبية الحركية المتأخر16. أظهرت الأجهزة العضوية القشرية المشتقة من المرضى الذين يعانون من مرض الميتوكوندريا ، متلازمة لي ، انخفاضا في الحجم ، وعيوبا في توليد البراعم الظهارية العصبية ، وفقدان العمارة القشرية17. أظهرت أعضاء الدماغ من مرضى متلازمة لي أن عيوب المرض تبدأ على مستوى خلايا السلف العصبية ، والتي لا يمكن أن تلتزم بعملية التمثيل الغذائي للميتوكوندريا ، مما يسبب تفريع الخلايا العصبية الشاذة والمورفوجينيس18. وهكذا، قد تمثل السلف العصبية هدفا علاجيا خلويا لأمراض الميتوكوندريا، وقد تدعم الاستراتيجيات التي تعزز وظيفتها الميتوكوندريا التطور الوظيفي للجهاز العصبي.
قد يساعد استخدام الأعضاء العضوية في الدماغ في الكشف عن المكونات العصبية النمائية لأمراض الميتوكوندريا. تعتبر أمراض الميتوكوندريا بشكل رئيسي تنكس عصبي مبكر5. ومع ذلك ، توجد عيوب نمائية عصبية أيضا في المرضى المتضررين من أمراض الميتوكوندريا ، بما في ذلك تأخر النمو وضعف الإدراك19. قد تساعد الأعضاء العضوية الدماغية الخاصة بمرضى معينين في معالجة هذه الجوانب وتوضيح كيفية تأثير أمراض الميتوكوندريا على نمو الدماغ البشري. يمكن أن يلعب خلل الميتوكوندريا أيضا دورا مسببا للأمراض في الأمراض العصبية الأخرى الأكثر شيوعا ، مثل مرض الزهايمر ومرض باركنسون ومرض هنتنغتون4. وبالتالي ، فإن توضيح تأثير عيوب الميتوكوندريا في النمو العصبي باستخدام أعضاء الدماغ قد يكون مفيدا أيضا لدراسة تلك الأمراض. تصف هذه الورقة بروتوكولا مفصلا لتوليد أعضاء الدماغ القابلة للاستنساخ التي يمكن استخدامها لإجراء نمذجة الأمراض لأمراض الميتوكوندريا.
Protocol
ملاحظة: قد يتطلب استخدام iPSCs البشرية موافقة أخلاقية. استمدت مراكز الرقابة الصحية الدولية المستخدمة في هذه الدراسة من أفراد مكافحة صحيين بعد الموافقة الأخلاقية المحلية (#2019-681). يجب أن يتم تنفيذ جميع إجراءات زراعة الخلايا تحت غطاء محرك السيارة ثقافة الخلية العقيمة، وتطهير بعناية جميع الكواشف والمواد الاستهلاكية قبل نقل تحت غطاء محرك السيارة. وينبغي أن يكون لدى مراكز زراعة الملوثات العصبية المضافة البشرية المستخدمة في التمايز رقم مرور يقل عن 50 لتجنب الانحرافات الجينومية المحتملة التي قد تحدث عند الثقافة الواسعة النطاق. يجب التحقق من صحة الحالة المتعددة القدرات للخلايا قبل توليد الجهاز ، على سبيل المثال ، من خلال مراقبة التعبير عن العلامات المرتبطة بالانفجار متعددة الخلايا مثل NANOG أو OCT4. وينبغي إجراء اختبارات الميكوبلازما أسبوعيا لضمان الثقافات الخالية من الميكوبلازما.
1. جيل من أعضاء الدماغ
- ثقافة iPSCs الإنسان
- ثقافة iPSCs الإنسان في ظل ظروف التغذية خالية في المتوسط iPSC (انظر جدول المواد) على لوحات مغلفة 6 آبار والاحتفاظ بها في حاضنة زراعة الأنسجة الرطبة في 37 درجة مئوية و 5٪ CO2.
ملاحظة: قد يعيق ترحيل الخلايا المغذية التمايز العضوي. مرور الخلايا مرة واحدة على الأقل في ظروف خالية من التغذية. - مرور iPSCs في التقاء 80٪ باستخدام وسيط مفرزة خالية من الانزيم في نسب تتراوح بين 1:4 إلى 1:12. لزيادة بقاء الخلية، أضف 10 ميكرومتر بروتين مرتبط كيناز (ROCK) المثبط (Y27632) بعد كل تقسيم.
- ثقافة iPSCs الإنسان في ظل ظروف التغذية خالية في المتوسط iPSC (انظر جدول المواد) على لوحات مغلفة 6 آبار والاحتفاظ بها في حاضنة زراعة الأنسجة الرطبة في 37 درجة مئوية و 5٪ CO2.
- فصل iPSCs (80٪ التقاء)-اليوم 0.
- إعداد التمايز القشري المتوسط I (CDMI) (الجدول 1). متوسط CDMI قبل الحرب في درجة حرارة الغرفة (22-25 درجة مئوية) قبل إضافته إلى الخلايا.
- غسل الآبار التي تحتوي على iPSCs مع المالحة العازلة بالفوسفات (PBS) لإزالة الخلايا الميتة والحطام.
- أضف 500 ميكرولتر من الكاشف A (جدول المواد) إلى كل بئر واحتضن لمدة 5 دقائق عند 37 درجة مئوية. تحقق تحت المجهر لضمان انفصال الخلية.
- إضافة 1 مل من iPSC المتوسطة لتخفيف الكاشف A لتحييد نشاطها.
- استخدام ماصة 1000 ميكرولتر لتفكيك الخلايا عن طريق الأنابيب صعودا وهبوطا ونقل تعليق الخلية إلى أنبوب الطرد المركزي 15 مل.
- طرد مركزي بلطف iPSCs في 125 × ز لمدة 5 دقائق في درجة حرارة الغرفة (22-25 درجة مئوية).
- يستنشق بعناية supernatant لتجنب إزعاج بيليه الخلية.
- Resuspend بيليه مع 1 مل من CDMI للحصول على تعليق خلية واحدة، والعد رقم الخلية.
- إعداد وسيط البذر مع 9000 iPSCs لكل 100 ميكرولتر في CDMI تكملها مثبطات روك 20 ميكرومتر، 3 ميكرومتر WNT-كاتينين المثبط (IWR1)، و 5 ميكرومتر SB431542.
- إضافة 100 ميكرولتر من متوسط البذر لكل بئر إلى لوحة v-bottom 96-well.
- احتفظ باللوحة في حاضنة زراعة الأنسجة الرطبة عند 37 درجة مئوية و5٪ من ثاني أكسيد الكربون.
- جيل الغلاف العصبي
- في اليوم الأول، لاحظ أن مجاميع الخلايا المستديرة (الخلايا العصبية) ذات الحدود الملساء المحددة تتشكل. لاحظ الخلايا الميتة حول التجميعات. الاستمرار في الثقافة في الحاضنة عند 37 درجة مئوية و 5٪ من ثاني أكسيد الكربون.
- في اليوم الثالث، قم بإثارة اللوحة عن طريق النقر على الجانبين ثلاث مرات لفصل الخلايا الميتة.
- إضافة 100 ميكرولتر من CDMI تكملها مع 20 μM روك المانع، 3 ميكرومتر IWR1، و 5 ميكرومتر SB431542 إلى كل بئر.
- أعد الطبق إلى الحاضنة عند 37 درجة مئوية و5٪ من ثاني أكسيد الكربون.
- في اليوم السادس، قم بإزالة 80 ميكرولتر من الوسيط الفائق بعناية من كل بئر. تجنب لمس الجزء السفلي من البئر.
- إضافة 100 ميكرولتر من CDMI تكملها مع 3 μM IWR1 و 5 ميكرومتر SB431542 إلى كل بئر. أعد الطبق إلى الحاضنة عند 37 درجة مئوية و5٪ من ثاني أكسيد الكربون.
- كرر الخطوتين 5 و6 كل 3 أيام حتى اليوم 18.
- نقل الغلاف العصبي
- في اليوم 18، قم بإعداد التمايز القشري المتوسط الثاني (CDMII) (الجدول 1) وإضافة 10 مل إلى لوحة ثقافة الخلايا المرفقة منخفضة للغاية مقاس 100 مم.
- استخدام ماصة 200 ميكرولتر مع طرف قطع لنقل neurospheres الجولة من لوحة 96 جيدا إلى 100 ملم فائقة منخفضة لوحة ثقافة الخلية المرفق.
ملاحظة: كن لطيفا لتجنب إتلاف الأعصاب عن طريق التأكد من أن فتحة الطرف واسعة بما فيه الكفاية وأن المجاميع لا يستنشق بسرعة كبيرة جدا. - إزالة 5 مل من المتوسطة من لوحة تحتوي على الخلايا العصبية وإضافة 5 مل من CDMII الطازجة.
ملاحظة: يساعد هذا الإجراء على تقليل مقدار وسيط CDMI التي قد تكون نقلت من نقل الأعصاب. - ضع اللوحة على شاكر مداري عند 70 دورة في الدقيقة داخل حاضنة زراعة الأنسجة الرطبة عند 37 درجة مئوية و5٪ من ثاني أكسيد الكربون.
ملاحظة: فحص بصريا في neurospheres في اليوم التالي. زيادة سرعة شاكر المداري إذا تم تجميعها معا أو تعلق على الجزء السفلي من لوحة. - كل 3 أيام، يستنشق بعناية المتوسطة فائقة واستبدالها مع CDMII الطازجة. اترك كمية صغيرة من الوسط لمنع الغلاف العصبي من الجفاف.
- في اليوم 35، قم بإعداد التمايز القشري المتوسط الثالث (CDMIII) (الجدول 1).
ملاحظة: يجب حل مكون المصفوفة في CDMIII الباردة. - يستنشق المتوسط من لوحة وإضافة 10 مل من CDMIII الباردة.
ملاحظة: هو أكثر فعالية لاستخدام المتوسطة الباردة بحيث يمكن للمكون مصفوفة معطف organoids دون تشكيل كتل. - بعد تغيير الوسط، ضع اللوحة مرة أخرى على شاكر مداري عند 70 دورة في الدقيقة داخل حاضنة زراعة الأنسجة الرطبة عند 37 درجة مئوية و5٪ من ثاني أكسيد الكربون.
- تغيير المتوسط كل 3-5 أيام اعتمادا على معدل النمو، كما هو مبين في لون الوسط.
- في اليوم 70، قم بإعداد التمايز القشري المتوسط الرابع (CDMIV) (الجدول 1). استخدام CDMIV المتوسطة حتى يتم التوصل إلى العمر المطلوب من organoids. خلال هذه الفترة، احتفظ باللوحة على شاكر مداري عند 70 دورة في الدقيقة داخل حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية و5٪ CO2).
- تغيير المتوسط كل 3-5 أيام، اعتمادا على معدل النمو.
2. الاحتواء المناعي للأعضاء في الدماغ
- إعداد الأنسجة
- إعداد محلول paraformaldehydede (PFA) بنسبة 4٪، ووضعه تحت غطاء أمان.
ملاحظة: ارتداء معدات السلامة الشخصية عند التعامل مع PFA. - جمع organoids الدماغ ونقلها بلطف مع حادة يميل 3 مل البلاستيك باستور ماصة إلى لوحة 6-جيدا مليئة PFA.
ملاحظة: استخدام organoids أقدم من 40 يوما للسماح التصور من الهياكل مع ارتفاع تعقيد الخلوية. - الحفاظ على organoids في الحل PFA لمدة 1 ساعة في درجة حرارة الغرفة.
- إزالة PFA بعناية مع ماصة باستور البلاستيك 3 مل، وغسل organoids ثابتة ثلاث مرات باستخدام برنامج تلفزيوني.
- تخزين organoids ثابتة في 4 درجة مئوية في برنامج تلفزيوني حتى مزيد من الاستخدام.
- إعداد محلول paraformaldehydede (PFA) بنسبة 4٪، ووضعه تحت غطاء أمان.
- إعداد شرائح الجهازية في الدماغ
- إعداد محلول أجار 3٪ والحرارة ببطء حتى المسال.
- ضع القالب (نهاية قطع حقنة 10 مل) على قطعة من ورق التصفية الماصة (الجانب السلس لأعلى). ضع قطرة من أجار عليه.
- بسرعة تأخذ organoid واحد من لوحة 6-جيدا مع ملعقة وإزالة برنامج تلفزيوني المفرط مع ورقة التصفية.
ملاحظة: يجب الحرص على عدم لمس organoid مباشرة مع ورقة التصفية. - ضع الجهاز على قطرة أجار.
- كرر هذا الإجراء مع ما يصل إلى ثلاثة organoids.
ملاحظة: العمل بسرعة لتجنب تجسيد أجار أثناء هذه الخطوة. - إعادة ملء القالب مع أجار حتى يتم تغطية جميع organoids بالكامل.
- انتظر حتى يبدأ أجار لترسيخ، ومن ثم نقل بلطف القالب بأكمله الذي يحتوي على organoids، بما في ذلك ورقة تصفية ماصة، على عنصر التبريد.
ملاحظة: إذا لم يكن عنصر التبريد متوفرا، قم بتخزين الأجهزة العضوية لبضع دقائق في الثلاجة عند درجة حرارة 4 درجات مئوية. - في غضون ذلك، والاستعداد لإجراء تشريح: وضع شفرة حلاقة (تنظيفها مع الأسيتون وغسلها بالماء المقطر المزدوج) في حامل الهزاز، وجبل على الحمام، وملئه مع برنامج تلفزيوني.
- إزالة القالب من أجار (صلبة) واستخدام مشرط لتقليم لتشكيل مكعب.
- إرفاق مكعب أجار التي تحتوي على organoids على لوحة الناقل من الهزاز مع هلام لاصقة (انظر جدول المواد)، ووضعه في الحمام الذي يحتوي على برنامج تلفزيوني.
- ضبط الهزاز (انظر جدول المواد) لقطع شرائح في سمك 150 ميكرومتر.
ملاحظة: قد تكون إعدادات الهزاز (الزاوية المناسبة والسعة والتردد وسرعة النصل) مشابهة لتلك المستخدمة في تقطيع أنسجة الدماغ الثابتة المشتقة من الحيوانات المبكرة بعد الولادة. ومع ذلك ، فإن الإعدادات المثالية تعتمد بشدة على نوع الهزاز ويجب تحديدها في خطوة أولى لمنع تشويه أو حتى تمزيق الأنسجة أثناء القطع. - بدء إجراء القطع. استخدام ماصة زجاجية أو ملعقة لنقل بلطف كل شريحة قطع الطازجة في لوحة 24 جيدا مليئة برنامج تلفزيوني.
- تخزين لوحة تحتوي على شرائح في 4 درجة مئوية (لمدة تصل إلى بضعة أيام) حتى مزيد من المعالجة.
- نقل شرائح من لوحة مع ماصة زجاجية أو ملعقة على الشرائح المجهر. استخدم شريحة 2 كحد أدنى لكل شريحة.
- إزالة بعناية أجار وبرنامج تلفزيوني الزائدة مع حقنة.
- السماح للشرائح لتجف حتى تلتزم الشرائح.
ملاحظة: في حين يمكن تخزين شرائح المجهر في غرف بلاستيكية مليئة برنامج تلفزيوني في 4 درجة مئوية، ينبغي أن تكون ملطخة في أقرب وقت ممكن بعد إجراء تشريح.
- تلطيخ الهسطو الكيميائي المناعي
- إعداد حل الحظر (الجدول 1).
- استخدم قلم PAP لرسم حدود مسعورة حول الشرائح على الشريحة للمساعدة في الحفاظ على جميع الحلول على الشرائح.
- أضف بعناية محلول الحجب على الشريحة، واحتضن لمدة ساعة واحدة في درجة حرارة الغرفة (22-25 درجة مئوية). لتجنب تدمير الأنسجة، لا تقم بإضافة الحل مباشرة على رأس الشرائح.
- يستنشق حل الحجب وتطبيق الأجسام المضادة الأولية المطلوبة المخففة في حل الحجب.
- احتضان الشريحة بين عشية وضحاها في غرفة رطبة في 4 درجة مئوية.
- شطف الشريحة ثلاث مرات مع برنامج تلفزيوني 1x لمدة 10 دقيقة لكل منهما.
- احتضان شرائح مع الأجسام المضادة الثانوية محددة مخففة في حل حجب وأداء تلطيخ Hoechst (1:2,500) لمدة 1 ساعة في درجة حرارة الغرفة في الظلام.
ملاحظة: تذكر لتنفيذ عناصر تحكم سالبة للتأكد من وجود أي ربط غير محددة أو التلقائي-fluorescence. - شطف ثلاث مرات مع برنامج تلفزيوني 1x لمدة 10 دقيقة لكل منهما في الظلام.
- إضافة قطرة واحدة من تصاعد المتوسطة إلى شريحة، ووضع غطاء على حافة قطرة، ووضع ببطء coverslip أسفل نحو شريحة لتجنب فقاعات الهواء.
- السماح للشريحة للراحة بين عشية وضحاها في درجة حرارة الغرفة. تطبيق طلاء الأظافر على حدود غطاء لمزيد من ختم الشريحة. للتخزين طويل الأجل، يخزن عند 4 درجات مئوية.
- توثيق التلطيخ
- لمسح الصور الكبيرة للخياطة، استخدم مجهرا عريض المجال مزودا بمحرك (انظر جدول المواد للحصول على تفاصيل) هدفا عالي الجودة؛ مجموعة مرشح DAPI (على سبيل المثال، الإثارة (EX): 340-380 نانومتر، مرآة ديكهروي (DM): 400 نانومتر، مرشح حاجز (BA): 435-485 نانومتر)؛ مجموعة مرشحات الفلورسين ايزوثيوسيانات (على سبيل المثال، EX: 465-495 نانومتر، DM: 505 نانومتر، BA: 515-555 نانومتر)؛ مجموعة مرشحات Alexa594 (على سبيل المثال، ET 575/40؛ T 600 LPXR; HC 623/24)؛ كاميرا رقمية؛ برامج اقتناء عالية الأداء تسمح للغرز الآلي وعمليات المكدس.
- للتعامل مع الصور، استخدم برنامج معالجة الصور القادر على إنشاء ملفات tif 8 بت، وزراعة الغرز، وضبط التباين والسطوع، ودمج القنوات (مثل الأزرق والأخضر والأحمر)، وإضافة أشرطة المقياس.
- لمسح التفاصيل، استخدم مجهر مسح ليزر كونفوجال مزود بهدف عالي الجودة، ليزر الأشعة فوق البنفسجية (EX: 408 نانومتر)، ليزر الأرجون (EX: 488 نانومتر)، ليزر هيليوم نيون (EX: 543)، برنامج تصوير لمجهر كونفوجال.
- للتعامل مع الصور من التفاصيل، استخدم برنامج معالجة الصور قادرة على توليد إسقاطات أقصى كثافة من confocal z-stacks (على سبيل المثال، المقاطع البصرية من 0.6 ميكرومتر لكل منهما)، وتوليد 8 بت tif-files، وضبط التباين والسطوع، ودمج القنوات (على سبيل المثال، الأزرق والأخضر والأحمر)، إضافة أشرطة مقياس.
- استخدم محرر رسومي لترتيب الأرقام.
3. التنميط الحيوي للأعضاء في الدماغ
- إعداد الأجهزة العضوية للتنميط الحيوي
- إعداد الحل papain و DNase باتباع بروتوكول الشركة المصنعة.
- نقل 3-5 organoids إلى لوحة 6-جيدا. غسلها مرتين مع برنامج تلفزيوني قبل الحرب.
- إضافة 2 مل من محلول الباباين المنشط قبل الحرب الذي يحتوي على DNase. باستخدام شفرة، وقطع organoids إلى قطع صغيرة.
- ضع اللوحة على شاكر مداري تم ضبطه على 27 دورة في الدقيقة داخل حاضنة ثقافة الخلية (عند 37 درجة مئوية، 5٪ CO2)، واحتضن لمدة 15-20 دقيقة.
ملاحظة: يعتمد وقت الحضانة على مرحلة العضيات. يمكن استخدام الأجهزة العضوية في المراحل المبكرة كما هي. بالنسبة للأعضاء التي يزيد عمرها عن 3 أشهر ، يوصى بقطع الأعضاء العضوية إلى 2-3 قطع قبل الانفصال واحتضان القطع بسرعة هزازة محددة في 27 دورة في الدقيقة لمدة 15-20 دقيقة عند 37 درجة مئوية. يمكن أن يساعد هذا الإجراء في إزالة الأنسجة النخرية التي قد تكون موجودة في الأجهزة العضوية في مرحلة لاحقة. - جمع الأنسجة المهضومة في أنبوب 15 مل وإضافة 5 مل من CDMIV الثقافة العضوية المتوسطة (الجدول 1).
- تريتورات النسيج مع ماصة بلاستيكية 10 مل عن طريق الأنابيب صعودا وهبوطا 10-15 مرات. دع الأنسجة غير المرتبطة تستقر في أسفل الأنبوب.
- نقل تعليق الخلية بعناية إلى أنبوب 15 مل، وتجنب أي قطعة من الأنسجة غير المرتبطة. تصفية الحل من خلال مصفاة الخلية 40 ميكرومتر (على سبيل المثال، أنابيب البوليسترين المستديرة القاع مع قبعات مصفاة الخلية).
- بيليه الخلايا عن طريق الطرد المركزي في 300 × ز لمدة 5 دقائق في درجة حرارة الغرفة.
- تقييم عدد الخلية وجودتها باستخدام تريبان الأزرق.
- لوحة العدد المطلوب (~ 20،000/ جيدا) من الخلايا على لوحات صغيرة المغلفة 96 جيدا. تغيير متوسط 6-8 ساعة بعد الطلاء إلى متوسط العصبية (الجدول 1).
- احتضان اللوحة الصغيرة المغلفة 96 جيدا في حاضنة ثاني أكسيد الكربون (37 درجة مئوية، 5٪ CO2) لمدة 4 أيام.
- التنميط الحيوي
- في اليوم الثالث بعد إعادة تجزؤ الخلايا المنفصلة، أضف 200 ميكرولتر من محلول المعايرة إلى كل بئر من الجزء السفلي من اللوحة الدقيقة ذات ال 96 بئرا، وضع خرطوشة الاستشعار الخضراء العلوية على اللوحة الدقيقة المائية.
ملاحظة: ضع خرطوشة المستشعر أعلى اللوحة الدقيقة في الاتجاه الصحيح وتأكد من أن حل الخرف يغطي جميع أجهزة الاستشعار. - احتضان اللوح الدقيق المرطب 96 جيدا في حاضنة غير ثاني أكسيد الكربون عند 37 درجة مئوية بين عشية وضحاها.
- قم بتشغيل المحلل للسماح للأداة بالاستقرار عند 37 درجة مئوية بين عشية وضحاها.
- في اليوم الرابع بعد إعادة الصياغة، تفقد ثقافة الجهازية المفككة على اللوحة الدقيقة ذات 96 بئرا تحت المجهر لضمان ظهور الخلايا كطاهر أحادي التقاء.
- إعداد متوسطة المقايسة (الجدول 1).
- إزالة الخلايا العصبية المتوسطة من جميع الآبار مع ماصة دون لمس الجزء السفلي من البئر لمنع تلف الخلايا. بدلا من ذلك، عكس بعناية لوحة كاملة ومن ثم تجفيفها على ورق نظيف. العمل بسرعة لتجنب موت الخلايا.
- غسل الخلايا مرتين مع prewarmed 200 ميكرولتر من متوسطة اساي. أضف Assay Medium إلى حجم نهائي قدره 180 ميكرولتر لكل بئر. احتضان اللوحة الدقيقة ذات ال96 بئرا في حاضنة غير ثاني أكسيد الكربون عند 37 درجة مئوية لمدة ساعة واحدة.
- إعداد حلول 10 ميكرومتر من مثبطات الميتوكوندريا في متوسطة المقايسة. لاحظ أن التركيز النهائي بعد الحقن هو 1 ميكرومتر.
- قم بتحميل خرطوشة الاستشعار الموضوعة في اللوحة الدقيقة المائية باستخدام حلول 10x لمثبطات الميتوكوندريا.
- إضافة 18 ميكرولتر من مثبطات الميتوكوندريا 1 في المنفذ A.
- إضافة 19.8 ميكرولتر من مثبطات الميتوكوندريا 2 في المنفذ B.
- إضافة 21.6 ميكرولتر من مثبطات الميتوكوندريا 2 في الميناء C.
- إضافة 23.4 ميكرولتر من مثبطات الميتوكوندريا 3 في الميناء D.
- ضع الخرطوشة المحملة في اللوح الصغير المرطب في حاضنة غير ثاني أكسيد الكربون عند 37 درجة مئوية حتى بداية الفحص.
- إعداد بروتوكول قيد التشغيل في برنامج الجهاز (الجدول 2).
- اضغط على START. خذ الخرطوشة المحملة من حاضنة ثاني أكسيد الكربون غير وضعها في المحلل للمعايرة.
ملاحظة: تأكد من إدراج اللوحة في الاتجاه الصحيح وبدون الغطاء. - بمجرد انتهاء خطوة المعايرة، قم بإزالة لوحة المعايرة. خذ اللوحة الدقيقة ذات ال 96 بئرا من حاضنة ثاني أكسيد الكربون غير وضعها في المحلل. انقر على متابعة لبدء القياسات.
- عند الانتهاء من تشغيل، وإزالة microplate ثقافة الخلية 96 جيدا من محلل وجمع المتوسطة من جميع الآبار دون إزعاج الخلايا.
ملاحظة: يمكن تخزين الوسيط عند -20 درجة مئوية واستخدامه لاحقا لقياس كمية اللاكتات التي تطلقها الخلايا في الوسط باستخدام مجموعة أجهزة قياس اللاكتات المناسبة. - غسل الخلايا مع 200 ميكرولتر من برنامج تلفزيوني 1x في كل بئر.
- بعد إزالة برنامج تلفزيوني، تجميد لوحة في -20 درجة مئوية.
ملاحظة: يمكن استخدام الصفيحة المجمدة لتحديد الخلايا أو البروتينات أو الحمض النووي في كل بئر من اللوحة الدقيقة. وستكون هناك حاجة إلى هذا التحديد الكمي لتطبيع معدلات الطاقة الحيوية التي تم الحصول عليها. اتبع إرشادات الشركة المصنعة للخلايا أو البروتين أو مقايسات تحديد الحمض النووي.
- في اليوم الثالث بعد إعادة تجزؤ الخلايا المنفصلة، أضف 200 ميكرولتر من محلول المعايرة إلى كل بئر من الجزء السفلي من اللوحة الدقيقة ذات ال 96 بئرا، وضع خرطوشة الاستشعار الخضراء العلوية على اللوحة الدقيقة المائية.
النتائج
البروتوكول الموصوف هنا يسهل توليد قوي من organoids الجولة (الشكل 1A). تحتوي الأجهزة العضوية المتولدة على خلايا عصبية ناضجة يمكن تصورها باستخدام علامات البروتين المحددة للمكونات (SMI312) والتشعبات (البروتين المرتبط بالميكروتبول 2 (MAP2)) (الشكل 1B).) لا تحتوي الأجهزة العضوية الناضجة على خلايا عصبية فقط (MAP2-positive) ولكن أيضا على خلايا جلوية (على سبيل المثال ، إيجابية لعلامة الخلايا الفلكية S100 بروتين ملزم للكالسيوم B (S100ß)) (الشكل 1B).)
من خلال تحليل شرائح أعضاء الدماغ باستخدام المجهر confocal ، فمن الممكن تحديد ورصد التوزيع التفصيلي والتنظيم لأنواع مختلفة من الخلايا والهياكل الخلوية. وهذا يمكن أن يوفر نظرة جديدة حول كيفية أمراض الميتوكوندريا قد تؤثر على تطوير الجهاز العصبي. على سبيل المثال، من الممكن مراقبة محاور عصبية (SMI312-positive) و dendrites (MAP2-positive) (الشكل 2A) أو حدوث الخلايا العصبية المتبادلة (MAP2-positive) والخلايا الدبقية (S100ß-positive) (الشكل 2A)). قد تساعد الصور Confocal أيضا على التحقيق بمزيد من التفصيل في توزيع وتنظيم السلف العصبية ((الجنس تحديد المنطقة Y) مربع-2 (SOX2)-إيجابية) فيما يتعلق بالخلايا العصبية (بيتا-III توبولين (TUJ1)-إيجابية) (الشكل 2B)). وأخيرا، يمكن أن تكون ملطخة organoids الدماغ لعلامات الميتوكوندريا محددة (مثل البروتين غشاء الميتوكوندريا الخارجي، translocase من الغشاء الخارجي 20 كيلودا وحدة فرعية (TOM20)) (الشكل 2C)).
يمكن البروتوكول الموصوف الباحثين من إجراء التنميط الحيوي للأعضاء العضوية في الدماغ. باستخدام هذا الإجراء، فمن الممكن لقياس كل من التمثيل الغذائي الميتوكوندريا باستخدام معدل استهلاك الأكسجين (OCR) (الشكل 2D) والتمثيل الغذائي الجليكوليك باستخدام معدل التحمض خارج الخلية (ECAR) (الشكل 2E). التنميط الحيوي يسمح برصد كيف يمكن للخلايا تعديل ملامح OCR و ECAR استجابة لإدارة متتابعة لمثبطات الميتوكوندريا.
أولا، يمكن تطبيق مثبط سينثاسي ATP، أوليغومايسين. Oligomycin يسبب انخفاض في ملف تعريف التعرف الضوئي على الحروف (الشكل 2D) ، وبالتالي ، يحدد OCR اللازمة لإنتاج ATP. عند علاج أوليغومايسين، قد يكون هناك أيضا زيادة تعويضية في ECAR (الشكل 2E)، مما يشير إلى أن الخلايا يمكن أن upregulate تحلل لمنع الإجهاد الأيضي الناجم عن انخفاض في التمثيل الغذائي الميتوكوندريا. التطبيق المزدوج اللاحق للبروتون الأيونوفور، كربونيل سيانيد-ف-تريفلوروميثوكسيفينيلهيدرازون (FCCP)، يسبب فقدان إمكانات غشاء الميتوكوندريا. وبما أن جزيئات الأكسجين حرة الآن في التحرك، فإن هذا يسبب زيادة سريعة في التعرف الضوئي على الحروف (الشكل 2D).)
تحدد هذه التغييرات في ملف تعريف التعرف الضوئي على الحروف قدرة التنفس القصوى للخلايا. الإدارة النهائية للروتينون بالإضافة إلى antimycin A يسبب كتلة من نقل الإلكترون، وبالتالي، انخفاض حاد في OCR (الشكل 2D). قد تظهر ECAR تقلبات بعد العلاج مع FCCP وروتينون بالإضافة إلى antimycin A (الشكل 2E) ، اعتمادا على القدرة الجليكوليكية المتبقية للخلايا. قد يتم تغيير ملامح OCR وECAR بشكل كبير في أعضاء الدماغ المستمدة من مرضى الميتوكوندريا.
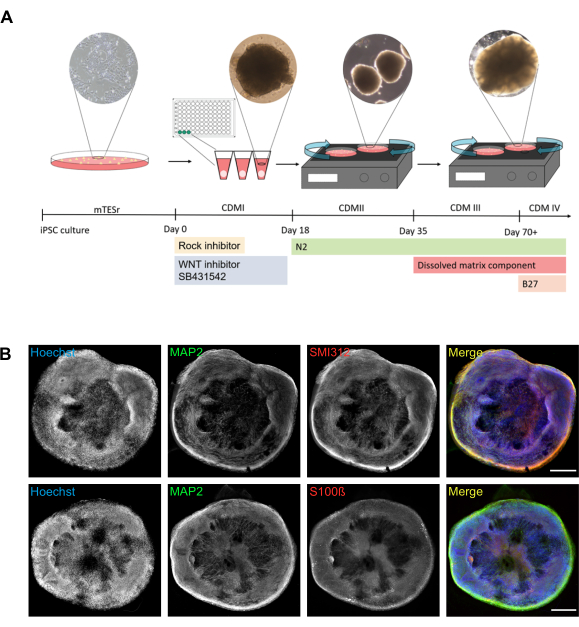
الشكل 1: جيل من الأعضاء العضوية في الدماغ من iPSCs الإنسان. (أ) التمثيل التخطيطي للبروتوكول المستخدمة لإنتاج organoids الدماغ مع صور انتقال المقابلة. اليوم 0 يتوافق مع تفكك iPSCs وبذر في لوحة 96 جيدا مع V-القاع باستخدام CDMI تكملها مثبط روك, مثبط WNT, وSB431542. في اليوم 18، يتم نقل الأعصاب من لوحات 96 بئر إلى 100 ملم أطباق ثقافة الخلية مع CDMII تكملها N2. من هذه النقطة فصاعدا، يتم وضع الثقافات على شاكر المدارية. في اليوم 35، يتم تبديل الوسيط من CDMII إلى CDMIII، والذي يحتوي أيضا على مكون مصفوفة مذاب (الجدول 1). من اليوم 70 فصاعدا، يتم تحويل CDMIII إلى CDMIV تكملها B27. تم التقاط صورة تمثيلية للغلاف العصبي في اليوم 12 باستخدام كاميرا المجهر مع تكبير 10x. تم التقاط صورة عضوية مبكرة في اليوم 22 باستخدام كاميرا المجهر في التكبير 4x. تم التقاط صورة عضوية ناضجة في اليوم 40 باستخدام كاميرا المجهر مع تكبير 4x. (ب) يمكن تصور الهيكل العام والتنظيم الخلوي لأجهزة الدماغ باستخدام المجهر واسع المجال. يتم عرض الصور التمثيلية المخيطة واسعة المجال لتصور العلاقات بين التشعبات (MAP2 إيجابية) والمكونات (SMI312 إيجابية) ، وبين الخلايا العصبية (MAP2 إيجابية) والخلايا الفلكية المفترضة (S100ß إيجابية). كانت الزنازين ملطخة ب(هويشست) لتكشف عن النوى تم التقاط جميع الصور باستخدام أعضاء الدماغ التي يبلغ عمرها 78 يوما. يظهر العمود الأيمن تراكب ثلاث قنوات (دمج). أشرطة المقياس = 500 ميكرومتر. المختصرات: iPSC = الخلايا الجذعية المستحثة متعددة القدرات؛ CDM = متوسط التمايز القشري؛ روك = رو كيناز; MAP2 = البروتين المرتبط بالميكروتبول 2؛ S100ß = S100 بروتين الكالسيوم ملزمة B. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التصور والتنميط الحيوي للأعضاء في الدماغ لنمذجة أمراض الميتوكوندريا. يمكن تحليل التنظيم المفصل والهندسة المعمارية للأجهزة العضوية باستخدام المجهر البؤري. تم التقاط جميع الصور باستخدام أعضاء الدماغ التي يبلغ عمرها 78 يوما وملطخة ب Hoechst للكشف عن النوى. يظهر العمود الأيمن تراكب ثلاث قنوات (دمج). أشرطة المقياس = 50 ميكرومتر (A) إسقاطات التركيز الموسع التمثيلي (44-48 طائرة بصرية، 0.6 ميكرومتر لكل منهما) التي تتناول التفاعل بين التشعبات (MAP2 إيجابية، رؤوس الأسهم) والمحورات (SMI312-positive، الأسهم)، وبين الخلايا العصبية (MAP2 إيجابية، رؤوس الأسهم) والخلايا الفلكية المفترضة (S100ß-positive، الأسهم). (ب) إسقاطات التركيز الموسع التمثيلي (14-31 طائرة بصرية، 0.6 ميكرومتر لكل منها) التي تبين توزيع الخلايا العصبية (TUJ1-positive، رؤوس الأسهم) فيما يتعلق بالسلف العصبية (الأسهم الإيجابية SOX2). (ج) إسقاطات تمثيلية ذات تركيز ممتد (20 طائرة بصرية، 0.6 ميكرومتر لكل منها) تبين التوزيع داخل الخلايا العصبية (TUJ1-positive، رؤوس الأسهم) من الميتوكوندريا (تصور باستخدام الأجسام المضادة ضد بروتين الغشاء الميتوكوندريا الخارجي TOM20، السهام). (د) يمكن رصد التنفس الميتوكوندريا من الأجهزة العضوية في الدماغ على أساس الملف الشخصي للتعرف الضوئي على الحروف بعد الإدارة المتتابعة لمثبطات الميتوكوندريا المختلفة (انظر النص للحصول على التفاصيل). (ه) يمكن رصد النشاط الجليكولي للأعضاء في الدماغ على أساس ECAR عند الإدارة المتتابعة لمثبطات الميتوكوندريا (انظر النص للحصول على التفاصيل). بالنسبة للتنميط الحيوي ، تم فصل ما يقرب من 10-15 عضوا في الدماغ للحصول على خلايا كافية لإعادة التشريح على اللوحة الدقيقة ذات 96 بئرا. تشير الأشرطة إلى الأجهزة الخاصة بالمعدات الأصلية استنادا إلى النتائج التي تم الحصول عليها في تجربتين مستقلتين. المختصرات: MAP2 = البروتين المرتبط بالميكروتبول 2؛ S100ß = S100 بروتين الكالسيوم ملزمة B; TUJ1 = بيتا الثالث توبولين; SOX2 = (الجنس تحديد المنطقة Y) مربع-2; TOM20 = translocase من الغشاء الخارجي 20 كيلودا وحدة فرعية؛ OCR = معدل استهلاك الأكسجين؛ ECAR = معدل التحمض خارج الخلية؛ أوليغوم. = أوليغوميسين; FCCP = سيانيد الكربونيل-ف-ثلاثيفلوروميثوكسيفينيلهيدرازون; R = روتينون; أنتا = أنتيميسين A; الشركات المصنعة للمعدات الأصلية = خطأ قياسي في الوسائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| التكوين الإعلامي | |||
| CDMI (اليوم 0-18) | آخر ارتجاج. | ||
| غلاسكو-مييم | جيبكو | 11710-035 | [1:1] |
| استبدال مصل خروج المغلوب (KSR) | جيبكو | 10828010 | 20% |
| MEM-NEAA (MEM غير الأساسية حل الأحماض الأمينية) | جيبكو | 11140-050 | 0.1 مليون متر |
| الصوديوم بيروفات | جيبكو | 11360070 | 1 مليون متر |
| 2 ميركابتيثانول | جيبكو | 31350-010 | 0.1 مليون متر |
| البنسلين والستريبتوميسين | جيبكو | 15140-122 | 100 U/mL و100 ميكروغرام/مل |
| CDMII (اليوم 18-35) | آخر ارتجاج. | ||
| DMEM/F12 | جيبكو | 31330038 | [1:1] |
| جلوتاماكس | جيبكو | 35050-061 | 2 مليون متر |
| N-2 الملحق (100x) | جيبكو | 17502-048 | 1% |
| تركيز الدهون المحدد كيميائيا | جيبكو | 11905031 | 1% |
| البنسلين والستريبتوميسين | جيبكو | 15140-122 | 100 U/mL و100 ميكروغرام/مل |
| CDMIII (اليوم 35-70) | آخر ارتجاج. | ||
| DMEM/F12 | جيبكو | 31330038 | [1:1] |
| جلوتاماكس | جيبكو | 35050-061 | 2 مليون متر |
| N-2 الملحق (100x) | جيبكو | 17502-048 | 1% |
| تركيز الدهون المحدد كيميائيا | جيبكو | 11905031 | 1% |
| البنسلين والستريبتوميسين | جيبكو | 15140-122 | 100 U/mL و100 ميكروغرام/مل |
| مصل الأبقار الجنيني (FBS) | جيبكو | 10270-106 | 10% |
| الهيبارين | ميرك | H3149-25KU | 5 ميكروغرام/مل |
| ماتريغل | كورنينج | 356231 | 1% |
| CDMIV(اليوم 70+) | آخر ارتجاج. | ||
| DMEM/F12 | جيبكو | 31330038 | [1:1] |
| جلوتاماكس | جيبكو | 35050-061 | 2 مليون متر |
| N-2 الملحق (100x) | جيبكو | 17502-048 | 1% |
| تركيز الدهون المحدد كيميائيا | جيبكو | 11905031 | 1% |
| البنسلين والستريبتوميسين | جيبكو | 15140-122 | 100 U/mL و100 ميكروغرام/مل |
| مصل الأبقار الجنيني (FBS) | جيبكو | 10270-106 | 10% |
| الهيبارين | ميرك | H3149-25KU | 5 ميكروغرام/مل |
| ماتريغل | كورنينج | 356231 | 2% |
| B-27 الملحق مع فيتامين (أ) 50x | جيبكو | 17504044 | 2% |
| وسط عصبي | آخر ارتجاج. | ||
| DMEM/F12 | جيبكو | 31330038 | [1:1] |
| N-2 الملحق | جيبكو | 17502048 | [1x] |
| B-27 الملحق مع فيتامين (أ) 50x | جيبكو | 17504044 | [1x] |
| حمض الأسكوربيك L | سيغما الدريتش | A92902 | [200 ميكرومتر] |
| db-cAMP (ثنائي بوتيل الأدينوزين الدوري أحادي الفوسفات) | سيغما الدريتش | D0627 | 500 ميكرومتر |
| BDNF (عامل العدلات المشتقة من الدماغ) | ماك ميلتيني | 130-093-811 | [10 نانوغرام/مل] |
| GDNF (عامل الخلايا الدبقية المشتقة من الخلايا العصبية) | ماك ميلتيني | 130-096-290 | [10 نانوغرام/مل] |
| TGF-β3 الإنسان (تحويل عامل النمو-beta3) | ماك ميلتيني | 130-094-007 | [1 نانوغرام/مل] |
| متوسطة المقايسة | آخر ارتجاج. | ||
| Seahorse XF DMEM المتوسطة | علوم سيهورس البيولوجية | 103680-100 | 500 مل |
| الصوديوم بيروفات | جيبكو | 11360070 | 1 مليون متر |
| إل-جلوتامين | لونزو | BEBP17-605E | 2 مليون متر |
| الجلوكوز | سيغما الدريتش | 50-99-7 | 10 مليون متر |
| حظر الحل | آخر ارتجاج. | ||
| برنامج تلفزيوني توين | [1:1] 0.1٪ توين | ||
| مصل الحمير | سيغما الدريتش | D9663 | 10% |
| تريتون-إكس | ميرك | X100-5ML | 1% |
الجدول 1: تفاصيل الوسائط والحلول المستخدمة لتوليد الجهاز.
| التهيئه | خط الأساس (X3) | حقن أوليغومايسين (X3) | حقن FCCP (X3) | حقن FCCP (X3) | مضاد A + حقن العفن (X3) |
| معايره | خلط | خلط | خلط | خلط | خلط |
| (04:00) | (04:00) | (04:00) | (04:00) | (04:00) | |
| توازن (12:00) | انتظري | انتظري | انتظري | انتظري | انتظري |
| (02:00) | (02:00) | (02:00) | (02:00) | (02:00) | |
| التدبير (03:00) | التدبير (03:00) | التدبير (03:00) | قاس | التدبير (03:00) | |
| (03:00) |
الجدول 2: إعداد البروتوكول للتنميط الحيوي. وصف الخطوات وطولها في دقائق باستخدام برنامج Seahorse Wave Desktop. المختصرات: FCCP = سيانيد الكربونيل-p-ثلاثي الفلوروميثوكسيفينيلهيدرازون; تعفن = روتينون; مكافحة A = أنتيميسين A.
Discussion
تصف هذه الورقة الجيل القابل للاستنساخ من الأعضاء العضوية البشرية المشتقة من الدماغ iPSC واستخدامها لنمذجة أمراض الميتوكوندريا. يتم تعديل البروتوكول الموضح هنا استنادا إلى work20 المنشورة مسبقا. وإحدى المزايا الرئيسية لهذا البروتوكول هي أنه لا يتطلب التضمين اليدوي لكل عضو عضوي في مصفوفة سقالات. في الواقع ، يتم حل حل المصفوفة ببساطة في وسط ثقافة الخلية. وعلاوة على ذلك، ليست هناك حاجة لتوظيف المفاعلات الحيوية باهظة الثمن، كما يمكن زراعة الأجهزة العضوية في زراعة الأنسجة القياسية 6-لوحات جيدا وضعه على شاكر المداري داخل الحاضنة. كما يتيح هذا الإجراء الزراعة المتوازية للعديد من الصفائح التي تحتوي على أعضاء مختلفة مشتقة من خطوط فردية مختلفة ، وبالتالي زيادة إنتاجية التجارب والسماح برصد الاختلافات المحتملة الناشئة في ملامح نمو الأجهزة العضوية المختلفة. اختبرنا هذا البروتوكول باستخدام iPSCs مختلفة مستمدة من ضوابط صحية والأفراد المتضررين من أمراض الميتوكوندريا، مع نتائج متسقة.
لنمذجة مرض الميتوكوندريا، من الضروري استخدام علامات مختلفة لتصور مورفولوجيا وتنظيم شبكة الميتوكوندريا. هذا الإجراء يمكن من التحقيق في ما إذا كان عدد الميتوكوندريا، مورفولوجيا، أو التوزيع قد تتغير في الأعضاء الدماغ المستمدة من المرضى الذين يعانون من أمراض الميتوكوندريا. وجود وتنظيم السلف العصبية داخل أعضاء الدماغ يمكن أن تكون ذات أهمية حاسمة لنمذجة اضطرابات الميتوكوندريا. اكتشفنا مؤخرا أن الطفرات التي تسبب مرض الميتوكوندريا ، متلازمة لي ، تعطل العمارة الخلوية وتوزيع خلايا السلف العصبي داخل الأعضاء الدماغية المشتقة من المريض18.
لإجراء التنميط الحيوي، قمنا بتكييف طريقة تم وصفها سابقا لتقييم الجيستيك الحيوي للخلايا الجذعية متعددة القدرات21. وصف بروتوكول حديث كيفية تنفيذ التنميط الحيوي للأورام العضوية المشتقة من الأمعاء الدقيقة للفأر والقولون البشري وأورام القولون والمستقيم22. ومع ذلك ، فإن هذه الأجهزة العضوية صغيرة جدا مقارنة بالأعضاء في الدماغ ، وبالتالي ، هناك حاجة إلى بروتوكول مختلف ، مثل البروتوكول المبلغ عنه هنا ، للأعضاء العضوية في الدماغ. لقد استخدمنا مؤخرا هذا البروتوكول لتقييم الملف الحيوي للأعضاء العضوية في الدماغ البشري التي تحمل طفرات في جين بروتين الموضع surfeit 1 (SURF1) الذي يسبب مرض الميتوكوندريا الحاد ، متلازمة لي18. وجدنا أن ملف تعريف OCR يتأثر بشكل خاص في الأجهزة العضوية لمتلازمة لي ، كما هو موضح من خلال انخفاض كبير في مستوى OCR القاعدي ، ومعدل إنتاج ATP ، ومعدل التنفس الأقصى18.
في الختام، نقدم هنا بروتوكول مفصل للجيل القوي من أعضاء الدماغ البشري ونصف كيفية إجراء التجارب التي من شأنها أن تكون مهمة للتحقيق في آليات المرض الكامنة وراء أمراض الميتوكوندريا. قد تكون الأعضاء البشرية في الدماغ ذات أهمية حاسمة لتوضيح تنوع الميتوكوندريا في الدماغ البشري ودوره في صحة الإنسان والأمراض23. من المهم توضيح أن أعضاء الدماغ المتولدة عن البروتوكولات المتاحة حاليا ، بما في ذلك تلك الموصوفة هنا ، لا تزال تحمل قيودا. وتشمل هذه، على سبيل المثال، عدم وجود الأوعية الدموية وعدم وجود السكان microglia24. وينبغي أن تؤخذ هذه الجوانب في الاعتبار لتفسير النتائج تفسيرا صحيحا.
على سبيل المثال، يمكن أن يحد نقص الأوعية الدموية والميكروجليا من الآليات التعويضية التي قد تكون موجودة في الجسم الحي. وبالتالي قد تظهر الأجهزة العضوية الدماغية المشتقة من المريض عيوبا أقوى من تلك التي لوحظت في المرضى17,18. وعلاوة على ذلك، وعلى الرغم من إمكانية استنساخ هذا البروتوكول بشكل عام20، يمكن ملاحظة عدم التجانس من سطر إلى خط. وتحقيقا لهذه الغاية، عند إجراء دراسات نمذجة الأمراض، من المهم دائما تحديد كمية منتظمة من توحيد السيطرة والأعضاء المريضة من خلال تقييم أنماط مورفولوجيا (الحجم، طبقة) وتوزيع علامات الجزيئية عبر الأجهزة العضوية المختلفة.
وأخيرا، فإنه ليس من الممكن لتوليد organoids الدماغ من iPSC واحد، والحد من جدوى الفحص الجيني على نطاق واسع مع CRISPR/Cas9. وبالنظر إلى وتيرة البحث، من المرجح أن يتم قريبا التغلب على بعض القيود الحالية للبروتوكول الموصوف هنا. سوف تصبح البروتوكولات المحسنة متوفرة. ونأمل أن تمكن هذه النماذج ثلاثية الأبعاد لأمراض الميتوكوندريا من اكتشاف علاجات قابلة للتنفيذ في نهاية المطاف لأمراض الميتوكوندريا، الضارة، وللأمراض غير القابلة للشفاء ذات الاحتياجات الطبية غير الملباة إلى حد كبير.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح مالية أو غير مالية متنافسة.
Acknowledgements
نشكر ميريام بونينج على الدعم الفني. نعترف بالدعم المقدم من دويتشه فوردشونجسجيمينشافت (DFG) (PR1527/5-1 إلى A.P.) وS spark ومعهد برلين للصحة (BIH) (صناديق التحقق من صحة BIH إلى A.P.) ، ويونايتد مؤسسة أمراض الميتوكوندريا (UMDF) (منحة الاتحاد الدولي لمتلازمة لي ل A.P.)، مستشفى دوسلدورف الجامعي (Forschungskommission UKD إلى A.P.)، ووزارة التعليم والبحوث الاتحادية الألمانية (BMBF) (e: بيو الشباب المحقق منح AZ 031L0211 إلى A.P.). تم دعم العمل في مختبر C.R.R. من قبل DFG (FOR 2795 "نقاط الاشتباك العصبي تحت الضغط"، Ro 2327/13-1).
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| Affinity Designer | Serif (Europe) Ltd | Layout software; Vector graphics editor | |
| Alexa Fluor 488 donkey anti-guinea pig | Sigma Aldrich | SAB4600033-250UL | 1:300 |
| Alexa Fluor 488 donkey anti-mouse | Thermo Fisher Scientific | A-31571 | 1:300 |
| Antimycin A | Sigma Aldrich | 1397-94-0 | |
| Anti-β-Tubulin III (TUJ-1) | Sigma Aldrich | T8578 | 1:2000 |
| Argon Laser | Melles Griot | Any other Laser, e.g., diode lasers emitting 488 is fine, too | |
| Ascorbic acid | Sigma | A92902 | |
| B-27 with Vitamin A | Gibco | 17504044 | |
| Bacto Agar | Becton Dickinson | 3% in PBS, store solution at -20 °C | |
| BDNF | Miltenyi Biotec | 130-093-0811 | |
| cAMP | Sigma | D0627 | |
| Cell Star cell culture 6 well plate | Greiner-Bio-One | 657160 | |
| Chemically Defined Lipid Concentrate | Gibco | 11905031 | |
| Confocal laser scanning microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement membrane matrix, Phenol Red-free, LDEV-free | Corning | 356231 | Matrix component |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher | C7026 | |
| DMEM/F12 | ThermoFisher | 31330038 | |
| DMSO | Sigma | D2660-100ML | |
| Donkey anti-goat Cy3 | Merck Millipore | AP180C | 1:300 |
| Donkey anti-mouse Cy3 | Merck Millipore | AP192C | 1:300 |
| Donkey anti-rabbit Cy3 | Merck Millipore | AP182C | 1:300 |
| DPBS | Gibco | 14190250 | |
| DS-Q1Mc camera | Nikon Microscope Solutions | ||
| Eclipse 90i upright widefield microscope | Nikon Microscope Solutions | ||
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse Ts2 Inverted Microscope | Nikon Microsope Solutions | ||
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| FCCP | Sigma Aldrich | 370-86-5 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| GDNF | Miltenyi Biotec | 130-096-291 | |
| Glasgow MEM | Gibco | 11710-035 | |
| Glass Pasteur pipette | Brand | 747715 | Inverted |
| Glutamax | Gibco | 35050-061 | |
| Helium-Neon Laser | Melles Griot | Every other Laser, e.g., diode lasers emitting 594 is fine, too | |
| Heparin | Merck | H3149-25KU | |
| HERACell 240i CO2 Incubator | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Invitrogen | H3570 | 1:2500 |
| Image J 1.53c | Wayne Rasband National Institute of Health | Image processing Software | |
| Injekt Solo 10 mL/ Luer | Braun | 4606108V | |
| Knockout Serum Replacement | Gibco | 10828010 | |
| Laser (407 nm) | Coherent | Any other Laser, e.g., diode lasers emitting 407 is fine, too | |
| Map2 | Synaptic Systems | No. 188004 | 1:1000 |
| Maxisafe 2030i | |||
| MEM NEAA | Gibco | 11140-050 | |
| mTeSR Plus | Stemcell Technology | 85850 | iPSC medium |
| Multifuge X3R Centrifuge | Thermo Scientific | 10325804 | |
| MycoAlert Mycoplasma Detection Kit | Lonza | # LT07-218 | |
| N2 Supplement | Gibco | 17502-048 | |
| Needle for single usage (23G x 1” TW) | Neoject | 10016 | |
| NIS-Elements Aadvanced Research 3.2 | Nikon | Imaging software | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Orbital Shaker Heidolph Unimax 1010 | Heidolph | 543-12310-00 | |
| PAP Pen | Sigma | Z377821-1EA | To draw hydrophobic barrier on slides. |
| Papain Dissociation System kit | Worthington | LK003150 | |
| Paraformaldehyde | Merck | 818715 | 4% in PBS, store solution at -20 °C |
| Pasteur pipette 7mL | VWR | 612-1681 | Graduated up to 3 mL |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Plan Apo VC 20x / 0.75 air DIC N2 ∞/0.17 WD 1.0 | Nikon Microscope Solutions | Dry Microscope Objective | |
| Plan Apo VC 60x / 1.40 oil DIC N2 ∞/0.17 WD 0.13 | Nikon Microscope Solutions | Oil Immersion Microscope Objective | |
| Polystyrene Petri dish (100 mm) | Greiner Bio-One | 664161 | |
| Polystyrene round-bottom tube with cell-strainer cap (5 mL) | Falcon | 352235 | |
| Potassium chloride | Roth | 6781.1 | |
| ProLong Glass Antifade Moutant | Invitrogen | P36980 | |
| Qualitative filter paper | VWR | 516-0813 | |
| Rock Inhibitior | Merck | SCM075 | |
| Rotenone | Sigma | 83-794 | |
| S100β | Abcam | Ab11178 | 1:600 |
| SB-431542 | Cayman Chemical Company | 13031 | |
| Scalpel blades | Heinz Herenz Hamburq | 1110918 | |
| SMI312 | Biolegend | 837904 | 1:500 |
| Sodium bicarbonate | Merck/Sigma | 31437-1kg-M | |
| Sodium chloride | Roth | 3957 | |
| Sodium dihydrogen phosphate | Applichem | 131965 | |
| Sodium Pyruvate | Gibco | 11360070 | |
| SOX2 | Santa Cruz Biotechnology | Sc-17320 | 1:100 |
| StemPro Accutase Cell Dissociation Reagent | Gibco/StemPro | A1110501 | Reagent A |
| Super Glue Gel | UHU | 63261 | adhesive gel |
| SuperFrost Plus | VWR | 631-0108 | |
| Syringe for single usage (1 mL) | BD Plastipak | 300015 | |
| TB2 Thermoblock | Biometra | ||
| TC Plate 24 Well | Sarstedt | 83.3922 | |
| TC Plate 6 Well | Sarstedt | 83.392 | |
| TGFbeta3 | Miltenyi Biotec | 130-094-007 | |
| Tissue Culture Hood | ThermoFisher | 51032711 | |
| TOM20 | Santa Cruz Biotechnology | SC-11415 | 1:200 |
| Triton-X | Merck | X100-5ML | |
| UltraPure 0.5M EDTA | Invitrogen | 15575020 | |
| Vibratome Microm HM 650 V | Thermo Scientific | Production terminated, any other adjustable microtome is fine, too. | |
| Vibratome Wilkinson Classic Razor Blade | Wilkinson Sword | 70517470 | |
| Whatman Benchkote | Merck/Sigma | 28418852 | |
| Wnt Antagonist I | EMD Millipore Corp | 3378738 | |
| XF 96 extracellular flux analyser | Seahorse Bioscience | 100737-101 | |
| XF Assay DMEM Medium | Seahorse Bioscience | 103680-100 | |
| XF Calibrant Solution | Seahorse Bioscience | 100840-000 | |
| XFe96 FluxPak (96-well microplate) | Seahorse Bioscience | 102416-100 |
References
- Koopman, W. J., Willems, P. H., Smeitink, J. A. Monogenic mitochondrial disorders. New England Journal of Medicine. 366 (12), 1132-1141 (2012).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Review Disease Primers. 2, 16080 (2016).
- Vafai, S. B., Mootha, V. K. Mitochondrial disorders as windows into an ancient organelle. Nature. 491 (7424), 374-383 (2012).
- Carelli, V., Chan, D. C. Mitochondrial DNA: impacting central and peripheral nervous systems. Neuron. 84 (6), 1126-1142 (2014).
- Russell, O. M., Gorman, G. S., Lightowlers, R. N., Turnbull, D. M. Mitochondrial diseases: hope for the future. Cell. 181 (1), 168-188 (2020).
- Weissig, V. Drug development for the therapy of mitochondrial diseases. Trends in Molecular Medicine. 26 (1), 40-57 (2020).
- Tyynismaa, H., Suomalainen, A. Mouse models of mitochondrial DNA defects and their relevance for human disease. EMBO Reports. 10 (2), 137-143 (2009).
- Ma, H., et al. Metabolic rescue in pluripotent cells from patients with mtDNA disease. Nature. 524 (7564), 234-238 (2015).
- Galera-Monge, T., et al. Mitochondrial dysfunction and calcium dysregulation in Leigh syndrome induced pluripotent stem cell derived neurons. International Journal of Molecular Science. 21 (9), 3191 (2020).
- Zheng, X., et al. Alleviation of neuronal energy deficiency by mTOR inhibition as a treatment for mitochondria-related neurodegeneration. Elife. 5, 13378 (2016).
- Lorenz, C., et al. Human iPSC-derived neural progenitors are an effective drug discovery model for neurological mtDNA disorders. Cell Stem Cell. 20 (5), 659-674 (2017).
- Inak, G., et al. Concise review: induced pluripotent stem cell-based drug discovery for mitochondrial disease. Stem Cells. 35 (7), 1655-1662 (2017).
- Chiaradia, I., Lancaster, M. A. Brain organoids for the study of human neurobiology at the interface of in vitro and in vivo. Nature Neuroscience. 23 (12), 1496-1508 (2020).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocol. 9 (10), 2329-2340 (2014).
- Liput, M., et al. Tools and approaches for analyzing the role of mitochondria in health, development and disease using human cerebral organoids. Developmental Neurobiology. , (2021).
- Winanto, K. Z. J., Soh, B. S., Fan, Y., Ng, S. Y. Organoid cultures of MELAS neural cells reveal hyperactive Notch signaling that impacts neurodevelopment. Cell Death and Disease. 11 (3), 182 (2020).
- Romero-Morales, A. I., et al. Human iPSC-derived cerebral organoids model features of Leigh Syndrome and reveal abnormal corticogenesis. bioRxiv. , (2020).
- Inak, G., et al. Defective metabolic programming impairs early neuronal morphogenesis in neural cultures and an organoid model of Leigh syndrome. Nature Communications. 12 (1), 1929 (2021).
- Falk, M. J. Neurodevelopmental manifestations of mitochondrial disease. Journal of Developmental & Behavioral Pediatrics. 31 (7), 610-621 (2010).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Pfiffer, V., Prigione, A. Assessing the bioenergetic profile of human pluripotent stem cells. Methods in Molecular Biology. 1264, 279-288 (2015).
- Ludikhuize, M. C., Meerlo, M., Burgering, B. M. T., Colman, R. M. J. Protocol to profile the bioenergetics of organoids using Seahorse. STAR Protocols. 2 (1), 100386 (2021).
- Menacho, C., Prigione, A. Tackling mitochondrial diversity in brain function: from animal models to human brain organoids. International Journal of Biochemestry & Cell Biology. 123, 105760 (2020).
- Del Dosso, A., Urenda, J. P., Nguyen, T., Quadrato, G. Upgrading the physiological relevance of human brain organoids. Neuron. 107 (6), 1014-1028 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved