Method Article
ミトコンドリア病モデルのためのヒト脳オルガノイドの生成
要約
ヒト誘導多能性幹細胞由来の脳オルガノイドの生成とミトコンドリア病のモデル化におけるその使用に関する詳細なプロトコルについて述べています。
要約
ミトコンドリア病は、代謝の生まれ変わりエラーの最大のクラスを表し、現在不治です。これらの疾患は、根本的なメカニズムが解明されたままの神経発達上の欠陥を引き起こす。主要な障害は、患者に見られる早期発症神経障害を再現する効果的なモデルの欠如である。誘導多能性幹細胞(iPSC)の技術の進歩により、神経系の発達と組織に対する疾患の影響を調べるための3次元(3D)脳オルガノイドの生成が可能になります。これらの著者を含む研究者は、最近、ミトコンドリア障害をモデル化するためにヒト脳オルガノイドを導入しました。本論文は、ヒトiPSC由来の脳オルガノイドの堅牢な生成と、ミトコンドリアの生体エネルギープロファイリングおよびイメージング分析におけるその使用に関する詳細なプロトコルを報告する。これらの実験は、脳オルガノイドを使用して代謝および発達の機能不全を調査することを可能にし、ミトコンドリア病の神経病理学を解剖するための重要な情報を提供するかもしれない。
概要
ミトコンドリア病は、代謝の内生誤差の最大のクラスを表します1.それらは、酸化リン酸化(OXPHOS)2、呼吸連鎖集合体、ミトコンドリアダイナミクス、ミトコンドリアDNA転写または複製を含む異なるミトコンドリアプロセスを破壊する遺伝子変異によって引き起こされる。エネルギー要件を有する組織は、特にミトコンドリア機能不全4の影響を受ける。したがって、ミトコンドリア病の患者は、典型的には早期発症の神経学的症状を発症する。
現在、ミトコンドリア病の影響を受ける小児に対する治療法はない5。ミトコンドリア病の薬剤開発の大きな障害は、ヒト疾患コース6を再現する有効なモデルの欠如である。現在研究されている動物モデルのいくつかは、患者7に存在する神経学的欠陥を示さない。したがって、ミトコンドリア病の神経病理学の根底にあるメカニズムはまだ完全には理解されていない。
最近の研究では、ミトコンドリア病の影響を受けた患者からiPSCを生成し、これらの細胞を使用して患者特異的神経細胞を得た。例えば、ミトコンドリア病に伴う遺伝的欠陥、リー症候群、細胞内の収差を生じさせるのが分かっており、細胞内の生体エネルギー8,9、タンパク質合成10、及びカルシウム恒常性9,11に収差を生じる。これらの報告は、ミトコンドリア病で起こる神経障害に関する重要な機械化的手がかりを提供し、これらの不治病の創薬への道を開いた12。
しかし、2次元(2D)文化は、3D臓器13の建築の複雑さと地域組織の調査を可能にしません。このことから、患者固有のiPSCs14 に由来する3D脳オルガノイドを使用することで、研究者はさらなる重要な情報を得ることができ、それによってミトコンドリア病が神経系の発達および機能にどのような影響を与えるかを解剖するのに役立つ可能性がある15。ミトコンドリア病を調べるiPSC由来の脳オルガノイドを用いた研究は、ミトコンドリア病の神経発達成分を解明し始めている。
ミトコンドリア病に関連する変異を運ぶ脊髄オルガノイドは、ミトコンドリア脳症、乳酸アシドーシス、および脳卒中様エピソード症候群(MELAS)、神経新生の欠陥および遅れた運動ニューロン分化を示した16。ミトコンドリア病患者由来の皮質オルガノイドは、リー症候群、サイズの縮小、神経上皮芽発生の欠損、皮質アーキテクチャの喪失を示した17。リー症候群患者の脳オルガノイドは、疾患欠陥がミトコンドリア代謝にコミットできない神経前駆細胞のレベルで開始し、異常な神経細胞の分岐および形態形成を引き起こすことを示した。したがって、神経前駆物質はミトコンドリア病の細胞治療標的を表し、ミトコンドリア機能を促進する戦略は神経系の機能的発達を支え得る。
脳オルガノイドの使用は、ミトコンドリア病の神経発達成分を明らかにするのに役立つかもしれません.ミトコンドリア病は、主に早期発症神経変性症として考えられる5。しかし、神経発達上の欠陥は、発達遅延および認知障害を含むミトコンドリア病の影響を受ける患者にも存在する19。患者固有の脳オルガノイドは、これらの側面に対処し、ミトコンドリア病が人間の脳の発達にどのような影響を与えるかを解明するのに役立つ可能性があります。ミトコンドリア機能障害は、アルツハイマー病、パーキンソン病、ハンチントン病などの他のより一般的な神経疾患においても病態的役割を果たす可能性がある4。したがって、脳オルガノイドを用いた神経発達におけるミトコンドリア欠損の影響を解明することは、これらの疾患の研究にも役立つかもしれない。本論文では、ミトコンドリア病の疾患モデル化に使用できる再現性脳オルガノイドを生成するための詳細なプロトコルについて説明する。
プロトコル
注: 人間の iPSC を使用するには、倫理的な承認が必要な場合があります。本研究で用いたiPSCは、現地の倫理的承認(#2019-681)に従って健康なコントロール個人に由来した。すべての細胞培養手順は、ボンネットの下で移送する前に、慎重にすべての試薬および消耗品を消毒し、無菌細胞培養フードの下で行われなければなりません。分化に使用するヒトiPSCは、広範な培養で起こり得る潜在的なゲノム収差を避けるために、50未満の通過番号を持つべきである。細胞の多能性状態は、例えば、NANOGまたはOCT4のような多能性関連マーカーの発現を監視することによって、オルガノイド生成の前に検証されるべきである。マイコプラズマの検査は、マイコプラズマを含まない培養を確実にするために毎週実施する必要があります。
1. 脳オルガノイドの生成
- ヒトiPSCの文化
- コーティングされた6ウェルプレートのiPSC培地( 材料表参照)のフィーダーフリー条件下で培養したヒトiPSCを、37°Cおよび5%CO2の加湿組織培養インキュベーターに保管します。
注:フィーダー細胞の持ち越しは、オルガノイド分化を妨げる可能性があります。フィーダーフリー条件で少なくとも一回細胞を通過させる。 - 1:4~1:12の酵素無剥離媒体を用いて80%の合流率でiPSCを通過させる。細胞生存率を高めるには、分割後に10μM Rho関連プロテインキナーゼ(ROCK)阻害剤(Y27632)を添加します。
- コーティングされた6ウェルプレートのiPSC培地( 材料表参照)のフィーダーフリー条件下で培養したヒトiPSCを、37°Cおよび5%CO2の加湿組織培養インキュベーターに保管します。
- iPSC(80%合流率)-Day 0を解約します。
- 皮質分化培地I(CDMI)を準備する(表1)。細胞に加える前に室温(22〜25°C)でプリウォームCDMI培地。
- iPSCを含むウェルをリン酸緩衝生理食塩分(PBS)で洗浄し、死んだ細胞やデブリを除去します。
- 各ウェルに500μLのプリウォーム付き試薬A(材料表)を加え、37°Cで5分間インキュベートします。 顕微鏡で確認して、細胞の剥離を確認します。
- iPSC培地1mLを加え、試薬Aを希釈して活性を中和する。
- 1000 μL ピペットを使用して、上下にピペットをピペット化して細胞を解約し、細胞懸濁液を 15 mL 遠心管に移します。
- iPSCを125 x g で静かに遠心し、室温(22~25°C)で5分間静かに遠心します。
- 細胞ペレットを乱さないように上清を慎重に吸引する。
- 1 mLのCDMIでペレットを再懸濁して単細胞懸濁液を得て、細胞数をカウントする。
- 20 μM ROCK阻害剤、3 μM WNT-カテニン阻害剤(IWR1)、および5 μM SB431542を添加したCDMIで、100 μLあたり9,000 iPSCでシード媒体を調製します。
- 96ウェルvボトムプレートにウェルあたり100μLのシード媒体を加えます。
- プレートを加湿した組織培養インキュベーターの37°Cおよび5%CO2に保ちます。
- 神経球発生
- 1日目に、滑らかな境界線が定義された丸い細胞凝集体(神経球)が形成されていることを観察します。集計の周囲の死んだセルに注意してください。37°Cおよび5%CO2で培養器内で培養を継続する。
- 3日目、サイドを3回タップしてプレートを攪拌し、死んだ細胞を取り外します。
- 20 μM ROCK 阻害剤、3 μM IWR1、および 5 μM SB431542 を各ウェルに加えた CDMI の 100 μL を加えます。
- プレートを37°C、5%CO2でインキュベーターに戻します。
- 6日目には、各ウェルから80μLの上清培地を慎重に取り除きます。井戸の底部に触れないようにしてください。
- 3 μM IWR1 と 5 μM SB431542 を補った CDMI の 100 μL を各ウェルに加えます。プレートを37°C、5%CO2でインキュベーターに戻します。
- ステップ 5 と 6 を 3 日ごとに 18 日目まで繰り返します。
- 神経球の移動
- 18日目に皮質分化培地II(CDMII)(表1)を準備し、100mm超低付着セル培養プレートに10mLを加える。
- チップを切り取った200 μLピペットを使用して、96ウェルプレートから100mm超低い取り付け細胞培養プレートに丸い神経球を移します。
注:先端の開口部が十分に広く、凝集体があまりにも速く吸引されないことを確認することによって、神経球を損傷しないように穏やかにしてください。 - 神経球を含むプレートから培地5 mLを取り出し、5 mLの新鮮なCDMIIを加えます。
注:この手順は、神経球の移動から引き継がれた可能性のあるCDMI培地の量を減らすのに役立ちます。 - プレートを37°Cおよび5%CO2の加湿組織培養インキュベーター内の70 rpmで軌道シェーカーに置きます。
注:次の日に神経球を視覚的に検査してください。神経球が一緒に束なっているか、プレートの底に取り付けられている場合は、軌道シェーカーの速度を上げます。 - 3日ごとに、上清培地を慎重に吸引し、新鮮なCDMIIに置き換えます。少量の培地を残して、神経球が乾燥するのを防ぎます。
- 35日目に、皮質分化培地III(CDMIII)を準備する(表1)。
注: マトリックスコンポーネントは、コールド CDMIII に溶解する必要があります。 - プレートから培地を吸引し、10 mLの冷たいCDMIIIを加えます。
注:マトリックス成分が塊を形成せずにオルガノイドをコーティングできるように、冷たい媒体を使用する方が効果的です。 - 培地を交換した後、プレートを37°Cおよび5%CO2の加湿組織培養インキュベーター内の70rpmで軌道シェーカーに戻します。
- 培地の色で示されるように、成長率に応じて3〜5日ごとに培地を変更します。
- 70日目に、皮質分化培地IV(CDMIV)を準備する(表1)。オルガノイドの所望の年齢に達するまでCDMIV培地を使用してください。この期間中、プレートを加湿した組織培養インキュベーター(37°Cおよび5%CO2)内で70rpmにセットした軌道シェーカーに置いてください。
- 成長率に応じて、3〜5日ごとに培地を変更します。
2. 脳オルガノイドの免疫染色
- 組織の準備
- 4%パラホルムアルデヒド(PFA)溶液を調製し、安全フードの下に置きます。
注:PFAを取り扱う際には、個人の安全装置を着用してください。 - 脳オルガノイドを収集し、穏やかにPFAで満たされた6ウェルプレートに鈍い先端3 mLプラスチックパスツールピペットでそれらを転送します。
注:40日以上前のオルガノイドを使用して、細胞の複雑度が高い構造を視覚化できるようにします。 - PFA溶液中のオルガノイドを室温で1時間保ちます。
- 慎重に3 mLプラスチックパスツールピペットでPFAを除去し、PBSを使用して固定オルガノイドを3回洗浄します。
- 固定オルガノイドは、さらに使用されるまでPBSで4°Cで保管してください。
- 4%パラホルムアルデヒド(PFA)溶液を調製し、安全フードの下に置きます。
- 脳オルガノイドスライスの調製
- 3%寒天溶液を調製し、液化するまでゆっくりと加熱します。
- 金型(10 mLシリンジのカットエンド)を吸収性フィルターペーパー(滑らかな側を上に)に置きます。その上に寒天の液滴を置きます。
- スパチュラで6ウェルプレートから単一のオルガノイドを素早く取り出し、濾紙で過剰なPBSを取り除きます。
メモ:フィルターペーパーでオルガノイドに直接触れないように注意してください。 - オルガノイドを寒天液滴の上に置きます。
- 最大3つのオルガノイドでこの手順を繰り返します。
注:このステップ中に寒天の固化を避けるために速く働きます。 - オルガノイドが完全に覆われるまで、金型に寒天を補充します。
- 寒天が固まり始めるまで待ってから、吸収性ろ過用紙を含むオルガノイドを含むモールド全体を冷却要素に静かに移します。
注:冷却要素が使用できない場合は、オルガノイドを4°Cの冷蔵庫に数分間保管してください。 - その間、スライス手順の準備をする:カミソリの刃(アセトンで洗浄し、二重蒸留水で洗浄)をビブラートのホルダーに入れ、お風呂に取り付け、PBSで満たします。
- (固化した)寒天から金型を取り出し、メスを使用して立方体を形成するためにそれをトリミングします。
- ビブラートドームの担体プレートにオルガノイドを含む寒天キューブを接着ゲル( 材料表参照)で貼り付け、PBSを含む浴槽に入れる。
- ビブラートを調整し( 材料表を参照)、スライスを150 μmの厚さにカットします。
注:ビブラートの設定(ブレードの適切な角度、振幅、周波数、および速度)は、早期出生後の動物に由来する固定脳組織をスライスするために使用されるものと同様である可能性があります。しかし、理想的な設定はビブラートの種類に強く依存し、切断中に組織の歪みや裂け目を防ぐために最初のステップで決定する必要があります。 - 切断手順を開始します。ガラスピペットまたはスパチュラを使用して、切りたてのスライスをPBSで満たされた24ウェルプレートにそっと移します。
- スライスを含むプレートは、さらに処理されるまで4°C(最大数日)に保管してください。
- ガラスピペットまたはヘラを顕微鏡スライドに入れて、プレートからスライスを移します。スライドごとに最低 2 つのスライスを使用します。
- 慎重に寒天と余分なPBSを注射器で除去します。
- スライスがスライドに付着するまで乾燥させます。
注:顕微鏡のスライドは4°CでPBSで満たされたプラスチックの部屋に保存することができますが、それらはスライス手順の後にできるだけ早く染色する必要があります。
- 免疫ヒストケミカル染色
- ブロッキングソリューションを準備します(表1)。
- PAP ペンを使用して、スライド上のスライスの周囲に疎水性の境界線を描画し、スライド上のすべてのソリューションを維持します。
- スライドにブロッキング液を慎重に加え、室温(22~25°C)で1時間インキュベートします。組織を破壊しないように、スライスの上に直接溶液を追加しないでください。
- ブロッキング溶液を吸引し、ブロッキング溶液に希釈した所望の一次抗体を塗布する。
- 4°Cの加湿チャンバーに一晩スライドをインキュベートします。
- スライドを1x PBSで3回、それぞれ10分間すすいでください。
- ブロッキング溶液で希釈した特異的二次抗体でスライスをインキュベートし、暗闇の中で室温で1時間のHoechst染色(1:2,500)を行います。
注:非特異的な結合または自動蛍光がないことを確認するために陰性制御を行うことを忘れないでください。 - 暗闇の中でそれぞれ10分間1倍のPBSで3回リンスします。
- スライスに取り付け媒体を1滴追加し、ドロップの端にカバースリップを置き、気泡を避けるためにゆっくりとスライスに向かってカバースリップを下に置きます。
- スライドを室温で一晩休ませてください。カバースリップの境界にマニキュアを適用して、スライドをさらに密封します。長期保存のため、4°Cで保管してください。
- 染色のドキュメンテーション
- ステッチのための大きな画像をスキャンするには、(詳細については 、材料のテーブル を参照してください)を装備した電動直立広視野顕微鏡を使用して、高品質の目標。DAPIフィルタセット(例えば、励起(EX):340-380 nm、ダイクロリックミラー(DM):400nm、バリアフィルタ(BA):435-485nm;フルオレセインイソチオシアネートフィルターセット(例えば、EX:465-495 nm、DM:505 nm、BA:515-555nm);Alexa594フィルタセット(例えば、ET 575/40;T 600 LPXR;HC 623/24);デジタルカメラ。高性能の取得ソフトウェアにより、自動ステッチとスタック操作が可能になります。
- 画像処理には、8ビットのtifファイルの生成、ステッチのトリミング、コントラストと明るさの調整、チャンネルの結合(例えば、青、緑、赤)、スケールバーの追加が可能な画像処理プログラムを使用します。
- 詳細をスキャンするには、高品質の目的、UVレーザー(EX:408 nm)、アルゴンレーザー(EX:488 nm)、ヘリウムネオンレーザー(EX:543)、共焦点顕微鏡用イメージングソフトウェアを搭載した電動共焦点レーザー走査顕微鏡を使用してください。
- 詳細の画像処理には、共焦点zスタックの最大強度投影(例えば、0.6μmの光学部分)を生成できる画像処理プログラムを使用し、8ビットのtifファイルを生成し、コントラストと明るさを調整し、チャンネルをマージ(例えば、青、緑、赤)、スケールバーを追加します。
- グラフィックエディタを使用して図形を配置します。
3. 脳オルガノイドのバイオエネルギープロファイリング
- バイオエネルギープロファイリングのためのオルガノイドの調製
- メーカーのプロトコルに従ってパパインとDNaseソリューションを準備します。
- 3~5オルガノイドを6ウェルプレートに移します。プリウォームドPBSで2回洗います。
- DNaseを含む2mLのプレウォーム活性化パパイン溶液を加える。刃を使ってオルガノイドを小さく切る。
- プレートを細胞培養インキュベーター内(37°C、5%CO2)内で27rpmにセットした軌道シェーカーに置き、15〜20分間インキュベートします。
注意:インキュベーションの時間はオルガノイドステージによって異なります。初期のオルガノイドは、その中身として使用することができます。オルガノイドが3ヶ月以上かかる場合は、解離前にオルガノイドを2〜3個にカットし、37°Cで15〜20分間27rpmに設定されたロッキングスピードでインキュベートすることをお勧めします。 この手順は、後段のオルガノイドに存在し得る壊死組織を除去するのに役立ちます。 - 消化した組織を15mLチューブに集め、5mLのオルガノイド培養培地CDMIVを加える(表1)。
- 10 mLのプラスチックピペットで組織を10〜15回上下にピペット化してトリチュレートします。解き放つ組織をチューブの底まで落ち着かせましょう。
- 慎重に細胞懸濁液を15 mLチューブに移し、解き分けのない組織の断片を避けます。40 μmの細胞ストレーナー(例えば、ポリスチレン丸底チューブ、セルストレーナーキャップ付き)を通して溶液をフィルターします。
- ペレットは、室温で5分間300xgで遠心分離して細胞をペレット化した。
- トリパンブルーを使用して、セルの数と品質を評価します。
- コーティングされた96ウェルマイクロプレートに細胞の所望の数(約20,000/well)をプレートします。メッキ後6~8時間をニューロン培地に変更する(表1)。
- CO2インキュベーター(37°C、5%CO2)にコーティングされた96ウェルマイクロプレートを4日間インキュベートします。
- バイオエネルギープロファイリング
- 解約した細胞を再めっきした3日目に、96ウェルマイクロプレートの下部の各ウェルに200μLのキャリブレーション液を追加し、水和したマイクロプレートに上部の緑色のセンサーカートリッジを置きます。
メモ:センサーカートリッジをマイクロプレートの上に正しい向きで置き、キャリブラントソリューションがすべてのセンサーを覆っていることを確認します。 - 水分補給された96ウェルマイクロプレートを一晩37°Cで非CO2 インキュベーターにインキュベートします。
- アナライザをオンにして、一晩で37 °Cで安定させます。
- 再めっき後4日目に、顕微鏡下で96ウェルマイクロプレート上の非関連オルガノイド培養を検査し、細胞がコンフルエント単層として現れるようにします。
- アッセイ媒体を準備する(表1)。
- 細胞の損傷を防ぐためにウェルの底部に触れることなく、ピペットですべての井戸からニューロン培地を除去します。また、慎重にプレート全体を反転し、きれいな紙の上で乾燥させます。細胞死を避けるために迅速に作業します。
- 細胞をアッセイ培地の200μLを温め、2回洗浄します。アッセイ媒体を井戸あたり180μLの最終容積に加えます。37°Cで37°Cで96ウェルマイクロプレートを1 時間インキュベートします。
- ミトコンドリア阻害剤の溶液をアッセイ培地に10μM調製します。なお、射出後の最終濃度は1μMです。
- ミトコンドリア阻害剤の10倍溶液で水和マイクロプレートに置かれたセンサーカートリッジをロードします。
- ミトコンドリア阻害剤1の18μLをポートAに加える。
- 19.8 μLのミトコンドリア阻害剤2をポートBに加えます。
- 21.6 μLのミトコンドリア阻害剤2をポートCに加える。
- 23.4 μLのミトコンドリア阻害剤3をポートDに加える。
- ロードされたカートリッジを、アッセイが始まるまで37°Cの非CO2 インキュベーターの水和マイクロプレートに入れる。
- 計測器のソフトウェアで実行中のプロトコルを設定します(表2)。
- [スタート] ボタンを押します。CO2インキュベーターから装填されたカートリッジを取り出し、キャリブレーションのためにアナライザーに入れてください。
メモ:プレートが正しい方向に挿入され、蓋が付いないようにしてください。 - キャリブレーションステップが終了したら、キャリブレーションプレートを取り外します。非CO2 インキュベーターから96ウェルマイクロプレートを取り出し、それを分析器に入れる。 [続行 ]をクリックして測定を開始します。
- 実行が終了したら、分析装置から96ウェル細胞培養マイクロプレートを取り出し、細胞を邪魔することなくすべてのウェルから培地を収集します。
注:培地は-20°Cで保存することができ、適切な乳酸アッセイキットを使用して培地中の細胞によって放出される乳酸塩の量を測定するために後で使用することができます。 - 各ウェルに200 μLの1x PBSで細胞を洗浄します。
- PBSを取り除いた後、プレートを-20°Cで凍結します。
注:凍結プレートは、マイクロプレートの各ウェル内の細胞、タンパク質、またはDNAを定量するために使用できます。この定量化は、得られた生体エネルギー速度を正常化するために必要とされる。細胞、タンパク質、または DNA 定量アッセイの製造元の指示に従ってください。
- 解約した細胞を再めっきした3日目に、96ウェルマイクロプレートの下部の各ウェルに200μLのキャリブレーション液を追加し、水和したマイクロプレートに上部の緑色のセンサーカートリッジを置きます。
結果
ここで説明するプロトコルは、丸型オルガノイドの堅牢な生成を容易にする(図1A)。生成されたオルガノイドには、軸索(SMI312)および樹状突起(微小管関連タンパク質2(MAP2))に特異的なタンパク質マーカーを使用して視覚化できる成熟したニューロンが含まれています(図1B)。成熟したオルガノイドは、神経細胞(MAP2陽性)だけでなく、グリア細胞(例えば、アストロサイトマーカーS100カルシウム結合タンパク質B(S100ß)に陽性)も含む(図1B)。
共焦点顕微鏡を用いて、切れた脳オルガノイドを解析することで、細胞型や細胞構造の詳細な分布や組織を特定し、監視することが可能です。これは、ミトコンドリア病が神経系の発達にどのような影響を与えるかについての新しい洞察を提供する可能性があります。例えば、神経軸索(SMI312陽性)および樹状突起(MAP2陽性)(図2A)または神経細胞(MAP2陽性)とグリア細胞の相互発生(S100ß陽性)を監視することが可能である(図2A)。共焦点画像は、ニューロン(β-III管状(TUJ1)陽性)に対する神経前駆物質((性別決定領域Y)ボックス-2(SOX2)陽性)の分布と組織をより詳細に調べるのに役立つかもしれません(図2B)。最後に、脳オルガノイドはミトコンドリア特異的マーカー(例えばミトコンドリア膜タンパク質、外膜20kDaサブユニットのトランスロケース(TOM20))について染色することができる(図2C)。
記載されたプロトコルは、研究者が脳オルガノイドの生体エネルギープロファイリングを行うことを可能にする。この手順を用いて、酸素消費率(OCR)を用いたミトコンドリア代謝 (図2D) と細胞外酸性化率(ECAR)を用いた解糖代謝の両方を測定することができる (図2E)。バイオエネルギッシュプロファイリングは、細胞がミトコンドリア阻害剤の逐次投与に応答してOCRおよびECARプロファイルをどのように変更するかを監視することを可能にする。
まず、ATPシンターゼ阻害剤、オリゴマイシン、適用することができる。オリゴマイシンはOCRプロファイルの低下を引き起こす(図2D)ため、ATP生産に必要なOCRを特定します。オリゴマイシン処理の際に、ECARの代償的増加(図2E)もあり、細胞が解糖分解をアップレジトリー状態にして、ミトコンドリア代謝の低下によって引き起こされる代謝ストレスを防ぐことができることを示唆している。その後のプロトンイオノフォアの二重塗布により、カルボニルシアニド-p-トリフルオロモキシフェニルヒドラゾン(FCCP)は、ミトコンドリア膜電位の損失を引き起こす。酸素分子が自由に動くため、OCRが急激に増加します(図2D)。
OCRプロファイルにおけるこれらの変化は、細胞の最大呼吸能力を特定する。ロテロンとアンチマイシンAの最終投与は、電子輸送のブロックを引き起こし、したがって、OCRの急激な減少 (図2D)を引き起こす。ECARは、細胞の残留解糖能力に応じて、FCCPおよびロテノンプラスアンチマイシンA (図2E)での処理後の変動を示す可能性がある。OCRおよびECARプロファイルは、ミトコンドリア患者に由来する脳オルガノイドにおいて劇的に変化する可能性がある。
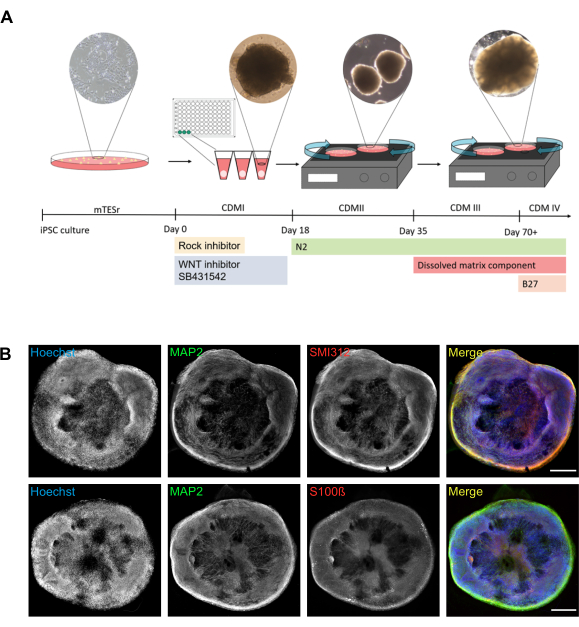
図1 ヒトiPSCからの脳オルガノイドの生成(A)対応する透過画像を持つ脳オルガノイドを生成するために使用されるプロトコルの模式的表現。0日目は、ロック阻害剤、WNT阻害剤、およびSB431542を加えたCDMIを使用したV-底を有するiPSCと96ウェルプレートでのiPSCと播種の解離に相当します。18日目に、神経球はN2を補充したCDMIIと共に96ウェルプレートから100mmの細胞培養皿に移される。この時点以降、培養は軌道シェーカーの上に配置されます。35日目に、培地はCDMIIからCDMIIIに切り替え、それにも溶解マトリックス成分が含まれている(表1)。70日目以降、CDMIIIはB27を補充したCDMIVに切り替えられます。代表的な神経球像を12日目に10倍の倍率の顕微鏡カメラを用いて撮影した。22日目に4倍の倍率で顕微鏡カメラを使用して初期のオルガノイド画像を撮影した。4倍倍の顕微鏡カメラを用いて40日目に成熟したオルガノイド像を撮影した。(B) 脳オルガノイドの全体的な構造と細胞組織は、広視野顕微鏡を用いて可視化することができる。代表的なステッチされた広視野画像は、樹状突起(MAP2陽性)と軸索(SMI312陽性)、およびニューロン細胞(MAP2陽性)と推定アストロサイト(S100-陽性)との関係を視覚化するために示されている。細胞を、核を明らかにするためにHoechstで対数化した。すべての画像は、78日齢の脳オルガノイドを使用して撮影されました。右の列には、3 つのチャンネルのオーバーレイが表示されます (マージ)。スケールバー= 500 μm略語: iPSC = 誘導多能性幹細胞;CDM = 皮質分化培地;ロック = ローキナーゼ;MAP2 = 微小管関連タンパク質 2;S100ß= S100カルシウム結合タンパク質B. ここをクリックして、この図のより大きなバージョンを表示してください。

図2 ミトコンドリア病モデルのための脳オルガノイドの可視化とバイオエネルギープロファイリングオルガノイドの詳細な組織とアーキテクチャは、共焦点顕微鏡を用いて分析することができる。すべての画像は、78日齢の脳オルガノイドとカウンターを使用して採取され、核を明らかにするためにHoechstで染色されました。右の列には、3 つのチャンネルのオーバーレイが表示されます (マージ)。スケールバー= 50 μm(A)デンドライト(MAP2陽性、矢印)と軸索(SMI312陽性、矢印)と神経細胞(MAP2陽性、矢印)と推定アストロサイト(S100-矢印)と推定アストロサイト(S100-矢印)の相互作用に対処する代表的な拡張焦点投影(44-48光学平面、各0.6 μm)(B)代表的な拡張焦点投影(14-31光学平面、各0.6μm)は、神経前駆物質(SOX2陽性、矢印)に対するニューロン(TUJ1陽性、矢印)の分布を示す。(C)代表的な拡張焦点投影(20個の光学平面、0.6μmずつ)は、ミトコンドリアのニューロン内の分布(TUJ1陽性、矢印頭)(外ミトコンドリア膜タンパク質TOM20、矢印に対する抗体を用いて可視化)(D)脳オルガノイドのミトコンドリア呼吸は、異なるミトコンドリア阻害剤の逐次投与後のOCRのプロファイルに基づいて監視することができる(詳細については、テキストを参照)。(e)脳オルガノイドの解糖活性は、ミトコンドリア阻害剤の逐次投与に基づいてECARに基づいて監視することができる(詳細はテキストを参照)。生体エネルギープロファイリングでは、約10〜15個の脳オルガノイドを解約し、96ウェルマイクロプレートに再プラッキするのに十分な細胞を得た。棒は2つの独立した実験で得られた結果に基づいてSEMを示す。略語: MAP2 = 微小管関連タンパク質 2;S100ß = S100カルシウム結合タンパク質B;TUJ1 = β-IIIチューブリン;SOX2 = (性決定領域 Y) ボックス-2;TOM20 = 外膜のトランスロケース 20 kDa サブユニット;OCR = 酸素消費率;ECAR = 細胞外酸性化率;オリゴム。= オリゴマイシン;FCCP = カルボニルシアニド-p-トリフルオロメトキシフェニルヒドラゾン;R = ロテノーネ;AntA = アンティマイシン A;SE = 平均の標準誤差。この図の大きなバージョンを表示するには、ここをクリックしてください。
| メディア構成 | |||
| CDMI(0-18日目) | 最後の簡潔な. | ||
| グラスゴー-MEM | ギブコ | 11710-035 | [1:1] |
| ノックアウト血清交換(KSR) | ギブコ | 10828010 | 20% |
| MEM-NEAA (MEM非必須アミノ酸溶液) | ギブコ | 11140-050 | 0.1 mM |
| ピルビン酸ナトリウム | ギブコ | 11360070 | 1 mM |
| 2-メルカプエタノール | ギブコ | 31350-010 | 0.1 mM |
| ペニシリンとストレプトマイシン | ギブコ | 15140-122 | 100 U/mLおよび100 μg/mL |
| CDMII(18-35日目) | 最後の簡潔な. | ||
| DMEM/F12 | ギブコ | 31330038 | [1:1] |
| グルタマックス | ギブコ | 35050-061 | 2 mM |
| N-2 サプリメント (100x) | ギブコ | 17502-048 | 1% |
| 化学的に定義された脂質濃縮物 | ギブコ | 11905031 | 1% |
| ペニシリンとストレプトマイシン | ギブコ | 15140-122 | 100 U/mLおよび100 μg/mL |
| CDMIII(35-70日目) | 最後の簡潔な. | ||
| DMEM/F12 | ギブコ | 31330038 | [1:1] |
| グルタマックス | ギブコ | 35050-061 | 2 mM |
| N-2 サプリメント (100x) | ギブコ | 17502-048 | 1% |
| 化学的に定義された脂質濃縮物 | ギブコ | 11905031 | 1% |
| ペニシリンとストレプトマイシン | ギブコ | 15140-122 | 100 U/mLおよび100 μg/mL |
| 牛胎児血清 (FBS) | ギブコ | 10270-106 | 10% |
| ヘパリン | メルク | H3149-25KU | 5 μg/mL |
| マトリゲル | コーニング | 356231 | 1% |
| CDMIV(70日以上) | 最後の簡潔な. | ||
| DMEM/F12 | ギブコ | 31330038 | [1:1] |
| グルタマックス | ギブコ | 35050-061 | 2 mM |
| N-2 サプリメント (100x) | ギブコ | 17502-048 | 1% |
| 化学的に定義された脂質濃縮物 | ギブコ | 11905031 | 1% |
| ペニシリンとストレプトマイシン | ギブコ | 15140-122 | 100 U/mLおよび100 μg/mL |
| 牛胎児血清 (FBS) | ギブコ | 10270-106 | 10% |
| ヘパリン | メルク | H3149-25KU | 5 μg/mL |
| マトリゲル | コーニング | 356231 | 2% |
| ビタミンA 50xとB-27サプリメント | ギブコ | 17504044 | 2% |
| 神経細胞培地 | 最後の簡潔な. | ||
| DMEM/F12 | ギブコ | 31330038 | [1:1] |
| N-2 サプリメント | ギブコ | 17502048 | [1x] |
| ビタミンA 50xのB-27サプリメント | ギブコ | 17504044 | [1x] |
| L-アスコルビン酸 | シグマ・アルドリッチ | A92902 | [200 μM] |
| db-cAMP (ジブチル環状アデノシン一リン酸) | シグマ・アルドリッチ | D0627 | 500 μM |
| BDNF (脳由来中型栄養因子) | マックス ミルテニ | 130-093-811 | [10 ng/mL] |
| GDNF (グリア細胞系由来神経栄養因子) | マックス ミルテニ | 130-096-290 | [10 ng/mL] |
| ヒトTGF-β3(成長因子-β3の転換) | マックス ミルテニ | 130-094-007 | [1 ng/mL] |
| アッセイミディアム | 最後の簡潔な. | ||
| タツノオトシゴ XF DMEM培地 | タツノオトシゴバイオサイエンス | 103680-100 | 500 mL |
| ピルビン酸ナトリウム | ギブコ | 11360070 | 1 mM |
| L-グルタミン | ロンザ | BEBP17-605E | 2 mM |
| グルコース | シグマ・アルドリッチ | 50-99-7 | 10mM |
| ソリューションのブロック | 最後の簡潔な. | ||
| PBS-トゥイーン | [1:1] 0.1% トゥイーン | ||
| ロバ血清 | シグマ・アルドリッチ | D9663 | 10% |
| トリトン-X | メルク | X100-5ML | 1% |
表1:オルガノイド生成に用いるメディアとソリューションの詳細
| 初期化 | ベースライン (X3) | オリゴマイシン注射 (X3) | FCCP インジェクション (X3) | FCCP インジェクション (X3) | アンチA+腐敗注射(X3) |
| 較正する | 混ぜる | 混ぜる | 混ぜる | 混ぜる | 混ぜる |
| (04:00) | (04:00) | (04:00) | (04:00) | (04:00) | |
| 平衡 (12:00) | 待つ | 待つ | 待つ | 待つ | 待つ |
| (02:00) | (02:00) | (02:00) | (02:00) | (02:00) | |
| 測定 (03:00) | 測定 (03:00) | 測定 (03:00) | 測る | 測定 (03:00) | |
| (03:00) |
表2:バイオエネルギープロファイリングのためのプロトコル設定 シーホースウェーブデスクトップソフトウェアを使用して、ステップとその長さ(分)の説明。略称: FCCP = シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン;腐敗 = ロテノーネ;抗A=アンチマイシンA.
ディスカッション
本論文では、ヒトiPSC由来の脳オルガノイドの再現性のある生成と、ミトコンドリア病のモデル化に用いることを説明する。ここで説明するプロトコルは、以前に公開された work20 に基づいて変更されます。本プロトコルの大きな利点の1つは、各オルガノイドを足場マトリックスに手動で埋め込む必要がなされないことである。実際、マトリックス溶液は、細胞培養培地に単に溶解される。さらに、オルガノイドはインキュベーター内の軌道シェーカー上に配置された標準的な組織培養6ウェルプレートで培養することができるので、高価なバイオリアクターを採用する必要はありません。この手順はまた、様々な個々のラインに由来する異なるオルガノイドを含む複数のプレートの並列栽培を可能にし、それによって実験のスループットを高め、異なるオルガノイドの成長プロファイルに出現する潜在的な違いをモニタリングすることを可能にする。我々は、一貫した結果で、健康なコントロールに由来する異なるiPSCとミトコンドリア病の影響を受ける個人を用いてこのプロトコルをテストした。
ミトコンドリア病のモデル化には、ミトコンドリアネットワークの形態や組織を可視化するために、異なるマーカーを用いることが不可欠です。この手順により、ミトコンドリア病患者由来の脳オルガノイドにおいてミトコンドリア数、形態、または分布が変化する可能性があるかどうかの調査が可能になる。脳オルガノイド内の神経前駆物質の存在と組織化は、ミトコンドリア障害をモデル化する上で極めて重要である可能性がある。我々は最近、ミトコンドリア病を引き起こす突然変異、リー症候群が、患者由来の脳オルガノイド内の神経前駆細胞の細胞アーキテクチャと分布を破壊することを発見した。
生体エネルギープロファイリングを行う場合、多能性幹細胞21の生体エネルギーを評価するために先に説明した方法を適応した。最近のプロトコルでは、マウス小腸、ヒト結腸、大腸腫瘍に由来するオルガノイドの生体エネルギープロファイリングを行う方法について説明した。しかし、これらのオルガノイドは脳オルガノイドに比べて非常に小さいため、ここで報告されたプロトコルのような異なるプロトコルが脳オルガノイドに必要です。我々は最近、重度のミトコンドリア病を引き起こすサーフェイト遺伝子1遺伝子(SURF1) の変異を運ぶヒト脳オルガノイドの生体エネルギープロファイルを評価するためにこのプロトコルを採用した、 Leigh症候群18。我々は、基底OCRレベル、ATP産生率、および最大呼吸率18の有意な減少によって示されるように、OCRプロファイルがリー症候群オルガノイドで特に影響を受けていることを発見した。
結論として、ヒト脳オルガノイドの堅牢な生成のための詳細なプロトコルをここに提示し、ミトコンドリア病の根底にある疾患メカニズムの調査に重要な実験を行う方法を説明する。ヒトの脳オルガノイドは、ヒトの脳におけるミトコンドリアの多様性と、ヒトの健康と疾患におけるその役割を解明するために非常に重要である可能性があります23。ここで説明したものも含め、現在利用可能なプロトコルで生成された脳オルガノイドは依然として限界を負っていることを明確にすることが重要です。これらには、例えば、血管化の欠如およびミクログリア集団の不在が含まれる24。これらの側面は、結果を正しく解釈するために考慮する必要があります。
例えば、血管系およびミクログリアの欠如は、生体内で実施される可能性のある補償メカニズムを制限する可能性がある。患者由来の脳オルガノイドは、患者17,18で観察されたものよりも強い欠陥を示す可能性があります。また、このプロトコル20の一般的な再現性にもかかわらず、ライン間の異種性が観察され得る。そのためには、疾患モデル化研究を行う際に、形態(大きさ、層)のパターンと、異なるオルガノイド間の分子マーカー分布を評価することによって、制御と患者オルガノイドの均一性を体系的に定量化することが常に重要である。
最後に、単一のiPSCから脳オルガノイドを生成することは不可能であり、CRISPR/Cas9による大規模な遺伝子スクリーニングの実現可能性を制限する。研究のペースを考えると、ここで説明するプロトコルの現在の限界の一部はまもなく克服される可能性が高い。最適化されたプロトコルが使用可能になります。ミトコンドリア病のこれらの3Dモデルは、有害であるミトコンドリア病、および非常に満たされていない医療ニーズを持つ不治の病に対する実装可能な治療法の最終的な発見を可能にすることを願っています。
開示事項
著者らは、競合する財政的利益や非財政的利益を宣言しない。
謝辞
ミリアム・ビュニングの技術サポートに感謝します。我々は、ドイツ・フォルシュングスゲミンシャフト(DFG)(PR1527/5-1からA.P.)、スパークとベルリン衛生研究所(BIH)(BIH検証資金からA.P.)、ユナイテッド・水戸からの支援を認める コンドリア病財団(UMDF)(リー症候群国際コンソーシアム補助金A.P.)、大学病院デュッセルドルフ(Forschungskommission UKDからA.P.)、ドイツ連邦教育研究省(BMBF)(e:バイオ若手研究者は、AZ 031L0211をA.P.に付与します。C.R.R.の研究室での作業は、DFG(FOR 2795 「ストレス下のシナプス」、Ro 2327/13-1)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| Affinity Designer | Serif (Europe) Ltd | Layout software; Vector graphics editor | |
| Alexa Fluor 488 donkey anti-guinea pig | Sigma Aldrich | SAB4600033-250UL | 1:300 |
| Alexa Fluor 488 donkey anti-mouse | Thermo Fisher Scientific | A-31571 | 1:300 |
| Antimycin A | Sigma Aldrich | 1397-94-0 | |
| Anti-β-Tubulin III (TUJ-1) | Sigma Aldrich | T8578 | 1:2000 |
| Argon Laser | Melles Griot | Any other Laser, e.g., diode lasers emitting 488 is fine, too | |
| Ascorbic acid | Sigma | A92902 | |
| B-27 with Vitamin A | Gibco | 17504044 | |
| Bacto Agar | Becton Dickinson | 3% in PBS, store solution at -20 °C | |
| BDNF | Miltenyi Biotec | 130-093-0811 | |
| cAMP | Sigma | D0627 | |
| Cell Star cell culture 6 well plate | Greiner-Bio-One | 657160 | |
| Chemically Defined Lipid Concentrate | Gibco | 11905031 | |
| Confocal laser scanning microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement membrane matrix, Phenol Red-free, LDEV-free | Corning | 356231 | Matrix component |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher | C7026 | |
| DMEM/F12 | ThermoFisher | 31330038 | |
| DMSO | Sigma | D2660-100ML | |
| Donkey anti-goat Cy3 | Merck Millipore | AP180C | 1:300 |
| Donkey anti-mouse Cy3 | Merck Millipore | AP192C | 1:300 |
| Donkey anti-rabbit Cy3 | Merck Millipore | AP182C | 1:300 |
| DPBS | Gibco | 14190250 | |
| DS-Q1Mc camera | Nikon Microscope Solutions | ||
| Eclipse 90i upright widefield microscope | Nikon Microscope Solutions | ||
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse Ts2 Inverted Microscope | Nikon Microsope Solutions | ||
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| FCCP | Sigma Aldrich | 370-86-5 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| GDNF | Miltenyi Biotec | 130-096-291 | |
| Glasgow MEM | Gibco | 11710-035 | |
| Glass Pasteur pipette | Brand | 747715 | Inverted |
| Glutamax | Gibco | 35050-061 | |
| Helium-Neon Laser | Melles Griot | Every other Laser, e.g., diode lasers emitting 594 is fine, too | |
| Heparin | Merck | H3149-25KU | |
| HERACell 240i CO2 Incubator | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Invitrogen | H3570 | 1:2500 |
| Image J 1.53c | Wayne Rasband National Institute of Health | Image processing Software | |
| Injekt Solo 10 mL/ Luer | Braun | 4606108V | |
| Knockout Serum Replacement | Gibco | 10828010 | |
| Laser (407 nm) | Coherent | Any other Laser, e.g., diode lasers emitting 407 is fine, too | |
| Map2 | Synaptic Systems | No. 188004 | 1:1000 |
| Maxisafe 2030i | |||
| MEM NEAA | Gibco | 11140-050 | |
| mTeSR Plus | Stemcell Technology | 85850 | iPSC medium |
| Multifuge X3R Centrifuge | Thermo Scientific | 10325804 | |
| MycoAlert Mycoplasma Detection Kit | Lonza | # LT07-218 | |
| N2 Supplement | Gibco | 17502-048 | |
| Needle for single usage (23G x 1” TW) | Neoject | 10016 | |
| NIS-Elements Aadvanced Research 3.2 | Nikon | Imaging software | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Orbital Shaker Heidolph Unimax 1010 | Heidolph | 543-12310-00 | |
| PAP Pen | Sigma | Z377821-1EA | To draw hydrophobic barrier on slides. |
| Papain Dissociation System kit | Worthington | LK003150 | |
| Paraformaldehyde | Merck | 818715 | 4% in PBS, store solution at -20 °C |
| Pasteur pipette 7mL | VWR | 612-1681 | Graduated up to 3 mL |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Plan Apo VC 20x / 0.75 air DIC N2 ∞/0.17 WD 1.0 | Nikon Microscope Solutions | Dry Microscope Objective | |
| Plan Apo VC 60x / 1.40 oil DIC N2 ∞/0.17 WD 0.13 | Nikon Microscope Solutions | Oil Immersion Microscope Objective | |
| Polystyrene Petri dish (100 mm) | Greiner Bio-One | 664161 | |
| Polystyrene round-bottom tube with cell-strainer cap (5 mL) | Falcon | 352235 | |
| Potassium chloride | Roth | 6781.1 | |
| ProLong Glass Antifade Moutant | Invitrogen | P36980 | |
| Qualitative filter paper | VWR | 516-0813 | |
| Rock Inhibitior | Merck | SCM075 | |
| Rotenone | Sigma | 83-794 | |
| S100β | Abcam | Ab11178 | 1:600 |
| SB-431542 | Cayman Chemical Company | 13031 | |
| Scalpel blades | Heinz Herenz Hamburq | 1110918 | |
| SMI312 | Biolegend | 837904 | 1:500 |
| Sodium bicarbonate | Merck/Sigma | 31437-1kg-M | |
| Sodium chloride | Roth | 3957 | |
| Sodium dihydrogen phosphate | Applichem | 131965 | |
| Sodium Pyruvate | Gibco | 11360070 | |
| SOX2 | Santa Cruz Biotechnology | Sc-17320 | 1:100 |
| StemPro Accutase Cell Dissociation Reagent | Gibco/StemPro | A1110501 | Reagent A |
| Super Glue Gel | UHU | 63261 | adhesive gel |
| SuperFrost Plus | VWR | 631-0108 | |
| Syringe for single usage (1 mL) | BD Plastipak | 300015 | |
| TB2 Thermoblock | Biometra | ||
| TC Plate 24 Well | Sarstedt | 83.3922 | |
| TC Plate 6 Well | Sarstedt | 83.392 | |
| TGFbeta3 | Miltenyi Biotec | 130-094-007 | |
| Tissue Culture Hood | ThermoFisher | 51032711 | |
| TOM20 | Santa Cruz Biotechnology | SC-11415 | 1:200 |
| Triton-X | Merck | X100-5ML | |
| UltraPure 0.5M EDTA | Invitrogen | 15575020 | |
| Vibratome Microm HM 650 V | Thermo Scientific | Production terminated, any other adjustable microtome is fine, too. | |
| Vibratome Wilkinson Classic Razor Blade | Wilkinson Sword | 70517470 | |
| Whatman Benchkote | Merck/Sigma | 28418852 | |
| Wnt Antagonist I | EMD Millipore Corp | 3378738 | |
| XF 96 extracellular flux analyser | Seahorse Bioscience | 100737-101 | |
| XF Assay DMEM Medium | Seahorse Bioscience | 103680-100 | |
| XF Calibrant Solution | Seahorse Bioscience | 100840-000 | |
| XFe96 FluxPak (96-well microplate) | Seahorse Bioscience | 102416-100 |
参考文献
- Koopman, W. J., Willems, P. H., Smeitink, J. A. Monogenic mitochondrial disorders. New England Journal of Medicine. 366 (12), 1132-1141 (2012).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Review Disease Primers. 2, 16080 (2016).
- Vafai, S. B., Mootha, V. K. Mitochondrial disorders as windows into an ancient organelle. Nature. 491 (7424), 374-383 (2012).
- Carelli, V., Chan, D. C. Mitochondrial DNA: impacting central and peripheral nervous systems. Neuron. 84 (6), 1126-1142 (2014).
- Russell, O. M., Gorman, G. S., Lightowlers, R. N., Turnbull, D. M. Mitochondrial diseases: hope for the future. Cell. 181 (1), 168-188 (2020).
- Weissig, V. Drug development for the therapy of mitochondrial diseases. Trends in Molecular Medicine. 26 (1), 40-57 (2020).
- Tyynismaa, H., Suomalainen, A. Mouse models of mitochondrial DNA defects and their relevance for human disease. EMBO Reports. 10 (2), 137-143 (2009).
- Ma, H., et al. Metabolic rescue in pluripotent cells from patients with mtDNA disease. Nature. 524 (7564), 234-238 (2015).
- Galera-Monge, T., et al. Mitochondrial dysfunction and calcium dysregulation in Leigh syndrome induced pluripotent stem cell derived neurons. International Journal of Molecular Science. 21 (9), 3191 (2020).
- Zheng, X., et al. Alleviation of neuronal energy deficiency by mTOR inhibition as a treatment for mitochondria-related neurodegeneration. Elife. 5, 13378 (2016).
- Lorenz, C., et al. Human iPSC-derived neural progenitors are an effective drug discovery model for neurological mtDNA disorders. Cell Stem Cell. 20 (5), 659-674 (2017).
- Inak, G., et al. Concise review: induced pluripotent stem cell-based drug discovery for mitochondrial disease. Stem Cells. 35 (7), 1655-1662 (2017).
- Chiaradia, I., Lancaster, M. A. Brain organoids for the study of human neurobiology at the interface of in vitro and in vivo. Nature Neuroscience. 23 (12), 1496-1508 (2020).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocol. 9 (10), 2329-2340 (2014).
- Liput, M., et al. Tools and approaches for analyzing the role of mitochondria in health, development and disease using human cerebral organoids. Developmental Neurobiology. , (2021).
- Winanto, K. Z. J., Soh, B. S., Fan, Y., Ng, S. Y. Organoid cultures of MELAS neural cells reveal hyperactive Notch signaling that impacts neurodevelopment. Cell Death and Disease. 11 (3), 182 (2020).
- Romero-Morales, A. I., et al. Human iPSC-derived cerebral organoids model features of Leigh Syndrome and reveal abnormal corticogenesis. bioRxiv. , (2020).
- Inak, G., et al. Defective metabolic programming impairs early neuronal morphogenesis in neural cultures and an organoid model of Leigh syndrome. Nature Communications. 12 (1), 1929 (2021).
- Falk, M. J. Neurodevelopmental manifestations of mitochondrial disease. Journal of Developmental & Behavioral Pediatrics. 31 (7), 610-621 (2010).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Pfiffer, V., Prigione, A. Assessing the bioenergetic profile of human pluripotent stem cells. Methods in Molecular Biology. 1264, 279-288 (2015).
- Ludikhuize, M. C., Meerlo, M., Burgering, B. M. T., Colman, R. M. J. Protocol to profile the bioenergetics of organoids using Seahorse. STAR Protocols. 2 (1), 100386 (2021).
- Menacho, C., Prigione, A. Tackling mitochondrial diversity in brain function: from animal models to human brain organoids. International Journal of Biochemestry & Cell Biology. 123, 105760 (2020).
- Del Dosso, A., Urenda, J. P., Nguyen, T., Quadrato, G. Upgrading the physiological relevance of human brain organoids. Neuron. 107 (6), 1014-1028 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved