Method Article
Métodos rápidos e enzimáticos para amplificação de modelos mínimos e lineares para prototipagem de proteínas usando sistemas livres de células
Neste Artigo
Resumo
O estudo descreve um protocolo para a criação de grandes (μg-mg) quantidades de DNA para campanhas de triagem de proteínas a partir de fragmentos de genes sintéticos sem clonagem ou uso de células vivas. O modelo mínimo é digerido e circularizado e, em seguida, amplificado usando amplificação do círculo de rolamento isotérmico. Reações de expressão livre de células poderiam ser realizadas com o produto não purificado.
Resumo
Este protocolo descreve o desenho de um modelo de DNA mínimo e os passos para a amplificação enzimática, permitindo a prototipagem rápida de proteínas assayable em menos de 24 h usando a expressão livre de células. Depois de receber DNA de um fornecedor, o fragmento genético é amplificado, cortado, circularizado e crio-bancário. Uma pequena quantidade do DNA bancado é então diluída e amplificada significativamente (até 106x) usando amplificação do círculo de rolamento isotemal (RCA). A RCA pode produzir quantidades de microgramas do modelo de expressão mínima dos níveis de picograma do material inicial (níveis de mg se todos os fragmentos sintéticos iniciais forem usados). Neste trabalho, uma quantidade inicial de 20 pg resultou em 4 μg do produto final. O produto RCA resultante (concatemer do modelo mínimo) pode ser adicionado diretamente a uma reação livre de células sem etapas de purificação. Devido a este método ser inteiramente baseado em PCR, ele pode permitir futuros esforços de triagem de alto rendimento quando juntamente com sistemas automatizados de manuseio de líquidos.
Introdução
A expressão genética livre de células (CFE) emergiu como uma ferramenta poderosa com muitas aplicações. Tais aplicações incluem detecção de doenças1,2,3,4,5,6, micronutrientes e detecção de moléculas pequenas7,8,9,10,11,12, biomanufacturing13,14,15,16,17 ,18, educação19,20,21, fabricação de proteínas difíceis de fabricação17,22,23,24,25,26,27, e triagem variante23,28,29,30,31,32 ,33. Isso se deve à natureza aberta dos sistemas livres de células e à flexibilidade que eles conferem. Muitos artigos de grande revisão oferecem educação histórica e perspectivas futuras sobre a tecnologia34,35,36,37,38,39,40,41,42,43,44.
Uma reação típica sem células consiste em três componentes principais: extrato celular, mistura de energia e modelo genético. O extrato de célula ativa contém todas as máquinas necessárias para transcrição e tradução (TXTL) e pode ser processado de várias maneiras36. Intermediários glicólticos, eletrólitos, aminoácidos e cofatores na mistura de energia suportam o processo TXTL. É uma grande fonte de variabilidade em experimentos sem células45 e pode ser preparado de muitas maneiras34,46. A preparação do modelo genético tem visto menos melhorias desde que os métodos tradicionais de clonagem resultam em plasmídeos com excelentes características de expressão. A desvantagem desses métodos tradicionais é o tempo de reviravolta e a quantidade de conhecimento biológico necessários para construí-los e propagar- los. Os esforços recentes de otimização resultaram em fluxos de trabalho simples de 24 horas para a preparação do extratocelular 47,48 que podem ser realizados em paralelo com a preparação do mix de energia49,50. No entanto, a clonagem tradicional adiciona vários dias à linha do tempo de prototipagem do CFE(Tabela 1)23. Produtos PCR rapidamente amplificados do fragmento genético comercial podem ser usadosdiretamente 51, mas isso limita o número de experimentos de prototipagem à medida que apenas 1 μg de DNA é produzido, o que corresponde a aproximadamente cinco reações (volumes tradicionais de 15 μL). Com essas etapas adicionais de circularização e amplificação isotérmica, quantidades maiores do que miligramas do DNA são possíveis (~5.000 reações por 1 mg). Isso aumenta drasticamente o número de testes que podem ser feitos em triagem de alta produtividade de proteínas ou redes enzimáticas combinatórias (engenharia metabólica livre de células); também permite a preservação efetiva da biblioteca de modelos lineares como DNA de alta concentração. Além disso, uma quantidade aumentada de modelo seria necessária para protótipo de quantidades maiores de proteína necessárias para aplicações científicas materiais (fibras à base de proteínas e hidrogéis). Algumas limitações de modelos lineares podem ser superadas usando um extrato de BL21 DE3 Star ou usando métodos recentemente descobertos para proteger modelos lineares da degradação52,53,54. No entanto, isso não aborda ter estoques limitados de DNA produzido pelo fornecedor para amplificação de PCR ou a questão da perícia biológica e equipamentos necessários para a clonagem.
Este trabalho apresenta um protocolo explicitamente projetado para aumentar a quantidade de modelo de expressão que pode ser obtido a partir de pequenas quantidades de fragmentos genéticos produzidos por fornecedores (tipicamente 500-1000 ng de pó liofilizado). O método descrito não requer as habilidades necessárias para realizar clonagem tradicional em plasmídeos ou transformação e propagação em células vivas. Ao receber um fragmento genético no e-mail, o usuário pode produzir modelos suficientes para muitas reações livres de células, empregando amplificação do círculo de rolamento isoterânmico (RCA) (Figura 1)23. Embora a quantidade de DNA recebida do fornecedor possa ser suficiente para esforços limitados de triagem, ele é rapidamente esgotado, e a recodência de fragmentos genéticos é demorada e cara. O método também é especialmente adequado para genes tóxicos e difíceis de clonar em E. coli.
Protocolo
1. Projetando o fragmento genético
NOTA: O fragmento genético deve ter todos os elementos genéticos necessários para transcrição/tradução, incluindo promotor, site de ligação ribossosome (RBS), codon inicial, gene de interesse e exterminador. Embora o exterminador não seja necessário para um modelo de expressão linear (LET), será importante se o usuário decidir inserir a sequência em um plasmídeo. Estas sequências foram levantadas do pJL1-sfGFP plasmid55 (presente do laboratório de Michael Jewett), que usa um promotor T7. Além desses elementos genéticos necessários, um local de corte de enzima de restrição é adicionado seis pares de base antes do promotor (local de corte de 5') e outros seis pares de base após o exterminador (local de corte de 3'), neste caso usando hindiii (outras enzimas de restrição podem ser usadas, mas é útil padronizar as sequências com uma enzima de restrição de alta fidelidade para reduzir o número necessário para manter na biblioteca). Os sites primer são adicionados dez pares de base a montante do site de corte de 5' e dez pares de base a jusante do local de corte de 3', neste caso usando sequências padronizadas de primer M13 (primers são itens de estoque baratos). O site de enzimas de restrição e os primers utilizados ficam a critério do usuário. No entanto, o usuário deve garantir que as sequências não estejam presentes em nenhum outro lugar do modelo (não quero criar cortes indesejados ou sites de iniciação de amplificação). As sequências dos modelos utilizados neste trabalho são detalhadas no material suplementar. Essas etapas são usadas para modificar a partir deste modelo base.
- Determine o gene desejado a ser expresso e obtenha a sequência de aminoácidos ou a sequência genética se tiver sido expresso em E. coli.
- Se for uma sequência de aminoácidos, realize a otimização de codon para E. coli usando uma das muitas ferramentas padrão de fornecedor56. Se usar o modelo fornecido no suplemento, certifique-se de que a sequência otimizada não tenha nenhum site de restrição hindiII (AAGCTT). No caso disso, continue a otimizar a sequência até que não haja mais um site hindiii.
- Copie a sequência e cole-a no modelo fornecido para a sequência suplementar #1, onde o gene de interesse é indicado. Se expressar sfGFP, use a sequência suplementar #1 como está. Se expressar subtilisina, use a sequência suplementar #2 como está.
- Peça o modelo mínimo e os primers necessários do serviço de síntese de DNA preferido.
2. Reutilizar o fragmento genético e os primers
NOTA: Após o recebimento do fragmento genético, siga os protocolos do fabricante para a ressuspensão ou use este guia simples para criar um estoque de DNA.
- Centrifugar o tubo (300 x g por 5 s) para coletar a pelota de DNA na parte inferior.
- Adicione água destilada dupla (ddH2O) para fazer uma concentração final de 10 ng/μL de modelo de DNA.
- Vortex a solução em uma configuração média para 5-10 s.
- Dissolva a pelota inteira incubando a 50 °C por 20 min.
- Brevemente vórtice novamente
- Centrifugar a 300 x g por 5 s para coletar a solução na parte inferior do tubo.
- Armazene a -20 °C ou use em PCR.
- Prepare um estoque de primer de 100 μM reutilizando os primers em água sem nuclease. Para determinar a quantidade de água a adicionar, multiplique o número de nanomoles de primer liophilizado por 10. Por exemplo, se o tubo contiver 45 nM de primer liofilizado, adicione 450 μL de ddH2O e o vórtice da solução.
- Armazene as soluções de estoque de primer a -20 °C ou continue a realizar a amplificação.
3. Amplificando o fragmento genético via PCR
NOTA: Decida qual kit PCR é adequado para o gene de interesse. Genes menores (<1.000 kb) podem ser mais favoráveis a uma polimerase Taq mais barata, enquanto genes maiores (≥1.000 kb) podem se beneficiar de polimerase de alta fidelidade para reduzir erros. É importante notar que essa amplificação inicial do PCR não é necessária se o usuário não estiver preocupado em preservar o fragmento genético inicial (fornece múltiplas tentativas de circularização e permite estudos comparativos do produto LET vs. RCA). Também é importante notar que este LET amplificado pcr pode ser usado diretamente em reações; no entanto, como mencionado na introdução, só permitiria um número limitado de reações se as etapas de amplificação adicionais fossem desconsideradas. A digestão e a ligadura podem ser realizadas no fragmento genético ressuspendeddiretamente 57 (se for certo, eles não precisarão de mais LET para realizar estoques adicionais de circularização). Se este for o caso, pule a seção 3 e continue até a seção 4. Para realizar PCR, siga estas etapas.
- Use os estoques de 100 μM da etapa 2.8 para criar soluções de trabalho de 10 μM. Muitos protocolos de kit PCR exigem soluções de 10 μM de primers.
- Programe o cicloviário térmico para conduzir a reação de acordo com os protocolos do fabricante do kit. Diferentes kits exigem parâmetros de ciclismo ligeiramente variados. Para o kit listado na Tabela de Materiais,as condições são de 94 °C para 30 s de desnaturação inicial; 30 ciclos de 94 °C para 30 s de desnaturação, 45 °C para 30 s de ressarem e 68 °C para 60 s de extensão; com extensão final a 68 °C por 5 min; e, finalmente, uma espera indefinida de 10 °C.
- Certifique-se de selecionar o tempo correto de alongamento (variável dependendo do comprimento do gene a ser amplificado). Tenha um tempo de alongamento de 1 min para cada 1.000 bp.
- Certifique-se de inserir a temperatura correta de ressarcial para os primers. Use uma calculadora Tm on-line que usa ambos os primers como entradas para determinar a melhor temperatura de ressarcial58. Uma temperatura de 45 °C é suficiente ao usar primers M13.
- Ao determinar o número de ciclos, consulte o protocolo do fabricante, mas 30 ciclos muitas vezes resultarão em amplificação suficiente.
- Se estiver executando PCR, descongele e vórtice os dNTPs. Use o buffer PCR fornecido no kit.
- Em um único tubo PCR, combine todos os componentes do kit conforme indicado no protocolo do fabricante. Para garantir a amplificação bem sucedida, adicione 1 μL de estoque de DNA resuspendido (etapa 2.6).
- Homogeneize suavemente a mistura por vórtice no ajuste médio para 5-10 s. Alternativamente, pipeta metade do volume para cima e para baixo 10-20 vezes para vórtice.
- Execute a reação do PCR.
- Se o protocolo PCR não incluir uma etapa final de resfriamento, permita que a reação esfrie por 5 min a 10 °C antes de remover para conduzir a condensação para a parte inferior do tubo.
- Purifique a reação usando um kit de limpeza pcr seguindo as instruções do fornecedor.
- Em um tubo de 1,5 mL, adicione tampão de ligação de DNA e amostra pcr a uma proporção de 5:1, respectivamente.
- Transfira esta mistura para a coluna de giro e centrífuga a 16.000 x g por 1 min. Descarte o fluxo.
- Adicione 200 μL de tampão de lavagem de DNA à coluna e incubar à temperatura ambiente por 1 min.
- Centrifugar por 1 min a 16.000 x g e descartar o fluxo.através.
- Repetir as etapas 2.8.3 e 2.8.4 sem a etapa de incubação de 1 min.
- Centrifugar por um adicional de 1-2 min a 16.000 x g para remover qualquer buffer restante.
- Elute o DNA em 46 μL de ddH2O.
- Quantifique o DNA purificado usando um espectotômetro.
- Armazene o DNA purificado a -20 °C ou prossiga para o próximo passo.
4. Digestão e circularização
NOTA: Uma ampliação adicional pode ser alcançada através da circularização do DNA seguido pela RCA. Digerir o DNA para preparar o modelo para circularização. Isso removerá as sequências de primer e criará extremidades pegajosas nas extremidades de 5' e 3' do modelo. Reanexe estes fins através da reação de ligadura.
- Em um tubo PCR, combine 5 μL do buffer necessário, 20 U de HindIII e 45 μL do DNA purificado da etapa 3.8.
- Homogeneize suavemente esta mistura com uma pipeta.
- Incubar a mistura em um cicloviário térmico por 15 min a 37 °C.
- Inativar o calor em hindiii incubando por 20 min a 80 °C.
- Deixe a reação esfriar até 10 °C antes de remover para conduzir a condensação para a parte inferior do tubo.
- Adicione 5 μL de tampão de ligase T4 e 800 U de liga ligase T4 ao DNA recém-digerido.
- Use ligadura T7, se desejar.
- Homogeneize suavemente esta mistura com uma pipeta.
- Incubar a mistura por 1h a 25 °C para realizar a reação de circularização.
- Purifique a reação usando um kit de limpeza pcr seguindo as instruções do fornecedor. Use o mesmo protocolo detalhado na etapa 3.8.
- Quantifique o DNA usando um espectrômetro. Os valores esperados são ~20 ng/μL.
- Armazene a -20 °C ou prossiga para a próxima etapa.
5. Amplificação do círculo de rolamento isotérmico
NOTA: A amplificação do círculo de rolamento (RCA) pode ser realizada usando um kit comercial ou com componentes adquiridos individualmente. Seguir o protocolo do fabricante garantirá uma amplificação bem sucedida. Os kits geralmente contêm um buffer de amostra, tampão de reação e polimerase de deslocamento de fios, como φ29 polimerase. Múltiplos tubos de reação podem ser combinados para produzir uma grande quantidade de DNA para a expressão livre de células (4 μg a partir de 20 pg de material inicial). O protocolo a seguir funciona de forma eficiente.
- Em um único tubo, misture 20 μL do buffer amostral, 20 μL do tampão de reação, 0,8 μL da enzima e 1 μL do modelo de expressão circular (CET) da etapa 4.9.
NOTA: Este terá uma massa total de DNA de ~20 ng, mas a RCA pode trabalhar com quantidades de picograma, permitindo assim a diluição da CET e amplificação enzimática extrema se houver uma necessidade significativa de material na triagem de alto rendimento. - Homogeneize a mistura com uma pipeta e alíquota de 10 μL da mistura em quatro tubos separados.
- Incubar a 30 °C para 4-18 h.
- O calor inativa a enzima incubando a 65 °C por 10 minutos. Reduza a temperatura para 12 °C por 5 minutos para incentivar a condensação na parte inferior do tubo.
NOTA: É mais fácil combinar todas as etapas de temperatura em um protocolo automatizado em um cicloviário térmico. - Diluir a solução resultante adicionando 15 μL de ddH2O a cada tubo.
- Combine todos os tubos e adicione diretamente a uma reação livre de células.
- Se desejar, use um kit de limpeza PCR para purificar o produto e elute-lo em 36 μL de ddH2O para quantificar. Certifique-se de que a concentração do modelo é ~100 ng/μL.
6. Reação sem células
NOTA: Realize a expressão livre de células combinando buffer de energia, extrato e modelo RCA. Uma reação típica sem células usando o buffer de energia PANOx-SP consiste em 1,2 mM ATP, 0,85 mM cada um de GMP, UMP e CMP, 30 mM phosphoenolpyruvate, 130 mM glutamato de potássio, 10 mM glutamato de amônio, 12 mM glutamato de magnésio, 1,5 mM de espertemidina, 1 mM putrescina, 34 μg/mL de ácido foliônico, 171 μg/mL de mistura de E. coli tRNA, 34 μg/mL de ácido foliônico, 171 μg/mL de mistura de E. coli tRNA, 1 mM 2 mM cada um dos 20 aminoácidos não rotulados, 0,33 mM NAD, 0,27 mM Coenzyme A (CoA), 4 mM de oxalato de potássio, 57 mM tampão HEPES-KOH (pH 7,5), 0,24% do extrato de E. coli e quantidades variáveis de DNA23,49. O volume de reação pode variar, mas as reações de 15 μL podem economizar no uso de reagentes e são pequenas o suficiente para uso em uma microplacão de parede preta 38449,50.
- Se expressar uma proteína fluorescente como o sfGFP, prepare um leitor de placas para ler na excitação/emissão desejada, temperatura e agitação.
- Se usar uma placa de 384 poços, aliquot 60 μL de H2O nos poços que beiram uma amostra vazia bem para manter a umidade e reduzir o efeito de borda.
- Adicione os vários componentes necessários em um tubo para cada amostra. Adicione o suficiente para realizar triplicados. As réplicas dentro da placa podem ajudar a identificar as causas da variabilidade.
- Adicione o extrato, o tampão de energia e, em seguida, o DNA.
- Diluir ao volume final desejado com ddH2O.
- Misture bem esta solução ao pipetar metade do volume da solução para cima e para baixo 10-20 vezes.
- Transfira a mistura de reação em alíquotas de 15 μL para os poços desejados na placa de microtítiter.
- Sele a placa com uma máquina de selar incolor para manter a umidade e evitar a evaporação.
- Coloque a placa selada no leitor de placas e deixe a reação completa.
- Se expressar uma proteína que não tenha a capacidade de ser monitorada ao vivo, use outro aparelho controlado pela temperatura, como um termobloco para incubar a placa.
7. Ensaio de subtilisina
NOTA: Se expressar o gene de subtilisina BPN' (SBT(n)) na Sequência Suplementar n2,siga este protocolo para avaliar a atividade.
- Prepare uma solução de estoque de 10 μM de N-succinyl-Ala-Ala-Pro-Phe p-nitroanilide em dimetilformamida (DMF).
- Defina um leitor de placas para medir a absorvância a 410 nm a cada 20 s por 10 minutos, mantendo uma temperatura de 25 °C.
- Em uma placa de fundo plano, incolor de 96 poços, alíquota de 94 μL de ddH2O e 1 μL de N-succinyl-Ala-Ala-Pro-Phe p-nitroanilide a partir do passo 7.1.
- Adicione 5 μL da reação sem células terminada da etapa 6.7 e leia usando um leitor de placa definido para o protocolo descrito na etapa 7.2.
Resultados
A expressão de sfGFP dos modelos RCA foi comparável à do plasmídeo pJL1 ao usar apenas 0,30 μL de DNA RCA não purificado em uma reação de 15 μL(Figura 2A). Na verdade, duplicar e triplicar a quantidade de modelo parece não oferecer nenhum benefício no extrato BL21 DE3 Star, sugerindo níveis já saturados do modelo a 0,30 μL por reação. Por outro lado, parece haver um benefício para aumentar a quantidade de modelo RCA quando adicionado ao extrato celular originado da cepa SHuffle(Figura 2B)28. Para algumas proteínas, os resultados podem ser observados muito rapidamente, o que comprime todo o fluxo de trabalho (amplificação e ensaio) a menos de 24 h. No entanto, algumas proteínas requerem temperatura mais baixa ou têm tempos de dobra mais lentos, o que aumentará o tempo até que os resultados sejam obtidos, mas afetará o fluxo de trabalho aqui apresentado. Isso pode ser observado ao expressar subtilisina (SBT(n)) onde o ensaio após 4h de expressão não foi longo o suficiente para o vencimento do SBT(Figura 3A,exemplo de resultado fracassado). Permitir que a reação continue até 16h pode levar a níveis detectáveis do SBT(n) (Figura 3B). Essa melhora pode ser dependente da temperatura, como observado na literatura onde foram exploradas condições de temperatura otimizadas59,60.

Figura 1: Um esquema representativo do modelo genético mínimo e do processo que ele sofre após a etapa inicial de amplificação do PCR. Os modelos são digeridos com hindiII, circularizados com liga ligase T4, e ainda amplificados com polimerase φ29 para criar grandes concatemeras. Clique aqui para ver uma versão maior desta figura.
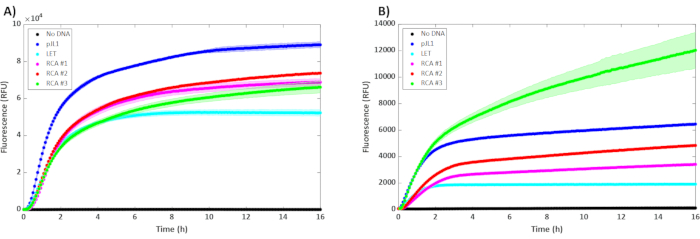
Figura 2: Resultados das reações livres de células com 5 nM não purificados de plasmídeo (pJL1), 5 nM de modelo linear (LET) e concentrações variadas de RCA não purificada. RCA #1, #2 e #3 continham 0,3 μL, 0,6 μL e 0,9 μL (respectivamente) de produto RCA não purificado em uma reação de 15 μL incubada a 30 °C (n = 3). As barras de erro representam ± 1 SD da média. O eixo y é a fluorescência, e o eixo x é o tempo que passou durante a reação. As cinéticas da expressão sfGFP estão representadas em (A) BL21 DE3 Star e (B) T7 SHuffle. Clique aqui para ver uma versão maior desta figura.

Figura 3: Reações sem células com 5 nM de SBT(n) LET e concentrações variadas de produto RCA não purificado. RCA ng e pg correspondem à concentração do DNA utilizado para realizar a amplificação do círculo de rolamento. O produto RCA não purificado foi utilizado em uma reação de 15 μL incubada a 30 °C (n = 3). As barras de erro representam ± 1 SD da média. O eixo y é a absorvância a 410 nm, e o eixo x é a quantidade de tempo que passou no ensaio. As reações foram realizadas para (A)4 h e (B) 16 h. Por favor clique aqui para ver uma versão maior desta figura.
| Método de clonagem | |
| PCR | 2 -4 h |
| Digestão plasmíida | 35 min. |
| Ligadura | 1h |
| Transformação | 2 h |
| Incubação noturna | 16 h |
| Seqüenciamento | 24 - 48 h |
| Glicerol Stock Prep | 16 h |
| Crescimento e Purificação | 16 h |
| Tempo Total | 46 - 72 h |
| Método RCA | |
| PCR | 2 - 4 h |
| Digestão | 35 min. |
| Ligadura | 1h |
| RCA | 4 - 18 h |
| CFE | 4 - 16 h |
| Tempo Total | 12 - 40 h |
Tabela 1: Uma comparação da linha do tempo entre um protocolo de clonagem tradicional simplificado e o protocolo RCA aqui abordado.
Arquivo suplementar: O arquivo suplementar lista as sequências. A sequência #1 é sfGFP (999 pares de base) e a sequência #2 é subtilisina BPN' (1344 bp). Clique aqui para baixar este Arquivo.
Discussão
O gene de interesse pode ser qualquer proteína desejada, mas é melhor começar com uma proteína fluorescente como repórter conveniente para leitura em tempo real ou ponto final em um leitor de placas de poço para novos adotantes deste método. Para novas sequências proteicas, copie a sequência de aminoácidos da proteína desejada e cole-a na ferramenta de otimização de codon desejada61,62. Geralmente existem muitos organismos disponíveis e cepas de E. coli na ferramenta de otimização do codon, mas escolher a opção geral Escherichia coli será adequado. Após a otimização, verifique novamente o gene para garantir que o local de corte previamente escolhido e as sequências de primer não estejam presentes. Se assim for, a sequência pode ser otimizada até que as sequências não estejam mais presentes. Em algumas situações, pode ser necessário substituir os locais de corte hindiII por um site de restrição diferente se a otimização repetida resultar consistentemente em um local interno de corte hindiII. É melhor usar o mesmo site de corte o mais frequentemente possível para manter o processo padronizado e reduzir o custo de manter múltiplas enzimas de restrição em mãos.
Antes de iniciar a amplificação, escolha o kit PCR que melhor se adapte ao LET. Um LET com <1.000 pares base pode ser amplificado com uma polimerase Taq simples, enquanto um LET com ≥ 1.000 pares de base pode exigir uma polimerase de maior fidelidade63. Configure o protocolo de amplificação de acordo com o fabricante do kit e a temperatura de ressarcial dos primers desejados. A temperatura de ressarcial é fundamental para uma amplificação bem sucedida. Uma regra geral é selecionar uma temperatura de ressaramento que seja 5 °C menor que a Tm dos primers. Existem ferramentas online gratuitas que fornecerão uma temperatura de ressarcial otimizada com base na sequência dos primers58. O uso da temperatura correta de ressaramento é fundamental para produzir um modelo de DNA de alta qualidade.
A expressão genética livre de células tem visto um renascimento nos últimos anos devido à sua velocidade, simplicidade e utilidade para a prototipagem da biologia sintética. Este trabalho esboçou um método para aumentar a velocidade e a facilidade ao testar uma grande biblioteca de novas proteínas funcionais. Embora os métodos tradicionais de clonagem possam levar dias ou semanas, este protocolo pode ser feito em menos de 24 horas. A tabela 1 descreve faixas de tempo típicas tanto para a clonagem tradicional quanto para o protocolo RCA. Observe que o protocolo de clonagem foi simplificado, e algumas etapas opcionais foram deixadas de fora, como o isolamento do gel. A Tabela 1 também refere-se apenas aos protocolos comuns de digestão de restrição; existem muitos outros métodos de clonagem, mas estes requerem uma quantidade de tempo semelhante. A faixa superior deste protocolo de amplificação enzimática requer menos tempo do que a faixa inferior do método de clonagem, especialmente quando se considera uma jornada de trabalho de 8 horas. Isso se deve, em grande parte, à remoção de incubações noturnas e à falta de confirmação de sequenciamento. O protocolo RCA é baseado inteiramente em PCR e RCA, que exigem habilidades menos especializadas do que as técnicas tradicionais de clonagem, transformação e cultura celular. Esse método torna a livre expressão celular acessível para laboratórios que não têm experiência prévia em clonagem ou acesso ao capital necessário para transformar e cultivar células. Este método também é adequado para projetos focados em proteínas citotóxica, onde a clonagem e propagação dos genes com clonagem tradicional é difícil devido à toxicidade na célula viva. Este protocolo RCA também é capaz de amplificar quantidades muito pequenas de DNA circular (picogramas de DNA) aos níveis necessários para CFE. Na Figura 3B,o modelo circularizado do SBT(n) foi diluído para 20 ng/μL e 20 pg/uL antes da RCA. Embora as taxas observadas de degradação tenham sido diferentes, ambas as reações resultaram na mesma quantidade de degradação do substrato dentro de 10 minutos. O método proposto não se destina a substituir a clonagem; a propagação plasmida pode produzir quantidades de DNA para genes não tóxicos que não podem ser correspondidos. Em vez disso, esta é uma ferramenta de prototipagem conveniente em uma fase maciça de triagem de biblioteca (etapas enzimáticas são favoráveis à automação com manipulador de fluidos padrão) que ajudariam a identificar quais sequências devem ser clonadas para arquivamento e propagação posterior.
Ao projetar uma reação livre de células, há muita flexibilidade, mas há alguns fatores que devem ser levados em consideração para garantir o sucesso. Reações menores têm uma maior relação superfície/volume, o que é ótimo para a troca de gás, mas a reação precisa cobrir completamente a parte inferior do poço para medições precisas de fluorescência. A temperatura da reação também pode variar dependendo do gene de interesse59. Existem várias opções para os usuários quando se trata da seleção de um buffer de energia34,46. Algumas receitas são mais caras que outras, mas a decisão é deixada para o usuário. Há também muitas fontes potenciais para o extrato de E. coli 36. Os usuários devem se familiarizar com protocolos de produção de extrato e decidir qual é o melhor para seus propósitos28,48,50,64,65,66,67.
Ao usar o RCA para amplificar modelos para a expressão livre de células, a escolha da cepa bacteriana é muito importante. O perfil de expressão tende a ser melhor do que o dos LETs. A popular cepa BL21 DE3 Star lida bem com isso, com RCA executando ~1,4x melhor que o LET e o plasmid pJL1 com desempenho ~1,2x melhor que a melhor concentração de RCA(Figura 2A). Por outro lado, algumas cepas apresentam degradação do modelo e têm um desempenho ruim devido à presença de núcleos nativos23,28. Neste caso, parece que a cepa SHuffle se beneficia de um modelo RCA aumentado. A literatura anterior mostrou que o extrato de SHuffle não tem bom desempenho com produtos pcr, mas a maior concentração de produto RCA não purificado utilizado neste estudo superou o plasmídeo pJL1 (Figura 2B). A expressão funcional sbt(n) (Figura 3) é um exemplo de uma proteína citotóxica que é convenientemente feita por células livres de células, mas difícil de protótipo em células vivas devido à toxicidade (incapaz de clonar este modelo de expressão em plasmídeo e propagar em E. coli). Ao contrário do SFFP, a atividade do SBT(n) não pode ser observada após apenas 4h de expressão(Figura 3A). O sinal é detectável após 16h de expressão e maturação(Figura 3B). O DNA não purificado usado nestes exemplos veio de 100 μL, que foi quatro reações RCA de 10 μL diluídas e combinadas. Este estoque pode suportar 333 reações livres de células se usar apenas 0,30 μL por reação.
A compatibilidade dos modelos de RCA com CFE precisa ser mais explorada com vários extratos. Complicações potenciais com produtos lineares podem ser aliviadas adicionando oligos curtos contendo a sequência E. coli chi ou a proteína GamS52,53. A literatura sugere que a adição de oligos chi pode fornecer maior proteção aos modelos lineares do que a proteína GamS53. Se usar um extrato conhecido por fornecer baixos rendimentos de modelos lineares, o usuário deve analisar o custo de cada agente protetor e usar aquele que melhor se adequa aos seus propósitos. Outra limitação é a incapacidade de converter concentrações de modelo RCA em molaridade devido à natureza do concatemer resultante. Isso significa que pode-se adicionar o mesmo número de modelos mínimos com base na massa, mas eles terão comprimentos de concatemer variados, o que pode afetar os níveis de expressão. Os autores não descobriram que isso é um problema na triagem/prototipagem, pois os níveis médios de expressão de cada poço são os mesmos (baixa variância), mas podem ser um problema se expressarem em volumes menores (por exemplo, microdroplets).
A expressão genética livre de células tem o potencial de ser usada como uma ferramenta significativa em prototipagem de proteínas e fluxos de trabalho de teste de construção de design. No entanto, a maioria dos fluxos de trabalho de liberdade celular ainda dependem dos plasmídeos tradicionais como modelo genético. Isso retarda o processo e impede que a expressão livre de células seja utilizada em sua extensão máxima para fins de triagem/prototipagem. Amplificar modelos e realizar posteriormente RCA pode produzir rapidamente modelos genéticos suficientes para muitas reações, produzindo proteína suficiente para caracterização a jusante e testes funcionais.
Divulgações
Nigel Reuel atua no conselho científico da BigHat Biosciences Inc., uma empresa que usa sistemas livres de células para o design de anticorpos.
Agradecimentos
Os autores reconhecem que o NIH 1R35GM138265-01 e o NSF 2029532 para apoio parcial deste projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| Alaline | Formedium | DOC0102 | |
| Ammonium glutamate | MP Biomedicals | MP21805951 | |
| Arginine | Formedium | DOC0106 | |
| Asparagine | Formedium | DOC0114 | |
| Aspartic Acid | Formedium | DOC0118 | |
| ATP | Sigma | A2383 | |
| Axygen Sealing Film | Corning | PCR-SP | |
| CMP | Sigma | C1006 | |
| Coenzyme A | Sigma | C3144 | |
| CutSmart Buffer | NEB | B7204S | Provided with HindIII |
| Cysteine | Formedium | DOC0122 | |
| DNA Clean and Concentrator Kit | Zymo Research | D4004 | Used for purifying DNA |
| dNTPs | NEB | N0447 | |
| E. coli tRNA | Sigma (Roche) | 10109541001 | |
| Folinic Acid | Sigma | 47612 | |
| Gene Fragment | IDT | ||
| Glutamic Acid | Formedium | DOC0134 | |
| Glutamine | Formedium | DOC0130 | |
| Glycine | Formedium | DOC0138 | |
| GMP | Sigma | G8377 | |
| HEPES | Sigma | H3375 | |
| HindIII-HF | NEB | R3104L | |
| Histidine | Formedium | DOC0142 | |
| Isoleucine | Formedium | DOC0150 | |
| Leucine | Formedium | DOC0154 | |
| Lysine | Formedium | DOC0158 | |
| Magnesium glutamate | Sigma | 49605 | |
| Methionine | Formedium | DOC0166 | |
| Microtiter Plate (384 well) | Greiner | 781906 | |
| Microtiter Plate (96 well) | Greiner | 655809 | |
| Multimode Plate Reader | BioTek | Synergy Neo2 | |
| NAD | Sigma | N8535 | |
| NanoPhotometer | Implen | NP80 | |
| OneTaq DNA Polymerase | NEB | M0480 | |
| PCR Tube | VWR | 20170-012 | |
| Phenylalanine | Formedium | DOC0170 | |
| Phosphoenolpyruvate | Sigma (Roche) | 10108294 | |
| Potassium glutamate | Sigma | G1501 | |
| Potassium oxalate | Fisher Scientific | P273 | |
| Proline | Formedium | DOC0174 | |
| Putrescine | Sigma | P5780 | |
| Serine | Formedium | DOC0178 | |
| Spermidine | Sigma | S0266 | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Reaction Buffer | NEB | B0202S | Provided with T4 DNA Ligase |
| TempliPhi Amplification Kit | Cytiva | 25640010 | Used for RCA |
| Thermal Cycler | Biorad | C1000 Touch | |
| Thermoblock | Eppendorf | ThermoMixer FP | |
| Threonine | Formedium | DOC0182 | |
| Tryptophan | Formedium | DOC0186 | |
| Tyrosine | Formedium | DOC0190 | |
| UMP | Sigma | U6375 | |
| Valine | Formedium | DOC0194 |
Referências
- Sun, Q., et al. A simple and low-cost paper-based colorimetric method for detecting and distinguishing the GII.4 and GII.17 genotypes of norovirus. Talanta. 225, 121978 (2021).
- Pardee, K., et al. Low-Cost Detection of Zika Virus Using Programmable Biomolecular Components. Cell. 165 (5), 1255-1266 (2016).
- Pardee, K., et al. Paper-based synthetic gene networks. Cell. 159 (4), 940-954 (2014).
- Ma, D., Shen, L., Wu, K., Diehnelt, C. W., Green, A. A. Low-cost detection of norovirus using paper-based cell-free systems and synbody-based viral enrichment. Synthetic Biology. 3 (1), (2018).
- Park, S., Lee, J. W. Detection of coronaviruses using rna toehold switch sensors. International Journal of Molecular Sciences. 22 (4), 1772 (2021).
- Cao, M., Sun, Q., Zhang, X., Ma, Y., Wang, J. Detection and differentiation of respiratory syncytial virus subgroups A and B with colorimetric toehold switch sensors in a paper-based cell-free system. Biosensors and Bioelectronics. 182, 113173 (2021).
- Mcnerney, M. P., et al. Point-of-care biomarker quantification enabled by sample-specific calibration. Science Advances. 5 (9), (2019).
- Silverman, A. D., Akova, U., Alam, K. K., Jewett, M. C., Lucks, J. B. Design and optimization of a cell-free atrazine biosensor. ACS Synthetic Biology. 9 (3), 671-677 (2020).
- Salehi, A. S. M., et al. Cell-free protein synthesis approach to biosensing hTRβ-specific endocrine disruptors. Analytical Chemistry. 89 (6), 3395-3401 (2017).
- Garamella, J., Majumder, S., Liu, A. P., Noireaux, V. An adaptive synthetic cell based on mechanosensing, biosensing, and inducible gene circuits. ACS Synthetic Biology. 8 (8), 1913-1920 (2019).
- Glasscock, C. J., et al. Dynamic control of pathway expression with riboregulated switchable feedback promoters. ACS Synthetic Biology. 16, (2019).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- Pardee, K., et al. Portable, on-demand biomolecular manufacturing. Cell. 167 (1), 248-259 (2016).
- Nelson, J. A. D., et al. Hydrofoam and oxygen headspace bioreactors improve cell-free therapeutic protein production yields through enhanced oxygen transport. Biotechnology Progress. 37 (2), 3079 (2020).
- Cai, Q., et al. A simplified and robust protocol for immunoglobulin expression in Escherichia coli cell-free protein synthesis systems. Biotechnology Progress. 31 (3), 823-831 (2015).
- Ogonah, O. W., Polizzi, K. M., Bracewell, D. G. Cell free protein synthesis: a viable option for stratified medicines manufacturing? A brief history of cell free synthesis systems. Current Opinion in Chemical Engineering. 18, 77-83 (2017).
- Zawada, J. F., et al. Microscale to manufacturing scale-up of cell-free cytokine production-a new approach for shortening protein production development timelines. Biotechnology and Bioengineering. 108 (7), 1570-1578 (2011).
- Stark, J. C., et al. On-demand biomanufacturing of protective conjugate vaccines. Science Advances. 7 (6), (2021).
- Huang, A., et al. BioBitsTM Explorer: A modular synthetic biology education kit. Science Advances. 4 (8), 1-11 (2018).
- Stark, J. C., et al. BioBits health: classroom activities exploring engineering, biology, and human health with fluorescent readouts. ACS Synthetic Biology. 8 (5), 1001-1009 (2019).
- Stark, J. C., et al. BioBitsTM Bright: A fluorescent synthetic biology education kit. Science Advances. 4 (8), 33 (2018).
- Shinoda, T., et al. Cell-free methods to produce structurally intact mammalian membrane proteins. Scientific Reports. 6, (2016).
- Dopp, J. L., Rothstein, S. M., Mansell, T. J., Reuel, N. F. Rapid prototyping of proteins: Mail order gene fragments to assayable proteins within 24 hours. Biotechnology and Bioengineering. 116 (3), 667-676 (2019).
- Sachse, R., Dondapati, S. K., Fenz, S. F., Schmidt, T., Kubick, S. Membrane protein synthesis in cell-free systems: From bio-mimetic systems to bio-membranes. FEBS Letters. 588 (17), 2774-2781 (2014).
- Salehi, A. S. M., et al. Cell-free protein synthesis of a cytotoxic cancer therapeutic: Onconase production and a just-add-water cell-free system. Biotechnology Journal. 11 (2), 274-281 (2016).
- Georgi, V., et al. On-chip automation of cell-free protein synthesis: New opportunities due to a novel reaction mode. Lab on a Chip. 16 (2), 269-281 (2016).
- Thoring, L., et al. Cell-free systems based on CHO cell lysates: Optimization strategies, synthesis of "difficult-to-express" proteins and future perspectives. PLoS One. 11 (9), (2016).
- Dopp, J. L., Reuel, N. F. Simple, functional, inexpensive cell extract for in vitro prototyping of proteins with disulfide bonds. Biochemical Engineering Journal. 164, 107790 (2020).
- Isaksson, L., Enberg, J., Neutze, R., Göran Karlsson, B., Pedersen, A. Expression screening of membrane proteins with cell-free protein synthesis. Protein Expression and Purification. 82 (1), 218-225 (2012).
- Techner, J. M., et al. High-throughput synthesis and analysis of intact glycoproteins using SAMDI-MS. Analytical Chemistry. 92 (2), 1963-1971 (2020).
- Kim, H. C., et al. Implementing bacterial acid resistance into cell-free protein synthesis for buffer-free expression and screening of enzymes. Biotechnology and Bioengineering. 112 (12), 2630-2635 (2015).
- Rolf, J., Siedentop, R., Lütz, S., Rosenthal, K. Screening and identification of novel cGAS homologues using a combination of in vitro and in vivo protein synthesis. International Journal of Molecular Sciences. 21 (1), (2020).
- Haslinger, K., Hackl, T., Prather, K. L. J. Rapid in vitro prototyping of O-methyltransferases for pathway applications in Escherichia coli. bioRxiv. , (2020).
- Dopp, J. L., Tamiev, D. D., Reuel, N. F. Cell-free supplement mixtures: Elucidating the history and biochemical utility of additives used to support in vitro protein synthesis in E. coli extract. Biotechnology Advances. 37 (1), 246-258 (2018).
- Gregorio, N. E., Levine, M. Z., Oza, J. P. A user's guide to cell-free protein synthesis. Methods and Protocols. 2 (1), 24 (2019).
- Cole, S. D., Miklos, A. E., Chiao, A. C., Sun, Z. Z., Lux, M. W. Methodologies for preparation of prokaryotic extracts for cell-free expression systems. Synthetic and Systems Biotechnology. 5 (4), 252-267 (2020).
- Chiba, C. H., Knirsch, M. C., Azzoni, A. R., Moreira, A. R., Stephano, M. A. Cell-free protein synthesis: advances on production process for biopharmaceuticals and immunobiological products. BioTechniques. 70, (2021).
- Laohakunakorn, N. Cell-free systems: A proving ground for rational biodesign. Frontiers in Bioengineering and Biotechnology. 8, 788 (2020).
- Dondapati, S. K., Stech, M., Zemella, A., Kubick, S. Cell-free protein synthesis: A promising option for future drug development. BioDrugs. , 1-22 (2020).
- Noireaux, V., Liu, A. P. The new age of cell-free biology. Annual Review of Biomedical Engineering. 22, 51-77 (2020).
- Khambhati, K., et al. Exploring the Potential of Cell-Free Protein Synthesis for Extending the Abilities of Biological Systems. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Rosenblum, G., Cooperman, B. S. Engine out of the chassis: Cell-free protein synthesis and its uses. FEBS Letters. 588 (2), 261-268 (2014).
- Swartz, J. R. Transforming biochemical engineering with cell-free biology. AIChE Journal. 58 (1), 5-13 (2012).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Caschera, F., Noireaux, V. A cost-effective polyphosphate-based metabolism fuels an all E. coli cell-free expression system. Metabolic Engineering. 27, 29-37 (2015).
- Levine, M. Z., et al. Activation of energy metabolism through growth media reformulation enables a 24-hour workflow for cell-free expression. ACS Synthetic Biology. 9 (10), 2765-2774 (2020).
- Hunt, J. P., et al. Streamlining the preparation of "endotoxin-free" ClearColi cell extract with autoinduction media for cell-free protein synthesis of the therapeutic protein crisantaspase. Synthetic and Systems Biotechnology. 4 (4), 220-224 (2019).
- Dopp, J. L., Jo, Y. R., Reuel, N. F. Methods to reduce variability in E. Coli-based cell-free protein expression experiments. Synthetic and Systems Biotechnology. 4 (4), 204-211 (2019).
- Sun, Z. Z., et al. Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Journal of Visualized Experiments: JoVE. , e50762 (2013).
- Schinn, S. M., Broadbent, A., Bradley, W. T., Bundy, B. C. Protein synthesis directly from PCR: Progress and applications of cell-free protein synthesis with linear DNA. New Biotechnology. 33 (4), 480-487 (2016).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of Biotechnology. 110 (3), 257-263 (2004).
- Marshall, R., Maxwell, C. S., Collins, S. P., Beisel, C. L., Noireaux, V. Short DNA containing χ sites enhances DNA stability and gene expression in E. coli cell-free transcription-translation systems. Biotechnology and Bioengineering. 114, 2137-2141 (2017).
- Sun, Z. Z., Yeung, E., Hayes, C. A., Noireaux, V., Murray, R. M. Linear DNA for rapid prototyping of synthetic biological circuits in an escherichia coli based TX-TL cell-free system. ACS Synthetic Biology. 3 (6), 387-397 (2014).
- . Addgene: pJL1 Available from: https://www.addgene.org/69496/ (2021)
- . IDT Codon Optimization Tool Available from: https://www.idtdna.com/pages/tools/codon-optimization-tool (2021)
- Hadi, T., et al. Rolling circle amplification of synthetic DNA accelerates biocatalytic determination of enzyme activity relative to conventional methods. Scientific Reports. 10 (1), 10279 (2020).
- . New England Biolabs Tm Calculator Available from: https://tmcalculator.neb.com/#!/main (2021)
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of Biological Engineering. 4, (2010).
- Colant, N., et al. A rational approach to improving titer in Escherichia coli-based cell-free protein synthesis reactions. Biotechnology Progress. 37 (1), 3062 (2021).
- Burgess-Brown, N. A., et al. Codon optimization can improve expression of human genes in Escherichia coli: A multi-gene study. Protein Expression and Purification. 59, 94-102 (2008).
- Maertens, B., et al. Gene optimization mechanisms: A multi-gene study reveals a high success rate of full-length human proteins expressed in Escherichia coli. Protein Science. 19 (7), 1312-1326 (2010).
- Eckert, K. A., Kunkel, T. A. DNA polymerase fidelity and the polymerase chain reaction. Genome Research. 1 (1), 17-24 (1991).
- Dopp, J. L., Reuel, N. F. Process optimization for scalable E. coli extract preparation for cell-free protein synthesis. Biochemical Engineering Journal. 138, 21-28 (2018).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia Coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology Progress. 21 (2), 460-465 (2005).
- Levine, M. Z., Gregorio, N. E., Jewett, M. C., Watts, K. R., Oza, J. P. Escherichia coli-Based Cell-Free Protein Synthesis: Protocols for a robust, flexible, and accessible platform technology. Journal of Visualized Experiments: JoVE. (144), e58882 (2019).
- Kwon, Y. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados