Method Article
Ex Vivo pressurizado Hipocampal Capilar-Parenchymal Arteriole Preparação para estudo funcional
Neste Artigo
Resumo
O presente manuscrito detalha como isolar as artérias hipocampais e capilares do cérebro do rato e como pressioná-las para a miografia de pressão, imunofluorescência, bioquímica e estudos moleculares.
Resumo
De alterações comportamentais sutis à demência em estágio avançado, o comprometimento cognitivo vascular geralmente se desenvolve após a isquemia cerebral. Acidente vascular cerebral e parada cardíaca são doenças extremamente sexualmente dimórficas, e ambos induzem isquemia cerebral. No entanto, o progresso na compreensão do comprometimento cognitivo vascular e, em seguida, o desenvolvimento de tratamentos específicos para o sexo, tem sido parcialmente limitado por desafios na investigação da microcirculação cerebral de modelos de camundongos em estudos funcionais. Aqui, apresentamos uma abordagem para examinar a sinalização capilar-a-arteriole em uma preparação de arteriole capilar-parenchymal hipvivo (HiCaPA) do cérebro do rato. Descrevemos como isolar, cannuar e pressurizar a microcirculação para medir o diâmetro arteriolar em resposta à estimulação capilar. Mostramos quais controles funcionais apropriados podem ser usados para validar a integridade de preparação hicapa e exibir resultados típicos, incluindo testar o potássio como um agente de acoplamento neurovascular e o efeito do inibidor recentemente caracterizado da família do canal de potássio retificada kir2, ML133. Além disso, comparamos as respostas nos preparativos obtidos de camundongos machos e fêmeas. Embora esses dados reflitam investigações funcionais, nossa abordagem também pode ser usada em biologia molecular, imunoquímica e estudos de eletrofisiologia.
Introdução
A circulação pial na superfície do cérebro tem sido objeto de muito estudo, em parte por causa de sua acessibilidade experimental. No entanto, a topologia da vasculatura cerebral cria regiões distintas. Em contraste com a robusta rede pial rica em anastomoisés com capacidade substancial para redirecionar o fluxo sanguíneo, as artérias parenchymal intracerebrais (PAs) apresentam fornecimento colateral limitado, cada um deles perfusando um volume discreto de tecido nervoso1,2. Isso cria um efeito de gargalo sobre o fluxo sanguíneo que, combinado com características fisiológicas únicas3,4,5,6,7,8, faz das artérias intracerebrais um local crucial para o fluxo sanguíneo cerebral (CBF) regulamento9,10. Apesar dos desafios técnicos inerentes ao isolamento e à cannulação das As, a última década tem visto um aumento do interesse em estudos funcionais ex vivo usando embarcações pressurizadas11,12,14,15,16, 17. Uma das razões para esse aumento do interesse é o considerável esforço de pesquisa realizado sobre o acoplamento neurovascular (NVC), o mecanismo que sustenta a hiperemia funcional cerebral18.
Regionalmente, a CBF pode aumentar rapidamente após a ativação neural local19. Os mecanismos celulares e as propriedades de sinalização que controlam o NVC são incompletamente compreendidos. No entanto, identificamos um papel previamente inesperado para os capilares cerebrais durante o NVC na detecção de atividade neural e traduzi-lo em um sinal elétrico hiperpolarizante para dilatar artérias a montante20,21,22. Os potenciais de ação23,24 e a abertura dos canais K+ (BK) ativados por grande conduta Ca2+(BK) nos pés arrumados ascíticos25,26 aumentam a concentração interstitial de íons de potássio [K+]o, o que resulta na ativação de canais retrógrados fortes K+ (Kir) no endotelium vascular dos capilares. Este canal é ativado por Kexterno + mas também pela própria hiperpolarização. Espalhando-se através de junções gap, a corrente hiperpolarizadora, em seguida, regenera em células endotélias capilares adjacentes até a arteriole, onde causa relaxamento miócito e aumento cbf20,21. O estudo deste mecanismo nos levou a desenvolver uma preparação pressurizada de arteriole capilar-parenchymal (CaPA) para medir o diâmetro arteriolar durante a estimulação capilar com agentes vasoativos. A preparação do CaPA é composta por um segmento de arteriole intracerebral cannulado com uma ramificação capilar intacta a jusante. As extremidades capilares são comprimidas contra o fundo de vidro de câmara por uma micropipette, o que oclude e estabiliza toda a formação vascular20,21.
Anteriormente fizemos inovações instrumentais por imagem capa preparações do córtex do rato20,21 e arterioles da amígdala de rato13 e hipocampo16,17. Como a vasculatura hipocampal recebe mais atenção devido à sua suscetibilidade a condições patológicas, aqui fornecemos um método passo a passo para a preparação da CaPA do hipocampo do camundongo (HiCaPA) que não só pode ser usado em estudos funcionais de NVC, mas também em biologia molecular, imunoquímica e eletrofisiologia.
Protocolo
Todos os experimentos foram aprovados pelo Institutional Animal Care and Use Committee (IACUC) da Universidade do Colorado, Anschutz Medical Campus e foram realizados de acordo com as diretrizes dos Institutos Nacionais de Saúde.
1. Soluções
- Use solha-tampão de MOPS para a dissecação e para manter amostras em 4 °C antes de sua utilização. Não gaseie a solução. Prepare MOPS soro fisiológico amortecida com seguinte composição: 135 mM NaCl, 5 mM KCl, 1 mM KH2PO4, 1 mM MgSO4, 2.5 mM CaCl2, 5 mM glicose, 3 mM MOPS, 0.02 mM EDTA, 2 mM pyruvate, 10 mg/mL bovine serum albumin, pH 7.3 em 4 °C.
- Use o líquido cefalorraquidiano artificial (aCSF) como solução de banho e solução de pipeta. Gás tanto aCSF e Ca2 +-aCSF livre com 5% CO2,20% O2,e N2 saldo. Prepare a solução com a seguinte composição: 125 mM NaCl, 3 mM KCl, 26 mM NaHCO3,1,25 mM NaH2PO4, 1 mM MgCl2, 4M glicose, 2 mM CaCl2, pH 7.3 (com aeração com 5% CO2,20% O2, e N2 saldo).
- Obtenha a dilatação máxima em nominalmente Ca2+-free aCSF (0 mM [Ca2+]o,5 mM EGTA).
2. Preparação da câmara do órgão
- Insira capilares de vidro borosilicato (diâmetro externo = 1,2 mm; diâmetro interno = 0,69 mm; comprimento = 10 cm) em um puxador de vidro. Puxe o capilar para fazer uma ponta longa e fina em uma extremidade.
- Para um lado da câmara, adicione uma cânula que pode se conectar a uma bomba peristaltic em miniatura para pressurizar luminally o vaso. um microscópio de dissecação, quebre a ponta da cânula para que seja pequena o suficiente para caber no vaso de interesse, mas grande o suficiente para permitir que as soluções fluam através da ponta. Certifique-se de que a ponta é de aproximadamente 10-15 μm de diâmetro.
- Encha a cânula usando uma seringa com um filtro de 0,22 μm anexado com aCSF oxigenado. Certifique-se de que não há bolhas de ar ou detritos na cânula.
- Adicione mais duas cânulas ao lado oposto da câmara. Não quebre suas dicas.
3. Dissecção e isolamento do hipocampo
- Eutanásia e decapita rasto um rato. Para este experimento, use um mouse C57BL6/J de 8 semanas de idade para comparar diferenças entre machos e fêmeas. Injetar o rato com pentobarbital e decapitar com tesoura cirúrgica.
- Usando pequenas tesouras de dissecação, corte a pele ao longo da linha média no topo de sua cabeça. Mova a pele para os lados.
- Começando no lado caudal do crânio, corte o crânio ao longo da linha média até que as lâmpadas olfativas sejam alcançadas. Retire partes do crânio até que o cérebro seja exposto.
- Retire lentamente o cérebro, começando perto do nariz do rato. Separe o cérebro das lâmpadas olfativas, nervos cranianos e medula espinhal cortando as estruturas com a pequena tesoura de dissecação.
- Coloque o cérebro em uma placa de dissecação com solução MOPS suficiente para submergi-lo completamente. Usando um microscópio de dissecação, coloque o cérebro no centro da placa de dissecação com o lado ventral voltado para baixo.
- Usando uma lâmina de barbear, corte o cérebro ao meio ao longo da fissura longitudinal. Segure a lâmina para que a borda afiada seja paralela à parte inferior da placa de dissecação. Pressione a lâmina através do cérebro em um golpe. Mova um hemisfério para o lado da placa.
- Realize os seguintes passos para cada hemisfério separadamente ou em paralelo.
- Coloque um hemisfério no centro da placa para que a linha média está voltada para baixo. Em seguida, use a lâmina de barbear para cortar ao longo da fissura transversal para remover o cerebelo e tronco cerebral. Empurre a lâmina diretamente através do tecido.
- Gire o hemisfério para que o lado medial esteja enfrentando(Figura 1A). Use uma espátula para manter o cérebro no lugar. Usando uma segunda espátula, insira a ponta abaixo do corpo caloso e colher por baixo para remover o tálamo, septo e hipotálamo, cobrindo o hipocampo(Figura 1B).
- Certifique-se de que o hipocampo é agora visível como uma estrutura curvaperto do lado posterior do cérebro. Usando uma espátula para manter o ceceto no lugar, use a segunda espátula para colher o hipocampo para fora do cerebelo (Figura 1C).
- Transfira o hipocampo para uma nova placa de dissecação cheia a meio caminho com a solução MOPS. Descarte o resto do cérebro.
4. Isolamento arteriole hipocampal
- Complete as seguintes etapas para cada hipocampo.
- Afixe um dos hipocampos usando pequenos pinos em cada extremidade da seção. A artéria hipocampal está virada para cima.
- Usando fórceps muito afiados, estica delicadamente seções pequenas do hipocampo. Isso vai soltar o tecido em torno das artérias, tornando mais fácil dissecá-los.
- Busca através do tecido hipocampal dorsal para identificar a artéria transversal externa (Figura 1C)16,27.
- Pegue suavemente a artéria transversal externa e lentamente puxá-la para longe do tecido para coletar as artérias e capilares que perfundem a região CA3 do hipocampo.
- Uma vez que não há mais vasos para serem removidos do tecido, descarte os hipocampi. Mantenha os vasos no gelo em placas enquanto não está em uso.
5. Hippocampal capilar-parenchymal arteriole cannulation
- Encontre uma arteriosle com um galho que termina com capilares. Transfira-o para a câmara de órgãos. Certifique-se de que o arteriole é de cerca de 15-30 μm quando totalmente dilatado(Figura 1D).
- Monte cuidadosamente o vaso sanguíneo, empurrando a ponta da cânula através da parede arteriole abaixo da área alvo. Cuidadosamente deslize o vaso para a cânula até que haja tecido suficiente para colocar o empate.
- Faça um nó solto com 12-0 suturas de nylon para que ele se encaixa sobre o vaso sanguíneo e cânula. Use um nó de meio engate para garantir laços. Em seguida, puxe as extremidades para apertar o nó e proteger o arteriole para a cânula. Remova todas as filiais estranhas da embarcação abaixo do laço delicadamente puxando os com fórceps.
- Faça outra gravata e fixá-lo do outro lado da arteriole para selá-lo.
- Abaixe a cânula com a embarcação unida até que esteja lisa de encontro ao coverslip na parte inferior da câmara. Tenha cuidado para não baixar a cânula demais ou ele vai quebrar.
- Usando uma cânula no lado oposto da câmara, abaixe-a de modo que o ponto dele pine para baixo o laço na extremidade do arteriole.
- Use a terceira cânula para fixar o galho capilar para o coverslip. Coloque a ponta perto do final do ramo, deixando as extremidades dos capilares expostos (não debaixo da cânula).
6. Miografia de pressão
- Mova a câmara do escopo de dissecação para o microscópio com o software de gravação.
- Conecte a tubulação de entrada e saída à câmara para perfusão. Inicie a perfusão com aCSF aquecido (37 °C) a uma taxa de fluxo de 4 mL/min.
- Anexar a cânula pressurização a uma bomba peristaltic emparelhado com um transdutor de pressão e trazer a pressão interna para 20 mm Hg.
- Comece o software de gravação. Ajuste as configurações de microscópio e imagem para alcançar a imagem mais clara possível. Comece a gravação uma vez que as configurações são otimizadas para o software de detecção.
- Aumentar a pressão do navio até 40 mm Hg ao gravar o diâmetro arterial com um software de detecção de borda.
- Permita que ~15-20 min lave a solução MOPS para fora da câmara com aCSF, e deixe a preparação da HiCaPA equilibrar e desenvolver o tom miogênico.
- Para testar a viabilidade de um navio, aplique a solução 1 μM NS309 à perfusão de banho (ver Figura 2A,B e a seção resultados representativos). O segmento arteriolar deve dilatar, demonstrando cerca de 30-40% de tom miogênico como descrito anteriormente3,14,20.
7. Estimulação focal de extremidades capilares
- Uma vez que o tom de base para o arteriole foi estabelecido e a função endotelial avaliada, teste a resposta da estimulação capilar.
- Usando um puxador de vidro, faça cânulas de modo que haja um ponto fino em uma extremidade. Quebre a ponta fora de uma cânula de modo que a droga testada possa fluir através da ponta lisamente em 5 psi.
- Preencha a cânula com a solução de droga de interesse e adicioná-lo a um micromanipulador de 3 eixos ligado ao microscópio. Conecte a tubulação do sistema de ejeção de pressão à cânula.
- Lentamente abaixe a cânula no banho perto dos capilares, tomando cuidado para não atingir qualquer parte do navio ou hardware na câmara. Manobrar a ponta da cânula ao lado das extremidades dos capilares sem tocá-los. Mantenha a ponta da cânula apenas fora do coverslip para impedir que a embarcação seja estimulada se a cânula escapa.
- Quando estiver pronto para estimular os capilares, abaixe a cânula para o deslizamento de capa e ao lado dos capilares. Ative o sistema de ejeção de pressão com o tempo de ejeção desejado (aqui 20 s). Uma vez que a estimulação é terminada, levante a cânula ligeiramente para evitar uma estimulação mais adicional.
- Repita a estimulação, se necessário. Alterar a cânula do sistema de ejeção de pressão para testar diferentes compostos de drogas.
- Para confirmar que apenas os capilares estão sendo estimulados, preencha a cânula com a solução de 1 μM NS309 e repita os degraus acima.
NOTA: As células endotélias capilares não expressam canais K+ ativados pelo NS309, de modo que a arteriole não deve responder à estimulação. Se o arteriole dilata, então a cânula terá de ser reposicionada ou o diâmetro do buraco terá de ser menor (ver Figura 2A,B e a seção de Resultados Representativos).
Resultados
A pequena condução endotelial (SK) e a condução intermediária (IK) Ca2+sensíveis aos canais K+ exercem uma influência dilatória sobre o diâmetro das PAs. Aplicação de banho de 1 μM NS309, um agonista sintético do canal IK e SK, causou quase dilatação máxima (Figura 2A,B). No entanto, as células endotélias capilares não possuem canais IK e SK e não hiperpolarizam em resposta ao NS30920. Como resultado, o estímulo às extremidades capilares com 1 μM NS309 por ejeção de pressão focal (20 s, 5 psi) não causou dilatação arteriolar a montante (Figura 2A,B). Este resultado indica que o NS309 não atingiu o arteriole nos preparativos da HiCaPA e pode ser usado como controle para avaliar a restrição espacial do composto aplicada em capilares por ejeção de pressão.
Esta preparação foi fundamentalmente projetada para a medição da sinalização elétrica de dentro para fora de capilares para PAs. Usando a preparação hicapa, aplicamos aCSF contendo 10 mM K+ para as extremidades capilares e medimos uma dilatação arteriolar a montante (Figura 2A,C),como fizemos anteriormente nos preparativos da CaPA da vasculatura cortical20. Em seguida, investigamos, pela primeira vez, ao nosso conhecimento, a sinalização elétrica capilar-a-arteriole em camundongos fêmeas usando preparações HiCaPA. Dilatação arteriolar evocada pela estimulação capilar com 10 mM K+ não difere entre os preparativos de camundongos machos e fêmeas (Figura 2A,C).
Finalmente, outro benefício fundamental dessa abordagem é a possibilidade de aplicar ferramentas farmacológicas no banho antes da estimulação capilar. Aqui testamos o efeito do ML133, um inibidor kir2 recentemente desenvolvido28. Adição de 10 μM ML133 à perfusão de banho praticamente aboliu a dilatação arteriolar induzida por capilar em resposta a 10 mM K+ em preparações HiCaPA de camundongos machos e fêmeas (Figura 2A,C). Este último resultado sugere que o canal Kir2.1 media a sinalização elétrica na vasculatura cerebral feminina, como descrito anteriormente na microcirculação cortical do cérebro masculino.
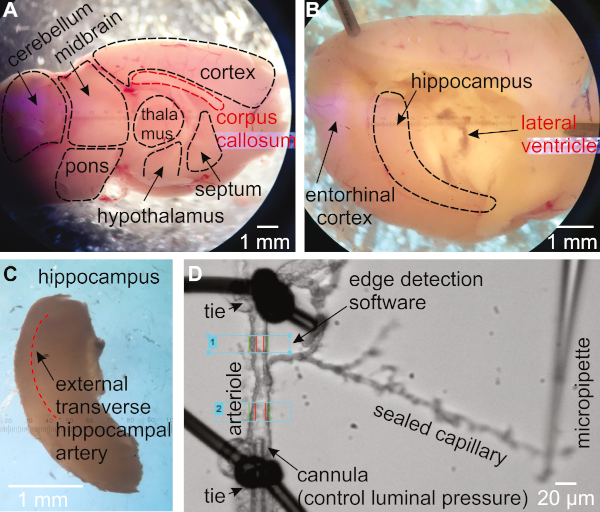
Figura 1: Metodologia para isolamento e pressurização das artérias capilares-parenchymal hipocampal (HiCaPA) preparação do mouse. (A) Cérebro recém-isolado é cortado ao meio no plano sulácido após a fissura interhemisférica e colocado com o lado medial voltado para cima. (B) O tálamo, o septo e o hipotálamo são gentilmente removidos para revelar o hipocampo. Ohipocampo é cuidadosamente removido. (D)As artérias com árvores capilares estão isoladas do hipocampo e uma extremidade do segmento arteriolar é cannulada com uma micropipette conectada a um sistema pressurizador, e a outra extremidade é ocluída. As extremidades capilares são seladas e mantidas contra o deslizamento de capa com a ponta de uma pipeta de vidro. O diâmetro interno é monitorado com um sistema de detecção de borda em uma ou várias regiões da arteriole. Clique aqui para ver uma versão maior deste número.

Figura 2: A estimulação focal dos capilares com 1 μM NS309 não tem efeito sobre o diâmetro arteriolar a montante, ao contrário da estimulação com aCSF contendo 10 mM K+. (A)Registro representativo do diâmetro arteriolar a montante mostrando o efeito da aplicação de banho de 1 μM NS309 seguido de estimulação sucessiva s termina capilar (20 s, 5 psi) com 1 μM NS309 e com aCSF contendo 10 mM K+ na ausência ou presença do inibidor do canal Kir2 ML133. A aplicação de 10 mM K+ em capilares produziu uma dilatação arteriolar rápida a montante que foi bloqueada por 10 μM ML133. NS309 não causou dilatação. A ausência de dilatação arteriolar a montante em resposta à estimulação capilar com NS309 ilustra que compostos ejetados por pressão não atingem a arteriole. (B) Dados sumários que mostram alterações de diâmetro induzidas por 1 μM NS309 aplicados no banho ou nas extremidades capilares (n = 14; ****p < 0,0001, t-test emparelhado). (C) Dados sumários que mostram alterações de diâmetro arteriolar induzidas por 10 mM K+ aplicadas diretamente nos capilares nos preparativos da HiCaPA de camundongos masculinos (n = 6) ou femininos (n = 8) antes e depois de 10 μM ML133 foram aplicados no banho (***p < 0,0005, n.s. = t-test não significativo e sem pares). Clique aqui para ver uma versão maior deste número.
Discussão
A preparação pressurizada hicapa (hipocampal capilar-parenchymal arteriole) descrita no presente manuscrito é uma extensão do nosso procedimento bem estabelecido para isolar, pressurizar e estudar as artérias parenchymal29. Recentemente, relatou que os canais Kir2.1 em células endotélias capilares cerebrais sentido aumenta em [K+]o associado com a ativação neural, e gerar um sinal hiperpolarizante ascendente que dilata artérias rioacima 20. Revelar este papel anteriormente inesperado para os capilares tem sido possível, em parte, a partir do desenvolvimento da preparação capa a partir de microcirculação cortical20,21. Este manuscrito apresenta uma abordagem experimental semelhante, mas de uma estrutura mais profunda e restrita do cérebro do rato para descrever uma abordagem simples e reproduzível para investigar a sinalização capilar-a-arteriole durante o acoplamento neurovascular.
A microcirculação cerebral é requintadamente frágil e certas práticas, especialmente minimizando o alongamento e o manuseio dos vasos, devem ser usadas para garantir a sobrevivência das artérias e capilares. O desenvolvimento espontâneo do tom miogênico é o primeiro indicador da viabilidade de uma preparação30. A função endotelial pode então ser avaliada adicionando o ns309 dos canais SK e IK à solução do banho, que deve causar a dilatação máxima próxima. Em caso de não desenvolver tom ou resposta à aplicação de banho do NS309, a preparação deve ser substituída por outra. NS309 também é usado para testar a propagação da estimulação capilar focal. Como as células endotélias capilares não possuem canais SK e IK20,a entrega local do NS309 em capilares por ejeção de pressão não deve ter efeito sobre o diâmetro arteriolar a montante, como indicado na Figura 2, ilustrando que os compostos não estimulam acidentalmente a arteriole. Uma vez que estas etapas são validadas, a sinalização capilar-à-arteriole pode ser testada.
Aqui examinamos a sinalização elétrica estimulando capilares com aCSF contendo 10 mM K+. No entanto, diferentes modalidades de sinalização podem ser exploradas usando a abordagem atual, estimulando capilares com diferentes agentes vasoativos conhecidos ou neurotransmissores. Outro benefício dessa preparação é a possibilidade de investigar e, eventualmente, comparar o NVC entre diferentes animais e entre diferentes regiões cerebrais. Isto é particularmente interessante porque o cérebro não é uniformemente alvo de patologias cerebrovasculares31,32. Uma limitação geral da abordagem aqui apresentada é que, ao isolar a microcirculação, componentes cruciais da unidade neurovascular, como neurônios e astrócitos, são perdidos. Outras preparações, como a janela craniana para imagens in vivo CBF, mantêm a estrutura da unidade neurovascular intacta e são mais adequadas para estudar NVC em um sistema intacto. No entanto, na preparação da janela craniana, as arteriolas parenchymal são difíceis de imagem sem equipamentos específicos, como um microscópio multi-foto, e regiões mais profundas, como o hipocampo, permanecem difíceis de imagem. A este respeito, a abordagem desenvolvida no laboratório Filosa usando fluxo luminal para induzir o tom miogênico em fatias cerebrais representa uma ligação elegante entre fatia do cérebro e in vivo se aproxima33. No entanto, o tecido nervoso circundante pode limitar a penetração de uma droga aplicada topicamente, aumentando seu potencial fora do alvo e dificultando as interpretações, porque vários tipos de células são expostos às drogas. Desenvolvemos principalmente nossa abordagem ex vivo para abordar esses problemas potenciais. Em conclusão, várias abordagens devem ser usadas em conjunto para estudar totalmente o NVC.
Em resumo, o presente relatório descreve uma preparação intacta ex vivo de artérias hipocampais pressurizadas e capilares que permite que os efeitos dos agentes farmacológicos e biológicos sejam testados em parâmetros funcionais em posições discretas ao longo do continuum capilar-arteriole.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores gostariam de agradecer a Jules Morin por comentários perspicazes sobre o manuscrito. Esta pesquisa foi financiada por prêmios da organização sem fins lucrativos CADASIL Together We Have Hope, do Center for Women's Health and Research e do NHLBI R01HL136636 (FD).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
Referências
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados