Method Article
Ex Vivo Pressurizzato Ippocampo Capillary-Parenchymal Arteriole Preparazione per lo Studio Funzionale
In questo articolo
Riepilogo
Il presente manoscritto descrive come isolare le arteriole e i capillari ippocampali dal cervello del topo e come pressurizzarli per la miografia a pressione, l'immunofluorescenza, la biochimica e gli studi molecolari.
Abstract
Dalle sottili alterazioni comportamentali alla demenza in fase avanzata, il danno vascolare si sviluppa in genere a seguito di ischemia cerebrale. L'ictus e l'arresto cardiaco sono malattie sessualmente dimorfiche, ed entrambi inducono l'ischemia cerebrale. Tuttavia, i progressi nella comprensione del danno vascolare vascolare, e quindi nello sviluppo di trattamenti specifici per il sesso, sono stati in parte limitati dalle sfide nello studio della microcircolazione cerebrale dai modelli murini negli studi funzionali. Qui, presentiamo un approccio per esaminare la segnalazione capillary-to-arteriola in una preparazione capillary-ppillaryle capillary-parenchymic (HiCaPA) ex vivo ippocampale -parenchymal (HiCaPA) dal cervello di topo. Descriviamo come isolare, cannulare e pressurizzare la microcircolazione per misurare il diametro arteriolare in risposta alla stimolazione capillare. Mostriamo quali controlli funzionali appropriati possono essere utilizzati per convalidare l'integrità di preparazione HiCaPA e visualizzare risultati tipici, tra cui il test del potassio come agente di accoppiamento neurovascolare e l'effetto dell'inibitore recentemente caratterizzato della famiglia di canali di potassio rettificante interno Kir2, ML133. Inoltre, confrontiamo le risposte nei preparati vinti da topi maschi e femmine. Mentre questi dati riflettono le indagini funzionali, il nostro approccio può essere utilizzato anche negli studi di biologia molecolare, immunochimica ed elettrofisiologia.
Introduzione
La circolazione pial sulla superficie del cervello è stata oggetto di molti studi, in parte a causa della sua accessibilità sperimentale. Tuttavia, la topologia della vascolatura cerebrale crea regioni distinte. In contrasto con la solida rete di pial ricca di anastomosi con notevole capacità di reindirizzare il flusso sanguigno, le arteriole parenchimale intracerebrali (PA) presentano un approvvigionamento collaterale limitato, ognuno dei quali perfonde un volume discreto di tessuto nervoso1,2. Questo crea un effetto di collo di bottiglia sul flusso sanguigno che, combinato con caratteristiche fisiologiche uniche3,4,5,6,7,8, rende arteriole intracerebrali un sito cruciale per la regolazione del flusso sanguigno cerebrale (CBF)9,10. Nonostante le sfide tecniche inerenti all'isolamento e alla cannosazione delle PA, l'ultimo decennio ha visto un crescente interesse per gli studi ex-vivo utilizzando navi pressurizzate11,12,13,14,15,16,17. Uno dei motivi di questo maggiore interesse è il notevole sforzo di ricerca condotto sull'accoppiamento neurovascolare (NVC), il meccanismo che sostiene l'iperemia funzionale del cervello18.
A livello regionale, CBF può aumentare rapidamente a seguito di attivazione neurale locale19. I meccanismi cellulari e le proprietà di segnalazione che controllano la NVC sono incompleti. Tuttavia, abbiamo identificato un ruolo precedentemente imprevisto per i capillari cerebrali durante NVC nel percepire l'attività neurale e tradurla in un segnale elettrico iperpolarizzante per dilatare arteriolea a monte20,21,22. Potenziale di azione23,24 e l'apertura di grande conduttanza Ca2 ,attivato K(BK) canali sui piedi di posta astrociti25,26 aumentare la concentrazione di ioni di potassio interstiziale [K]o, che si traduce in attivazione di forte rettificatore interiore K(Kir) canali nell'endotelio vascolare dei capillari. Questo canale è attivato da Kesterno, ma anche dall'iperpolarizzazione stessa. Diffondendosi attraverso giunzioni gap, la corrente iperpolarizzante poi si rigenera in cellule endoteliali capillari adiacenti fino all'arteriolo, dove provoca il rilassamento del miocito e l'aumento della CBF20,21. Lo studio di questo meccanismo ci ha portato a sviluppare una preparazione capillare-parenchymal arteriola (CaPA) pressurizzata per misurare il diametro arteriolare durante la stimolazione capillare con agenti vasoattivi. La preparazione CaPA è composta da un segmento di arteriole intracerebrale cannulato con una ramificazione capillare intatta a valle. Le estremità capillari sono compresse sul fondo del vetro della camera da una micropipetta, che occia e stabilizza l'intera formazione vascolare20,21.
In precedenza abbiamo fatto innovazioni strumentali da imaging Preparati CaPA dalla corteccia del topo20,21 e arteriole dal ratto amigdala13 e ippocampo16,17. Poiché la vascolatura dell'ippocampa riceve maggiore attenzione a causa della sua suscettibilità alle condizioni patologiche, qui forniamo un metodo passo-passo per la preparazione del CaPA dall'ippocampo del topo (HiCaPA) che può essere utilizzato non solo negli studi funzionali NVC, ma anche nella biologia molecolare, nell'immunochimica e nell'elettrofisiologia.
Protocollo
Tutti gli esperimenti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) dell'Università del Colorado, Anschutz Medical Campus e sono stati eseguiti secondo le linee guida del National Institutes of Health.
1. Soluzioni
- Utilizzare la salina tampone MOPS per la dissezione e conservare i campioni a 4 gradi centigradi prima del loro utilizzo. Non gas la soluzione. Preparare la salina tamponata tamponata MOPS con la seguente composizione: 135 mM NaCl, 5 mM KCl, 1 mM KH2PO2, 1 mM MgMgMG CaCl2, 5 mM di glucosio, 3 mM MOPS, 0,02 mM EDTA, 2 mM di pirama, 10 album di siero bovino mg/mL, pH 7.3.
- Utilizzare il liquido cerebrospinale artificiale (aCSF) come soluzione di bagno e pipetta. Gas sia aCSF che Ca2 -freeaCSF con 5% CO2, 20% O2e N2 equilibrio. Preparare la soluzione con la seguente composizione: 125 mM NaCl, 3 mM KCl, 26 mM NaHCO3, 1,25 mM NaH2PO4, 1 mM MgCl2, 4 mM di glucosio, 2 mM CaCl2, pH 7.3 (con aerazione con 5% CO2, 20% O2e N2 equilibrio).
- Ottenere la dilatazione massima in aCSF nominalmente Ca2o-free (0 mM [Ca2 )o, 5 mM EGTA).
2. Preparazione della camera dell'organo
- Inserire capillari di vetro borosilicato (diametro esterno 1,2 mm; diametro interno di 0,69 mm; lunghezza 10 cm) in un estraente di vetro. Tirare il capillare per fare una punta lunga e sottile ad un'estremità.
- Da un lato della camera, aggiungere una cannula che può collegarsi a una pompa peristaltica in miniatura per pressurizzare la nave. Sotto un microscopio a dissezione, rompere la punta della cannula in modo che sia abbastanza piccola da adattarsi al vaso di interesse, ma abbastanza grande da consentire alle soluzioni di fluire attraverso la punta. Assicurarsi che la punta sia di circa 10-15 m di diametro.
- Riempire la cannula con una siringa con un filtro da 0,22 m allegato con aCSF ossigenato. Assicurarsi che non ci siano bolle d'aria o detriti nella cannula.
- Aggiungere altre due cannule sul lato opposto della camera. Non rompere le loro punte.
3. Dissezione e isolamento dell'ippocampo
- Eutanasia e decapitare un topo. Per questo esperimento, usa un topo C57BL6/J di 8 settimane per confrontare le differenze tra maschi e femmine. Iniettare il mouse con pentobarbital e decapitare con forbici chirurgiche.
- Utilizzando piccole forbici dissezione, tagliare la pelle lungo la linea mediana nella parte superiore della testa. Spostare la pelle ai lati.
- Partendo dal lato caudale del cranio, tagliare il cranio lungo la linea mediana fino a raggiungere i bulbi olfattivi. Rimuovere parti del cranio fino a quando il cervello è esposto.
- Rimuovere lentamente il cervello, iniziando vicino al naso del mouse. Separare il cervello dai bulbi olfattivi, nervi cranici e midollo spinale tagliando le strutture con le piccole forbici dissezione.
- Posizionare il cervello in una piastra di dissezione con soluzione MOPS sufficiente per sommergerlo completamente. Utilizzando un microscopio di dissezione, posizionare il cervello al centro della piastra di dissezione con il lato ventrale rivolto verso il basso.
- Usando una lama di rasoio, tagliare il cervello a metà lungo la fessura longitudinale. Tenere la lama in modo che il bordo tagliente sia parallelo al fondo della piastra di dissezione. Premere la lama attraverso il cervello in un colpo solo. Spostare un emisfero sul lato della piastra.
- Eseguire la procedura seguente per ogni emisfero separatamente o in parallelo.
- Posizionare un emisfero al centro della piastra in modo che la linea mediana sia rivolta verso il basso. Quindi utilizzare la lama del rasoio per tagliare lungo la fessura trasversale per rimuovere il cervelletto e il tronco encefalico. Spingere la lama dritto attraverso il tessuto.
- Ruotare l'emisfero in modo che il lato mediale sia rivolto verso l'alto (Figura 1A). Utilizzare una spatola per tenere il cervello in posizione. Utilizzando una seconda spatola, inserire la punta sotto il corpo callosum e scoop sotto per rimuovere il talamo, il setto e l'ipotalamo, coprendo l'ippocampo (Figura 1B).
- Assicurarsi che l'ippocampo sia ora visibile come struttura curva vicino al lato posteriore del cervello. Utilizzando una spatola per tenere il cervello in posizione, utilizzare la seconda spatola per scoop l'ippocampo fuori dal cervello (Figura 1C).
- Trasferire gli ippocampi su una nuova piastra di dissezione riempita circa a metà con soluzione MOPS. Scarta il resto del cervello.
4. Isolamento dell'arteriosa ippocampale
- Completa i seguenti passaggi per ogni ippocampo.
- Pin down uno degli ippocampi utilizzando piccoli perni ad ogni estremità della sezione. L'arteria ippocampale è rivolta verso l'alto.
- Utilizzando pinze molto affilate, allungare delicatamente piccole sezioni dell'ippocampo. Questo allenta il tessuto che circonda le arteriole, rendendo più facile sezionarli.
- Ricerca attraverso il tessuto ippocampale dorsale per identificare l'arteria trasversale esterna (Figura 1C)16,27.
- Afferrare delicatamente l'arteria trasversale esterna e allontanarla lentamente dal tessuto per raccogliere gli arterioli e i capillari che perfondela noto nella regione CA3 dell'ippocampo.
- Una volta che non ci sono più vasi da rimuovere dal tessuto, scartare gli ippocampi. Tenere le navi sul ghiaccio nei piatti mentre non sono in uso.
5. Cannolazione arteriola capillare-parenchimale ippocampale-parenchimale
- Trova un'arteriole con un ramo che termina con i capillari. Trasferirlo alla camera dell'organo. Assicurarsi che l'arteriole sia di circa 15-30 m quando è completamente dilatata (Figura 1D).
- Montare con attenzione il vaso sanguigno spingendo la punta della cannula attraverso la parete arteriosa sotto l'area bersaglio. Far scorrere con attenzione il vaso sulla cannula fino a quando non c'è abbastanza tessuto per posizionare la cravatta.
- Fare un nodo sciolto con suture di nylon 12-0 in modo che si adatti sopra il vaso sanguigno e cannula. Utilizzare un nodo di mezzo autostop per fissare le cravatte. Quindi tirare le estremità per stringere il nodo e fissare l'arteriola alla cannula. Rimuovere eventuali rami estranei del recipiente sotto la cravatta tirandoli delicatamente con pinze.
- Fare un altro legame e fissarlo sull'altra estremità dell'arteriolo per sigillarlo.
- Abbassare la cannula con il recipiente attaccato fino a quando non è piatta contro il coperchio sul fondo della camera. Fare attenzione a non abbassare troppo la cannula o si romperà.
- Utilizzando una cannula sul lato opposto della camera, abbassarla in modo che il punto di esso appunti la cravatta all'estremità dell'arteriole.
- Utilizzare la terza cannula per pin giù il ramo capillare alla vela. Posizionare la punta vicino all'estremità del ramo lasciando le estremità dei capillari esposti (non sotto la cannula).
6. Mitologia a pressione
- Spostare la camera dal mirino di dissezione al microscopio con il software di registrazione.
- Collegare il tubo di afflusso e di flusso alla camera per la perfusione. Avviare la perfusione con aCSF riscaldato (37 gradi centigradi) ad una portata di 4 mL/min.
- Attaccare la cannula pressurizzante a una pompa peristale abbinata a un trasduttore di pressione e portare la pressione interna a 20 mm Hg.
- Avviare il software di registrazione. Regolare il microscopio e le impostazioni di imaging per ottenere l'immagine più chiara possibile. Avviare la registrazione una volta che le impostazioni sono ottimizzate per il software di rilevamento.
- Aumentare la pressione del recipiente fino a 40 mm Hg durante la registrazione del diametro arterioso con un software di rilevamento dei bordi.
- Lasciare che 15-20 min per lavare la soluzione MOPS fuori dalla camera con aCSF, e lasciare che la preparazione HiCaPA per eclessia e sviluppi tono miogenico.
- Per verificare la fattibilità di un recipiente, applicare la soluzione NS309 di 1 M alla perfusione del bagno (vedere la figura 2A, B e la sezione Risultati rappresentativi). Il segmento arteriolare deve dilatarsi, dimostrando circa il 30-40% di tono miogenico come descritto in precedenza3,14,20.
7. Stimolazione focale delle estremità capillari
- Una volta stabilito il tono di base per l'arteriole e valutata la funzione endoteliale, verificare la risposta della stimolazione capillare.
- Utilizzando un tiratore di vetro, fare cannulas in modo che ci sia un punto fine ad una estremità. Rompere la punta di una cannula in modo che il farmaco testato possa fluire attraverso la punta senza problemi a 5 psi.
- Riempire la cannula con la soluzione farmacologica di interesse e aggiungerla a un micromanipolatore a 3 assi collegato al microscopio. Collegare il tubo dal sistema di espulsione della pressione alla cannula.
- Abbassare lentamente la cannula nel bagno vicino ai capillari, facendo attenzione a non colpire alcuna parte della nave o dell'hardware nella camera. Manovra la punta della cannula accanto alle estremità dei capillari senza toccarli. Tenere la punta della cannula appena fuori dal coperchio per evitare che la nave venga stimolata in caso di perdite di cannula.
- Quando si è pronti a stimolare i capillari, abbassare la cannula alla coverslip e proprio accanto ai capillari. Attivare il sistema di espulsione della pressione con il tempo di espulsione desiderato (qui 20 s). Una volta terminata la stimolazione, sollevare leggermente la cannula per evitare ulteriori stimolazioni.
- Ripetere la stimolazione in base alle esigenze. Cambiare la cannula del sistema di espulsione della pressione per testare diversi composti farmacologici.
- Per confermare che solo i capillari vengono stimolati, riempire la cannula con 1 soluzione NS309 m e ripetere i passaggi precedenti.
NOTA: Le cellule endoteliali capillari non esprimono i canali Ke attivati da NS309, quindi l'arteriosa non deve rispondere alla stimolazione. Se l'arteriola si dilata, la cannula dovrà essere riposizionata o il diametro del foro dovrà essere più piccolo (vedere Figura 2A, B e la sezione Risultati rappresentativi).
Risultati
Icanali diconducono conduzione endoteliale di piccole endoterie (SK) e di conduzione intermedia (IK) Ca2,sensibili a K, esercitano un'influenza dilatoria sul diametro delle PA. L'applicazione del bagno di 1 -M NS309, un agonista sintetico IK e SK canale, causato dilatazione quasi massima (Figura 2A,B). Tuttavia, le cellule endoteliali capillari mancano di canali IK e SK e non hanno iperpolarizzato in risposta a NS30920. Di conseguenza, la stimolazione delle terminazioni capillari con 1 M NS309 per espulsione della pressione focale (20 s, 5 psi) non ha causato dilatazione arteriolar a monte (Figura 2A,B). Questo risultato indica che NS309 non ha raggiunto l'arteriole nei preparati HiCaPA e potrebbe essere utilizzato come controllo per valutare la restrizione spaziale del composto applicato sui capillari mediante espulsione della pressione.
Questa preparazione è stata fondamentalmente progettata per la misurazione della segnalazione elettrica inside-out dai capillari alle PA. Utilizzando la preparazione HiCaPA, abbiamo applicato aCSF contenente 10 mMK sulle estremità capillari e misurato una dilatazione arteriolare a monte (Figura 2A,C) come abbiamo fatto in precedenza nei preparati CaPA dalla vascolatura corticale20. Abbiamo poi studiato, per la prima volta a nostra conoscenza, la segnalazione elettrica capillare-a-arteriosa nei topi femminili utilizzando preparati HiCaPA. La dilatazione arteriolare evocata dalla stimolazione capillare con 10 mMK non differiva tra i preparativi dei topi maschi e femmine (Figura 2A,C).
Infine, un altro vantaggio fondamentale di questo approccio è la possibilità di applicare strumenti farmacologici nella vasca da bagno prima della stimolazione capillare. Qui abbiamo testato l'effetto di ML133, un inibitore Kir2 recentemente sviluppato28. L'aggiunta di 10 M ML133 alla perfusione del bagno praticamente abolito dilatazione arteriolar indotta capillare in risposta a 10 mMK , nei preparati HiCaPA da topi maschi e femmine (Figura 2A,C). Quest'ultimo risultato suggerisce che il canale Kir2.1 media la segnalazione elettrica nella vascolatura cerebrale femminile come abbiamo descritto in precedenza nella microcircolazione corticale del cervello maschile.
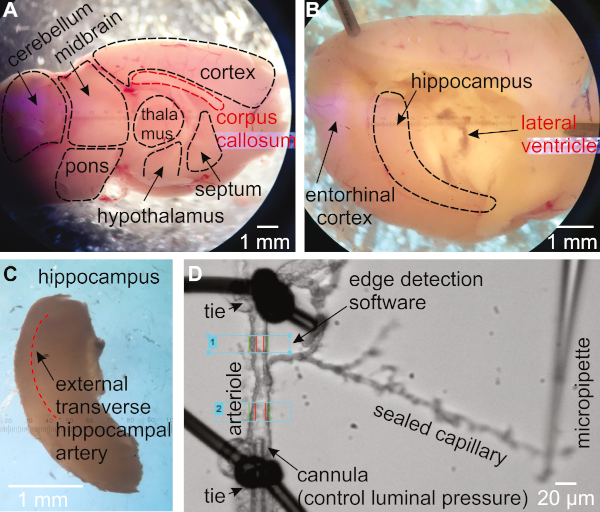
Figura 1: Metodologia per l'isolamento e la pressurizzazione della preparazione di arteriole capillari-parenchyli (HiCaPA) ippocampali (HiCaPA) dal topo. (A) Il cervello appena isolato viene tagliato a metà nel piano sagittale a seguito della fessura interhemispheric e posto con il lato mediale rivolto verso l'alto. (B) Il talamo, il setto e l'ipotalamo vengono delicatamente rimossi per rivelare l'ippocampo. (C) L'ippocampo viene accuratamente rimosso. (D) Le arteriole sfere con alberi capillari sono isolate dall'ippocampo e un'estremità del segmento arteriolatra è cannulata con una micropipetta collegata ad un sistema di pressurizzazione, e l'altra estremità è occlude. Le estremità capillari sono sigillate e mantenute contro la vetrina con la punta di una pipetta di vetro. Il diametro interno viene monitorato con un sistema di rilevamento dei bordi in una o più regioni dell'arteriole. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: La stimolazione focale dei capillari con 1 m NS309 non ha alcun effetto sul diametro arterioale a monte, a differenza della stimolazione con aCSF contenente 10 mM K . (A) Registrazione rappresentativa del diametro arteriolario a monte che mostra l'effetto dell'applicazione del bagno di 1 -M NS309 seguita da successiva stimolazione capillare (20 s, 5 psi) con 1 sM NS309 e con aCSF contenente 10 mM Kin assenza o presenza dell'inibitore del canale Kir2 ML133. L'applicazione di 10 mM Ksui capillari ha prodotto una rapida dilatazione arteriolar a monte che è stata bloccata da 10 M ML133. NS309 non ha causato dilatazione. L'assenza di dilatazione arteriolare a monte in risposta alla stimolazione capillare con NS309 dimostra che i composti eiettati a pressione non raggiungono l'arteriole. (B) Dati di riepilogo che mostrano i cambiamenti di diametro indotti di 1 m NS309 applicati nella vasca da bagno o alle estremità capillari (n : 14; (C) Dati riassuntivi che mostrano i cambiamenti di diametro arteriolare indotti di 10 mMK , applicati direttamente sui capillari nei preparati HiCaPA dai topi maschi (n ) o da femmine (n ) prima e dopo l'applicazione di 10 ML13 nella vasca da bagno (Sezione . Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La preparazione pressurizzata HiCaPA (ippocampo capillary-parenchymal arteriole) descritta nel presente manoscritto è un'estensione della nostra procedura consolidata per isolare, pressurizzare e studiare arteriole parenchymal29. Recentemente abbiamo riferito che Kir2.1 canali in cervello capillare cellule endoteliali senso aumenta in [K]o associato con l'attivazione neurale, e generare un segnale iperpolarizzante ascendente che dilata arterioles a monte20. Rivelare questo ruolo inaspettato per i capillari è stato possibile in parte sviluppando la preparazione CaPA dalla microcircolazione corticale20,21. Questo manoscritto presenta un approccio sperimentale simile, ma da una struttura più profonda e più ristretta del cervello dei topi per descrivere un approccio semplice e riproducibile per studiare la segnalazione capillare-arteriosa durante l'accoppiamento neurovascolare.
La microcircolazione cerebrale è squisitamente fragile e alcune pratiche, in particolare lo stiramento e la manipolazione dei vasi, devono essere utilizzate per garantire la sopravvivenza degli arterioli e dei capillari. Lo sviluppo spontaneo del tono miogenico è il primo indicatore della fattibilità di una preparazione30. La funzione endoteliale può quindi essere valutata aggiungendo l'agonista NS309 dei canali SK e IK alla soluzione di bagno, che dovrebbe causare quasi la massima dilatazione. In caso di mancato sviluppo di tono o risposta all'applicazione bagno di NS309, la preparazione deve essere sostituita con un altro. NS309 viene utilizzato anche per testare la diffusione della stimolazione capillare focale. Poiché le cellule endoteliali capillari mancano di canali SK e IK20, la consegna locale di NS309 su capillari mediante espulsione di pressione non dovrebbe avere alcun effetto sul diametro arteriolare a monte come mostrato nella Figura 2, illustrando che i composti non stimolano accidentalmente l'arteriolo. Una volta convalidati questi passaggi, è possibile testare la segnalazione capillare-arteriosa.
Qui abbiamo esaminato la segnalazione elettrica stimolando i capillari con aCSF contenente 10 mMK. Tuttavia, diverse modalità di segnalazione possono essere esplorate utilizzando l'approccio attuale stimolando i capillari con diversi agenti vasoattivi noti o neurotrasmettitori. Un altro vantaggio di questa preparazione è la possibilità di indagare ed eventualmente confrontare NVC tra diversi animali e tra diverse regioni del cervello. Questo è particolarmente interessante perché il cervello non è uniformemente mirato da patologie cerebrovascolari31,32. Una limitazione generale dell'approccio qui presentato è che isolando la microcircolazione, i componenti cruciali dell'unità neurovascolare, come neuroni e astrociti, vengono persi. Altri preparati, come la finestra cranica per l'imaging CBF in vivo, mantengono la struttura dell'unità neurovascolare intatta e sono più appropriati per studiare NVC in un sistema intatto. Tuttavia, nella preparazione della finestra cranica, le arteriole parenchimale sono difficili da immaginare senza attrezzature specifiche, come un microscopio multifotonico, e regioni più profonde, come l'ippocampo, rimangono difficili da immaginare. A questo proposito, l'approccio sviluppato nel laboratorio Filosa utilizzando il flusso luminale per indurre il tono miogenico nelle fette cerebrali rappresenta un elegante legame tra la fetta del cervello e gli approcci in vivo 33. Tuttavia, il tessuto nervoso circostante può limitare la penetrazione di un farmaco applicato topicamente, aumentando il suo potenziale off-target e rendendo le interpretazioni difficili, perché diversi tipi di cellule sono esposti ai farmaci. Abbiamo sviluppato principalmente il nostro approccio ex vivo per affrontare questi potenziali problemi. In conclusione, più approcci dovrebbero essere utilizzati in combinazione per studiare completamente NVC.
In sintesi, il presente rapporto descrive una preparazione ex vivo intatta di arteriole e capillari pressurizzati che consente di testare gli effetti degli agenti farmacologici e biologici su parametri funzionali in posizioni discrete lungo il continuum capillare-arteriole.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Jules Morin per commenti approfonditi sul manoscritto. Questa ricerca è stata finanziata dai premi dell'organizzazione non-profit CADASIL Together We Have Hope, del Center for Women's Health and Research e della NHLBI R01HL136636 (FD).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
Riferimenti
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon