Method Article
Ex Vivo Pressurized Hippocampal Capillary-Parenchymal Arteriole Préparation pour l'étude fonctionnelle
Dans cet article
Résumé
Le présent manuscrit détaille comment isoler les artérioles et les capillaires hippocampiques du cerveau de la souris et comment les pressuriser pour la myographie sous pression, l'immunofluorescence, la biochimie et les études moléculaires.
Résumé
Des altérations comportementales subtiles à la démence de phase tardive, l'affaiblissement cognitif vasculaire se développe typiquement suivant l'ischémie cérébrale. L'aVC et l'arrêt cardiaque sont des maladies dimorphiques remarquablement sexuellement, et les deux induisent l'ischémie cérébrale. Cependant, les progrès dans la compréhension de l'affaiblissement cognitif vasculaire, et puis développant des traitements sex-spécifiques, ont été en partie limités par des défis en étudiant la microcirculation de cerveau des modèles de souris dans les études fonctionnelles. Ici, nous présentons une approche pour examiner la signalisation capillaire-à-arteriole dans un artériole capillaire-parenchymal ex vivo (HiCaPA) préparation du cerveau de souris. Nous décrivons comment isoler, canuler, et pressuriser la microcirculation pour mesurer le diamètre artériolaire en réponse à la stimulation capillaire. Nous montrons quels contrôles fonctionnels appropriés peuvent être utilisés pour valider l'intégrité de préparation HiCaPA et afficher des résultats typiques, y compris l'essai de potassium comme agent de couplage neurovasculaire et l'effet de l'inhibiteur récemment caractérisé de la famille de canaux de potassium rectifiant s'intériorisent Kir2, ML133. En outre, nous comparons les réponses dans les préparations obtenues des souris mâles et femelles. Bien que ces données reflètent des études fonctionnelles, notre approche peut également être utilisée dans les études de biologie moléculaire, d'immunochimie et d'électrophysiologie.
Introduction
La circulation piale à la surface du cerveau a fait l'objet de nombreuses études, en partie en raison de son accessibilité expérimentale. Cependant, la topologie de la vascularisation cérébrale crée des régions distinctes. Contrairement au solide réseau pial riche en anastomoses avec une capacité substantielle pour rediriger le flux sanguin, les artérioles parenchymales intracérébrales (PA) présentent un approvisionnement collatéral limité, chacun d'eux perfusant un volume discret de tissu nerveux1,2. Cela crée un effet de goulot d'étranglement sur le flux sanguin qui, combiné avec des caractéristiques physiologiques uniques3,4,5,6,7,8, fait artérioles intracérébrales un site crucial pour le flux sanguin cérébral (CBF) régulation9,10. Malgré les défis techniques inhérents à l'isolement et à l'annulation des AP, la dernière décennie a vu un intérêt accru pour les études fonctionnelles ex vivo à l'aide de navires pressurisés11,12,13,14,15,16,17. Une des raisons de cet intérêt accru est l'effort considérable de recherche mené sur le couplage neurovasculaire (NVC), le mécanisme soutenant l'hyperémie fonctionnelle de cerveau18.
À l'échelle régionale, le CBF peut augmenter rapidement après l'activation neuronale locale19. Les mécanismes cellulaires et les propriétés de signalisation contrôlant NVC sont incomplètement compris. Cependant, nous avons identifié un rôle précédemment imprévu pour les capillaires de cerveau pendant NVC en sensibilisant l'activité neurale et en la traduisant dans un signal électrique hyperpolarisant pour dilater les artérioles en amont20,21,22. Potentield d'action23,24 et l'ouverture des canaux de grande conductance Ca2-activéK(BK) sur les pieds d'extrémité astrocytiques25,26 augmentent la concentration interstitielle d'ions de potassium [K-]o, qui a comme conséquence l'activation des canaux intérieurs forts de rectifier K(Kir) dans l'endothelium vasculaire des capillaires. Ce canal est activé park externe mais aussi par hyperpolarisation elle-même. Se propageant à travers les jonctions d'écart, le courant hyperpolarisant se régénère alors dans les cellules endothéliales capillaires adjacentes jusqu'à l'artériole, où il provoque la relaxation de myocyte et l'augmentation de CBF20,21. L'étude de ce mécanisme nous a menés à développer une préparation pressurisée d'artériole capillaire-parenchymal (CaPA) pour mesurer le diamètre artériolar pendant la stimulation capillaire avec des agents vasoactifs. La préparation de CaPA est composée d'un segment d'artériole intracérébrale cannulated avec une ramification capillaire intacte et en aval. Les extrémités capillaires sont comprimées contre le fond de verre de la chambre par une micropipette, qui occludes et stabilise toute la formation vasculaire20,21.
Nous avons précédemment fait des innovations instrumentales en imagerie des préparations CaPA à partir du cortex de souris20,21 et les artérioles du rat amygdale13 et hippocampe16,17. Comme la vascularisation hippocampal reçoit plus d'attention en raison de sa susceptibilité aux conditions pathologiques, ici nous fournissons une méthode étape par étape pour la préparation de CaPA de l'hippocampe de souris (HiCaPA) qui peut non seulement être employée dans les études fonctionnelles de NVC mais également dans la biologie moléculaire, l'immunochimie, et l'électrophysiologie.
Protocole
Toutes les expériences ont été approuvées par l'Institutional Animal Care and Use Committee (IACUC) de l'Université du Colorado, Anschutz Medical Campus et ont été effectuées selon les directives des National Institutes of Health.
1. Solutions
- Utilisez la saline tamponnée MOPS pour la dissection et pour conserver les échantillons à 4 oC avant leur utilisation. Ne pas gazer la solution. Préparer moPS tamponné saline avec composition suivante: 135 mM NaCl, 5 mM KCl, 1 mM KH2PO4, 1 mM MgSO4, 2,5 mM CaCl2, 5 mM glucose, 3 mM MOPS, 0,02 mM EDTA, 2 mM pyruvate, 10 mg/mL sérique albumin, pH 7,3 à 4 oC.
- Utilisez le liquide céphalo-rachidien artificiel (aCSF) comme solution de bain et de pipette. Gaz aCSF et Ca 2 -aCSF libre avec 5% CO2, 20% O2, et N2 solde. Préparer la solution avec la composition suivante: 125 mM NaCl, 3 mM KCl, 26 mM NaHCO3, 1,25 mM NaH2PO4, 1 mM MgCl2, 4 mM glucose, 2 mM CaCl2, pH 7,3 (avec aération avec 5% CO2, 20% O2, et N2 équilibre).
- Obtenir la dilatation maximale en nominalement Ca2-free aCSF (0 mM [Ca2 '] o, 5 mM EGTA).
2. Préparation de chambre d'organe
- Insérer des capillaires en verre borosilicate (diamètre extérieur de 1,2 mm; diamètre intérieur à 0,69 mm; longueur de 10 cm) dans un tire-verre. Tirez le capillaire pour faire une pointe longue et mince à une extrémité.
- D'un côté de la chambre, ajoutez une canule qui peut se connecter à une pompe péristtaltique miniature pour pressuriser le navire. Sous un microscope de dissection, casser la pointe de la canule de sorte qu'il soit assez petit pour s'adapter au récipient d'intérêt, mais assez grand pour permettre aux solutions de circuler à travers la pointe. Assurez-vous que la pointe a un diamètre d'environ 10 à 15 m.
- Remplissez la canule à l'aide d'une seringue à l'aide d'un filtre de 0,22 m attaché avec de l'aCSF oxygéné. Assurez-vous qu'il n'y a pas de bulles d'air ou de débris dans la canule.
- Ajouter deux autres canules de l'autre côté de la chambre. Ne cassez pas leurs pourboires.
3. Dissection et isolement d'Hippocampe
- Euthanasier et décapiter une souris. Pour cette expérience, utilisez une souris C57BL6/J de 8 semaines pour comparer les différences entre les mâles et les femelles. Injecter la souris avec du pentobarbital et décapiter avec des ciseaux chirurgicaux.
- À l'aide de petits ciseaux de dissection, couper la peau le long de la ligne médiane au sommet de sa tête. Déplacez la peau sur les côtés.
- À partir du côté caudal du crâne, couper le crâne le long de la ligne médiane jusqu'à ce que les ampoules olfactives sont atteints. Enlever les parties du crâne jusqu'à ce que le cerveau soit exposé.
- Enlevez lentement le cerveau, en commençant près du nez de la souris. Séparez le cerveau des ampoules olfactives, des nerfs crâniens et de la moelle épinière en coupant à travers les structures avec les petits ciseaux de dissection.
- Placez le cerveau dans une plaque de dissection avec une solution MOPS suffisante pour le submerger complètement. À l'aide d'un microscope à dissection, placez le cerveau au centre de la plaque de dissection avec le côté ventral vers le bas.
- À l'aide d'une lame de rasoir, couper le cerveau en deux le long de la fissure longitudinale. Maintenez la lame de sorte que le bord tranchant soit parallèle au fond de la plaque de dissection. Appuyez la lame à travers le cerveau d'un seul coup. Déplacer un hémisphère sur le côté de la plaque.
- Effectuez les étapes suivantes pour chaque hémisphère séparément ou en parallèle.
- Placez un hémisphère au centre de la plaque de sorte que la ligne médiane est orientée vers le bas. Ensuite, utilisez la lame de rasoir pour couper le long de la fissure transversale pour enlever le cervelet et le tronc cérébral. Poussez la lame directement à travers le tissu.
- Faites pivoter l'hémisphère de sorte que le côté médial soit orienté vers le haut (Figure 1A). Utilisez une spatule pour maintenir le cerveau en place. À l'aide d'une deuxième spatule, insérez la pointe sous le corpus callosum et pellez en dessous pour enlever le thalamus, le septum et l'hypothalamus, couvrant l'hippocampe (figure 1B).
- Assurez-vous que l'hippocampe est maintenant visible sous forme de structure incurvée près du côté postérieur du cerveau. À l'aide d'une spatule pour maintenir le cerveau en place, utiliser la deuxième spatule pour extraire l'hippocampe du cerveau (Figure 1C).
- Transférer l'hippocampe dans une nouvelle plaque de dissection remplie à mi-chemin de la solution MOPS. Jetez le reste du cerveau.
4. Isolement artériole hippocampal
- Complétez les étapes suivantes pour chaque hippocampe.
- Épinglez l'un des hippocampi à l'aide de petites broches à chaque extrémité de la section. L'artère hippocampique est orientée vers le haut.
- À l'aide de forceps très pointus, étirer délicatement de petites sections de l'hippocampe. Cela va desserrer le tissu entourant les artérioles, ce qui rend plus facile de les disséquer.
- Rechercher à travers le tissu hippocampique dorsal pour identifier l'artère transversale externe (Figure 1C)16,27.
- Saisissez doucement l'artère transversale externe et éloignez-la lentement du tissu pour recueillir les artérioles et les capillaires perfusant la région CA3 de l'hippocampe.
- Une fois qu'il n'y a plus de vaisseaux à enlever du tissu, jetez l'hippocampe. Gardez les navires sur la glace dans des plaques pendant qu'ils ne sont pas utilisés.
5. Hippocampal capillaire-parenchymal arteriole cannulation
- Trouvez une artériole avec une branche qui se termine par des capillaires. Transférez-le à la chambre d'orgue. Assurez-vous que l'artériole est d'environ 15-30 m lorsqu'il est complètement dilaté (Figure 1D).
- Montez soigneusement le vaisseau sanguin en poussant la pointe de la canule à travers la paroi artériole en dessous de la zone cible. Faites glisser soigneusement le récipient sur la canule jusqu'à ce qu'il y ait assez de tissu pour placer la cravate.
- Faire un noeud lâche avec 12-0 sutures en nylon de sorte qu'il s'adapte sur le vaisseau sanguin et la canule. Utilisez un demi-noeud pour fixer les liens. Puis tirez les extrémités pour serrer le noeud et fixer l'artériole à la canule. Retirez toutes les branches de navire extra-terrestres sous la cravate en les tirant doucement avec des forceps.
- Faites une autre cravate et fixez-la à l'autre extrémité de l'artériole pour la sceller.
- Baisser la canule avec le récipient attaché jusqu'à ce qu'elle soit plate contre la glissière de couverture au fond de la chambre. Veillez à ne pas abaisser la canule trop ou il se cassera.
- À l'aide d'une canule de l'autre côté de la chambre, abaissez-la de sorte que le point de celui-ci épingle la cravate à l'extrémité de l'artériole.
- Utilisez la troisième canule pour épingler la branche capillaire à la couverture. Placez la pointe près de l'extrémité de la branche tout en laissant les extrémités des capillaires exposés (pas sous la canule).
6. Myographie de pression
- Déplacez la chambre de la portée de dissection au microscope avec le logiciel d'enregistrement.
- Connectez l'entrée et le tube d'écoulement à la chambre pour la perfusion. Démarrer la perfusion avec un aCSF chauffé (37 oC) à un débit de 4 ml/min.
- Fixez la canule pressurisante à une pompe péristaltique jumelée à un transducteur de pression et amenez la pression interne à 20 mm Hg.
- Démarrez le logiciel d'enregistrement. Ajustez les réglages du microscope et de l'imagerie pour obtenir l'image la plus claire possible. Commencez l'enregistrement une fois que les paramètres sont optimisés pour le logiciel de détection.
- Augmentez la pression du navire jusqu'à 40 mm Hg tout en enregistrant le diamètre artériel avec un logiciel de détection des bords.
- Laisser la solution MOPS de 15 à 20 min pour laver la solution MOPS de la chambre avec aCSF, et laisser la préparation HiCaPA pour équilibrer et développer le ton myogénique.
- Pour vérifier la viabilité d'un navire, appliquez une solution NS309 de 1 M À la perfusion du bain (voir la figure 2A,B et la section Résultats représentatifs). Le segment artériolaire doit se dilater, démontrant environ 30-40% de tonalité myogène comme précédemment décrit3,14,20.
7. Stimulation focale des extrémités capillaires
- Une fois que le ton de base pour l'artériole a été établi et la fonction endothéliale évaluée, testez la réponse de la stimulation capillaire.
- À l'aide d'un tire-lait en verre, faire des canules afin qu'il y ait un point fin à une extrémité. Briser la pointe d'une canule de sorte que le médicament testé peut circuler à travers la pointe en douceur à 5 psi.
- Remplissez la canule avec la solution médicamenteuse d'intérêt et ajoutez-la à un micromanipulateur à 3 axes attaché au microscope. Connectez le tube du système d'éjection de pression à la canule.
- Abaissez lentement la canule dans le bain près des capillaires, en prenant soin de ne pas heurter une partie du navire ou du matériel dans la chambre. Manœuvrer la pointe de la canule à côté des extrémités des capillaires sans les toucher. Gardez la pointe de la canule juste à l'écart de la glissière de couverture pour empêcher le navire d'être stimulé si la canule fuit.
- Lorsque vous êtes prêt à stimuler les capillaires, abaisser la canule à la couverture et juste à côté des capillaires. Activer le système d'éjection de pression avec le temps d'éjection souhaité (ici 20 s). Une fois la stimulation terminée, soulevez légèrement la canule pour éviter une stimulation supplémentaire.
- Répétez la stimulation au besoin. Modifier la canule du système d'éjection de pression pour tester différents composés médicamenteux.
- Pour confirmer que seuls les capillaires sont stimulés, remplissez la canule d'une solution NS309 de 1 M et répétez les étapes ci-dessus.
REMARQUE : Les cellules endothéliales capillaires n'expriment pas les canaux Ket Activés par NS309, de sorte que l'artériole ne doit pas répondre à la stimulation. Si l'artériole se dilate, la canule devra être repositionnée ou le diamètre du trou devra être plus petit (voir la figure 2A,B et la section Résultats représentatifs).
Résultats
Les canaux endothélial de petite conductance (SK) et de conduite intermédiaire (IK) Ca2'sensiblesK', exercent une influence dilatoire sur le diamètre des AP. L'application de bain de 1 M NS309, un agoniste synthétique de canal IK et SK, a causé la dilatation presque maximale (figure 2A,B). Cependant, les cellules endothéliales capillaires manquent de canaux IK et SK et n'ont pas hyperpolarisé en réponse à NS30920. Par conséquent, la stimulation des extrémités capillaires avec 1 M NS309 par éjection de pression focale (20 s, 5 psi) n'a pas causé de dilatation artériolaire en amont (Figure 2A,B). Ce résultat indique que NS309 n'a pas atteint l'artériole dans les préparations HiCaPA et pourrait être utilisé comme un contrôle pour évaluer la restriction spatiale du composé appliqué sur les capillaires par éjection de pression.
Cette préparation a été fondamentalement conçue pour la mesure de la signalisation électrique à l'intérieur-out des capillaires aux PA. En utilisant la préparation HiCaPA, nous avons appliqué aCSF contenant 10 mM Ksur les extrémités capillaires et mesuré une dilatation artériolaire en amont (Figure 2A,C) comme nous l'avons fait précédemment dans les préparations CaPA de la vascularisation corticale20. Nous avons ensuite étudié, pour la première fois à notre connaissance, la signalisation électrique capillaire-à-arteriole chez les souris femelles utilisant des préparations de HiCaPA. La dilatation artériolaire évoquée par stimulation capillaire avec 10 mM K- ne différait pas entre les préparations des souris mâles et femelles (Figure 2A,C).
Enfin, un autre avantage fondamental de cette approche est la possibilité d'appliquer des outils pharmacologiques dans le bain avant la stimulation capillaire. Ici, nous avons testé l'effet de ML133, un inhibiteur Kir2 récemment développé28. Ajout de 10 ML133 à la perfusion de bain pratiquement aboli la dilatation artériole induite par le capillaire en réponse à 10 mM K- dans les préparations HiCaPA de souris mâles et femelles (Figure 2A,C). Ce dernier résultat suggère que le canal de Kir2.1 médiatise la signalisation électrique dans la vascularisation cérébrale femelle comme nous l'avons précédemment décrit dans la microcirculation corticale du cerveau masculin.
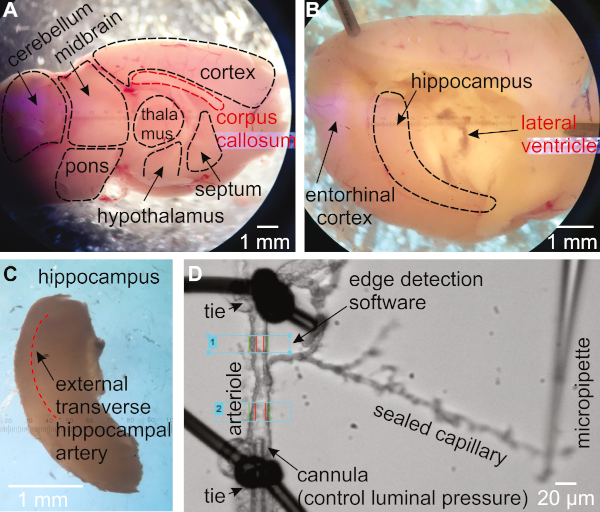
Figure 1 : Méthodologie pour l'isolement et la pressurisation des artérioles capillaires-parenchymals hippocampes (HiCaPA) préparation de la souris. (A) Le cerveau fraîchement isolé est coupé en deux dans le plan sagittal suivant la fissure interhémisphérique et placé avec le côté médial tourné vers le haut. (B) Le thalamus, le septum et l'hypothalamus sont délicatement enlevés pour révéler l'hippocampe. (C) L'hippocampe est soigneusement enlevé. (D) Les artérioles avec des arbres capillaires sont isolées de l'hippocampe et une extrémité du segment artériolaire est cannulated avec une micropipette reliée à un système pressurisant, et l'autre extrémité est occluded. Les extrémités capillaires sont scellées et maintenues contre la glissière de couverture avec la pointe d'une pipette en verre. Le diamètre interne est surveillé à l'aide d'un système de détection des bords dans une ou plusieurs régions de l'artériole. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : La stimulation focale des capillaires avec 1 M NS309 n'a aucun effet sur le diamètre artériolaire en amont, contrairement à la stimulation avec un ACSF contenant 10mK. (A) Enregistrement représentatif du diamètre artériolaire en amont montrant l'effet de l'application du bain de 1 M NS309 suivi d'une stimulation capillaire successive (20 s, 5 psi) avec 1 M NS309 et avec un ACSF contenant 10 mKen l'absence ou la présence de l'inhibiteur du canal Kir2 ML133. L'application de 10 mM Ksur les capillaires a produit une dilatation artériolaire en amont rapide qui a été bloquée par 10 ML133. NS309 n'a pas causé de dilatation. L'absence de dilatation artériolaire en amont en réponse à la stimulation capillaire avec NS309 illustre que les composés éjectés par pression n'atteignent pas l'artériole. (B) Données sommaires montrant les changements de diamètre induits par 1 M NS309 appliqué dans le bain ou sur les extrémités capillaires (n ' 14;p 'lt; 0,0001, t-test jumelé). (C) Données sommaires montrant des changements de diamètre artériolaire induits par 10 mM K- appliqués directement sur les capillaires dans les préparations HiCaPA des souris mâles (n - 6) ou femelles (n - 8) avant et après 10 MMM133 a été appliquée dans le bain (p'lt; 0,0005, n.s. - non significatif, non apparié t-test). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
La préparation sous pression HiCaPA (artériole capillaire-parenchymale hippocampal) décrite dans le présent manuscrit est une extension de notre procédure bien établie pour isoler, pressuriser et étudier les artérioles parchymales29. Nous avons récemment rapporté que les canaux Kir2.1 dans les cellules endothéliales capillaires du cerveau sentent des augmentations dans [K'] o associés à l'activation neurale, et génèrent un signal hyperpolarisant ascendant qui dilate les artérioles en amont20. Révéler ce rôle jusque-là imprévu pour les capillaires a été possible en partie en développant la préparation CaPA à partir de la microcirculation corticale20,21. Ce manuscrit présente une approche expérimentale similaire, mais à partir d'une structure plus profonde et plus restreinte du cerveau de la souris pour décrire une approche simple et reproductible pour étudier la signalisation capillaire-artériole pendant le couplage neurovasculaire.
La microcirculation cérébrale est extrêmement fragile et certaines pratiques, en particulier la minimisation de l'étirement et la manipulation des vaisseaux, doivent être utilisées pour assurer la survie des artérioles et des capillaires. Le développement spontané du tonicité myogénique est le premier indicateur de la viabilité d'une préparation30. La fonction endothéliale peut ensuite être évaluée en ajoutant les canaux SK et IK agoniste SS309 à la solution de bain, ce qui devrait causer une dilatation presque maximale. En cas d'échec à développer le ton ou la réponse à l'application de bain de NS309, la préparation doit être remplacée par une autre. NS309 est également utilisé pour tester la propagation de la stimulation capillaire focale. Puisque les cellules endothéliales capillaires manquent de canaux SK et IK20,la livraison locale de NS309 sur les capillaires par éjection de pression ne devrait avoir aucun effet sur le diamètre artériolaire en amont comme indiqué dans la figure 2, illustrant que les composés ne stimulent pas accidentellement l'artériole. Une fois ces étapes validées, la signalisation capillaire-artériole peut être testée.
Ici, nous avons examiné la signalisation électrique en stimulant les capillaires avec aCSF contenant 10 mM K. Cependant, différentes modalités de signalisation peuvent être explorées en utilisant l'approche actuelle en stimulant les capillaires avec différents agents vasoactifs connus ou neurotransmetteurs. Un autre avantage de cette préparation est la possibilité d'étudier et éventuellement de comparer la CNV entre différents animaux et entre différentes régions du cerveau. Ceci est particulièrement intéressant parce que le cerveau n'est pas uniformément ciblé par les pathologies cérébrovasculaires31,32. Une limitation générale de l'approche présentée ici est qu'en isolant la microcirculation, des composants cruciaux de l'unité neurovasculaire, tels que les neurones et les astrocytes, sont perdus. D'autres préparations, telles que la fenêtre crânienne pour la formation image in vivo de CBF, maintiennent la structure de l'unité neurovascular intacte et sont plus appropriées pour étudier NVC dans un système intact. Cependant, dans la préparation de fenêtre crânienne, les artérioles parenchymales sont difficiles à imaginer sans équipement spécifique, comme un microscope multiphoton, et les régions plus profondes, telles que l'hippocampe, restent difficiles à imager. À cet égard, l'approche développée dans le laboratoire Filosa en utilisant le flux luminal pour induire un ton myogénique dans les tranches de cerveau représente un lien élégant entre la tranche de cerveau et les approches in vivo 33. Cependant, le tissu nerveux environnant peut limiter la pénétration d'un médicament appliqué par voie topique, augmentant son potentiel hors cible et rendant les interprétations difficiles, parce que plusieurs types de cellules sont exposés aux médicaments. Nous avons principalement développé notre approche ex vivo pour résoudre ces problèmes potentiels. En conclusion, plusieurs approches devraient être utilisées en conjonction pour étudier pleinement la CNV.
En résumé, le présent rapport décrit une préparation ex vivo intacte des artérioles et des capillaires hippocampiques pressurisés qui permet aux effets des agents pharmacologiques et biologiques d'être testés sur des paramètres fonctionnels à des positions discrètes le long du continuum capillaire-artériole.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tient à remercier Jules Morin pour ses commentaires perspicaces sur le manuscrit. Cette recherche a été financée par des prix de l'organisme à but non lucratif CADASIL Together We Have Hope, du Center for Women's Health and Research et du NHLBI R01HL136636 (FD).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
Références
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon