Method Article
Ex Vivo Druck hippocampal Kapillare-Parenchymale Arteriole Vorbereitung für die funktionelle Studie
In diesem Artikel
Zusammenfassung
Das vorliegende Manuskript beschreibt, wie Hippocampus-Arteriolen und Kapillaren aus dem Maushirn isoliert werden können und wie man sie für Druckmyographie, Immunfluoreszenz, Biochemie und molekulare Studien unter Druck setzt.
Zusammenfassung
Von subtilen Verhaltensänderungen bis hin zu Demenz im spätstadium entwickelt sich in der Regel eine vaskuläre kognitive Beeinträchtigung nach zerebraler Ischämie. Schlaganfall und Herzstillstand sind bemerkenswert geschlechtsdiamorphe Erkrankungen, und beide induzieren zerebrale Ischämie. Der Fortschritt beim Verständnis der vaskulären kognitiven Beeinträchtigung und der Entwicklung geschlechtsspezifischer Behandlungen wurde jedoch teilweise durch Herausforderungen bei der Untersuchung der Mikrozirkulation des Gehirns aus Mausmodellen in funktionellen Studien begrenzt. Hier stellen wir einen Ansatz zur Untersuchung der Kapillar-Arteriole-Signalisierung in einem ex vivo hippocampalen Kapillar-Parenchymal-Arteriole (HiCaPA)-Präparat vom Maushirn vor. Wir beschreiben, wie man die Mikrozirkulation isoliert, cannulate und unter Druck setzt, um den Arteriolardurchmesser als Reaktion auf die Kapillarstimulation zu messen. Wir zeigen, welche geeigneten funktionellen Kontrollen verwendet werden können, um die Integrität der HiCaPA-Präparation zu validieren und typische Ergebnisse anzuzeigen, einschließlich der Prüfung von Kalium als neurovaskulärem Kopplungsmittel und der Wirkung des kürzlich charakterisierten Inhibitors der Kir2-Inwärtsrektifigungs-Kaliumkanalfamilie ML133. Darüber hinaus vergleichen wir die Reaktionen in Präparaten von männlichen und weiblichen Mäusen. Während diese Daten funktionelle Untersuchungen widerspiegeln, kann unser Ansatz auch in molekularbiologischen, Immunchemie- und Elektrophysiologiestudien verwendet werden.
Einleitung
Die piale Zirkulation auf der Oberfläche des Gehirns war Gegenstand vieler Untersuchungen, teilweise wegen seiner experimentellen Zugänglichkeit. Die Topologie der zerebralen Vaskulatur schafft jedoch unterschiedliche Regionen. Im Gegensatz zum robusten pialen Netzwerk reich an Anastomosen mit beträchtlicher Kapazität zur Umleitung des Blutflusses, die intrazerebralen parenchymalen Arteriolen (PAs) bieten eine begrenzte Kollateralversorgung, die jeweils ein diskretes Volumen an Nervengewebe1,2durchdringen. Dies erzeugt einen Engpass-Effekt auf den Blutfluss, die, kombiniert mit einzigartigen physiologischen Merkmalen3,4,5,6,7,8, macht intracerebral arterioles eine entscheidende Stelle für zerebrale Durchblutung (CBF) Regulierung9,10. Trotz der technischen Herausforderungen, die mit der Isolierung und Cannulation von PAs verbunden sind, hat das Interesse an ex vivo funktionellen Studien mit Druckgefäßen11,12,13,14,15,16,17zugenommen. Einer der Gründe für dieses erhöhte Interesse ist der beträchtliche Forschungsaufwand an neurovaskulärer Kopplung (NVC), dem Mechanismus zur Erhaltung der funktionellen Hyperämie des Gehirns18.
Regional kann CBF nach lokaler neuronaler Aktivierung schnell ansteigen19. Die zellulären Mechanismen und Signaleigenschaften, die NVC steuern, sind unvollständig verstanden. Wir identifizierten jedoch eine bisher unerwartete Rolle für die Hirnkapillaren während NVC bei der Erfassung der neuronalen Aktivität und der Übersetzung in ein hyperpolarisierendes elektrisches Signal zur Ausgliederung der vorgelagerten Arteriolen20,21,22. Aktionspotentiale23,24 und Öffnung von Großleitfähigkeit Ca2+-aktivierten K+ (BK) Kanälen auf den astrozytischen Endfüßen25,26 erhöhen die interstitielle Kaliumionenkonzentration [K+]o, was zur Aktivierung starker nachinnen gleichrichternder K+ (Kir) Kanäle im vaskulären Endothel von Kapillaren führt. Dieser Kanal wird durch externes K+, aber auch durch Hyperpolarisation selbst aktiviert. Der hyperpolarisierende Strom, der sich durch Spaltknoten ausbreitet, regeneriert sich dann in benachbarten Kapillaren-Endothelzellen bis zur Arteriole, wo er Myozytenentspannung und CBF-Erhöhung20,21verursacht. Die Untersuchung dieses Mechanismus führte uns dazu, ein unter Druck stehendes kapillar-parenchymale Arteriol (CaPA) Präparat zu entwickeln, um den arteriolaren Durchmesser während der Kapillarstimulation mit vasoaktiven Wirkstoffen zu messen. Das CaPA-Präparat besteht aus einem kanülierten intracereralen Arteriolsegment mit einer intakten, nachgeschalteten Kapillarverzweigung. Die Kapillarenden werden durch eine Mikropipette gegen den Kammerglasboden verdichtet, die die gesamte Gefäßbildung verdichtet und stabilisiert20,21.
Wir haben zuvor instrumentale Innovationen durch die Abbildung CaPA-Präpa-Präpa-Präpa-Präpaden aus dem Mauskortex20,21 und Arteriolen aus der Rattenamygdala13 und hippocampus16,17gemacht. Da die Hippocampus-Vaskulatur aufgrund ihrer Anfälligkeit für pathologische Bedingungen mehr Aufmerksamkeit erhält, bieten wir hier eine Schritt-für-Schritt-Methode zur CaPA-Vorbereitung aus dem Maus-Hippocampus (HiCaPA), die nicht nur in funktionellen NVC-Studien, sondern auch in der Molekularbiologie, Immunchemie und Elektrophysiologie eingesetzt werden kann.
Protokoll
Alle Experimente wurden vom Institutional Animal Care and Use Committee (IACUC) der University of Colorado, Anschutz Medical Campus, genehmigt und nach den Richtlinien der National Institutes of Health durchgeführt.
1. Lösungen
- Verwenden Sie MOPS-gepufferte Saline für die Sezierung und halten Sie Proben bei 4 °C vor ihrer Nutzung. Vergasen Sie die Lösung nicht. Bereiten Sie MOPS gepufferte Saline mit folgender Zusammensetzung vor: 135 mM NaCl, 5 mM KCl, 1 mM KH2PO4, 1 mM MgSO4, 2,5 mM CaCl2, 5 mM Glukose, 3 mM MOPS, 0,02 mM EDTA, 2 mM Pyruvat, 10 mg/mL Rinderserumalbumin, pH 7,3 bei 4 °C.
- Verwenden Sie künstliche Zerebrospinalflüssigkeit (aCSF) als Badlösung und Pipettenlösung. Gas sowohl aCSF und Ca2+-frei aCSF mit 5% CO2, 20% O2, und N2 Balance. Bereiten Sie die Lösung mit der folgenden Zusammensetzung vor: 125 mM NaCl, 3 mM KCl, 26 mM NaHCO3, 1,25 mM NaH2PO4, 1 mM MgCl2, 4 mM Glucose, 2 mM CaCl2, pH 7.3 (mit Belüftung mit 5% CO2, 20% O2und N2 Balance).
- Erhalten Sie die maximale Dilatation in nominell Ca2+-frei aCSF (0 mM [Ca2+]o, 5 mM EGTA).
2. Orgelkammervorbereitung
- Borosilikatglaskapillaren (Außendurchmesser = 1,2 mm; Innendurchmesser = 0,69 mm; Länge = 10 cm) in einen Glasabzieher einlegen. Ziehen Sie die Kapillare, um eine lange, dünne Spitze an einem Ende zu machen.
- Auf einer Seite der Kammer, fügen Sie eine Kanüle, die zu einer Miniatur-Peristaltikpumpe verbinden kann, um das Gefäß luminally unter Druck zu setzen. Unter einem Seziermikroskop die Spitze der Kanüle so brechen, dass sie klein genug ist, um in das Gefäß des Interesses zu passen, aber groß genug, um Lösungen durch die Spitze fließen zu lassen. Stellen Sie sicher, dass die Spitze einen Durchmesser von ca. 10-15 m hat.
- Füllen Sie die Kanüle mit einer Spritze mit einem angeschlossenen 0,22 m Filter mit sauerstoffhaltigem aCSF. Stellen Sie sicher, dass sich keine Luftblasen oder Schmutz in der Kanüle befinden.
- Fügen Sie auf der gegenüberliegenden Seite der Kammer zwei weitere Kanülen hinzu. Brechen Sie nicht ihre Spitzen.
3. Hippocampus-Sektion und Isolierung
- Eine Maus verleiten und enthaupten. Verwenden Sie für dieses Experiment eine 8 Wochen alte C57BL6/J-Maus, um Unterschiede zwischen Männern und Frauen zu vergleichen. Injizieren Sie die Maus mit Pentobarbital und enthaupten Sie mit chirurgischer Schere.
- Schneiden Sie die Haut mit einer kleinen Sezierschere entlang der Mittellinie an der Oberseite ihres Kopfes. Bewegen Sie die Haut an den Seiten.
- Beginnend an der kaudalen Seite des Schädels, schneiden Sie den Schädel entlang der Mittellinie, bis die olfaktorischen Zwiebeln erreicht sind. Entfernen Sie Teile des Schädels, bis das Großhirn freigelegt ist.
- Entfernen Sie langsam das Gehirn, beginnend in der Nähe der Nase der Maus. Trennen Sie das Gehirn von den Riechzwiebeln, Denhirnnerven und dem Rückenmark, indem Sie die Strukturen mit der kleinen Sezierschere durchschneiden.
- Legen Sie das Gehirn in eine Sezierplatte mit genügend MOPS-Lösung, um es vollständig zu versenken. Platzieren Sie das Gehirn mit einem Seziermikroskop in der Mitte der Sezierplatte mit der ventralen Seite nach unten.
- Mit einer Rasierklinge, schneiden Sie das Gehirn in der Hälfte entlang der Längsspalte. Halten Sie die Klinge so, dass die scharfe Kante parallel zur Unterseite der Sezierplatte verläuft. Drücken Sie die Klinge auf einen Schlag durch das Gehirn. Bewegen Sie eine Hemisphäre zur Seite der Platte.
- Führen Sie die folgenden Schritte für jede Hemisphäre einzeln oder parallel aus.
- Platzieren Sie eine Hemisphäre in der Mitte der Platte, so dass die Mittellinie nach unten gerichtet ist. Dann verwenden Sie die Rasierklinge entlang der Querspalte entlang, um das Kleinhirn und den Hirnstamm zu entfernen. Drücken Sie die Klinge gerade durch das Gewebe.
- Drehen Sie die Halbkugel so, dass die mediale Seite nach oben gerichtet ist (Abbildung 1A). Verwenden Sie einen Spachtel, um das Gehirn an Ort und Stelle zu halten. Mit einem zweiten Spachtel, legen Sie die Spitze unter dem Corpus callosum und Schaufel darunter, um den Thalamus, Septum, und Hypothalamus zu entfernen, abdeckung der Hippocampus (Abbildung 1B).
- Stellen Sie sicher, dass der Hippocampus nun als gekrümmte Struktur in der Nähe der hinteren Seite des Großhirns sichtbar ist. Verwenden Sie einen Spachtel, um das Großhirn an Ort und Stelle zu halten, verwenden Sie den zweiten Spachtel, um den Hippocampus aus dem Großhirn zu schaufeln (Abbildung 1C).
- Übertragen Sie das Hippocampi auf eine neue Sezierplatte, die etwa zur Hälfte mit MOPS-Lösung gefüllt ist. Entsorgen Sie den Rest des Gehirns.
4. Hippocampal Arteriole Isolierung
- Führen Sie die folgenden Schritte für jeden Hippocampus aus.
- Setzen Sie einen der Hippocampi mit kleinen Stiften an jedem Ende des Abschnitts. Die Hippocampus-Arterie steht nach oben.
- Mit sehr scharfen Zangen, sanft dehnen kleine Abschnitte des Hippocampus. Dadurch wird das Gewebe, das die Arteriolen umgibt, gelöst, wodurch es einfacher wird, sie zu sezieren.
- Durchsuchen Sie das dorsale Hippocampusgewebe, um die äußere Querarterie zu identifizieren (Abbildung 1C)16,27.
- Greifen Sie vorsichtig die äußere Querarterie und ziehen Sie sie langsam aus dem Gewebe, um die Arteriolen und Kapillaren zu sammeln, die den CA3-Bereich des Hippocampus durchdringen.
- Sobald es keine Gefäße mehr aus dem Gewebe entfernt werden, entsorgen Sie die Hippocampi. Halten Sie die Gefäße auf Eis in Platten, während nicht in Gebrauch.
5. Hippocampal Kapillare-parenchymale Arteriole-Kannulation
- Finden Sie eine Arterie mit einem Ast, der mit Kapillaren endet. Übertragen Sie es in die Orgelkammer. Stellen Sie sicher, dass das Arteriol bei vollständiger Erweiterung ca. 15-30 m beträgt (Abbildung 1D).
- Montieren Sie das Blutgefäß vorsichtig, indem Sie die Kanülenspitze durch die Arterienwand unterhalb des Zielbereichs schieben. Schieben Sie das Gefäß vorsichtig auf die Kanüle, bis genügend Gewebe vorhanden ist, um die Krawatte aufzubringen.
- Machen Sie einen lockeren Knoten mit 12-0 Nylon Nähte, so dass es über das Blutgefäß und Kanüle passt. Verwenden Sie einen Halben-Hitch-Knoten, um Krawatten zu sichern. Ziehen Sie dann die Enden, um den Knoten zu ziehen und die Arterie an der Kanüle zu sichern. Entfernen Sie alle überflüssigen Gefäßzweige unter der Krawatte, indem Sie sie vorsichtig mit Zangen ziehen.
- Machen Sie eine weitere Krawatte und sichern Sie es am anderen Ende der Arterie, um sie zu versiegeln.
- Senken Sie die Kanüle mit dem befestigten Gefäß, bis es flach gegen den Deckelrutsch auf der Unterseite der Kammer ist. Achten Sie darauf, die Kanüle nicht zu stark zu senken, oder es wird brechen.
- Mit einer Kanüle auf der gegenüberliegenden Seite der Kammer, senken Sie es, so dass der Punkt davon die Krawatte am Ende der Arterien festsetzt.
- Verwenden Sie die dritte Kanüle, um den Kapillarzweig an den Deckelzuschlag festzunageln. Platzieren Sie die Spitze nahe am Ende des Asts, während Sie die Enden der Kapillaren exponiert lassen (nicht unter der Kanüle).
6. Druckmyographie
- Bewegen Sie die Kammer mit der Aufnahmesoftware vom Sezierbereich auf das Mikroskop.
- Schließen Sie den Zu- und Abflussschlauch zur Durchblutung an die Kammer an. Beginnen Sie die Perfusion mit erhitztem aCSF (37 °C) bei einer Durchflussrate von 4 ml/min.
- Befestigen Sie die Druckkanüle an einer peristaltischen Pumpe gepaart mit einem Druckaufnehmer und bringen Sie den Innendruck auf 20 mm Hg.
- Starten Sie die Aufnahmesoftware. Passen Sie die Einstellungen für das Mikroskop und die Bildgebung an, um ein möglichst klares Bild zu erhalten. Beginnen Sie die Aufzeichnung, sobald die Einstellungen für die Erkennungssoftware optimiert sind.
- Erhöhen Sie den Druck des Behälters auf bis zu 40 mm Hg, während Sie den Arteriendurchmesser mit einer Kantenerkennungssoftware aufzeichnen.
- Lassen Sie die MOPS-Lösung mit einem CSF aus der Kammer waschen und lassen Sie die HiCaPA-Zubereitung ausgleichen und myogenen Ton entwickeln.
- Um die Lebensfähigkeit eines Behälters zu testen, wenden Sie 1 M NS309-Lösung auf die Badperfusion an (siehe Abbildung 2A,B und Abschnitt Repräsentative Ergebnisse). Das arteriolar Segment muss sich erweitern und zeigt etwa 30-40% myogenen Ton, wie zuvor beschrieben3,14,20.
7. Fokale Stimulation von Kapillarenden
- Sobald der Ausgangston für die Artezolalermittelte festgelegt und die Endothelfunktion bewertet wurde, testen Sie das Ansprechen der Kapillarstimulation.
- Mit einem Glasabzieher, machen Kanülen, so dass es einen feinen Punkt an einem Ende. Brechen Sie die Spitze aus einer Kanüle, so dass das getestete Medikament durch die Spitze reibungslos bei 5 psi fließen kann.
- Füllen Sie die Kanüle mit der Wirkstofflösung von Interesse und fügen Sie sie zu einem 3-Achsen-Mikromanipulator am Mikroskop befestigt. Schließen Sie die Schläuche vom Druckauswurfsystem an die Kanüle an.
- Senken Sie langsam die Kanüle in das Bad in der Nähe der Kapillaren, achten Sie darauf, keinen Teil des Gefäßes oder Hardware in der Kammer zu treffen. Manövrieren Sie die Spitze der Kanüle neben den Enden der Kapillaren, ohne sie zu berühren. Halten Sie die Spitze der Kanüle direkt neben dem Deckelschlupf, um zu verhindern, dass das Gefäß stimuliert wird, wenn die Kanüle austritt.
- Wenn Sie bereit sind, die Kapillaren zu stimulieren, senken Sie die Kanüle auf den Deckelrutsch und direkt neben den Kapillaren. Aktivieren Sie das Druckauswurfsystem mit der gewünschten Auswurfzeit (hier 20 s). Sobald die Stimulation abgeschlossen ist, heben Sie die Kanüle leicht an, um eine weitere Stimulation zu vermeiden.
- Wiederholen Sie die Stimulation bei Bedarf. Ändern Sie die Kanüle des Druckauswurfsystems, um verschiedene Wirkstoffverbindungen zu testen.
- Um zu bestätigen, dass nur die Kapillaren stimuliert werden, füllen Sie die Kanüle mit 1 M NS309 Lösung und wiederholen Sie die oben genannten Schritte.
HINWEIS: Kapillaren-Endothelzellen drücken keine K+ Kanäle aus, die durch NS309 aktiviert werden, so dass die Arteriole nicht auf die Stimulation reagieren darf. Wenn sich die Arteriole datiert, muss die Kanüle neu positioniert werden, oder der Durchmesser der Bohrung muss kleiner sein (siehe Abbildung 2A,B und abschnitt repräsentative Ergebnisse).
Ergebnisse
Endotheliale Kleinleitfähigkeit (SK) und Zwischenleitfähigkeit (IK) Ca2+-sensitive K+ Kanäle üben einen dilatatorischen Einfluss auf den Durchmesser von PAs aus. Badapplikation von 1 M NS309, einem synthetischen IK- und SK-Kanalagonisten, verursachte eine nahezu maximale Dilatation (Abbildung 2A,B). Kapillaren-Endothelzellen fehlen jedoch keine IK- und SK-Kanäle und haben als Reaktion auf NS30920keine Hyperpolarisation. Dadurch verursachten stimulierende Kapillarenenden mit 1 M NS309 durch Fokaldruckauswurf (20 s, 5 psi) keine vorgelagerte arteriolare Dilatation (Abbildung 2A,B). Dieses Ergebnis deutet darauf hin, dass NS309 die Arteriole in den HiCaPA-Präparaten nicht erreicht hat und als Kontrolle verwendet werden könnte, um die räumliche Beschränkung der Verbindung zu beurteilen, die durch Druckauswurf auf Kapillaren aufgebracht wird.
Dieses Präparat wurde grundlegend für die Messung der elektrischen Signalgebung von Kapillaren bis zu PAs von Innenaußen entwickelt. Mit Hilfe des HiCaPA-Präparats haben wir ein CSF mit 10 mM K+ auf die Kapillarenenden aufgetragen und eine vorgelagerte arteriolare Dilatation gemessen (Abbildung 2A,C), wie wir es zuvor bei CaPA-Präparaten aus der kortikalen Vaskulatur20getan haben. Wir untersuchten dann zum ersten Mal nach unserem Wissen die elektrische Kapillar-arteriole-Signalisierung bei weiblichen Mäusen mit HiCaPA-Präparaten. Die arteriolare Dilatation, die durch Kapillarstimulation mit 10 mM K+ evoziert wird, unterschied sich nicht zwischen Präparaten von männlichen und weiblichen Mäusen (Abbildung 2A,C).
Ein weiterer grundlegender Vorteil dieses Ansatzes ist die Möglichkeit, vor der Kapillarstimulation pharmakologische Werkzeuge im Bad anzuwenden. Hier haben wir die Wirkung von ML133 getestet, einem kürzlich entwickelten Kir2-Hemmer28. Die Zugabe von 10 M ML133 zur Badperfusion schaffte die kapillarinduzierte arteriolare Dilatation als Reaktion auf 10 mM K+ in HiCaPA-Präparaten sowohl von männlichen als auch von weiblichen Mäusen praktisch ab (Abbildung 2A,C). Dieses letzte Ergebnis legt nahe, dass der Kir2.1-Kanal elektrische Signalisierung in weiblicher zerebraler Vaskulatur vermittelt, wie wir zuvor in der kortikalen Mikrozirkulation des männlichen Gehirns beschrieben haben.
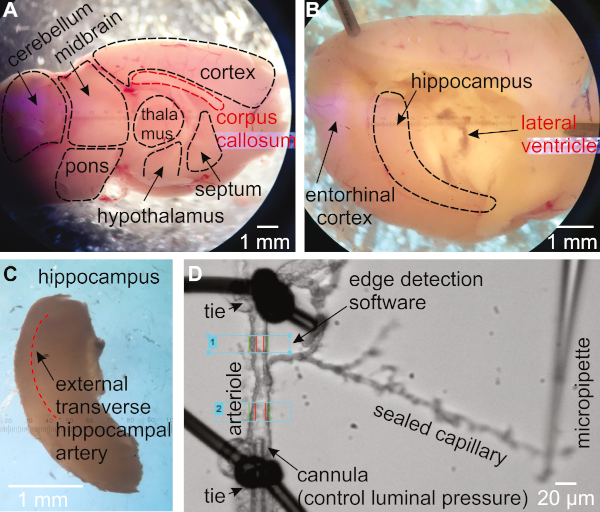
Abbildung 1: Methodik zur Isolierung und Druckbildung von Hippocampuskapillar-Parenchymalarteriolen (HiCaPA) Aus der Maus. (A) Frisch isoliertes Gehirn wird in der sagittalen Ebene nach der interhemisphärischen Spalte halbiert und mit der medialen Seite nach oben gelegt. (B) Thalamus, Septum und Hypothalamus werden sanft entfernt, um den Hippocampus zu enthüllen. (C) Der Hippocampus wird sorgfältig entfernt. (D) Arteriolen mit Kapillarbäumen werden vom Hippocampus isoliert und ein Ende des arteriolaren Segments wird mit einer Mikropipette, die mit einem Drucksystem verbunden ist, kantülisiert, und das andere Ende ist geschlossen. Kapillarenenden werden mit der Spitze einer Glaspipette versiegelt und gegen den Deckelschlupf gehalten. Der Innendurchmesser wird mit einem Kantendetektionssystem in einem oder mehreren Bereichen der Artezola überwacht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Die fokale Stimulation von Kapillaren mit 1 M NS309 hat keinen Einfluss auf den vorgelagerten arteriolaren Durchmesser, im Gegensatz zur Stimulation mit einem CSF mit 10 mM K+. (A) Repräsentative Aufzeichnung des vorgelagerten arteriolaren Durchmessers, die die Wirkung der Badanwendung von 1 M NS309 zeigt, gefolgt von einer aufeinanderfolgenden Kapillarenenstimulation (20 s, 5 psi) mit 1 M NS309 und mit einem CSF, der 10 mM K+ in Abwesenheit oder Anwesenheit des Kir2-Kanalinhibitors ML133 enthält. Die Anwendung von 10 mM K+ auf Kapillaren führte zu einer schnellen vorgelagerten arteriolaren Dilatation, die durch 10 M ML133 blockiert wurde. NS309 verursachte keine Dilatation. Das Fehlen einer vorgelagerten arteriolaren Dilatation als Reaktion auf die Kapillarstimulation mit NS309 zeigt, dass druckeimete Verbindungen das Arteriole nicht erreichen. (B) Zusammenfassungsdaten, die Durchmesseränderungen zeigen, die durch 1 M NS309 verursacht werden, die im Bad oder an den Kapillarenden aufgebracht werden (n = 14; ****p < 0,0001, gekoppelter t-Test). (C) Zusammenfassende Daten, die arteriolare Durchmesseränderungen zeigen, die durch 10 mM K+ direkt auf die Kapillaren von HiCaPA-Präparaten von männlichen (n = 6) oder weiblichen (n = 8) Mäusen vor und nach 10 m ML133 verursacht wurden, wurden im Bad angewendet (***p < 0.0005, n.s. = nicht signifikant, ungepaarter t-Test). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die unter Druck stehende HiCaPA (hippocampal kapillar-parenchymale Arteriole) Präparation, die in diesem Manuskript beschrieben wird, ist eine Erweiterung unseres etablierten Verfahrens zur Isolierung, Unterdruck bildung und Untersuchung von parenchymalen Arteriolen29. Wir berichteten vor kurzem, dass Kir2.1 Kanäle in Gehirnkapillaren Endothelzellen Wahrnehmen steigt in [K+]o mit neuronaler Aktivierung verbunden, und erzeugen ein aufsteigendes hyperpolarisierendes Signal, das vorgelagerte Arteriole20erweitert. Die Enthüllung dieser bisher unvorhergesehenen Rolle für die Kapillaren war teilweise durch die Entwicklung der CaPA-Präparation aus kortikaler Mikrozirkulationmöglich 20,21. Dieses Manuskript stellt einen ähnlichen experimentellen Ansatz dar, aber aus einer tieferen und eingeschränkteren Struktur des Maushirns, um einen einfachen und reproduzierbaren Ansatz zur Untersuchung der Kapillar-Arteriole-Signalisierung während der neurovaskulären Kopplung zu beschreiben.
Die Mikrozirkulation des Gehirns ist exquisit zerbrechlich und bestimmte Praktiken, insbesondere die Minimierung der Dehnung und Handhabung der Gefäße, müssen verwendet werden, um das Überleben der Arteriolen und Kapillaren zu gewährleisten. Die spontane Entwicklung des myogenen Tons ist der erste Indikator für die Lebensfähigkeit eines Präparats30. Die Endothelfunktion kann dann beurteilt werden, indem der Agonist NS309 des SK- und IK-Kanals zur Badlösung hinzugefügt wird, was eine nahezu maximale Dilatation verursachen sollte. Im Falle eines Nichtentwickelns von Ton oder einer Reaktion auf die Badanwendung von NS309 sollte die Zubereitung durch eine andere ersetzt werden. NS309 wird auch verwendet, um die Ausbreitung der fokalen Kapillarstimulation zu testen. Da kapillaren Endothelzellen keine SK- und IK-Kanäle20enthalten, sollte die lokale Abgabe von NS309 auf Kapillaren durch Druckauswurf keinen Einfluss auf den vorgelagerten Arteriolardurchmesser haben, wie in Abbildung 2dargestellt, was veranschaulicht, dass Verbindungen das Arteriol nicht versehentlich stimulieren. Sobald diese Schritte validiert sind, kann die Kapillar-Arteriole-Signalisierung getestet werden.
Hier untersuchten wir die elektrische Signalgebung durch Stimulierung von Kapillaren mit einem CSF von 10 mM K+. Jedoch, verschiedene Signalisierungsmodalitäten können mit dem vorliegenden Ansatz durch die Stimulierung von Kapillaren mit verschiedenen bekannten vasoaktiven Wirkstoffen oder Neurotransmittern erforscht werden. Ein weiterer Vorteil dieser Zubereitung ist die Möglichkeit, NVC zwischen verschiedenen Tieren und zwischen verschiedenen Hirnregionen zu untersuchen und schließlich zu vergleichen. Dies ist besonders interessant, weil das Gehirn nicht einheitlich von zerebrovaskulären Pathologien31,32ins Visier genommen wird. Eine allgemeine Einschränkung des hier vorgestellten Ansatzes besteht darin, dass durch die Isolierung der Mikrozirkulation entscheidende Komponenten der neurovaskulären Einheit, wie Neuronen und Astrozyten, verloren gehen. Andere Präparate, wie das Schädelfenster für die In-vivo-CBF-Bildgebung, erhalten die Struktur der intakten neurovaskulären Einheit und sind besser geeignet, NVC in einem intakten System zu untersuchen. Bei der Vorbereitung des Schädelfensters sind parenchymale Arteriolen jedoch ohne spezifische Ausrüstung, wie ein Multiphotonenmikroskop, schwer abzubilden, und tiefere Regionen, wie der Hippocampus, bleiben schwer abzubilden. In dieser Hinsicht stellt der im Filosa-Labor entwickelte Ansatz, der mit Luminalfluss einen myogenen Ton in Hirnscheiben induziert, eine elegante Verbindung zwischen Gehirnscheibe und in vivo-Ansätzen dar33. Das umgebende Nervengewebe kann jedoch die Penetration eines medikamentös angewendeten Medikaments einschränken, sein Off-Target-Potenzial erhöhen und Interpretationen erschweren, da mehrere Zelltypen den Medikamenten ausgesetzt sind. Wir haben in erster Linie unseren ex vivo-Ansatz entwickelt, um diese potenziellen Probleme anzugehen. Zusammenfassend lässt sich sagen, dass mehrere Ansätze in Verbindung mit der vollständigen Untersuchung von NVC verwendet werden sollten.
Zusammenfassend beschreibt der vorliegende Bericht eine ex vivo intakte Zubereitung von unter Druck stehenden Hippocampusartriolen und Kapillaren, die es ermöglicht, die Wirkungen pharmakologischer und biologischer Arbeitsstoffe auf funktionelle Parameter an diskreten Positionen entlang des Kapillar-Arteriol-Kontinuums zu testen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Jules Morin für die aufschlussreichen Kommentare zum Manuskript. Diese Forschung wurde durch Auszeichnungen der gemeinnützigen Organisation CADASIL Together We Have Hope, des Center for Women es Health and Research und des NHLBI R01HL136636 (FD) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
Referenzen
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten