Method Article
Ex Vivo Presurizado Hippocampal Capillary-Parenchymal Arteriole Preparación para Estudio Funcional
En este artículo
Resumen
El presente manuscrito detalla cómo aislar las arterias y capilares del hipocampo del cerebro del ratón y cómo presurizarlas para miografía a presión, inmunofluorescencia, bioquímica y estudios moleculares.
Resumen
Desde alteraciones conductuales sutiles hasta demencia en etapa sorpresa, el deterioro cognitivo vascular generalmente se desarrolla después de la isquemia cerebral. El accidente cerebrovascular y el paro cardíaco son enfermedades notablemente dimórficas sexualmente, y ambas inducen isquemia cerebral. Sin embargo, el progreso en la comprensión del deterioro cognitivo vascular, y luego el desarrollo de tratamientos específicos del sexo, se ha visto en parte limitado por los desafíos en la investigación de la microcirculación cerebral de los modelos de ratón en estudios funcionales. Aquí, presentamos un enfoque para examinar la señalización capilar-a-arteriola en una preparación ex vivo del arteriolo capilar-parenquimal del hipocampo (HiCaPA) del cerebro del ratón. Describimos cómo aislar, canalizar y presurizar la microcirculación para medir el diámetro arteriolar en respuesta a la estimulación capilar. Mostramos qué controles funcionales apropiados se pueden utilizar para validar la integridad de la preparación hiCaPA y mostrar resultados típicos, incluyendo la prueba de potasio como un agente de acoplamiento neurovascular y el efecto del inhibidor recientemente caracterizado de la familia de canales de potasio de retificación interna Kir2, ML133. Además, comparamos las respuestas en los preparados obtenidos de ratones machos y hembras. Si bien estos datos reflejan investigaciones funcionales, nuestro enfoque también se puede utilizar en estudios de biología molecular, inmunoquímica y electrofisiología.
Introducción
La circulación pial en la superficie del cerebro ha sido objeto de mucho estudio, en parte debido a su accesibilidad experimental. Sin embargo, la topología de la vasculatura cerebral crea regiones distintas. A diferencia de la robusta red pial rica en anastomosas con capacidad sustancial para redirigir el flujo sanguíneo, las arteriolas parénquimas intracerebrales (PA) presentan un suministro colateral limitado, cada uno de ellos perdiendo un volumen discreto de tejido nervioso1,2. Esto crea un efecto cuello de botella en el flujo sanguíneo que, combinado con características fisiológicas únicas3,4,5,6,7,8, hace que las arterias intracerebrales un sitio crucial para la regulación del flujo sanguíneo cerebral (CBF)9,10. A pesar de los desafíos técnicos inherentes al aislamiento y la cannulación de los PA, en la última década se ha visto un mayor interés en los estudios funcionales ex vivo utilizando recipientes presurizados11,12,13,14,15,16,17. Una de las razones de este mayor interés es el considerable esfuerzo de investigación realizado en el acoplamiento neurovascular (NVC), el mecanismo que sostiene la hiperemia funcional cerebral18.
Regionalmente, CBF puede aumentar rápidamente después de la activación neuronal local19. Los mecanismos celulares y las propiedades de señalización que controlan NVC se entienden incompletamente. Sin embargo, identificamos un papel previamente imprevisto para los capilares cerebrales durante la nCV en la observación de la actividad neuronal y traduciéndolo en una señal eléctrica hiperpolarizadora para dilatar las arterias aguas arriba20,21,22. Potenciales de acción23,24 y apertura de canales de gran conducta ca2+-activados K+ (BK) en los pies de extremo astrocíticos25,26 aumentan la concentración de iones de potasio intersticial [K+] o ,loque resulta en la activación de fuertes canales rectificadores internos K+ (Kir) en el endotelio vascular de los capilares. Este canal es activado por K+ externo, pero también por hiperpolarización en sí. La corriente hiperpolarizante se regenera en las células endoteliales capilares adyacentes hasta la arteriola, donde provoca relajación de los miocitos y aumento de la CBF20,21. El estudio de este mecanismo nos llevó a desarrollar una preparación capilar-parénquimal presurizada (CaPA) para medir el diámetro arteriolar durante la estimulación capilar con agentes vasoactivos. La preparación de CaPA se compone de un segmento de arteriolas intracerebrales canulados con una ramificación capilar intacta y aguas abajo. Los extremos capilares se comprimen contra el fondo del cristal de la cámara mediante un micropipeta, que ocluye y estabilice toda la formación vascular20,21.
Anteriormente realizamos innovaciones instrumentales mediante la toma de imágenes de los preparativos de CaPA a partir de la corteza del ratón20,21 y arterioles de la amígdala de rata13 y el hipocampo16,17. A medida que la vasculatura del hipocampo recibe más atención debido a su susceptibilidad a las condiciones patológicas, aquí proporcionamos un método paso a paso para la preparación de CaPA desde el hipocampo de ratón (HiCaPA) que no sólo se puede utilizar en estudios funcionales de NVC, sino también en biología molecular, inmunoquímica y electrofisiología.
Protocolo
Todos los experimentos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Colorado, Anschutz Medical Campus y se realizaron de acuerdo con las directrices de los Institutos Nacionales de Salud.
1. Soluciones
- Utilice la solución salina con búfer MOPS para la disección y para mantener las muestras a 4 oC antes de su utilización. No gasgaste la solución. Preparar solución salina tamponada MOPS con la siguiente composición: 135 mM NaCl, 5 mM KCl, 1 mM KH2PO4, 1 mM MgSO4, 2,5 mM CaCl2, 5 mM de glucosa, 3 mM MOPS, 0,02 mM EDTA, 2 mM de piruvato, 10 mg/mL de albúmina bovina, pH 7,3 a 4 oC.
- Utilice líquido cefalorraquídeo artificial (aCSF) como solución de baño y solución de pipeta. Gas tanto aCSF como Ca2+-free aCSF con 5% CO2, 20% O2y N2 balance. Preparar la solución con la siguiente composición: 125 mM NaCl, 3 mM KCl, 26 mM NaHCO3, 1,25 mM NaH2PO4, 1 mM MgCl2, 4 mM de glucosa, 2 mM CaCl2,pH 7.3 (con aireación con 5% CO2, 20% O2y N2 de balance).
- Obtenga la dilatación máxima en ACSF nominalmente Ca2+(0 mM [Ca2+]o, 5 mM EGTA).
2. Preparación de la cámara de órganos
- Inserte los capilares de vidrio borosilicato (diámetro exterior de 1,2 mm; diámetro interior a 0,69 mm; longitud a 10 cm) en un tirador de vidrio. Tire del capilar para hacer una punta larga y delgada en un extremo.
- A un lado de la cámara, agregue una cánula que se pueda conectar a una bomba peristáltica en miniatura para presurizar luminalmente el recipiente. Bajo un microscopio de disección, rompa la punta de la cánula para que sea lo suficientemente pequeña como para caber en el recipiente de interés, pero lo suficientemente grande como para permitir que las soluciones fluyan a través de la punta. Asegúrese de que la punta tenga aproximadamente 10-15 m de diámetro.
- Llene la cánula con una jeringa con un filtro de 0,22 m con aCSF oxigenado. Asegúrese de que no haya burbujas de aire o escombros en la cánula.
- Agregue dos cánulas más al lado opuesto de la cámara. No rompas sus consejos.
3. Disección y aislamiento del hipocampo
- Eutanasia y decapita un ratón. Para este experimento, utilice un ratón C57BL6/J de 8 semanas de edad para comparar las diferencias entre machos y hembras. Inyectar el ratón con pentobarbital y decapitar con tijeras quirúrgicas.
- Usando tijeras de disección pequeñas, corta la piel a lo largo de la línea media en la parte superior de su cabeza. Mueva la piel hacia los lados.
- Comenzando en el lado caudal del cráneo, corta el cráneo a lo largo de la línea media hasta que se alcancen las bombillas olfativas. Retire las porciones del cráneo hasta que el cerebro esté expuesto.
- Retire lentamente el cerebro, comenzando cerca de la nariz del ratón. Separe el cerebro de los bulbos olfativos, los nervios craneales y la médula espinal cortando las estructuras con las tijeras de disección pequeñas.
- Coloque el cerebro en una placa de disección con suficiente solución MOPS para sumergirlo por completo. Usando un microscopio de disección, coloque el cerebro en el centro de la placa de disección con el lado ventral hacia abajo.
- Usando una cuchilla de afeitar, corta el cerebro por la mitad a lo largo de la fisura longitudinal. Sujete la hoja de modo que el borde afilado sea paralelo a la parte inferior de la placa de disección. Presione la hoja a través del cerebro de un solo golpe. Mueva un hemisferio a un lado de la placa.
- Realice los siguientes pasos para cada hemisferio por separado o en paralelo.
- Coloque un hemisferio en el centro de la placa para que la línea media esté orientada hacia abajo. A continuación, utilice la cuchilla de afeitar para cortar a lo largo de la fisura transversal para eliminar el cerebelo y el tallo cerebral. Empuje la hoja directamente a través del tejido.
- Gire el hemisferio de modo que el lado medial esté mirando hacia arriba(Figura 1A). Usa una espátula para mantener el cerebro en su lugar. Usando una segunda espátula, inserte la punta debajo del cuerpo calloso y la cuchara debajo para eliminar el tálamo, el tabique y el hipotálamo, cubriendo el hipocampo(Figura 1B).
- Asegúrese de que el hipocampo sea ahora visible como una estructura curva cerca del lado posterior del cerebro. Usando una espátula para mantener el cerebrum en su lugar, utilice la segunda espátula para sacar el hipocampo del cerebro(Figura 1C).
- Transfiera el hipocampo a una nueva placa de disección llena a la mitad con la solución MOPS. Descarta el resto del cerebro.
4. Aislamiento de arteriolas hipocampales
- Complete los siguientes pasos para cada hipocampo.
- Anclar uno de los hipocampi usando pequeños pines en cada extremo de la sección. La arteria del hipocampo está mirando hacia arriba.
- Usando fórceps muy afilados, estira suavemente pequeñas secciones del hipocampo. Esto aflojará el tejido que rodea las arterias, lo que facilita su disección.
- Buscar a través del tejido del hipocampo dorsal para identificar la arteria transversal externa (Figura 1C)16,27.
- Agarre suavemente la arteria transversal externa y tire lentamente del tejido para recoger las arterias y capilares que perfunden la región CA3 del hipocampo.
- Una vez que no haya más vasos que extraer del tejido, deseche el hipocampo. Mantenga los recipientes sobre hielo en placas mientras no estén en uso.
5. Canyulación arterioscular capilar-parenquimal hipocampo
- Encuentra una arteriola con una rama que termina con capilares. Transfiéralo a la cámara de órganos. Asegúrese de que la arteriola esté a unos 15-30 m cuando esté completamente dilatada(Figura 1D).
- Monte cuidadosamente el vaso sanguíneo empujando la punta de la cánula a través de la pared arteriola por debajo del área objetivo. Deslice cuidadosamente el vaso sobre la cánula hasta que haya suficiente tejido para colocar la corbata.
- Haga un nudo suelto con 12-0 suturas de nylon para que quepa sobre el vaso sanguíneo y la cánula. Usa un nudo de medio enganche para asegurar las corbatas. A continuación, tire de los extremos para apretar el nudo y fijar la arteriola a la cánula. Retire las ramas extrañas del recipiente debajo de la corbata tirando suavemente de ellas con fórceps.
- Haz otra corbata y asegúrate en el otro extremo de la arteriola para sellarla.
- Baje la cánula con el recipiente adjunto hasta que quede plana contra el cubreobjetos en la parte inferior de la cámara. Tenga cuidado de no bajar demasiado la cánula o se romperá.
- Usando una cánula en el lado opuesto de la cámara, bájala de modo que el punto de la misma aros hacia abajo de la corbata en el extremo de la arteria.
- Utilice la tercera cánula para fijar la rama capilar hasta el cubreobjetos. Coloque la punta cerca del extremo de la rama mientras deja los extremos de los capilares expuestos (no debajo de la cánula).
6. Miografía de presión
- Mueva la cámara del visor de disección al microscopio con el software de grabación.
- Conecte el tubo de entrada y salida a la cámara para perfusión. Iniciar la perfusión con aCSF calentado (37 oC) a un caudal de 4 ml/min.
- Fije la cánula presurizante a una bomba peristáltica emparejada con un transductor de presión y lleve la presión interna a 20 mm Hg.
- Inicie el software de grabación. Ajuste los ajustes del microscopio y de la imagen para lograr la imagen más clara posible. Comience la grabación una vez que los ajustes estén optimizados para el software de detección.
- Aumente la presión del recipiente hasta 40 mm Hg mientras registra el diámetro arterial con un software de detección de bordes.
- Permita que lave la solución MOPS de 15-20 minutos fuera de la cámara con aCSF, y deje que la preparación HiCaPA equilibre y desarrolle el tono miogénico.
- Para probar la viabilidad de un recipiente, aplique 1 solución NS309 a la perfusión de baño (consulte la Figura 2A,B y la sección Resultados representativos). El segmento arteriolar debe dilatarse, demostrando alrededor de 30-40% tono miogénico como se describió anteriormente3,14,20.
7. Estimulación focal de los extremos capilares
- Una vez establecido el tono basal para la arteriola y evaluado la función endotelial, pruebe la respuesta de la estimulación capilar.
- Usando un tirador de vidrio, haga las cánulas para que haya un punto fino en un extremo. Romper la punta de una cánula para que el medicamento probado puede fluir a través de la punta suavemente a 5 psi.
- Llene la cánula con la solución de fármaco de interés y agréguela a un micromanipulador de 3 ejes unido al microscopio. Conecte el tubo del sistema de eyección de presión a la cánula.
- Baje lentamente la cánula en el baño cerca de los capilares, teniendo cuidado de no golpear ninguna parte del recipiente o hardware en la cámara. Maniobra la punta de la cánula junto a los extremos de los capilares sin tocarlos. Mantenga la punta de la cánula justo fuera de la cubierta para evitar que el vaso se estimule si la cánula tiene fugas.
- Cuando esté listo para estimular los capilares, baje la cánula hasta la cubierta y justo al lado de los capilares. Active el sistema de eyección de presión con el tiempo de eyección deseado (aquí 20 s). Una vez finalizada la estimulación, levante ligeramente la cánula para evitar más estimulación.
- Repita la estimulación según sea necesario. Cambie la cánula del sistema de eyección de presión para probar diferentes compuestos farmacológicos.
- Para confirmar que sólo se están estimulando los capilares, llene la cánula con una solución NS309 de 1 M y repita los pasos anteriores.
NOTA: Las células endoteliales capilares no expresan canales K+ activados por NS309, por lo que la arteriola no debe responder a la estimulación. Si la arteriola se dilata, entonces la cánula tendrá que ser reposicionada o el diámetro del agujero tendrá que ser más pequeño (ver Figura 2A,B y la sección Resultados Representativos).
Resultados
Los canales Endoteliales de pequeña conductancia (SK) e intermedio de conductividad (IK) Ca2+-sensibles K+ ejercen una influencia dilatoria sobre el diámetro de los PA. Aplicación de baño de 1 M NS309, un agonista sintético del canal IK y SK, causado cerca de la dilatación máxima(Figura 2A, B). Sin embargo, las células endoteliales capilares carecen de canales IK y SK y no hiperpolarizan en respuesta a NS30920. Como resultado, la estimulación de los extremos capilares con 1 M NS309 por eyección de presión focal (20 s, 5 psi) no causó dilatación arteriolar aguas arriba(Figura 2A,B). Este resultado indica que NS309 no llegó a la arteriola en los preparados HiCaPA y podría utilizarse como control para evaluar la restricción espacial del compuesto aplicado a los capilares por eyección por presión.
Esta preparación fue diseñada fundamentalmente para la medición de la señalización eléctrica de dentro hacia fuera de los capilares a los PA. Usando la preparación HiCaPA, aplicamos aCSF que contiene 10 mM K+ en los extremos capilares y medimos una dilatación arteriolar aguas arriba(Figura 2A,C)como hicimos anteriormente en los preparativos de CaPA de la vasculatura cortical20. Luego investigamos, por primera vez a nuestro conocimiento, la señalización eléctrica capilar a arteriola en ratones hembra utilizando preparaciones HiCaPA. La dilatación arteriolar evocada por la estimulación capilar con 10 mM K+ no difirió entre las preparaciones de ratones macho y hembra(Figura 2A,C).
Por último, otro beneficio fundamental de este enfoque es la posibilidad de aplicar herramientas farmacológicas en el baño antes de la estimulación capilar. Aquí probamos el efecto de ML133, un inhibidor Kir228desarrollado recientemente. Adición de 10 M ML133 a la perfusión de baño prácticamente abolió la dilatación arteriolar inducida por capilares en respuesta a 10 mM K+ en preparaciones HiCaPA de ratones macho y hembra(Figura 2A,C). Este último resultado sugiere que el canal Kir2.1 media la señalización eléctrica en la vasculatura cerebral femenina como describimos anteriormente en la microcirculación cortical del cerebro masculino.
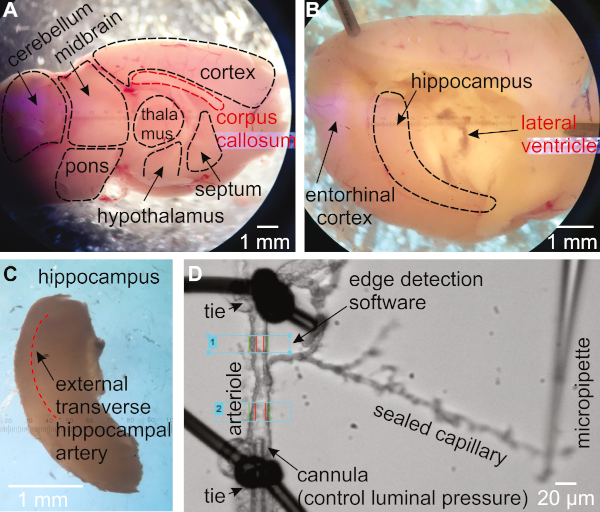
Figura 1: Metodología para el aislamiento y presurización de la preparación de arteriolas capilares-parénquimas del hipocampo (HiCaPA) de la preparación del ratón. (A) El cerebro recién aislado se corta por la mitad en el plano sagital siguiendo la fisura interhemisférica y se coloca con el lado medial hacia arriba. (B) El tálamo, el tabique y el hipotálamo se retiran suavemente para revelar el hipocampo. ( C) El hipocampo se retira cuidadosamente. (D) Las arterias con árboles capilares están aisladas del hipocampo y un extremo del segmento arteriolar se puede cofular con una micropieta conectada a un sistema de presurización, y el otro extremo se ocluye. Los extremos capilares se sellan y se mantienen contra el cubreobjetos con la punta de una pipeta de vidrio. El diámetro interno se controla con un sistema de detección de bordes en una o varias regiones de la arteriola. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: La estimulación focal de los capilares con 1 M NS309 no tiene ningún efecto sobre el diámetro arterial aguas arriba, a diferencia de la estimulación con aCSF que contiene 10 mM K+. (A) Registro representativo del diámetro arteriolar aguas arriba que muestra el efecto de la aplicación del baño de 1 M NS309 seguido de estimulación sucesiva de los extremos capilares (20 s, 5 psi) con 1 M NS309 y con aCSF que contiene 10 mM K+ en ausencia o presencia del inhibidor de canal Kir2 ML133. La aplicación de 10 mM K+ en los capilares produjo una dilatación arteriolar aguas arriba rápida que fue bloqueada por 10 m ML133. NS309 no causó dilatación. La ausencia de dilatación arteriolar aguas arriba en respuesta a la estimulación capilar con NS309 ilustra que los compuestos inyectados a presión no llegan a la arteriola. (B) Datos de resumen que muestran los cambios de diámetro inducidos por 1 M NS309 aplicado en el baño o en los extremos capilares (n a 14; ****p < 0.0001, prueba t emparejada). (C) Resumen de los datos que muestran los cambios de diámetro arteriolar inducidos por 10 mM K+ aplicados directamente a los capilares en preparaciones HiCaPA de macho (n a 6) o hembra (n x 8) ratones antes y después de 10 M ML133 se aplicó en el baño (***p < 0.0005, n.s. - no significativo, no paráxo t-test). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La preparación presurizada HiCaPA (arteriola capilar-parénquimal del hipocampo) descrita en el presente manuscrito es una extensión de nuestro procedimiento bien establecido para aislar, presurizar y estudiar arteriolas parénquimas29. Recientemente informamos que los canales Kir2.1 en las células endoteliales capilares cerebrales detectan aumentos en [K+]o asociados con la activación neuronal, y generan una señal de hiperpolarización ascendente que dilata los arteriolas aguas arriba20. La revelación de este papel antes imprevisto para los capilares ha sido posible en parte mediante el desarrollo de la preparación de CaPA a partir de la microcirculación cortical20,21. Este manuscrito presenta un enfoque experimental similar pero a partir de una estructura más profunda y restringida del cerebro del ratón para describir un enfoque simple y reproducible para investigar la señalización capilar a arteriola durante el acoplamiento neurovascular.
La microcirculación cerebral es exquisitamente frágil y ciertas prácticas, especialmente minimizando el estiramiento y la manipulación de los vasos, deben utilizarse para garantizar la supervivencia de las arterias y capilares. El desarrollo espontáneo del tono miogénico es el primer indicador de la viabilidad de una preparación30. La función endotelial se puede evaluar añadiendo el agonista NS309 de los canales SK e IK a la solución de baño, que debería causar una dilatación casi máxima. En caso de que no se desarrolle el tono o la respuesta a la aplicación de baño de NS309, la preparación debe ser reemplazada por otra. NS309 también se utiliza para probar la propagación de la estimulación capilar focal. Debido a que las células endoteliales capilares carecen de canales SK e IK20, la administración local de NS309 en capilares por eyección por presión no debe tener ningún efecto sobre el diámetro del arteriolar aguas arriba como se muestra en la Figura 2,lo que ilustra que los compuestos no estimulan accidentalmente la arteria. Una vez validados estos pasos, se puede probar la señalización capilar a arteriola.
Aquí examinamos la señalización eléctrica estimulando capilares con aCSF que contienen 10 mM K+. Sin embargo, diferentes modalidades de señalización se pueden explorar utilizando el enfoque actual mediante la estimulación de capilares con diferentes agentes vasoactivos conocidos o neurotransmisores. Otro beneficio de esta preparación es la posibilidad de investigar y eventualmente comparar NVC entre diferentes animales y entre diferentes regiones cerebrales. Esto es particularmente interesante porque el cerebro no está uniformemente dirigido por patologías cerebrovasculares31,32. Una limitación general del enfoque presentado aquí es que al aislar la microcirculación, se pierden componentes cruciales de la unidad neurovascular, como las neuronas y los astrocitos. Otras preparaciones, como la ventana craneal para la toma de imágenes CBF in vivo, mantienen la estructura de la unidad neurovascular intacta y son más apropiadas para estudiar la NVC en un sistema intacto. Sin embargo, en la preparación de la ventana craneal, las arterias parénquimas son difíciles de crear sin equipos específicos, como un microscopio multifotón, y las regiones más profundas, como el hipocampo, siguen siendo difíciles de imaginar. En este sentido, el enfoque desarrollado en el laboratorio de Filosa utilizando flujo luminal para inducir el tono miogénico en las rebanadas cerebrales representa un vínculo elegante entre la rebanada cerebral y los enfoques in vivo 33. Sin embargo, el tejido nervioso circundante puede limitar la penetración de un fármaco aplicado tópicamente, aumentando su potencial fuera de objetivo y dificultando las interpretaciones, porque varios tipos de células están expuestos a los medicamentos. Desarrollamos principalmente nuestro enfoque ex vivo para abordar estos posibles problemas. En conclusión, se deben utilizar múltiples enfoques junto con el estudio completo de la NVC.
En resumen, el presente informe describe una preparación intacta ex vivo de arteriolas y capilares presurizados del hipocampo que permite probar los efectos de los agentes farmacológicos y biológicos en parámetros funcionales en posiciones discretas a lo largo del continuo capilar-arteriolo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores quieren agradecer a Jules Morin por comentarios perspicaces sobre el manuscrito. Esta investigación fue financiada por premios de la organización sin fines de lucro CADASIL Together We Have Hope, el Center for Women's Health and Research y el NHLBI R01HL136636 (FD).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
Referencias
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados