Method Article
Ex Vivo 가압 해모골 모세관-Parenchymal Arteriole 기능 적 연구를 위한 준비
요약
본 원고는 마우스 뇌에서 해마 동맥과 모세 혈관을 분리하는 방법과 압력 myography, 면역 형광, 생화학 및 분자 연구를 위해 그들을 가압하는 방법을 자세히 설명합니다.
초록
미묘한 행동 변경에서 말기 치매에, 혈관 인식 손상은 전형적으로 대뇌 허혈 다음 발전합니다. 뇌졸중과 심장 마비는 현저하게 성적으로 이형질환이며, 둘 다 대뇌 허혈을 유발합니다. 그러나, 혈관 인지 장애를 이해 하 고 다음 성 별 치료를 개발에 진행, 기능 연구에서 마우스 모델에서 뇌 미세 순환을 조사에 의해 부분적으로 제한 되었습니다. 여기에서, 우리는 마우스 두뇌에서 전 생체 내 해모모세-자영-자영 아테리올(HiCaPA) 준비에서 모세관-아티올 신호신호를 검사하는 접근법을 제시한다. 우리는 모세관 자극에 응하여 동맥 직경을 측정하기 위하여 미세 순환을 분리, 통조림 및 가압하는 방법을 기술합니다. 우리는 HiCaPA 제제 무결성을 검증하고 신경 혈관 커플링 제로 칼륨을 테스트하고 Kir2 안쪽정류 칼륨 채널 패밀리, ML133의 최근 특징 억제제의 효과를 포함하여 전형적인 결과를 표시하는 데 사용할 수있는 적절한 기능 적 제어를 보여줍니다. 또한, 우리는 남성과 여성 마우스로부터 수득된 제제에서의 반응을 비교한다. 이러한 데이터는 기능적 조사를 반영하는 반면, 우리의 접근 방식은 분자 생물학, 면역 화학 및 전기 생리학 연구에서도 사용될 수 있습니다.
서문
뇌 표면의 pial 순환은 많은 연구의 대상이되었습니다, 부분적으로 때문에 실험 접근성. 그러나 대뇌 혈관 구조의 토폴로지는 뚜렷한 영역을 만듭니다. 혈류를 리디렉션하기위한 실질적인 용량을 가진 해부학이 풍부한 견고한 pial 네트워크와는 달리, 내측 중골 동맥 동맥 (PA)은 제한된 부수적 공급을 제시하며, 이들 각각은 신경 조직의 개별 부피를교배1,2. 이것은 독특한 생리적 특징3,4,5,6,7,8과결합하여 뇌혈류(CBF) 조절9,10을위한 중요한 부위로 뇌내 동맥을 만드는 혈류에 병목 현상 효과를 일으킨다. PA의 격리 및 통조림에 내재된 기술적 과제에도 불구하고, 지난 10년 동안 가압용기11,12,13,14,15,16,17을이용한 생체내 기능연구에 대한 관심이 높아지고 있다. 이러한 관심증가에 대한 이유 중 하나는 뇌 기능성 충혈을 지지하는 기전인 신경혈관 커플링(NVC)에 대한 상당한 연구 노력이 수행된 것이다18.
지역적으로, CBF는 현지 신경 활성화19에따라 급속하게 증가할 수 있다. NVC를 제어하는 셀룰러 메커니즘 및 신호 특성은 불완전하게 이해됩니다. 그러나, 우리는 신경 활동을 감지하고 상류 동맥20,21,22를팽창시키기 위하여 과극화 전기 신호로 번역하는 NVC 도중 두뇌 모세혈관을 위한 이전에 예기치 않은 역할을 확인했습니다. 행동 전위23,24 및 성상 세포 종받에 큰 전도도Ca2+활성화 된 K+ (BK) 채널의 개방25,26 간질 칼륨 이온 농도 [K+]o,이는 모세 혈관내 혈관 내 내 정류기 K+ (Kir) 채널의 활성화를 초래한다. 이 채널은 외부 K+에 의해뿐만 아니라 과분극 자체에 의해 활성화됩니다. 갭 접합을 통해 확산, 과분극 전류는 근세포 이완 및 CBF 증가20,21원인 arteriole까지 인접한 모세관 내피 세포에서 재생. 이 기계장치의 연구 결과는 혈관 활성에이전트를 가진 모세관 자극 도중 동맥 직경을 측정하기 위하여 가압 모세관-parenchymal arteriole (CaPA) 준비를 개발하기 위하여 저희를 지도했습니다. CaPA 제제는 손상되지 않은 하류 모세관 파급 효과를 가진 굴절식 중계 동맥 분절로 구성됩니다. 모세관 끝은 마이크로피펫에 의해 챔버 유리 바닥에 압축되며, 이는 전체 혈관형성을 20,21로막고 안정화시킵니다.
우리는 이전에 쥐 편도체 13 및 해마16, 17에서마우스 피질20,21 및 동맥에서 CaPA 제제를 이미징하여 도구적 혁신을 이루었다. 해마 혈관구조는 병리학적 조건에 대한 감수성으로 인해 더 많은 관심을 받고 있기 때문에, 여기서 우리는 기능적 NVC 연구뿐만 아니라 분자 생물학, 면역 화학 및 전기 생리학에서도 사용할 수있는 마우스 해마 (HiCaPA)에서 CaPA 준비를위한 단계별 방법을 제공합니다.
프로토콜
모든 실험은 콜로라도 대학, 안슈츠 의료 캠퍼스의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었으며 국립 보건원의 지침에 따라 수행되었습니다.
1. 솔루션
- 해부를 위해 MOPS 버퍼링 식염수를 사용하고 시료를 사용 전에 4 °C로 유지하십시오. 용액을 가스로 사용하지 마십시오. 다음 조성으로 MOPS 완충 식염수 준비: 135 mM NaCl, 5 mM KCl, 1 mM KH2PO4,1 mM MgSO4,2.5 mM CaCl2,5 mM 포도당, 3 mM MOPS, 0.02 mM EDTA, 2 mM pyruvate, 10 mg/mL 소 세루민, 30 mg/mL 소 세루민, 30 mg/mL 소 세루민 을 준비한다.
- 인공 뇌척수액(aCSF)을 목욕 용액 및 파이펫 용액으로 사용하십시오. 가스 모두 ACSF 및 Ca2+-free aCSF 5% CO2,20% O2및 N2 균형. 다음 조성물로 용액을 준비: 125 mM NaCl, 3 mM KCl, 26 mM NaHCO3,1.25 mM NaH2PO4,1 mM MgCl2,4 mM 포도당, 2 mM CaCl2,pH 7.3 (5%CO2,20%O2,및 N2 균형).
- 명목상 Ca2+-free aCSF (0 mM [Ca2 +]o, 5 mM EGTA)에서 최대 팽창을 가져옵니다.
2. 장기 챔버 준비
- 보로실리케이트 유리 모세혈관(외부 직경 = 1.2 mm; 내경 = 0.69 mm; 길이 = 10cm)을 유리 풀러에 삽입합니다. 모세관을 당겨 한쪽 끝에 길고 얇은 팁을 만듭니다.
- 챔버의 한쪽에, 용기를 발광하기 위해 소형 연동 펌프에 연결할 수있는 캐뉼라를 추가합니다. 해부 현미경으로 캐뉼라의 끝을 부러뜨려 관심있는 용기에 맞을 만큼 작지만 솔루션이 팁을 통해 흐를 수 있을 만큼 충분히 큽니다. 팁의 직경이 약 10-15 μm인지 확인하십시오.
- 산소 aCSF가 부착 된 0.22 μm 필터로 주사기를 사용하여 캐뉼라를 채웁니다. 캐뉼라에 기포나 이물질이 없는지 확인하십시오.
- 챔버의 반대편에 두 개의 캐뉼라를 더 추가합니다. 그들의 팁을 깰하지 마십시오.
3. 해마 해부 및 격리
- 마우스를 안락사시키고 참수한다. 이 실험에서는 8주된 C57BL6/J 마우스를 사용하여 남성과 여성의 차이를 비교합니다. 펜토바르비탈로 마우스를 주입하고 외과 용 가위로 참수하십시오.
- 작은 해부 가위를 사용하여 머리 상단의 중간선을 따라 피부를 잘라냅니다. 스킨을 측면으로 이동합니다.
- 두개골의 꼬리 쪽에서 시작하여 후각 전구에 도달 할 때까지 중간 선을 따라 두개골을 잘라냅니다. 뇌가 노출 될 때까지 두개골의 일부를 제거합니다.
- 천천히 마우스의 코 근처에서 시작, 뇌를 제거합니다. 작은 해부 가위로 구조를 절단하여 후각 전구, 두개골 신경 및 척수에서 뇌를 분리하십시오.
- 완전히 침수하기에 충분한 MOPS 용액으로 해부 판에 뇌를 놓습니다. 해부 현미경을 사용하여 뇌를 해부 판의 중앙에 놓고 복부 쪽을 아래를 향합니다.
- 면도날을 사용하여 세로 균열을 따라 뇌를 반으로 자른다. 날카로운 모서리가 해부 판의 바닥과 평행하도록 블레이드를 잡습니다. 한 번의 스트로크로 뇌를 통해 블레이드를 누릅니다. 한 반구를 플레이트의 측면으로 이동합니다.
- 각 반구에 대해 따로 또는 병렬로 다음 단계를 수행합니다.
- 중간선이 아래를 향할 수 있도록 플레이트 중앙에 반구 를 배치합니다. 그런 다음 면도날을 사용하여 횡방향 균열을 따라 절단하여 소뇌와 뇌간을 제거합니다. 블레이드를 티슈를 통해 똑바로 밀어 넣습니다.
- 내측이 위를 향도록 반구를 회전시다(그림1A). 한 주걱을 사용하여 뇌를 제자리에 고정시다. 두 번째 주걱을 사용하여, 코퍼스 callosum 아래에 팁을 삽입하고 시상, 중격, 시상 하부를 제거하기 위해, 해마를 덮고(그림 1B).
- 해마가 이제 대뇌의 후방 측 근처의 곡선 구조로 보이는지 확인하십시오. 한 주걱을 사용하여 뇌를 제자리에 고정하고 두 번째 주걱을 사용하여 해마를 대뇌에서 스쿱합니다(그림 1C).
- MOPS 용액으로 반쯤 채워진 새로운 해부 판으로 해마를 옮긴다. 뇌의 나머지 부분을 폐기하십시오.
4. 하마 동맥 격리
- 각 해마에 대한 다음 단계를 완료합니다.
- 섹션의 각 끝에 작은 핀을 사용하여 해마 중 하나를 핀 다운합니다. 해마 동맥이 위를 향하고 있습니다.
- 매우 날카로운 집게를 사용하여 해마의 작은 부분을 부드럽게 스트레칭하십시오. 이것은 동맥을 둘러싼 조직을 풀어, 그(것)들을 해부하는 것을 쉽게 합니다.
- 등쪽 해마 조직을 통해 검색하여 외부 횡방향 동맥을 식별한다(도1C)16,27.
- 부드럽게 외부 횡방향 동맥을 잡고 천천히 해마의 CA3 영역을 정유 동맥과 모세 혈관을 수집하기 위해 조직에서 멀리 당겨.
- 일단 조직에서 제거 될 더 이상 혈관이 없다면, 해마를 폐기하십시오. 사용하지 않는 동안 에는 용기를 얼음에 얼음에 보관하십시오.
5. 해포 모세관 - 자렌 성 동맥 통조림
- 모세 혈관으로 끝나는 가지가있는 동맥을 찾으십시오. 장기 챔버로 옮김을 옮김으로 옮김. 아테리올이 완전히 팽창할 때 약 15-30 μm인지 확인한다(도1D).
- 조심스럽게 대상 영역 아래 의 동맥 벽을 통해 캐뉼라 팁을 밀어 혈관을 탑재. 넥타이를 묶을 수 있는 충분한 조직이 있을 때까지 용기를 캐뉼라 에 조심스럽게 밀어 놓습니다.
- 12-0 나일론 봉합사로 느슨한 매듭을 만들어 혈관과 캐뉼라에 맞도록하십시오. 반 히치 매듭을 사용하여 동점을 확보하십시오. 그런 다음 끝을 당겨 매듭을 조이고 동맥을 캐뉼라에 고정시십시오. 끈 아래에 있는 불필요한 용기 가지를 집게로 부드럽게 당겨 제거합니다.
- 다른 넥타이를 만들고 그것을 밀봉하기 위해 arteriole의 다른 쪽 끝에 고정합니다.
- 챔버 바닥의 커버 슬립에 대해 평평해질 때까지 부착된 용기로 캐뉼라를 낮춥니다. 캐뉼라를 너무 많이 낮추지 않도록 주의하십시오.
- 챔버의 반대편에 하나의 캐뉼라를 사용하여, 그것의 포인트가 arteriole의 끝에 넥타이를 고정되도록 그것을 낮춥시다.
- 세 번째 캐뉼라를 사용하여 모세관 가지를 커버슬립에 고정합니다. 모세혈관의 끝을 노출된 채로 분기 의 끝에 가깝게 놓습니다(캐뉼라 아래가 아님).
6. 압력 조영술
- 기록 소프트웨어로 해부 범위에서 현미경으로 챔버를 이동합니다.
- 유입 및 유출 튜브를 챔버에 연결하여 관류를 확인합니다. 4 mL / min의 유량으로 가열 된 aCSF (37 °C)로 관류를 시작합니다.
- 가압 캐뉼러를 압력 트랜스듀서와 페어링된 연동 펌프에 부착하고 내부 압력을 20mm Hg로 가져옵니다.
- 레코딩 소프트웨어를 시작합니다. 현미경 및 이미징 설정을 조정하여 가능한 가장 선명한 이미지를 구현합니다. 설정이 감지 소프트웨어에 최적화되면 레코딩을 시작합니다.
- 에지 감지 소프트웨어로 동맥 직경을 기록하면서 용기의 압력을 최대 40mm Hg까지 높입니다.
- ~15-20 분 동안 MOPS 용액을 aCSF로 챔버밖으로 씻어 내고 HiCaPA 가 균질 톤을 평형화하고 개발할 수 있도록하십시오.
- 용기의 생존 가능성을 테스트하려면 1 μM NS309 용액을 목욕 관류에 적용하십시오(그림 2A, B 및 대표 결과 섹션 참조). 동맥 세그먼트는 앞서 설명한 대로 약 30-40% 근생 톤을 보여주는 팽창해야하며, 3,14,20.
7. 모세 혈관 끝의 초점 자극
- 동맥에 대한 기준선이 확립되고 내피 기능이 평가되면 모세관 자극의 반응을 테스트하십시오.
- 유리 풀러를 사용하여 한쪽 끝에 미세한 지점이 있도록 캐뉼라를 만듭니다. 테스트 된 약물이 5 psi에서 팁을 원활하게 통과 할 수 있도록 캐뉼라에서 팁을 끊습니다.
- 관심있는 약물 용액으로 캐뉼라를 채우고 현미경에 부착 된 3 축 미세 조작체에 추가하십시오. 압력 배출 시스템에서 캐뉼라에 튜브를 연결합니다.
- 캐뉼라를 모세 혈관 근처의 욕조로 천천히 내리고 챔버의 용기 나 하드웨어의 일부를 치지 않도록주의하십시오. 캐뉼라 끝을 건드리지 않고 모세혈관 끝 옆에 있는 캐뉼라 끝을 조종합니다. 캐뉼라가 누출되면 용기가 자극되지 않도록 캐뉼라 끝을 커버슬립에서 막아두십시오.
- 모세 혈관을 자극 할 준비가되면 캐뉼라를 덮개 슬립과 모세 혈관 바로 옆에 낮춥습니다. 원하는 배출 시간(여기 20s)으로 압력 배출 시스템을 활성화합니다. 자극이 끝나면 추가 자극을 피하기 위해 캐뉼라를 약간 올립니다.
- 필요에 따라 자극을 반복하십시오. 압력 배출 시스템 캐뉼라를 변경하여 다른 약물 화합물을 테스트합니다.
- 모세 혈관만 자극되고 있는지 확인하려면 캐뉼라를 1 μM NS309 용액으로 채우고 위의 단계를 반복하십시오.
참고: 모세관 내피 세포는 NS309에 의해 활성화된K+ 채널을 발현하지 않으므로 아테리올은 자극에 반응하지 않아야 합니다. 동맥이 팽창하는 경우 캐뉼라를 재배치해야 하거나 구멍의 직경을 더 작아야 합니다(그림 2 A, B 및 대표 결과 섹션 참조).
결과
내피 소형 전도도 (SK) 및 중간 전도도 (IK) Ca2 +-민감한 K+ 채널은 PA의 직경에 경악영향을 미칩니다. 1 μM NS309의 목욕 적용, 합성 IK 및 SK 채널 작용제, 거의 최대 팽창 발생(그림 2A,B). 그러나, 모세관 내피 세포는 IK 및 SK 채널이 부족하고 NS30920에대한 반응으로 과분극화되지 않았다. 그 결과, 모세관을 자극하는 것은 초점 압력 배출(20s, 5 psi)에 의해 1 μM NS309로 끝나며 상류 동맥 팽창을 일으키지않았다(도 2A, B). 이러한 결과는 NS309가 HiCaPA 제제에서 동맥에 도달하지 못했고 압력 배출에 의해 모세혈관에 가해지는 화합물의 공간 적 제한을 평가하는 대조군으로서 사용될 수 있음을 나타낸다.
이 준비는 모세 혈관에서 PA로의 내부 전기 신호 측정을 위해 근본적으로 설계되었습니다. HiCaPA 제제를 사용하여, 우리는 모세관 말단에 10 mMK +를 포함하는 aCSF를 적용하고 우리가 이전에 피질 혈관 구조20에서CaPA 준비에서 했던 것과 같이 상류 동맥 팽창(그림 2A, C)을측정했습니다. 우리는 HiCaPA 준비를 사용하여 여성 마우스에 있는 우리의 지식, 모세관-arteriole 전기 신호에 처음으로, 조사했습니다. 10 mM K+를 가진 모세관 자극에 의해 유발된 동맥 팽창은 수컷 및 암컷 마우스로부터의 제제 사이에 다르지않았다(도 2A,C).
마지막으로,이 접근법의 또 다른 근본적인 이점은 모세관 자극 전에 목욕에 약리학적 도구를 적용 할 수있는 가능성입니다. 여기서 우리는 ML133, 최근에 개발 된 Kir2 억제제(28)의효과를 테스트했다. 목욕 관류에 10 μM ML133을 첨가하여 수컷 및 암컷 마우스 둘 다로부터 HiCaPA 제제에서 10 mMK+에 반응하여 모세관 유도 동맥 팽창을 사실상 폐지하였다(도2A,C). 이 마지막 결과는 Kir2.1 채널이 우리가 이전에 남성 두뇌의 피질 미세 순환에서 설명한 대로 여성 대뇌 혈관구조에 있는 전기 신호를 중재한다는 것을 건의합니다.
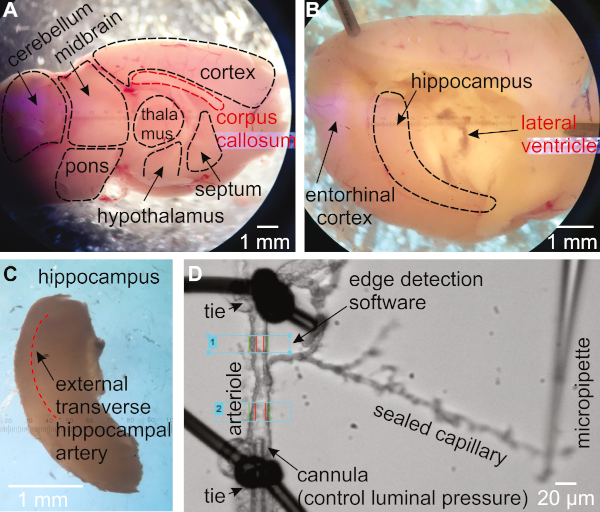
그림 1: 마우스로부터의 해마 모세관-자영동맥(HiCaPA) 제제의 분리 및 가압을 위한 방법론. (A)새로 고립된 뇌는 시상면에서 반으로 자른 후, 간구체 균열을 따라 내측을 위로 향하게 한다. (B)시상, 중격 및 시상 하부가 부드럽게 제거되어 해마를 드러냅니다. (C)해마를 조심스럽게 제거합니다. (D)모세관을 가진 동맥은 해마로부터 분리되고 동맥 분절의 한쪽 끝은 가압 시스템에 연결된 마이크로파이펫으로 캐뉼되고, 다른 쪽 끝은 폐색된다. 모세관 끝은 유리 파이펫 끝으로 커버 슬립에 대해 밀봉되고 유지됩니다. 내부 직경은 arteriole의 하나 또는 여러 영역에서 에지 검출 시스템으로 모니터링됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 1 μM NS309를 가진 모세혈관의 초점 자극은 10 mM K+를포함하는 aCSF를 가진 자극과는 달리 상류 동맥 직경에 영향을 미치지 않습니다. (a)1 μM NS309의 목욕 적용 효과를 나타내는 상류 동맥 직경의 대표적인 기록과 1 μM NS309및 Kir2 채널 억제제 ML133의 부재 또는 존재 시 10 mMK+를 함유하는 aCSF를 가진 연속적인 모세관 말단 자극(20s, 5psi)을 나타냈다. 모세혈관상에 10 mMK+를 적용하여 10 μM ML133에 의해 차단된 신속한 상류 동맥 팽창을 일으켰다. NS309는 팽창을 일으키지 않았습니다. NS309를 가진 모세관 자극에 응하여 상류 동맥 팽창의 부재는 압력 방출화합물이 동맥에 도달하지 않는다는 것을 보여줍니다. (b)욕조 또는 모세관 말단에 적용된 1 μM NS309에 의해 유도된 직경 변화를 나타내는 요약 데이터(n = 14; ****p < 0.0001, 쌍을 이루는 t-검정). (C)10 mM K+에 의해 유도된 동맥 직경 변화를 보여주는 요약 데이터는 수컷(n=6) 또는 암컷(n=8) 마우스로부터 HiCaPA 제제에서 모세혈관에 직접 적용하여 10 μM ML133 전후에 목욕에 적용하였다(***p < 0.0005, n.s. = 중요하지 않은, 미짝 t-test). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 원고에 기재된 가압 HiCaPA(해모세혈관-자영형 동맥) 제제는 중증 모낭 동맥 을 분리, 가압 및 연구하기 위한 당사의 잘 확립된 절차의 연장체이다29. 최근 뇌 모세관 내피 세포에서 Kir2.1 채널이 신경 활성화와 관련된 [K+]o에서 감각이 증가하고, 상류 동맥20을팽창시키는 오름차순 과극성 신호를 생성한다고 보고하였다. 모세 혈관에 대한 이전에 예기치 않은 역할을 밝히는 것은 부분적으로 피질 미세 순환20,21에서CaPA 준비를 개발함으로써 가능했습니다. 이 원고는 유사한 실험 적인 접근을 제시하지만 신경 혈관 커플링 동안 모세관 - 동맥 신호를 조사하기 위해 간단하고 재현 가능한 접근 방식을 설명하기 위해 마우스 뇌의 더 깊고 제한된 구조에서.
뇌 미세 순환은 정교하게 깨지기 쉽고 특정 관행, 특히 혈관의 스트레칭과 취급을 최소화하는 데 사용되어야 관절과 모세 혈관의 생존을 보장해야합니다. 근생 톤의 자발적인 발달은 준비의생존가능성30의첫 번째 지표이다. 내피 기능은 다음 목욕 용액에 SK와 IK 채널의 주작동근 NS309를 추가하여 평가 될 수있다, 이는 거의 최대 팽창을 야기한다. NS309의 목욕 적용에 대한 톤 이나 반응을 개발하지 못하는 경우, 제제는 다른 것으로 대체되어야한다. NS309는 또한 초점 모세관 자극의 확산을 시험하기 위하여 이용됩니다. 모세관 내피 세포는 SK 및 IK채널(20)이부족하기 때문에, NS309를 압력 배출에 의한 모세혈관에 국소 전달하는 것은 도 2에도시된 바와 같이 상류 동맥 직경에 영향을 미치지 않아야 하며, 화합물이 실수로 동맥을 자극하지 않는다는 것을 보여 주었습니다. 이러한 단계가 검증되면 모세관 간 신호 신호를 테스트할 수 있습니다.
여기에서 우리는 10 mM K+를포함하는 aCSF를 가진 모세혈관을 자극하여 전기 신호를 검토했습니다. 그러나, 다른 신호 양식은 다른 공지된 혈관 활성제 또는 신경 전달 물질을 가진 모세혈관을 자극해서 본 접근을 사용하여 탐구될 수 있다. 이 준비의 또 다른 이점은 조사하고 결국 다른 동물 사이 그리고 다른 두뇌 지구 사이 NVC를 비교하는 가능성입니다. 이것은 뇌가 뇌혈관 병리학31,32에의해 균일하게 표적으로 하지 않기 때문에 특히 흥미롭습니다. 여기에 제시된 접근법의 일반적인 제한은 미세 순환을 분리함으로써 뉴런 및 성상 세포와 같은 신경 혈관 단위의 중요한 구성 요소가 손실된다는 것입니다. 생체 내 CBF 이미징을 위한 두개골 창과 같은 다른 제제는 손상되지 않은 신경 혈관 단위의 구조를 유지하고 손상되지 않은 시스템에서 NVC를 연구하는 것이 더 적절하다. 그러나 두개골 창 준비에서, 실치 동맥은 다광자 현미경과 같은 특정 장비없이 이미지하기가 어렵고, 해마와 같은 더 깊은 영역은 이미지화하기가 어렵습니다. 이와 관련하여, 뇌 슬라이스에서 근생 톤을 유도하기 위해 발광 흐름을 사용하여 필로사 실험실에서 개발된 접근법은 뇌 슬라이스와 생체 내 접근법33사이의 우아한 링크를 나타낸다. 그러나, 주변 신경 조직은 국순하게 적용된 약의 침투를 제한할 수 있고, 몇몇 세포 모형이 약에 드러내기 때문에 그것의 오프 표적 잠재력을 증가하고 해석을 어렵게 만듭니다. 우리는 주로 이러한 잠재적 인 문제를 해결하기 위해 생체 내 접근 방식을 개발했습니다. 결론적으로, NVC를 완전히 연구하기 위해 여러 가지 접근법을 함께 사용해야 합니다.
요약하면, 본 보고서는 약리학 및 생물학적 제제의 효과를 모세관-arteriole 연속체를 따라 이산 위치에서 기능적 매개 변수에 대해 테스트할 수 있도록 가압된 해마 동맥 및 모세혈관의 생체 내 전적 전모를 설명합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 원고에 대한 통찰력있는 의견에 줄스 모린에게 감사드립니다. 이 연구는 CADASIL 함께 우리는 희망 비영리 단체, 여성 건강 및 연구 센터, NHLBI R01HL136636 (FD)에서 상에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
참고문헌
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유