Method Article
機能的研究のためのEx Vivo加圧海馬毛細血管-パンレンキマル動脈製剤
要約
本原稿では、海馬動脈と毛細血管をマウス脳から分離する方法と、圧力ミオグラフィー、免疫蛍光、生化学、分子研究のためにそれらを加圧する方法について詳しく説明している。
要約
微妙な行動変化から後期型認知症まで、血管認知障害は典型的には脳虚血の後に発症する。脳卒中と心停止は著しく性的に二形性疾患であり、どちらも脳虚血を誘発する。しかしながら、血管認知障害を理解し、その後性特異的な治療法を開発する進歩は、機能研究におけるマウスモデルからの脳微小循環の調査における課題によって部分的に制限されている。ここでは、マウス脳からの生体内海馬毛細血管-毛細血管-毛細血管-毛細血管-毛細血管性動脈(HiCaPA)製剤における毛細血管から動脈へのシグナル伝達を調べるアプローチを提示する。毛細血管刺激に応じて動脈径を測定するために微小循環を分離、カニューレート、加圧する方法について説明する。我々は、HiCaPA調製完全性を検証し、神経血管カップリング剤としてのカリウムの試験および最近特徴付けられたキル2内向き整流カリウムチャネルファミリーML133の効果を含む典型的な結果を表示するために使用できる適切な機能制御を示す。また、雄マウスと雌マウスから得られた調製物中の応答を比較する。これらのデータは機能的な調査を反映していますが、分子生物学、免疫化学、電気生理学の研究にも活用できます。
概要
脳表面の膜循環は、実験的なアクセシビリティの一部で、多くの研究の対象となっています。しかし、脳血管系のトポロジーは、異なる領域を作成します。血流をリダイレクトするための実質的な能力を有するアナストモーゼに富む堅牢な膜ネットワークとは対照的に、脳内性脳静脈内動脈(P)は限られた側頭供給を有し、それぞれが神経組織1、2の離散体積を透過する。これは、独特の生理学的特徴3、4、5、6、7、8と組み合わせることで、脳内動脈を脳血流(CBF)調節9、10にする血流にボトルネック効果を生じる。PAの分離およびカンギュレーションに固有の技術的な課題にもかかわらず、過去10年間は、加圧容器11、12、13、14、15、17を使用したex vivo機能研究への関心が高まっています。この関心の高まりの理由の一つは、神経血管カップリング(NVC)に対して行われたかなりの研究努力であり、脳機能性充血18を支持するメカニズムである。
地域的には、CBFは局所神経活性化19に続いて急速に増加することができる。NVCを制御する細胞機構およびシグナル伝達特性は不完全に理解されている。しかし、神経活動を感知し、上流動脈20、21、22を拡張する過分極電気信号に変換する際に、NVC中の脳毛細血管に対する予想外の役割を同定した。作用電位23、24および大導電Ca2+活性化K+(BK)チャネルの星腸エンドフィート25上の大導電率Ca2+活性化K+(BK)チャネルの開口部は、間質カリウムイオン濃度[K+]oを増加させ、その結果、毛細血管の血管内皮における強い内向き整流K+(Kir)チャネルの活性化をもたらす。このチャネルは、外部K+だけでなく、高分極自体によって活性化されます。ギャップ接合部を介して広がる、過分極電流は、その後、動脈まで隣接する毛細血管内皮細胞で再生し、そこで筋細胞弛緩およびCBF増加20、21を引き起こす。このメカニズムの研究は、血管活性剤による毛細血管刺激中に動脈径を測定するための加圧毛細血管-パン酸動脈(CaPA)製剤を開発することにつながりました。CaPA調製物は、無傷の下流の毛細血管の影響を有するカニューレ化された脳内動脈セグメントで構成される。毛細血管端部は、マイクロピペットによってチャンバーガラス底部に対して圧縮され、血管形成全体を閉塞し安定化させる20、21である。
我々は以前、マウス扁桃体13および海馬13、17からマウス皮質20、21および動脈からのCaPA製剤をイメージングすることによって器械的な革新を行った。海馬血管系は病理学的状態に対する感受性から注目を集める中、機能的NVC研究のみならず、分子生物学、免疫化学、電気生理学においても使用できるマウス海馬(HiCaPA)からのCaPA調製方法を段階的に提供します。
プロトコル
すべての実験は、コロラド大学アンシュッツメディカルキャンパスの制度動物ケア利用委員会(IACUC)によって承認され、国立衛生研究所のガイドラインに従って行われました。
1. ソリューション
- 解剖のためにMOPS緩衝生理行を使用し、サンプルを使用する前に4°Cに保ちます。溶液にガスを入ないでください。次の組成でMOPS緩衝生理食合を準備する: 135 mM NaCl, 5 mM KCl, 1 mMKH 2PO4, 1 mM MgSO4, 2.5 mM CaCl2, 5 mM グルコース, 3 mM MOPS, 0.02 mM EDTA, 2 mM ピルビン酸, 10 mg/mL ウシ血清アルブミン, pH 7.3 °C.
- 人工脳脊髄液(aCSF)を浴用液およびピペット溶液として使用してください。ガスaCSFとCa2+-フリーaCSFの両方で、5%CO2、20%O2、N2バランスを有します。125 mM NaCl、3 mM KCl、26 mM NaHCO 3、1.25 mMNaH2PO4、1mM MgCl2、4mM グルコース、2 mM CaCl2、pH 7.3 (5% CO2、20%O2、および N2バランスで通気)を使用して溶液を準備します。
- 公称 Ca2+-フリー aCSF (0 mM [Ca2+]o,5 mM EGTA) で最大膨張を得る。
2. 臓器室の準備
- ホウケイ酸ガラスキャピラリー(外径= 1.2mm、内径=0.69mm、長さ=10cm)をガラスプーラーに挿入します。毛細管を引っ張って、一方の端に細い長い先端を作ります。
- チャンバーの片側に、ミニチュア蠕動ポンプに接続できるカニューレを追加して、容器を明るく加圧します。解剖顕微鏡の下で、カニューレの先端を折って、目的の血管に合うほど小さいが、溶液が先端を流れるように十分な大きさになるようにする。先端の直径が約10~15μmであることを確認します。
- 酸素化されたaCSFを備えた0.22μmフィルターを付けたシリンジを使用してカニューレを充填します。カニューレに気泡や破片がないことを確認します。
- チャンバーの反対側にカニューレを2つ追加します。彼らのヒントを壊しないでください。
3. 海馬の解剖と隔離
- マウスを安楽死させ、首を切る。この実験では、8週齢のC57BL6/Jマウスを使用して、男性と女性の違いを比較します。ペントバルビタールでマウスを注入し、外科的なはさみで切断します。
- 小さな解剖はさみを使用して、頭の上部の中間線に沿って皮膚をカットします。スキンを側面に移動します。
- 頭蓋骨の大胆な側面から始めて、嗅球に達するまで中線に沿って頭蓋骨を切断します。大脳が露出するまで頭蓋骨の一部を取り除く。
- ゆっくりと脳を取り除き、マウスの鼻の近くから始めます。小さな解剖はさみで構造を切り取ることによって、嗅球、脳神経、脊髄から脳を分離します。
- 完全に水没するのに十分なMOPS溶液を持つ解剖プレートに脳を配置します。解剖顕微鏡を使用して、腹部を下に向けた解剖プレートの中央に脳を配置します。
- カミソリの刃を使って、縦の裂け目に沿って脳を半分に切ります。鋭いエッジが解剖プレートの底部に平行になるようにブレードを保持します。1回のストロークで脳を通してブレードを押します。1 つの半球をプレートの側面に移動します。
- 各半球に対して、個別に、または並列に、次の手順を実行します。
- 中線が下を向いているように、プレートの中央に 1 つの半球を配置します。その後、かみそりの刃を使用して横裂けに沿って切断し、小脳と脳幹を除去します。ブレードを組織にまっすぐ押し込みます。
- 半球を回転させて、内側の側が上を向きになるようにします(図1A)。脳を所定の場所に保持するために1つのへらを使用してください。2番目のへらを使用して、海馬を覆う視床、中隔、視床下部を取り除くために、脳梁と下のスクープの下に先端を挿入します(図1B)。
- 海馬が大脳の後側付近の曲線構造として見えるようにします。1つのへらを使って大脳を所定の場所に保持し、2番目のへらを使って海馬を大脳からすくい出す(図1C)。
- 海馬をMOPS溶液で約半分に満たされた新しい解剖板に移します。脳の残りの部分を破棄します。
4. 海馬動脈分離
- 海馬ごとに次の手順を実行します。
- セクションの両端に小さなピンを使用して、海馬の1つをピンダウンします。海馬動脈は上を向いている。
- 非常に鋭い鉗子を使用して、海馬の小さなセクションを穏やかに伸ばす。これは動脈を取り巻く組織を緩め、解剖しやすくなる。
- 後部海馬組織を探索して、外部横動脈を同定する(図1C)16、27。
- 外部の横動脈を穏やかにつかみ、ゆっくりと組織から引き離して、海馬のCA3領域を貫通する動脈および毛細血管を収集する。
- 組織から取り出す血管がなくなったら、海馬を捨てる。使用していない間、容器を氷の上に置いてください。
5. 海馬毛細血管-毛細血管-毛細血管カンナリカンス
- 毛細血管で終わる枝を持つ動脈を見つける。オルガン室に移します。動脈が完全に拡張されたとき、動脈が約15〜30μmであることを確認してください(図1D)。
- カニューレの先端を標的領域の下の動脈壁に押し込んで慎重に血管を取り付けます。ネクタイを置くのに十分な組織ができるまで、容器をカニューレに慎重にスライドさせます。
- 血管とカニューレにフィットするように、12-0ナイロン縫合糸で緩い結び目を作ります。ハーフヒッチノットを使用して、ネクタイを固定します。その後、結び目を引き締め、カニューレに動脈を固定するために端を引っ張ります。力でそっと引っ張って、ネクタイの下にある余分な容器の枝を取り除きます。
- 別のネクタイを作り、それを密封するために動脈の反対側にそれを固定します。
- チャンバーの底面のカバースリップに対して平らになるまで、付属の容器でカニューレを下ろします。カニューレを下げすぎないように気をつけてください。
- チャンバーの反対側にカニューレを1つ使用し、その点が動脈の端のネクタイを固定するように下げます。
- 3番目のカニューレを使用して、キャピラリーブランチをカバースリップに固定します。先端を枝の端近くに置き、毛細血管の端部を露出したままにします(カニューレの下ではなく)。
6. 圧力ミオグラフィー
- チャンバーを解剖スコープから記録ソフトウェアで顕微鏡に移動します。
- 流入管と流出管をチャンバーに接続して灌流します。4 mL/minの流量で加熱されたaCSF(37°)で灌流を開始します。
- 加圧カニューレを圧力トランスデューサと組み合わせた蠕動ポンプに取り付け、内圧を20mm Hgにします。
- 記録ソフトウェアを起動します。顕微鏡とイメージングの設定を調整して、可能な限り鮮明な画像を実現します。検出ソフトウェア用に設定が最適化されたら、記録を開始します。
- エッジ検出ソフトウェアで動脈径を記録しながら、容器の圧力を最大40mm Hgまで高めます。
- aCSFで室内からMOPS溶液を洗浄し、HiCaPAの調製物を平衡化し、筋原性トーンを開発するために〜15-20分を許可します。
- 容器の生存率をテストするには、1 μM NS309溶液を浴灌流に塗布します(図2A,Bおよび代表的な結果セクションを参照)。動脈セグメントは、前に説明したように約30〜40%の筋原性トーンを示す拡張しなければならない。
7. 毛細血管端部の焦点刺激
- 動脈のベースライントーンが確立され、内皮機能が評価されたら、毛細血管刺激の応答をテストする。
- ガラスのプラーを使用して、一方の端に細かい点があるようにカニューレを作ります。テストされた薬物が5 psiで滑らかに先端を流ることができるように、カニューレの先端を断ち切ります。
- 目的の薬剤溶液でカニューレを充填し、顕微鏡に取り付けた3軸マイクロマニピュレータに追加します。圧力放出システムからカニューレにチューブを接続します。
- カニューレを毛細血管の近くの浴室にゆっくりと下ろし、容器やハードウェアの一部を室内にぶつけないように注意してください。毛細血管の端の横にあるカニューレの先端を触らずに操縦する。カニューレが漏れた場合に血管が刺激されるのを防ぐために、カニューレの先端をカバースリップから外しておきます。
- 毛細血管を刺激する準備ができたら、カニューレをカバースリップに下げ、毛細血管のすぐ隣に下げます。目的の射出時間(ここでは 20 s)で圧力吐出システムをアクティブにします。刺激が終わったら、カニューレを少し上げて刺激を避ける。
- 必要に応じて刺激を繰り返します。異なる薬物化合物をテストするために圧力排出システムカニューレを変更します。
- 毛細血管のみが刺激されていることを確認するには、カニューレに1μM NS309溶液を充填し、上記の手順を繰り返します。
注:毛細血管内皮細胞はNS309によって活性化されたK+チャネルを発現しないので、動脈は刺激に反応してはならない。動脈が拡張する場合は、カニューレを再配置するか、穴の直径を小さくする必要があります(図2A、Bおよび代表的な結果セクションを参照)。
結果
内皮小導電率(SK)および中間導電率(IK)Ca2+感受性K+チャネルは、CAの直径に拡張的な影響を及ぼす。合成IKおよびSKチャネルアゴニストである1μM NS309の浴適用は、最大膨張に近い原因となった(図2A,B)。しかし、毛細血管内皮細胞はIKおよびSKチャネルを欠き、NS30920に応答して過分極を行わなかった。その結果、焦点圧放出による1μM NS309(20s,5psi)による刺激毛細血管末端は上流動脈拡張を引き起こさなかった(図2A,B)。この結果は、NS309がHiCaPA製剤中の動脈に到達しておらず、圧力放出によって毛細血管に適用される化合物の空間的制限を評価する制御として使用できることを示している。
この調製は、毛細血管からPAへの内部電気信号の測定のために基本的に設計されました。HiCaPA調製物を用いて、10mM K+を含むaCSFを毛細血管端端に塗布し、皮質血管系20から以前に行ったように上流動脈拡張(図2A,C)を測定した。その後、HiCaPA製剤を用いた雌マウスにおける毛細血管から動脈への電気シグナル伝達を初めて調査した。10mMK+による毛細血管刺激によって誘発される動脈拡張は、男性マウスと雌マウスとの調製物との間で異ならなかった(図2A,C)。
最後に、このアプローチのもう一つの基本的な利点は、毛細血管刺激の前に風呂に薬理学的ツールを適用する可能性です。ここではML133の効果を試験し、最近開発されたKir2阻害剤28.男性マウスと雌マウスの両方からHiCaPA製剤中の10mM K+に応答して、浴灌流に10μM ML133を事実上廃止した毛細血管誘発動脈拡張を加える(図2A,C)。この最後の結果は、Kir2.1チャネルが、男性脳の皮質微小循環で前述したように、女性の脳血管系における電気信号を媒送することを示唆している。
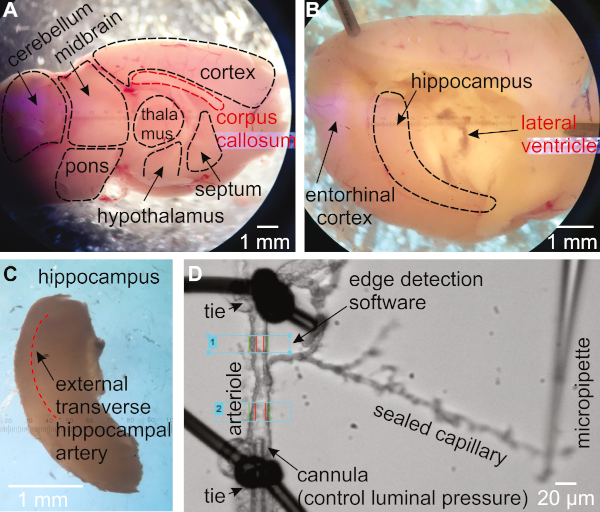
図1:海馬毛細血管-毛細血管-毛細血管(HiCaPA)製剤のマウスからの分離および加圧のための方法論。(A)新鮮に孤立した脳は、破膜裂傷に続いて矢状面で半分に切断され、内側側を上に向けて置かれる。(B) 視床、中隔、視床下部を穏やかに除去し、海馬を明らかにする。(C) 海馬は慎重に除去される。(D)毛細血管を有する動脈は海馬から単離され、動脈遮断体セグメントの一端は加圧システムに接続されたマイクロピペットでカニューリンされ、もう一方の端は閉塞する。キャピラリーの端は密封され、ガラスピペットの先端のカバースリップに対して維持される。内径は動脈の1つまたは複数の領域のエッジ検出システムによって監視される。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:1μM NS309を有する毛細血管の焦点刺激は、10mMK+を含むaCSFを有するaCSFとは異なり、上流動脈径に影響を及ぼさない。(A)上流動脈径の代表的な記録は、1μM NS309の浴適用の効果を示し、続いて連続した毛細血管端刺激(20s、5 psi)を1μM NS309と、Kir2チャネル阻害剤ML133の存在下で10mMK+を含むACSFを有する。10 mM K+オントキャピラリーの適用は、10 μM ML133 によってブロックされた急速な上流動脈拡張を生成しました。NS309は膨張を引き起こさなかった。NS309による毛細血管刺激に応答する上流動脈拡張の欠如は、圧力噴出化合物が動脈に到達しないことを示す。(B)浴中または毛細血管端に塗布された1μM NS309によって誘発される直径変化を示す要約データ(n=14;****p<0.0001、対対t検定)。(C)10mMK+によって誘発された動脈径変化を示す要約データは、10μM ML133の前後のヒト(n=6)またはメス(n=8)からHiCaPA製剤の毛細血管に直接塗布し、浴中に塗布した(***p< 0.0005、n.s.=非有意性、対比しないt検定)。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本原稿に記載されている加圧されたHiCaPA(海馬毛細血管-パンレンキマル動脈)製剤は、分極化、加圧、および研究性の高い動脈29を分離、加圧、および研究するための確立された手順の延長である。我々は最近、脳毛細血管内皮細胞におけるKir2.1チャネルが神経活性化に関連する[K+]oにおいて感覚が増加し、上流動脈20を拡張する昇順の高い偏光シグナルを生成することを報告した。毛細血管に対するこの予想外の役割を明らかにすることは、皮質微小循環20、21からのCaPA調製物を開発することによって部分的に可能であった。この原稿は、同様の実験的アプローチを提示するが、マウス脳のより深く、より制限された構造から、神経血管結合中に毛細血管から動脈へのシグナル伝達を調査するための単純かつ再現可能なアプローチを記述する。
脳の微小循環は絶妙に脆弱であり、特定の慣行、特に血管の伸張および取り扱いを最小限に抑え、動脈および毛細血管の生存を確実にするために使用されなければならない。筋原性トーンの自発的な発達は、調製物の生存率30の最初の指標である。内皮機能は、SKおよびIKチャンネルのアゴニストNS309を浴溶液に加えることで評価することができ、これはほぼ最大膨張を引き起こすはずです。NS309の入浴アプリケーションに対するトーンまたは応答を開発できなかった場合、準備は別のものに置き換える必要があります。NS309はまた、焦点毛細血管刺激の広がりをテストするために使用されます。毛細血管内皮細胞はSKおよびIKチャネル20を欠いているので、圧力放出による毛細血管へのNS309の局所送達は、図2に示すように上流動脈径に影響を及ぼさないはずであり、化合物が誤って動脈を刺激しないことを示す。これらのステップが検証されると、毛細血管から動脈へのシグナル伝達をテストすることができます。
ここでは、10mM K+を含むaCSFで毛細血管を刺激することにより電気信号を調べた。しかしながら、異なるシグナル伝達様式は、異なる既知の血管活性剤または神経伝達物質を有する毛細血管を刺激することによって、本アプローチを用いて探索することができる。この調製のもう一つの利点は、調査し、最終的に異なる動物間および異なる脳領域間のNVCを比較する可能性です。脳が脳血管病理31、32によって均一に標的化されていないため、これは特に興味深い。ここで提示されるアプローチの一般的な制限は、微小循環を分離することによって、ニューロンおよびアストロサイトなどの神経血管ユニットの重要な構成要素が失われるということである。生体内CBFイメージングのための頭蓋窓のような他の製剤は、無傷の神経血管ユニットの構造を維持し、無傷のシステムでNVCを研究するためにより適切である。しかし、頭蓋窓の準備では、多光子顕微鏡のような特定の装置なしでは、毛体動脈を画像化することは困難であり、海馬のようなより深い領域は画像化が困難なままである。この点に関して、脳スライスに筋原性トーンを誘導する発光流を用いてフィローザ研究室で開発されたアプローチは、脳スライスとインビボアプローチ33との間のエレガントなリンクを表す。しかし、周囲の神経組織は、局所的に適用される薬物の浸透を制限し、そのオフターゲット電位を増加させ、いくつかの細胞タイプが薬物にさらされるので、解釈を困難にする。私たちは主に、これらの潜在的な問題に対処するために、ex vivoアプローチを開発しました。結論として、NVCを完全に研究するには、複数のアプローチを組み合わせて使用する必要があります。
要約すると、本報告書は、加圧された海馬動脈および毛細血管のex vivo無傷の調製について説明し、薬理学的および生物学的薬剤の効果を毛細血管-動脈-動脈連続体に沿った離散位置で機能的パラメータ上で試験することを可能にする。
開示事項
著者たちは何も開示する必要はない。
謝辞
著者たちは、原稿に関する洞察力に満ちたコメントをジュール・モリンに感謝したいと思います。この研究は、CADASIL Together Have Hope非営利団体、女性の健康と研究センター、NHLBI R01HL136636(FD)からの賞によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22µm Syringe Filters | CELLTREAT Scientific Products | 229751 | |
| 12-0 Nylon (12cm) Black | Microsurgery Instruments, Inc | S12-0 NYLON | |
| Automatic Temperature Controller | Warner Instruments | TC-324B | |
| Borosilicate Glass O.D.: 1.2 mm, I.D.: 0.68 mm | Sutter Instruments | B120-69-10 | |
| Bovine serum albumin | Sigma-Aldrich | A7030 | |
| CaCl2 dihydrate | Sigma-Aldrich | C3881 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| Dissection Scope | Olympus | SZ11 | |
| ECOLINE VC-MS/CA 4-12 — complete Pump with Drive and MS/CA 4-12 pump-head | Ismatec | ISM 1090 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-09 | |
| Inline Water Heater | Warner Instruments | SH-27B | |
| Integra™ Miltex™Tissue Forceps | Fisher Scientific | 12-460-117 | |
| KCl | Sigma-Aldrich | P9333 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | |
| MgCl Anhydrous | Sigma-Aldrich | M8266 | |
| Micromanipulator | Narishige | MN-153 | |
| ML 133 hydrochloride | Tocris | 4549 | |
| MOPS | Sigma-Aldrich | M1254 | |
| NaCl | Sigma-Aldrich | S9625 | |
| NaH2PO4 | Sigma-Aldrich | S9638 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NS309 | Tocris | 3895 | |
| Picospritzer III - Intracellular Microinjection Dispense Systems, 2-channel | Parker Hannifin | 052-0500-900 | |
| Pressure Servo Controller with Peristaltic Pump | Living Systems Instrumentation | PS-200 | |
| Sodium pyruvate | Sigma-Aldrich | P3662 | |
| Super Fine Forceps | Fine Science Tools | 11252-20 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Vertical Micropipette Puller | Narishige | PP-83 |
参考文献
- Nishimura, N., Schaffer, C. B., Friedman, B., Lyden, P. D., Kleinfeld, D. Penetrating arterioles are a bottleneck in the perfusion of neocortex. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 365-370 (2007).
- Shih, A. Y., et al. Robust and fragile aspects of cortical blood flow in relation to the underlying angioarchitecture. Microcirculation (New York, N.Y.:1994). 22 (3), 204-218 (2015).
- Cipolla, M. J., Smith, J., Kohlmeyer, M. M., Godfrey, J. A. SKCa and IKCa Channels, Myogenic Tone, and Vasodilator Responses in Middle Cerebral Arteries and Parenchymal Arterioles: Effect of Ischemia and Reperfusion. Stroke. 40 (4), 1451-1457 (2009).
- Nystoriak, M. A., et al. Fundamental increase in pressure-dependent constriction of brain parenchymal arterioles from subarachnoid hemorrhage model rats due to membrane depolarization. AJP: Heart and Circulatory Physiology. 300 (3), H803-H812 (2011).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circulation Research. 110 (2), 285-294 (2012).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation (New York, N.Y.:1994). 20 (4), 307-316 (2013).
- Cipolla, M. J., et al. Increased pressure-induced tone in rat parenchymal arterioles vs. middle cerebral arteries: role of ion channels and calcium sensitivity. Journal of Applied Physiology. 117 (1), 53-59 (2014).
- De Silva, T. M., Modrick, M. L., Dabertrand, F., Faraci, F. M. Changes in Cerebral Arteries and Parenchymal Arterioles with Aging: Role of Rho Kinase 2 and Impact of Genetic Background. Hypertension. 71 (5), 921-927 (2018).
- Shih, A. Y., et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit. Nature Neuroscience. 16 (1), 55-63 (2013).
- Koide, M., et al. The yin and yang of KV channels in cerebral small vessel pathologies. Microcirculation (New York, N.Y.:1994). 25 (1), (2018).
- Girouard, H., et al. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proceedings of the National Academy of Sciences of the United States of America. 107 (8), 3811-3816 (2010).
- Dabertrand, F., et al. Prostaglandin E2, a postulated astrocyte-derived neurovascular coupling agent, constricts rather than dilates parenchymal arterioles. Journal of Cerebral Blood Flow & Metabolism. 33 (4), 479-482 (2013).
- Longden, T. A., Dabertrand, F., Hill-Eubanks, D. C., Hammack, S. E., Nelson, M. T. Stress-induced glucocorticoid signaling remodels neurovascular coupling through impairment of cerebrovascular inwardly rectifying K+ channel function. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7462-7467 (2014).
- Dabertrand, F., et al. Potassium channelopathy-like defect underlies early-stage cerebrovascular dysfunction in a genetic model of small vessel disease. Proceedings of the National Academy of Sciences of the United States of America. 112 (7), E796-E805 (2015).
- Pires, P. W., Sullivan, M. N., Pritchard, H. A. T., Robinson, J. J., Earley, S. Unitary TRPV3 channel Ca2+ influx events elicit endothelium-dependent dilation of cerebral parenchymal arterioles. AJP: Heart and Circulatory Physiology. 309 (12), H2031-H2041 (2015).
- Johnson, A. C., Cipolla, M. J. Altered hippocampal arteriole structure and function in a rat model of preeclampsia: Potential role in impaired seizure-induced hyperemia. Journal of Cerebral Blood Flow & Metabolism. 37 (8), 2857-2869 (2016).
- Johnson, A. C., Miller, J. E., Cipolla, M. J. Memory impairment in spontaneously hypertensive rats is associated with hippocampal hypoperfusion and hippocampal vascular dysfunction. Journal of Cerebral Blood Flow & Metabolism. , (2019).
- Iadecola, C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 96 (1), 17-42 (2017).
- Roy, C. S., Sherrington, C. S. On the Regulation of the Blood-supply of the Brain. The Journal of Physiology. 11 (1-2), 85-158 (1890).
- Longden, T. A., et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow. Nature Neuroscience. 20 (5), 717-726 (2017).
- Harraz, O. F., Longden, T. A., Dabertrand, F., Hill-Eubanks, D., Nelson, M. T. Endothelial GqPCR activity controls capillary electrical signaling and brain blood flow through PIP2 depletion. Proceedings of the National Academy of Sciences of the United States of America. 115 (15), E3569-E3577 (2018).
- Harraz, O. F., Longden, T. A., Hill-Eubanks, D., Nelson, M. T. PIP2 depletion promotes TRPV4 channel activity in mouse brain capillary endothelial cells. eLife. 7, 351(2018).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Ballanyi, K., Doutheil, J., Brockhaus, J. Membrane potentials and microenvironment of rat dorsal vagal cells in vitro during energy depletion. The Journal of Physiology. 495 (Pt 3), 769-784 (1996).
- Filosa, J. A., et al. Local potassium signaling couples neuronal activity to vasodilation in the brain. Nature Neuroscience. 9 (11), 1397-1403 (2006).
- Attwell, D., et al. Glial and neuronal control of brain blood flow. Nature. 468 (7321), 232-243 (2010).
- Coyle, P. Vascular patterns of the rat hippocampal formation. Experimental Neurology. 52 (3), 447-458 (1976).
- Wang, H. R., et al. Selective inhibition of the K(ir)2 family of inward rectifier potassium channels by a small molecule probe: the discovery, SAR, and pharmacological characterization of ML133. ACS Chemical Biology. 6 (8), 845-856 (2011).
- Pires, P. W., Dabertrand, F., Earley, S. Isolation and Cannulation of Cerebral Parenchymal Arterioles. Journal of Visualized Experiments. (111), 1-11 (2016).
- Bayliss, W. M. On the local reactions of the arterial wall to changes of internal pressure. The Journal of Physiology. 28 (3), 220-231 (1902).
- Montagne, A., et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 85 (2), 296-302 (2015).
- Zhang, X., et al. Circulating heparin oligosaccharides rapidly target the hippocampus in sepsis, potentially impacting cognitive functions. Proceedings of the National Academy of Sciences of the United States of America. 116 (19), 9208-9213 (2019).
- Kim, K. J., Filosa, J. A. Advanced in vitro approach to study neurovascular coupling mechanisms in the brain microcirculation. The Journal of Physiology. 590 (7), 1757-1770 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved