Method Article
Avaliação da migração do linfócito em um sistema de transmigração ex vivo
Neste Artigo
Resumo
Neste protocolo, os linfócitos são colocados na câmara superior de um sistema de transmigração, separados da câmara inferior por uma membrana porosa. A quimiocina é adicionada à câmara inferior, o que induz a migração ativa ao longo de um gradiente de quimiocina. Após 48 h, os linfócitos são contados em ambas as câmaras para quantificar o transmigration.
Resumo
Neste documento, apresentamos um método eficiente que pode ser executado com habilidades e materiais laboratoriais básicos para avaliar o movimento quimiocineítico do linfócito em um sistema de transmigração ex vivo. As pilhas lymphoid inata do grupo 2 (ILC2) e as pilhas do ajudante de CD4+ T foram isoladas dos baços e dos pulmões do ovalbumina do ovo da galinha (óvulos)-desafiaram ratos de Balb/c. Nós confirmamos a expressão de CCR4 em pilhas de T CD4+ e em ILC2, comparativamente. CCL17 e CCL22 são os ligantes conhecidos para CCR4; Conseqüentemente, usando este método ex vivo da transmigração nós examinamos o movimento CCL17- e CCL22-INDUCED de CCR4+ linfócitos. Para estabelecer gradientes de quimiocina, CCL17 e CCL22 foram colocados na câmara inferior do sistema de transmigração. Os linfócitos isolados foram adicionados então às câmaras superiores e sobre um período de 48 h os linfócitos migraram ativamente através dos poros de 3 μm para o quimiocina na câmara inferior. Este é um sistema eficaz para determinar o chemokinetics dos linfócitos, mas, compreensivelmente, não imitam as complexidades encontradas nos microambientes in vivo do órgão. Esta é uma limitação do método que pode ser superado pela adição da imagem latente in situ do órgão e dos linfócitos o estudo. Por outro lado, a vantagem deste método é que é pode ser realizada por um técnico de nível de entrada a uma taxa muito mais rentável do que imagens ao vivo. Como os compostos terapêuticos tornam-se disponíveis para melhorar a migração, como no caso de tumor infiltrando células imunes citotóxicas, ou para inibir a migração, talvez no caso de doenças auto-imunes onde a Imunopatologia é preocupante, este método pode ser usado como um ferramenta de triagem. Em geral, o método é eficaz se a quimiocina de interesse é consistentemente gerando quimiocinetics em um nível estatisticamente mais elevado do que o controle de mídia. Em tais casos, o grau de inibição/realce por um composto dado pode ser determinado também.
Introdução
Este método original de transmigração foi apresentado por Stephen Boyden em 1962 no periódico de medicina experimental1. Muito do que sabemos sobre quimiotaxia e quimiocinetics não seria possível sem o desenvolvimento da câmara de Boyden. Antes da descoberta da primeira quimiocina em 1977, os sistemas de transmigração ex vivo foram utilizados para aprender sobre os fatores séricos que poderiam prender o movimento celular em macrófagos, enquanto amplificavam a motilidade celular em neutrófilos1,2. Uma riqueza maciça do conhecimento foi desenvolvida a respeito da migração imune da pilha, e até à data, 47 quimiocinas foram descobertas agora com 19 receptores correspondentes3,4. Além disso, multidões de inibidores/potenciadores dessas vias de quimiocina passaram por desenvolvimento para fins terapêuticos5,6,7,8. Muitos desses compostos foram testados em câmaras de transmigração semelhantes para compreender as interações diretas entre os compostos e a responsividade da célula imune a uma determinada quimiocina9.
A transmigração, ou diapedese, em tecido inflamado é um processo essencial para uma resposta inflamatória saudável à infecção clara10,11. Uma câmara de Boyden, sistema de transmigração, ou aparelho transwell são geralmente compostas por duas câmaras separadas por uma membrana porosa1,12. A câmara inferior mais frequentemente detém meios contendo a quimiocina de interesse, enquanto os leucócitos são colocados na câmara superior. O tamanho do poro na membrana pode ser selecionado com base no tamanho da célula de interesse. Para este projeto, selecionamos uma membrana porosa de 3 μm, pois as células linfóides têm 7-20 μm de tamanho, dependendo do estágio do desenvolvimento celular. Este tamanho do poro assegura-se de que estas pilhas não estejam caindo passivamente através dos poros, mas que estão migrando ativamente em resposta ao inclinação do quimiocina.
A principal vantagem deste protocolo é a sua rentabilidade. A transmigração in vivo é difícil porque requer treinamento extensivo em manuseio e cirurgia de animais, e muitas vezes envolve microscopia de alta potência que nem sempre está disponível para um pesquisador. A triagem econômica de compostos pensados para aprimorar ou inibir a transmigração pode ser realizada com antecedência na imagem latente in vivo. Como o sistema de transmigração é rigorosamente controlado, as células podem ser tratadas inicialmente, em seguida, adicionadas ao aparelho transwell, ou, vice-versa, a quimiocina pode ser tratada primeiro com um inibidor de quimiocina, em seguida, as células adicionadas ao aparelho transwell. Por fim, células endoteliais e/ou proteínas da membrana basal podem ser adicionadas ao fundo da pastilha transwell 1-2 dias antes do experimento de transmigração para compreender o envolvimento dessas células de barreira em quimiocinetics. Novamente, essas manipulações do sistema fornecem um meio poderoso de determinar informações importantes sobre a eficácia de um determinado composto antes de estudos mais complicados in vivo.
A utilização de um sistema de câmara de transmigração é uma forma efetiva de avaliar a mobilidade dos linfócitos várias condições in vivo e in vitro12,13,14. Nisto, nós descrevemos um método aperfeiçoado para avaliar a compreensibilidade ex vivo do linfócito aos quimiocinas em uma câmara do transmigração. Neste experimento de exemplo, as células T CD4+ e as células linfóides inatas do grupo 2 (ILC2) foram isoladas de camundongos machos e fêmeas, Balb/c após exposição de óvulos-alérgeno. Uma hipótese foi gerada que CCR4+ CD45+ Lineage-(Lin-) ILC2 dos ratos alérgeno-desafiados migrariam mais EFICIENTEMENTE para CCL17 e CCL22 do que pilhas do ajudante de CCR4+ de CD4+ T. CCL17 e CCL22 são quimiocinas comumente produzidas por células dendríticas e macrófagos do fenótipo m2 (alérgico), entreoutrascélulas, emalergia15,16. CCL17 e CCL22 podem ser pensados como biomarcadores de inflamaçãoalérgica, poissão prontamente detectados nos pulmões durante as exacerbações das vias aéreas16,17,18. É importante ressaltar que a expressão CCR4 é elevada em comparação aos controles não tratados, como revelado em dados bioinformaticos gerados a partir de ILC2 isolados de animais tratados com ácaros da casa, e similarmente ILC2 de animais ingênuos tratados ex vivo com IL-33 ( cytokine inata de promoção do alérgeno) upregulates CCR4,19. Além disso, de acordo com dados para ILC2 na base de dados do projeto do genoma imunológico (www.immgen.org), CCR4 mRNA é expressado altamente nestas pilhas imunes inata. Até o momento, pouco se sabe sobre o tráfico de ILC2 em tecidos, mas é provável que as células T de ILC2 e CD4+ usem quimiocinas e receptores semelhantes para quimiotaxia e quimiocinetics, pois expressam fatores e receptores de transcrição semelhantes. Assim, comparamos a responsividade CCL17 versus CCL22, dos linfócitos T de ILC2 e CD4+ , tanto de machos como de fêmeas, animais desafiados por óvulos.
Protocolo
Todos os métodos descritos aqui foram revisados e aprovados pelos comitês institucionais de cuidados e uso de animais da Universidade de Nebraska Medical Center (UNMC) e da Universidade de Utah.
1. configuração e preparação de reagentes
-
Prepare a mídia completa do RPMI (Roswell Park Memorial Institute).
- Adicionar 10 mL de soro bovino fetal inativado por calor (FBS) a 90 mL de RPMI.
- Adicionar 1 mL de 100 x penicilina-estreptomicina-glutamina a 100 mL de 10% FBS RPMI.
-
Prepare a mídia de expansão ILC2.
- Adicione IL-2 e IL-33 (20 ng/mL cada citocina) a 10 mL de RPMI completo.
- Se as citocinas de ações são 10 μg/mL, pipetam 20 μL de IL-2 e IL-33 em um tubo de 15 mL contendo 10 mL de meios completos de RPMI.
-
Prepare o meio de dissociação pulmonar.
- Adicionar 50 mg de colagenase tipo 1 a 250 ml de RPMI não suplementado.
- Adicionar 2,5 mL de penicilina 100x-estreptomicina-glutamina para o 250 mL de mídia na etapa 1.3.1.
- Misture suavemente a mídia para garantir que o tipo 1 Collagenase está completamente dissolvido antes de usar.
-
Prepare RPMI livre de soro.
- Diluir 1 g de albumina sérica bovina liofilizada (BSA) em 200 mL de RPMI.
- Adicionar 2 mL de 100x penicilina-estreptomicina-glutamina.
- Misture suavemente a mídia para garantir que a BSA é completamente dissolvido na mídia antes de usar.
-
Prepare o meio de migração com CCL17.
- Adquira 10 mL de RPMI sem soro e adicione CCL17 [50 ng/mL].
- Se a CCL17 de ações for de 10 μg/mL, adicione 50 μL de estoque de CCL17 a 10 mL de mídia RPMI sem soro.
- Adquira 10 mL de RPMI sem soro e adicione CCL17 [50 ng/mL].
-
Prepare o meio de migração com CCL22.
- Adquira 10 mL de RPMI sem soro e adicione CCL22 [50 ng/mL].
- Se a CCL22 de ações for de 10 μg/mL, adicione 50 μL de estoque de CCL22 a 10 mL de mídia RPMI sem soro.
-
Prepare CCR4 anticorpo mancha cocktail.
- Para 10 testes totais, adicione 5 μL de cada um dos seguintes anticorpos a um tubo de 5 mL: CCR4, CD19, CD11b, CD45, ST2, e ICOS do anti-rato.
Nota: Exemplo de como fazer coquetel de anticorpos para 10 amostras: 0,5 μL de cada anticorpo x 10 amostras = 5 μL de cada um dos anticorpos listados em 1.7.1. - Para 10 testes totais, adicione 2,5 μL dos seguintes anticorpos ao cocktail do anticorpo do passo 1.7.1: anti-rato CD3, CD11c, e NK 1.1.
Nota: Exemplo para completar o coquetel de anticorpos para 10 amostras: 0,25 μL x 10 amostras = 2,5 μL de anticorpos CD3, CD11c e NK 1.1. - Guarde o cocktail de coloração do anticorpo CCR4 a 4 ° c até estar pronto para adicionar às amostras. Descarte o coquetel de anticorpos após 1 semana se não for usado.
- Para 10 testes totais, adicione 5 μL de cada um dos seguintes anticorpos a um tubo de 5 mL: CCR4, CD19, CD11b, CD45, ST2, e ICOS do anti-rato.
-
Prepare o Fixative de estabilização 1x.
- Adicionar 10 mL de água destilada desionizada a 5 mL de concentrado fixativo de estabilização 3x
2. preparação de camundongos BALB/c com deficiência de alérgeno
Nota: Camundongos BALB/c machos e fêmeas foram comprados no Rio Charles (UNMC) ou Jackson Laboratories (Universidade de Utah) às 6 a 8 semanas de idade.
-
Após a aclimatação (1 semana), sensibilize todos os animais para OVA.
- Combine 100 μg/mL de OVA adsorto a hidróxido de alumínio (20 mg/mL) num tubo de poliestireno de 5 mL.
- Misture o tubo e extraia imediatamente 500 μL da suspensão de OVA-alum numa seringa de 1 mL, 28 G (seringa de insulina).
- Coloque um rato num jarro de sino contendo isoflurano (1 – 2 mL um piso falso, para que o animal não esteja parado directamente no isoflurano). Permitir que o mouse para ir anestesia por aproximadamente 1-2 min, ou até que a taxa de respiração cai.
- Rapidamente pegar o mouse pela pele nas costas e ombros e injetar 100 μl de ova-alum via intraperitoneal por mouse21,22.
- Coloc o rato para trás em sua gaiola e preste atenção para certificar-se que recuperam a mobilidade; Isto deve ocorrer dentro de 2 – 5 min.
-
Sete dias após a sensibilização, sujeitar todos os animais à intranasal (i.n.) 1,5% OVA diluída em soro fisiológico estéril em câmara de nebulização (data Sciences International) por 20 min.
- Retire os camundongos de suas gaiolas e coloque-os na câmara de nebulização animal. Feche a tampa da câmara.
- Prenda a mangueira de nebulização ao bico de entrada na câmara de nebulização.
- Adicionar 30 mL de 1,5% de óvulos diluídos em soro fisiológico estéril no copo de nebulização no nebulizador.
- Gire sobre o nebulizador e permita que a câmara encha com a névoa por 20 minutos.
- Desligue o nebulizador e deixe a névoa assentar.
- Devolva os animais para suas gaiolas.
- Repita o passo 2,2 para um total de 5 vezes, em 5 dias consecutivos, para induzir a inflamação alérgica.
3. isolamento de células T CD4+ de baços e pulmões de camundongos desafiados por óvulos
- Humanamente eutanizar todos os animais machos e fêmeas tratados com OVA por asfixia de CO2 de acordo com protocolos iacuc aprovados, utilizando 2 a 3 animais por grupo, por experimento.
- Os pulmões e os baços do imposto de consumo dos animais e colocam tecidos em tubos separados da dissociação baseados no tipo e no sexo do tecido do animal23.
- Dissociar o tecido pulmonar em 500 μL de meios de dissociação pulmonar (25 U/mL; Collagenase, tipo 1) no Dissociador de tecidos automatizado utilizando o protocolo ' pulmão '.
- Repita 3,2 e 3,3 um total de duas vezes.
- Dissociar o tecido do baço em 500 μL de meios completos de RPMI usando o protocolo do ' Spleen ' no dissociator automatizado do tecido.
Nota: As etapas restantes devem ser executadas em um armário biológico da segurança usando a técnica estéril. - Enxague os tubos de dissociação contendo homogeneatos de pulmão e baço com 5 mL de meios adicionais de dissociação pulmonar ou RPMI completo, respectivamente.
- Filtre suspensões de células através de um filtro de células de 40 μm e colete em tubos cônicos de 50 mL.
- Incubar homogeneatos pulmonares por 15 – 30 min em uma incubadora de 37 ° c com 5% de CO2 para dissociar ainda mais o tecido pulmonar.
- Adicione 5 mL de RPMI completo aos homogeneatos de pulmão e baço e pellet as células na parte inferior dos tubos de 50 mL usando a centrifugação; 378 x g à temperatura ambiente (RT) durante 5 min.
- Combine esplenócitos e pilhas do pulmão em um único tubo cônico de 50 ml e determine contagens totais da pilha usando o contador automatizado da pilha.
- Ajuste as suspensões de células masculinas e femininas para 1 x 108 células/ml no tampão de separação e adicione a um tubo de poliestireno de 5 ml.
Nota: O protocolo de enriquecimento pode ser ajustado até 14 mL de tubos de poliestireno quando mais células são adquiridas do baço e pulmões. Este protocolo foi projetado para os tecidos de 2 – 3 camundongos por grupo; Portanto, um tubo de 5 mL deve ser suficiente. - Use aproximadamente dois terços das células totais para o isolamento ILC2 de acordo com o protocolo de enriquecimento ILC2.
- Adicionar um cocktail de anticorpos (50 μL/mL) à suspensão celular e incubar durante 5 min em RT.
- Vortex esferas rápidas para 30 s e adicionar à amostra a uma taxa de 75 μL/mL de suspensão celular. Misture suavemente e incubar por 5 min em RT.
- Top o tubo até 3 mL de volume total com buffer de separação e coloque no ímã de separação fácil de 8 câmaras. Incubar por 3 min em RT.
- Derrube o ímã para a frente (longe dos complexos da esfera-anticorpo-pilha aderiram à parte traseira do tubo) e da pipeta fora da suspensão da pilha em um tubo limpo de 5 mL.
- Adicionar 1,5 mL de RPMI completo aos tubos e centrifugar a 378 x g durante 5 min em RT.
- Despeje a mídia do pellet celular e ressuscite o ILC2 em 1 x 107 células por ml.
- Coloc 100 uL do macho e da fêmea ILC2 por bem em um U-parte inferior, placa de 96 poços e adicione 100 μL de meios de expansão ILC2 a cada poço.
- Incubar as células por 4 – 5 dias para expandir o ILC2.
- Colete o ILC2 em um tubo de 5 mL e adicione até 4,5 mL de RPMI sem soro. Centrifugue as células a 378 x g durante 5 min em RT.
- Células de contagem usando um hemacitômetro e ressuscitem em 1 x 107 ILC2 por ml em RPMI soro-livre.
- Use as células restantes para o procedimento de isolamento de células t CD4+ , que é conduzido de acordo com o protocolo de isolamento de células t CD4+ mouse com poucas modificações.
- Adicione soro de rato (50 μL/mL) à suspensão de enriquecimento de células T CD4.
- Adicionar cocktail de isolamento (50 μL/mL) à amostra e incubar durante 10 min na RT.
- Vortex esferas rápidas para 30 s e adicionar à amostra a uma taxa de 75 μL/mL.
- Misture suavemente a suspensão celular e incubar para 2,5 min e RT
- Top as amostras até 3 mL e coloque os tubos de 5 mL no ímã de separação fácil de 8 câmaras e incubar por 5 min em RT.
- Derrube o íman para a frente e pipetar a suspensão da célula para um tubo de 5 mL limpo.
- Adicionar 1,5 mL de RPMI sem soro aos tubos e centrifugar a 378 x g durante 5 min em RT.
- Derrame fora os meios da pelota da pilha e ressuscite as pilhas de T CD4+ em 1 x 107 pilhas por o ml no RPMI soro-livre.
4. Determine CCR4 expressão em células T CD4+ e grupo 2 células linfóides INATAS (ILC2) de animais desafiados por óvulos por citometria de fluxo
Nota: As seguintes etapas podem ser executadas em uma parte superior de banco aberta porque são técnicas não-estéreis.
-
Adquira aproximadamente 1 – 2,5 x 105 ILC2 células da etapa 3.11.10 e 1 – 2,5 x 106 células T CD4+ da etapa 3.12.8 em tubos separados de 5 ml.
- Mantenha um tubo adicional de pelo menos 5,0 x 104 células T CD4 + como um controle não manchado.
- Suspenda as células em 100 – 200 μL de tampão FACS e adicione 1 μL de bloco FC a cada tubo, em seguida, incubar no gelo (ou em um refrigerador de 4 ° c) por 10 min.
- Adicionar 1 – 2 mL de FACS buffer a cada tubo e centrifugar a 378 x g durante 5 min em RT.
- Despeje o sobrenadante e ressuscita as células em 100 – 200 μL de tampão FACS.
- Adicionar 37,5 μL do cocktail de coloração do anticorpo CCR4 à suspensão da célula em cada tubo, excepto o tubo que contém as células "não manchadas".
- Incubar os tubos no gelo, ou em um refrigerador de 4 ° c, por 20 – 30 min.
- Adicionar 1 – 2 mL de FACS buffer a cada tubo e centrifugar a 378 x g durante 5 min em RT.
- Despeje o sobrenadante.
- Repita as etapas 4,7 e 4,8.
- Adicione 250 – 300 μL de fixador estabilizante 1x (ver tabela de materiais) a cada tubo.
-
Prepare controles de talão de cor única para cada anticorpo no coquetel de anticorpos CCR4 de acordo com o protocolo fornecido com as contas de compensação.
- Vortex os grânulos de compensação.
- Adicione uma gota das contas a cada tubo de controle de cor única.
- Adicione 1 μL de cada anticorpo no cocktail de anticorpo CCR4 ao seu próprio tubo rotulado.
- Misture suavemente e incubar por 10 min em um refrigerador de 4 ° c ou no gelo.
- Adicionar 1 – 2 mL de FACS buffer a todos os tubos e centrifugar a 378 x g durante 5 min em RT.
- Despeje o sobrenadante e ressuscita as contas em 200 μL de tampão FACS.
- Leve à geladeira os controles de cor única até que todas as amostras sejam manchadas e prontas para serem analisadas no citometro de fluxo.
- Analise as células não manchadas, controles de cor única e as amostras experimentais no citometro de fluxo dentro de 24 h de fixação.
5. procedimento de transmigração ex vivo
Nota: As seguintes etapas devem ser executadas em um armário de segurança biológico, porque exigem a técnica estéril.
- Adquira o ILC2 da etapa 3.11.10 e das células T CD4 da etapa 3.12.8 e determine o número de inserções do transwell necessárias para o experimento.
Nota: Exemplo: para 1,2 mL de células T CD4 enriquecidas a partir do passo 3.12.8, multiplicar 1,2 x 1.000 μL = 1.200 μL; em seguida, divida 1.200 uL por 100 μL = 12, o número de pastilhas necessárias para a transmigração CD4 T. - Mova delicadamente as inserções do transwell de 3 μm das fileiras médias de uma placa de 24 poços.
- Adicionar 500 μL de meios de migração com CCL17 a aproximadamente um terço dos poços.
- Adicionar 500 μL de meios de migração com CCL22 para outro um terço dos poços.
- Adicionar 500 μL de RPMI sem soro contendo nenhuma quimiocina ao último terço dos poços.
- Rotule claramente a tampa na placa com a mídia de transmigração apropriada colocada nos poços inferiores.
- Coloc as inserções do transwell de volta nos poços que contêm os vários tratamentos.
- Adicione suavemente 100 μL de células T CD4 ou ILC2 ao poço superior de cada pastilha. Não misture ou Pipetar a suspensão da célula para cima e para baixo nas transpoços, pois isso pode confundir os resultados do experimento.
- Etiquetar claramente a tampa da placa com o tipo de célula colocado em cada poço e escrever a data ea hora do dia em que as células foram adicionadas.
- Repita as etapas 5,2 a 5,9 até que todas as células tenham sido colocadas em inserções de transpoços com mídia.
- Coloc delicadamente a placa em uma incubadora de 37 ° c com 5% CO2 para 48 h. Minimize o contato com a placa durante o período de incubação.
6. quantificação da transmigração ex vivo
- Remova delicadamente a placa da incubadora e remova todas as inserções do transwell das fileiras médias nos poços vazios apenas acima ou abaixo.
- Colete as células dos poços inferior e superior das inserções do transwell em tubos rotulados com TOP ou BOTTOM, com CCL17, CCL22 ou mídia, com o tipo de célula, e com o número replicado (pelo menos 3 repetições por experimento).
- Enxague os poços inferiores com 500 μL de 1X PBS e recolha esta enxaguadura no tubo correspondente.
- Enxague os poços superiores com 250 μL de 1X PBS e recolha esta enxaguadura no tubo correspondente.
- Pellet as células por centrifugação em 378 x g por 5 min em RT.
- Gentilmente pipeta fora todo o sobrenadante da pelota da pilha.
- Resuspender as células T e ILC2 em 50 μL de 1X PBS.
- Tome 10 μL das suspensões celulares e adicione a 90 μL de 0,4% de azul de Tripan.
-
Conte as células no contador de células automatizado.
- Registro% de viabilidade.
- Registre a contagem de células por mL para cada amostra.
- Determine o número total de células por tratamento na parte superior e na câmara inferior; gravar as contagens de células.
Resultados
Expressão CCR4 em células T CD4 + e ILC2.
Para o sucesso do experimento de transmigração ex vivo, é imperativo determinar se os linfócitos são responsivos a CCL17 e CCL22 a CCR4; Conseqüentemente, nós determinamos a expressão CCR4 em pilhas de T CD4+ e ILC2 pela citometria do fluxo. Embora seja bem sabido que as células T do ajudante CD4+ específicas de ova expressam CCR4, menos é conhecida da expressão de CCR4 em ILC2. A Figura 1 mostra os resultados representativos da expressão de CCR4, comparativamente, em células T CD4+ (Figura 1a, C) e ILC2 (Figura 1B, D) de camundongos Balb/C de machos e fêmeas, desafiados por óvulos. A citometria de fluxo foi utilizada para detectar CCR4 usando um anticorpo monoclonal conjugado à alopofcocianina (APC). Usando a análise de variância unidirecional (ANOVA), determinou-se que não houve diferenças na expressão de CCR4 entre hospedeiros masculinos e femininos (Figura 1a – D), porém, a expressão de CCR4 em uma base por célula (MFI) em ILC2 foi maior em comparação com CD4 + Células T (Figura 1C em comparação com a Figura 1D). Esses resultados são importantes para mostrar que as células T ILC2 e CD4+ devem responder a CCL17 e CCL22 no experimento a seguir.
Responsividade de células T CD4+ para CCR4 ligantes nas câmaras superior e inferior de um sistema de transmigração.
Células T CD4+ de camundongos machos, Balb/c desafiados por óvulos foram isolados dos pulmões e dos baços e colocados na câmara superior de um aparelho de transmigração separado por uma membrana porosa de 3 ΜM (Figura 2). Um resumo da preparação in vivo de camundongos tratados com óvulos (Figura 2a) e o procedimento de transmigração (Figura 2b) são mostrados para referência. Uma combinação de CCL17 (25 ng/mL) e de CCL22 (25 ng/mL) foi coloc na câmara superior, na câmara inferior ou nas câmaras superiores e inferiores para confirmar (Figura 2C), (1) que as pilhas de T CD4+ dos animais óvulos-desafiados eram responsivos a CCR4 ligands, e (2) que a migração quimiocina-induzida era um processo ativo por que as pilhas de T se estavam movendo através dos pores em resposta ao inclinação do quimiocina, e que os linfócitos não se estavam movendo através dos poros independentes do quimiocina. Um controle dos meios (nenhum chemokine) foi incluído para mostrar que as pilhas de T CD4+ não poderiam migrar através dos poros de 3 μm sem estimulação. Nesta circunstância, a porcentagem a mais elevada das pilhas remanesceu na câmara superior. Quando as quimiocinas foram colocadas na câmara superior e inferior simultaneamente, detectamos 52% das células T totais na câmara inferior e 48% das células na câmara superior (tratamento TOP/BOTTOM). Como esperado, a distribuição das células se moveu em resposta à quimiocina colocada apenas no topo ou apenas na câmara inferior, pois detectamos a maior percentagem de células no compartimento onde a quimiocina estava presente.
Responsividade de células T CD4+ e ILC2 a CCL17 e CCL22 em um aparelho de transmigração ex vivo.
Células T CD4 e ILC2 de machos e fêmeas, camundongos desafiados com OVA foram isolados de pulmões e baços, então colocados na câmara superior de um aparelho de transmigração transwell (Figura 3). A câmara inferior do aparelho foi preenchida com meios de cultura celular não tratados, meios contendo CCL17, ou meios contendo CCL22. Os resultados representativos mostram que menos de 14% (13,37 + 6,5%) das células migradas em condições de controle de mídia (Figura 3A – D). Em resposta a CCL22, ambos os tipos de células, independentemente de terem sido de hospedeiros masculinos ou femininos, responderam a CCL22 (Figura 3a – D), no entanto, os resultados para CCL17 foram menos consistentes. CCL17 apenas induziu migração significativa para as células T CD4 femininas e ILC2 em comparação aos meios de comunicação isoladamente (Figura 3C, D). O tratamento CCL17 não foi diferente do que A média para as células T CD4+ ou masculino ILC2 (Figura 3A, B) e CCL22 maior migração induzida do que CCL17 na ILC2 masculina (Figura 2b).
Resultados de transmigração suboptimal para células T CD4+ com baixa viabilidade.
Resultados suboptimais foram gerados para fornecer ao pesquisador um exemplo do que esperar quando o experimento de transmigração não funciona corretamente (Figura 4). Nós isolamos pilhas CD4+ T masculinas dos animais de acordo com este protocolo e coloc os no poço superior do sistema do transmigração. Depois que as células T CD4+ foram adicionadas, no entanto, a placa permaneceu à temperatura ambiente durante os primeiros 24 h, em seguida, a placa foi movida para a incubadora para os restantes 24 h do período de incubação. Não surpreendentemente, não detectamos migração para CCL17 e CCL22 (figura 4a) e a viabilidade das células foi notavelmente baixa (< 15%) para as células na parte superior (Figura 4B). Estes resultados defeituosos destacam a importância de usar as temperaturas e as circunstâncias corretas detalhadas neste protocolo para conseguir resultados os melhores.
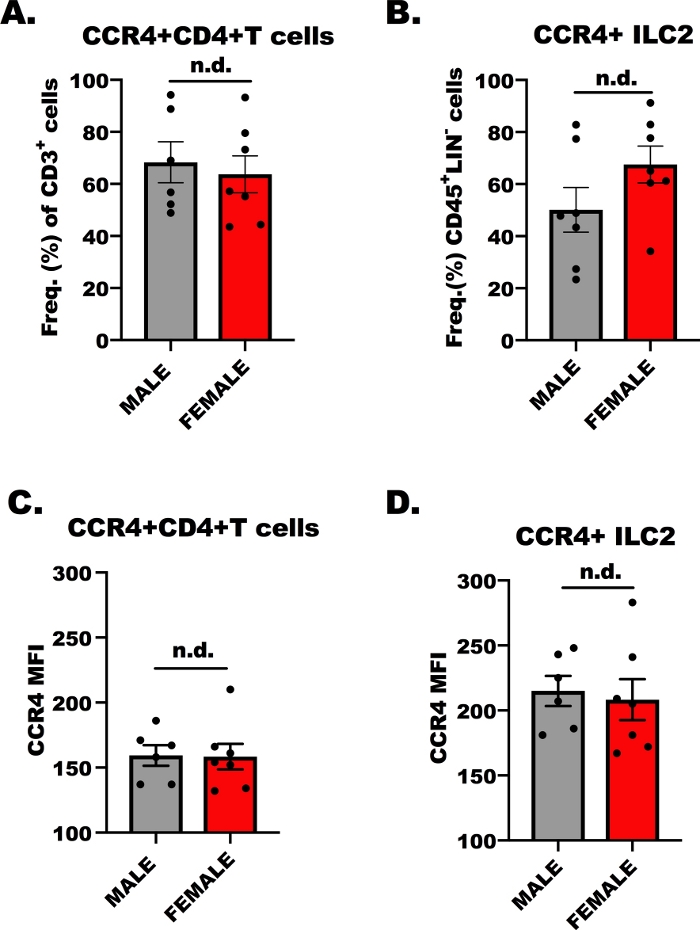
Figura 1: expressão CCR4 em células T CD4+ e ILC2. 7 a 9 semanas de idade, machos e fêmeas, camundongos Balb/c foram injetados uma vez com 100 μl de óvulos adsorvedos a hidróxido de alumínio (500 μg/ml; Óvulos e 20 mg/mL de hidróxido de alumínio) 7 dias antes do primeiro de 5, repetitivos, desafios diários da via aérea com 1,5% de OVA em soro fisiológico. Os animais alérgeno-desafiados eram humanamente eutthanized, e o tecido do pulmão e do spleen foi coletado para a isolação das pilhas de ILC2 e de CD4+ T. Uma pequena alíquota de células foi então manchada e analisada por citometria de fluxo para determinar o nível de CCR4 em cada tipo de célula. (A) frequência de células T CD4+ que são CCR4+ de óvulos + camundongos, onde as barras de erro representam o erro padrão da média (+ sem). (B) frequência de ILC2 que foram CCR4+ (+ sem). (C, D) Intensidade média de fluorescência (+ SEM) de CCR4 em (C) células T CD4 + e (D) ILC2. Um total de 13 camundongos foi utilizado para gerar esses dados, e o experimento de fluxo foi repetido duas vezes, com 3 repetições de cada tratamento por experimento. A significância foi determinada pela ANOVA One-Way; n.d. indica que não houve diferenças entre os grupos. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: responsividade de células T CD4+ para CCR4 ligantes nas câmaras superior e inferior de um sistema de transmigração. Camundongos BALB/c machos sensibilizados e desafiado com ovalbumina de ovo de galinha (OVA) e células T CD4 + foram isolados dos baços e pulmões (a, B). Para este experimento de transmigração, as células T CD4+ foram suspensas em meios livres de soro em 1 x 107 células/ml. CCL17 e CCL22 foram adicionados aos meios soro-livres em uma concentração de 50 ng/ml (25 ng/ml de cada quimiocina para conseguir um total de 50 ng/ml). A mídia contendo chemokine foi adicionada apenas à câmara superior, apenas à câmara inferior ou às câmaras superior e inferior. Um volume total de 500 μL de meios de transmigração foi adicionado aos poços inferiores e 100 μL de suspensão celular (1 x 106 células/poço) foi adicionado ao poço superior. A transmigração foi mensurada após 48 h na cultura (C). Esses dados foram gerados a partir de um único experimento, 3 camundongos machos tratados com OVA foram utilizados para coleta tecidual, e 3 repetições foram feitas por tratamento. A significância estatística foi determinada pela ANOVA One-Way; *p < 0, 5. Por favor clique aqui para ver uma versão maior desta figura.
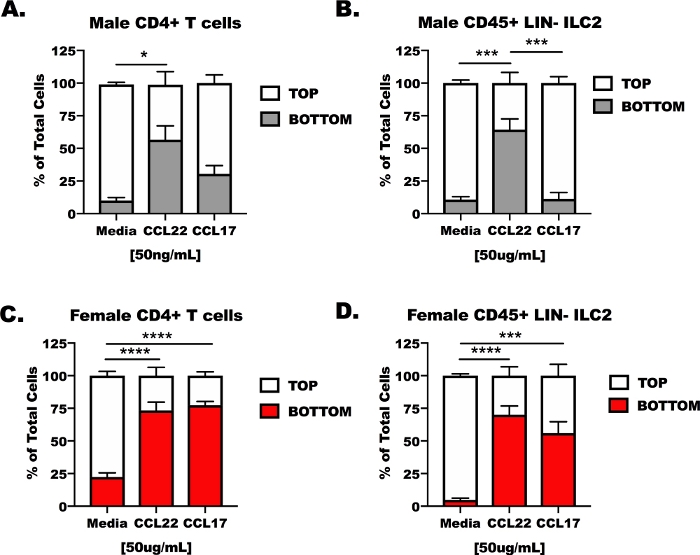
Figura 3: responsividade de células T CD4 + e ILC2 a CCL17 e CCL22 em um aparelho de transmigração ex vivo . Os camundongos foram preparados como na Figura 1 para a célula T CD4+ e ILC2 isolamento de baços e pulmões. As pilhas de T de CD4+ e os ILC2 foram suspendidos em meios soro-livres em 1 x 107 Cells/ml. CCL17 ou CCL22 foram adicionados aos meios soro-livres em uma concentração de 50 ng/mL. 500 μL de meios de transmigração foram adicionados aos poços inferiores e 100 μL de suspensão celular (1 x 106 células/poço) foi adicionado ao poço superior. A transmigração foi mensurada após 48 h na cultura. (A) células T CD4+ e (B) ILC2 de hospedeiros machos foram tratadas com meios de comunicação como controle, CCL17 ou CCL22. Similarmente, (C) as pilhas de T CD4+ fêmeas e (D) fêmeas ILC2 foram tratadas com meios, CCL17, ou CCL22. Um total de 14 camundongos foi utilizado para gerar esses dados. O experimento de transmigração foi repetido 4 vezes, com 3 – 6 repetições de cada tratamento por experimento. A significância foi determinada pela ANOVA One-Way; *p < 0, 5, * * *p < 0, 1, * * * *p < 0, 1. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: resultados de transmigração suboptimal para células T CD4 com baixa viabilidade. Camundongos BALB/c machos ingênuos foram adquiridos para coleta de tecido pulmonar e baço e isolamento de células T CD4+ como na Figura 1, Figura 2e Figura 3. As pilhas de T CD4 foram adicionadas à câmara superior do instrumento do transmigração e os meios soro-livres que contêm CCL17, CCL22 ou nenhum quimiocina (controle de meios) foram adicionados ao poço inferior. Para os primeiros 24 h do experimento, a chapa foi deixada à temperatura ambiente, então foi movida para uma incubadora de 37 ° c com 5% de CO2 para um adicional de 24 h. (a) percentual de células remanescentes nos poços superior e inferior após 24 h. (B) viabilidade do C D4 + células T na câmara superior e inferior após condições de incubação pobres. Esses dados foram gerados a partir de um único experimento, 3 camundongos machos ingênuos foram utilizados para coleta tecidual e 3 repetições foram feitas por tratamento. A significância estatística não foi determinada. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Nisto, nós apresentamos um método bem estabelecido para avaliar a migração chemokine-induzida dos linfócitos em um sistema ex vivo da transmigração. Existem várias etapas críticas no protocolo, sendo que a primeira é verificar a expressão do receptor de quimiocina correto nas células imunes no experimento. Em nossas mãos, nós escolhemos CCR4 por causa do corpo da literatura que destaca a importância de CCR4 em células T do ajudante Th2 na inflamação alérgica. A inflamação induzida por ovalbumina foi mostrada previamente para ser limitada por pelo menos dois antagonistas CCR424,25; Entretanto, isso foi prévio à descoberta do grupo 2 células linfóides inatas (ILC2)26,27. Nós geramos os dados novos que mostram que as pilhas ILC2 expressam um CCR4 mais elevado do que pilhas de T CD4+ e mostraram que estas pilhas eram consistentemente responsivas ao CCL22.
Um segundo passo crítico a seguir no protocolo é garantir que as células sejam mantidas em meio ideal para a cultura antes de iniciar a parte de transmigração do protocolo. No caso de ILC2, tivemos que cultura essas células em ILC2 Media de expansão que contém tanto IL-2 e IL-33. Il-2 e Il-7 são ambos relatados na literatura para apoiar ILC2 na cultura por até 14 dias28,29. Se a viabilidade se tornar um problema para células T CD4+ e ILC2 em experimentos futuros, a adição de Il-2 ou Il-7 provavelmente melhoraria a sobrevida dos linfócitos até o desfecho do experimento. Cada uma das mídias aqui apresentadas foi definida ao longo de vários experimentos e foram otimizadas para uso neste protocolo14,30,31. Na Figura 4, apresentamos resultados defeituosos para demonstrar a importância do uso de uma incubadora com temperatura adequada e 5% de co2. Manter as placas de transmigração na incubadora onde elas não serão perturbadas é outro passo crítico para o sucesso do protocolo.
Como afirmado anteriormente, há vantagens em usar a microscopia in vivo disponível na maioria das instituições, no entanto, a imagem latente in vivo pode ser demorada e dispendiosa. Um procedimento experimental alternativo que é menos dispendioso usa microfluídica em combinação com gradientes de quimiocina para compreender o extravasamento da leucócito e a migração do tecido32,33,34. Esses sistemas possuem valor científico, pois avaliam as complexidades da cinética celular que envolvem células endoteliais, que podem ser cultivadas nos capilares dos sistemas microfluílicos. Além disso, estes sistemas microfluídicos avaliam a importância das proteínas das aderências (por exemplo, e-cadherin) nas pilhas endothelial e nas integrinas nas pilhas imunes no processo de adesão da pilha a circulação sanguínea. No entanto, esses sistemas exigem equipamentos especializados e complexas programações computacionais e estatísticas para determinar a importância de cada condição de tratamento. Portanto, embora a limitação do método de transmigração aqui apresentada seja de natureza artificial, ela pode ser usada como uma importante ferramenta de triagem para limitar o desperdício de reagentes desnecessários em métodos subseqüentes in vivo. O significado do método é que, como novas células são descobertas, como é o caso para ILC2, podemos tela essas células para sua capacidade de resposta para quimiocinas conhecidas. Esta é uma das aplicações futuras que envolvem ILC2 e as terapias potenciais que podem inibir sua migração nos pulmões durante a exacerbação da asma. Este protocolo de transmigração será usado para a tela de vários inibidores que podem ser usados para limitar CCR4 ou outros mediadores quimotáticos envolvidos no recrutamento de ILC2. Ao todo, este protocolo de transmigração ex vivo levará à geração de dados críticos que podem ser verificados com futuros experimentos in vivo.
Divulgações
Os autores não têm divulgações financeiras ou conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi financiado pela American Lung Association (K.J.W.), o Memorial Eugene Kenney fundo concedido a T.A.W. e K.J.W., generoso apoio start-up da Universidade de Utah para K.J.W., e um departamento de assuntos veteranos prêmio de T.A.W. (VA I01BX0003635). T.A.W. é o destinatário de um prêmio de cientista de carreira de pesquisa (IK6 BX003781) do departamento de assuntos de veteranos. Os autores desejam reconhecer a assistência editorial da Sra. Lisa Chudomelka. Os autores agradecem o núcleo de citometria de fluxo da UNMC por seu apoio na coleta dos dados de citometria de fluxo gerados para este manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
Referências
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548 (2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477 (2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508 (2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038 (2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684 (2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51 (2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados